Similar presentations:
Строение органических соединений, взаимное влияние атомов в их молекулах и их кислотные и основные свойства
1.
Строение органических соединений, взаимное влияниеатомов в их молекулах
и их кислотные и основные свойства
2.
Строение органических соединений,взаимное влияние атомов в их молекулах
и их кислотные и основные свойства
● Введение в химию органическихсоединений
● Электронное строение органических соединений
○ Гибридизация атомныхорбиталей
○ Химические связи атома углерода
○ Сопряжение
○ Понятие ароматичности
○ Основные характеристики ковалентных связей
o Электронные эффекты
● Кислотность и основность органическихсоединений
○ Типы кислот и оснований
○ Факторы, определяющие кислотность и основность
2
3.
ОРГАНИЧЕСКАЯ ХИМИЯ— химия соединений углерода
Некоторые термины и определения,
используемые в курсе органической химии,
имеющем медицинскую направленность
• Биополимеры (и их структурные компоненты) —
высокомолекулярные природные соединения, служащие
структурной основой живых организмов (пептиды и белки,
углеводы, нуклеиновые кислоты, липиды)
• Биорегуляторы —
соединения, регулирующие обмен веществ
(витамины, гормоны, синтетические биологически активные
вещества, в том числе лекарственные средства)
• Метаболиты —
вещества, образующиеся или распадающиеся
в процессах обменавеществ
• Ферменты —
биокатализаторы белковой природы, увеличивающие
скорости биохимических реакций в106 – 1010 раз
3
4.
• Коферменты – низкомолекулярные вещества, необходимыедляфункционирования некоторыхферментов
• Ксенобиотики – чужеродные для живого организма вещества:
вещества, загрязняющие окружающую среду, лекарственные
препараты, яды, наркотики
Метаболизм (обмен веществ) — совокупность химических
реакций, протекающих в организме; дает энергию и вещества,
необходимые для функционирования организма
Катаболизм – реакции распада (выделение энергии; окисление [O])
Анаболизм – реакции биосинтеза (затрата энергии; восстановление [Н])
"Биосинтез" – химические реакции, приводящие в условиях орга-
низма к получению конкретного класса соединений
"in vitro" – вне организма
"in vivo" – в условиях организма
4
5.
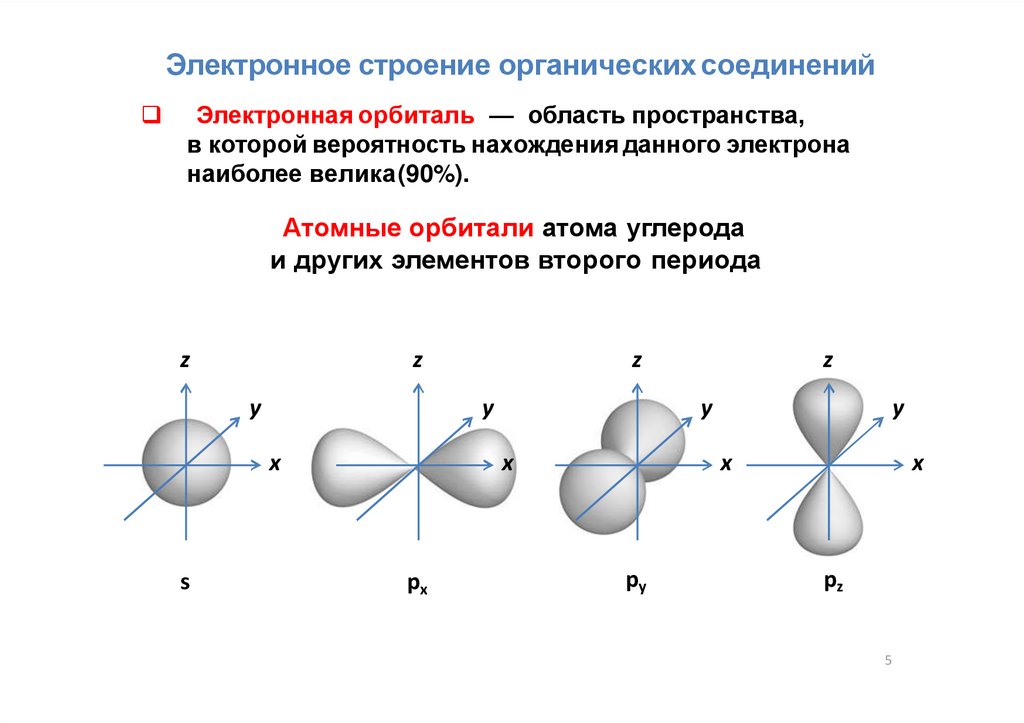
Электронное строение органических соединенийЭлектронная орбиталь — область пространства,
в которой вероятность нахождения данного электрона
наиболее велика(90%).
Атомные орбитали атома углерода
и других элементов второго периода
z
z
y
y
x
s
z
y
x
px
z
y
x
py
x
pz
5
6.
Распределение электронов по орбиталям у атома углеродав основном (С) и возбужденном (С*) состоянии
2p
C
2s
1s
2p
C*
2s
1s2 2s2 2p2
1s
Энергии s и p орбиталей различны, но все четыре
C–H связи в метане имеют одинаковую длину
(0.154 нм) и все валентныеуглы равны (109.5°)
1s2 2s1 2p3
H
C
H
H
H
Молекула метана – идеальный тетраэдр.
Почему?
Ответ: гибридизация атомныхорбиталей
6
7.
Гибридизация атомных орбиталей— смешивание нескольких атомных орбиталей различной
формы и близкой энергии с образованием такого же числа
новых гибридных орбиталей, расположение которых в
пространстве соответствует геометрии молекулы.
– для элементов 2-го периода гибридные орбитали имеют
одинаковую форму и энергию;
– гибридные орбитали за счет более эффективного перекрывания
образуют более прочные связи
(по сравнению с негибридизованными орбиталями);
– тип гибридизации определяет направленность гибридных
орбиталей в пространстве и, следовательно, геометрию
молекул и ионов
Сколько орбиталей гибридизуется – столько и образуется
гибридных орбиталей
7
8.
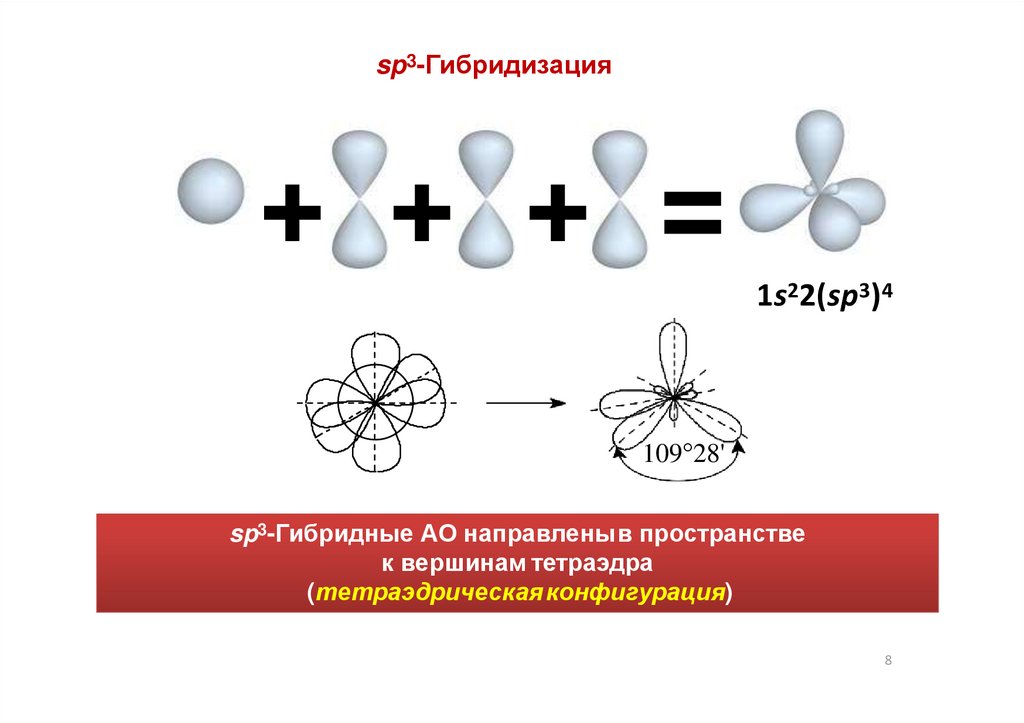
sp3-Гибридизация+ + + =
1s22(sp3)4
109°28'
sp3-Гибридные АО направленыв пространстве
к вершинам тетраэдра
(тетраэдрическая конфигурация)
8
9.
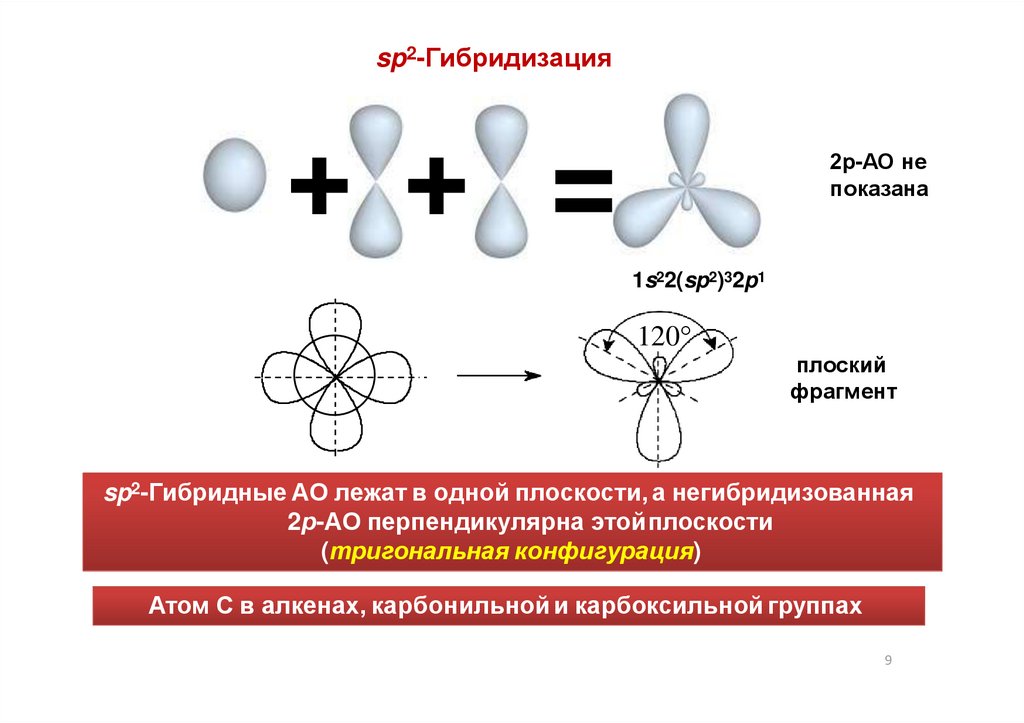
sp2-Гибридизация+ + =
2р-АО не
показана
1s22(sp2)32p1
120°
плоский
фрагмент
sp2-Гибридные АО лежат в одной плоскости, а негибридизованная
2р-АО перпендикулярна этойплоскости
(тригональная конфигурация)
Атом С в алкенах, карбонильной и карбоксильной группах
9
10.
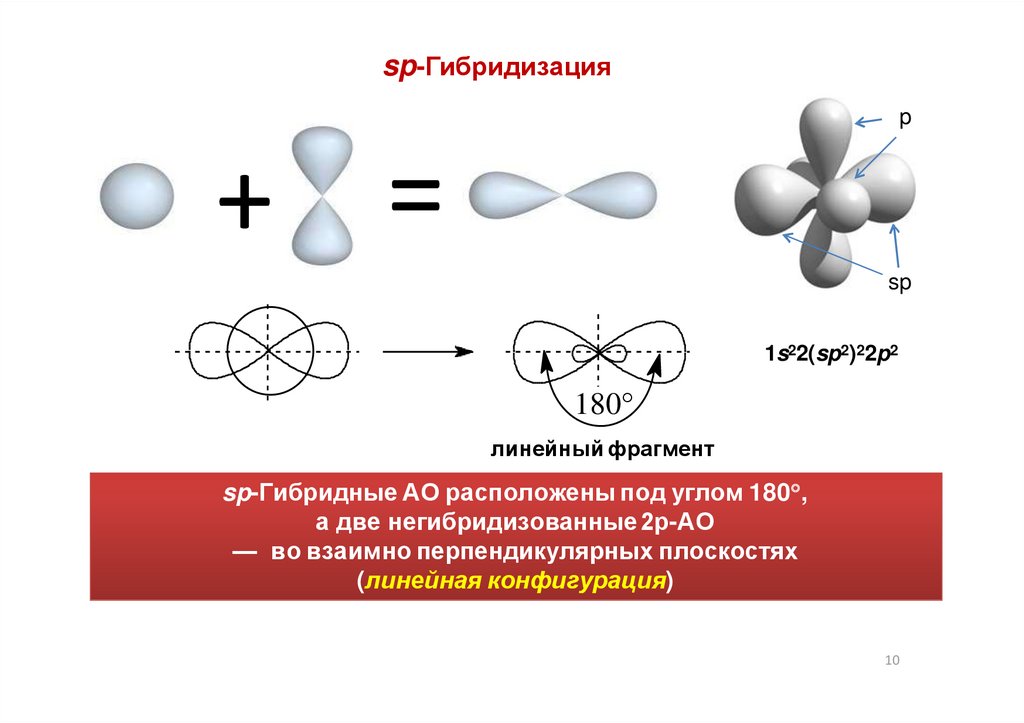
sp-Гибридизацияp
+ =
sp
1s22(sp2)22p2
180°
линейный фрагмент
sp-Гибридные АО расположены под углом 180 ,
а две негибридизованные 2р-АО
— во взаимно перпендикулярных плоскостях
(линейная конфигурация)
10
11.
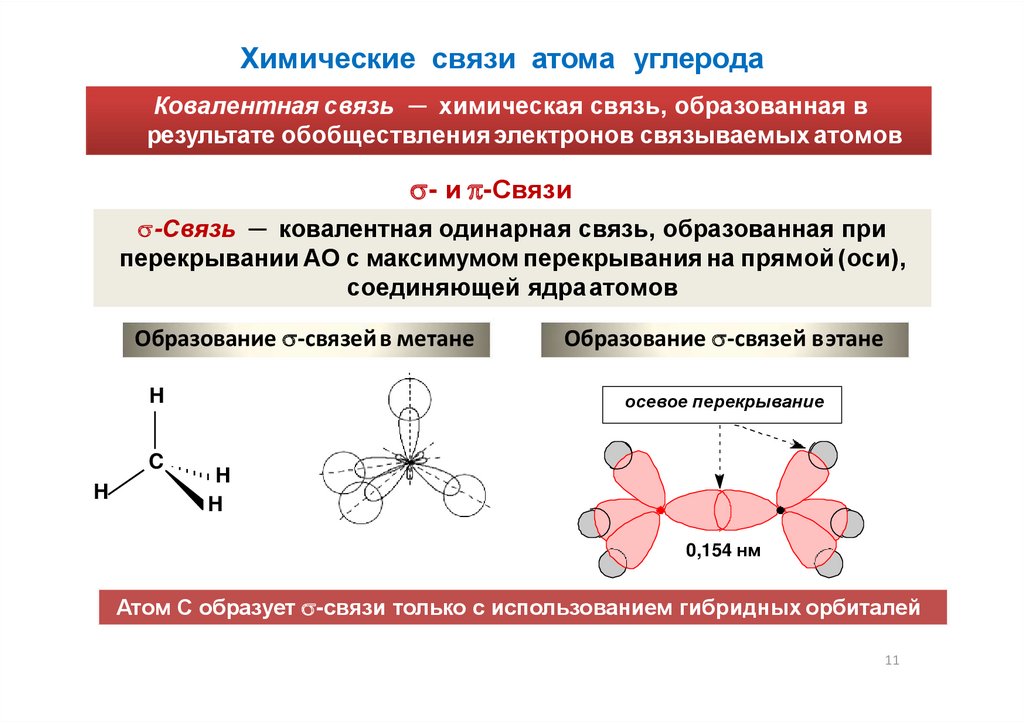
Химические связи атома углеродаКовалентная связь ─ химическая связь, образованная в
результате обобществления электронов связываемых атомов
- и -Связи
-Связь ─ ковалентная одинарная связь, образованная при
перекрывании АО с максимумом перекрывания на прямой (оси),
соединяющей ядраатомов
Образование -связей в метане
H
C
H
Образование -связей вэтане
осевое перекрывание
H
H
0,154 нм
Атом С образует -связи только с использованием гибридных орбиталей
11
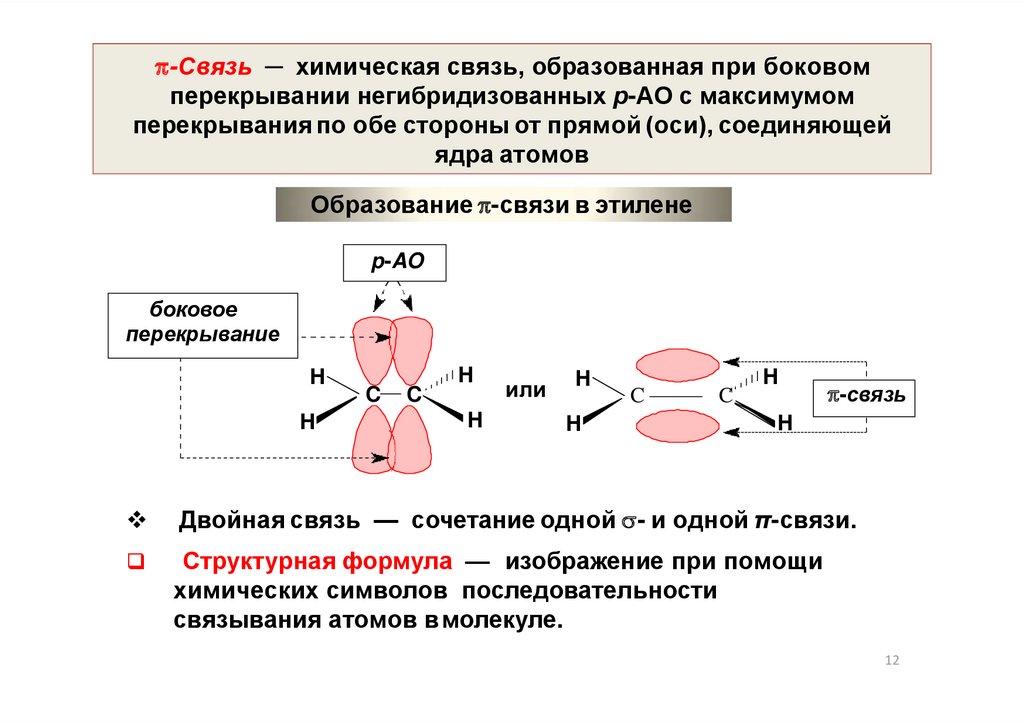
12.
-Связь ─ химическая связь, образованная при боковомперекрывании негибридизованных р-АО с максимумом
перекрывания по обе стороны от прямой (оси), соединяющей
ядра атомов
Образование -связи в этилене
p-AO
боковое
перекрывание
H
H
C
C
H
H
или
H
H
C
C
H
-связь
H
Двойная связь — сочетание одной - и одной π-связи.
Структурная формула — изображение при помощи
химических символов последовательности
связывания атомов вмолекуле.
12
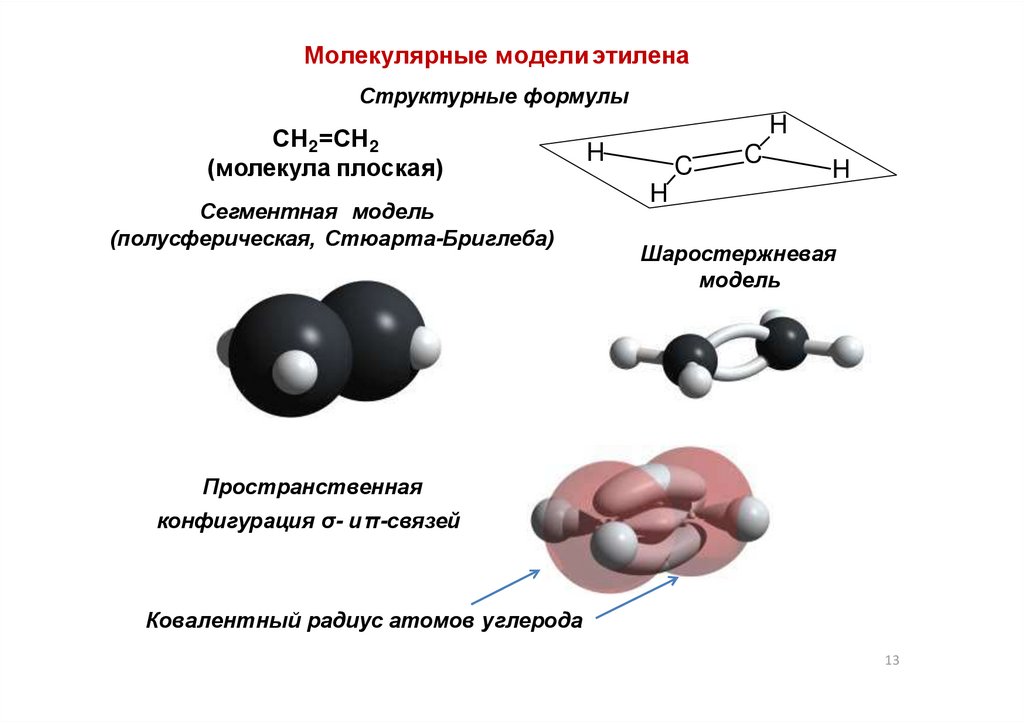
13.
Молекулярные модели этиленаСтруктурные формулы
СН2=СН2
(молекула плоская)
Сегментная модель
(полусферическая, Стюарта-Бриглеба)
H
H
C
C
H
H
Шаростержневая
модель
Пространственная
конфигурация σ- иπ-связей
Ковалентный радиус атомов углерода
13
14.
Образование -связей в ацетиленеТройная связь — сочетание одной - и двух π-связей.
Молекулярные модели ацетилена
Структурные формулы
НС СН
(молекула линейная)
Сегментная
модель
Пространственная
конфигурация
σ- и π-связей
H
C
C
H
Шаростержневая
модель
Ковалентный
радиус
атомов углерода
14
15.
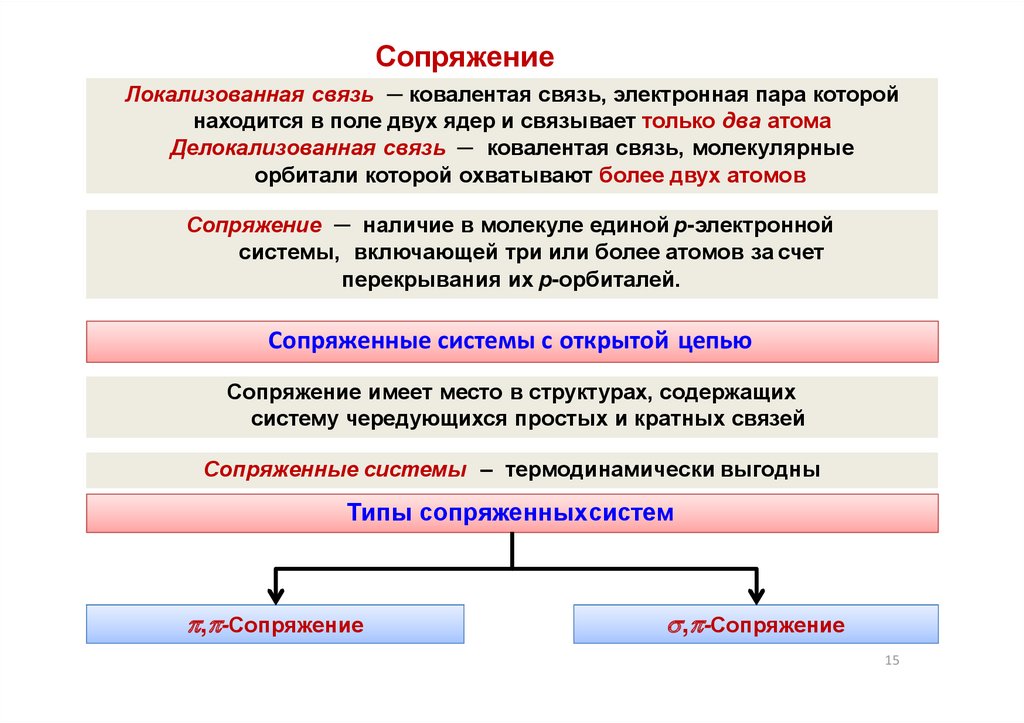
СопряжениеЛокализованная связь ─ ковалентая связь, электронная пара которой
находится в поле двух ядер и связывает только два атома
Делокализованная связь ─ ковалентая связь, молекулярные
орбитали которой охватывают более двух атомов
Сопряжение ─ наличие в молекуле единой р-электронной
системы, включающей три или более атомов за счет
перекрывания их р-орбиталей.
Сопряженные системы с открытой цепью
Сопряжение имеет место в структурах, содержащих
систему чередующихся простых и кратных связей
Сопряженные системы – термодинамически выгодны
Типы сопряженныхсистем
, -Сопряжение
, -Сопряжение
15
16.
, -CопряжениеСопряжение в бутадиене-1,3
CH 2=CH–СН=СН2
(молекула плоская)
Гипотетическая структура
1
H
C
H
2H
3
C
H
C
4
C
H
H
Выравнивание связей и зарядов
за счет сопряжения
Энергия сопряжения — выигрыш в энергии за счет сопряжения;
для бутадиена-1,3 равен 15кДж/моль
16
17.
p, -СопряжениеСопряжение в винилметиловом эфире
CH 2=CH–O–СН 3
H
H
Структура с негибридизованными
p-орбиталями
C
C
H
O
H
C
H
H
Окончательная структура
β-Каротин
Сопряженная система, включающая 22 р-электрона
17
18.
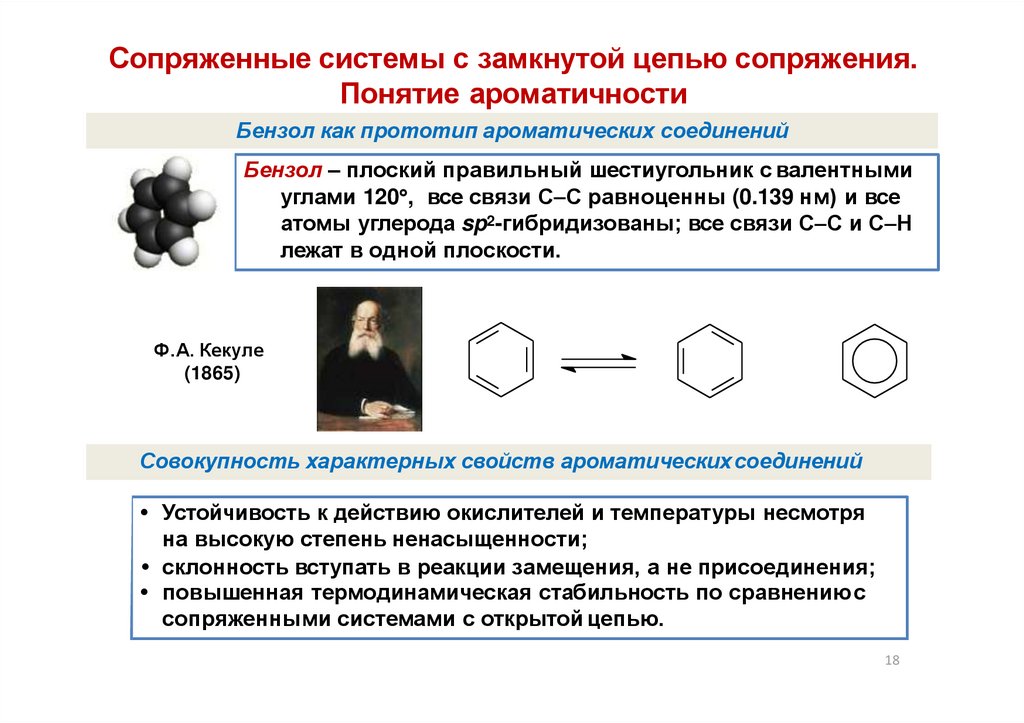
Сопряженные системы с замкнутой цепью сопряжения.Понятие ароматичности
Бензол как прототип ароматических соединений
Бензол – плоский правильный шестиугольник с валентными
углами 120 , все связи С С равноценны (0.139 нм) и все
атомы углерода sp2-гибридизованы; все связи С С и С Н
лежат в одной плоскости.
Ф.А. Кекуле
(1865)
Совокупность характерных свойств ароматических соединений
Устойчивость к действию окислителей и температуры несмотря
на высокую степень ненасыщенности;
склонность вступать в реакции замещения, а не присоединения;
повышенная термодинамическая стабильность по сравнениюс
сопряженными системами с открытой цепью.
18
19.
АроматичностьСоединение ароматично, если оно имеет плоский цикл и
сопряженную -электронную систему, охватывающую все
атомы цикла и содержащую 4n + 2 р-электрона (n = 0, 1, 2, 3 и
т.д., правило Хюккеля, 1931)
СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА (6 P-ЭЛЕКТРОНОВ, n = 1)
Гипотетические структуры
p-орбитали непоказаны
негибридизованные
p-орбитали
Окончательная
структура
Выравнивание
связей и зарядов
Термодинамическая стабильность бензола (его энергия
cопряжения или энергия делокализации) — 150 кДж/моль
19
20.
Примеры ароматических соединенийКонденсированные ароматические системы
нафталин
10 -электронов
(n = 2)
антрацен
14 -электронов
(n = 3)
Ароматические гетероциклы
N
H
O
N
пиррол
фуран
пиридин
25
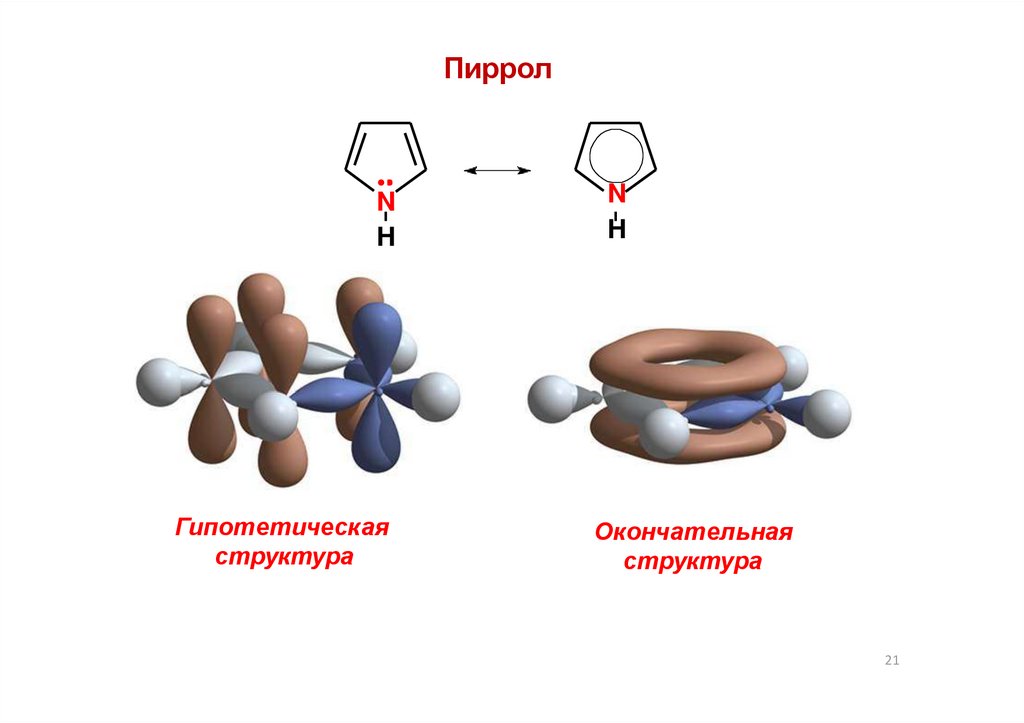
21.
ПирролN
H
Гипотетическая
структура
N
H
Окончательная
структура
21
22.
Гем(входит в состав кислородпереносящего белка гемоглобина)
H3C
CH3
CH
HOOCCH2CH2
N
CH2
N
Fe
N
N
CH3
HOOCCH2CH2
H3C
CH
CH2
n = 6, 4 × 6 + 2 = 26 p-электронов
22
23.
Основные характеристики ковалентной связиДлина связи ─ расстояние между центрами связанных атомов (нм)
C─C
C=C
C≡C
C─O
C=O
C─N
C=N
C≡N
0.154 0.134 0.120 0.143 0.121 0.147 0.128 0.116
Двойная связь короче одинарной, тройная – короче двойной
Энергия связи ─ средняя величина энергии, необходимой для
гомолитического разрыва связи (энергия диссоциации, кДж/моль)
C─C
C=C
C≡C
C─O
C=O
C─N
C=N
C≡N
348
620
834
414
473
331
277
239
Чем больше энергия связи, тем связь прочнее;
чем длиннее связь ─ тем меньше ее энергия (т.е. связь слабее)
23
24.
Электроотрицательность (ЭО) — способность атома в молекулепритягивать электроны, участвующие в образовании химической связи
ШКАЛА ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ ПОЛИНГА
Na
Li
H
S
Csp3
0.9
1.0
2.1
2.5
2.5
Лайнус Полинг
1901 – 1994
увеличение ЭО
СNO F
Cl
Br
I
у
в
е
л
и
ч
е
н
и
е
I
Br
Csp2
Cl
2.6 2.8
2.8
3.0 3.1 3.5
Csp
O
F
4.0
увеличение ЭО
Csp
Csp2
Csp3
ЭО
24
25.
Полярность связи ─ неравномерное распределение электроннойплотности между связанными атомами, вызванное ее смещением в
сторону одного из атомов
Неполярная связь – пары электронов связи в равной степени
принадлежат обоим связываемым атомам
CH3 CH3
CH2 CH2
CH CH
Полярная связь – ковалентная связь, электронная плотность
которой смещена в сторону более электроотрицательного атома
C + Cl –, C + O –, C + N –, O – H +, C – Mg +
Неполярные связи
СН3 СН3
Малополярные связи
СН3
Полярные связи
СН3
F
Н
СН3
СН3 SH
СН3 I
OH
C O
СН3
CH = CH2
C C
H
О
Н
Разница в электроотрицательности ( ) характеризует степень
полярности связи.
25
26.
Электронные эффекты• Взаимное влияние атомов в молекулах передается с помощью
электронных и пространственныхэффектов.
Индуктивный эффект (I-эффект) — передача электронного влияния
заместителя по цепи -связей.
По сравнению с атомом водорода, IH = 0
Н
+ICH
К. Ингольд
1893–1970
3
Н
СН2
СН2
Н
F
I CF3
С
F
F
C
CH2
CH2
+IO
I NH +
3
O
+
H3N
CH2
CH2
CH2
CH2
CH2
CH2
Электронодонорные заместители — СН3 и др. алкилы, Li, Na, Mg, O —
обладают положительным I-эффектом (+I)
Электроноакцепторные заместители — Hal, OH, H2O+, NH2, NH3+, NO2,
C N, C(O)H, C(O)R, COOH, COOR, SO3H — обладают
отрицательным I-эффектом (–I)
26
27.
Мезомерный эффект (M-эффект) — передача электронного влияниязаместителя по цепи сопряжения
+М-эффект
+MCH O
3
СН3 О СН
СН2
+MNH
2
винилметиловый эфир
NH2
анилин
Электронодонорные заместители — С=C, C6H5, OH, OR, O , NH2
–М-эффект
О
МСНО СН = СН — С
2
Н
акролеин
О
М СООН
С
ОН
бензойная кислота
Электроноакцепторные заместители — C=O, COOH, C=C, C6H5, NO2
— Индуктивные и мезомерные эффекты заместителей могут не
совпадать по направлению;
— эти эффекты влияют на реакционную способность соединений
27
28.
Электронные эффекты некоторых заместителейЗаместитель
Электронные эффекты
индуктивный
мезомерный
Алкильные группы (R)
+I
O
+I
+M
NH2, NHR, NR2
I
+M
OH, OR
NH3+, NR3 +
I
+M
I
Галогены (F, Cl, Br, I)
I
+M
C=O
I
M
COOH, COOR
I
M
NO2
I
M
C N
I
M
SO3H
I
M
Характер
совместного действия
28
29.
Кислотность и основность органических соединенийТеория Бренстеда – Лоури (1923 г.)
Кислота – нейтральная молекула или ион, способная
отдавать протон (H+), т.е. донор протона.
Основание – нейтральная молекула или ион, способная
присоединить протон, т.е. акцептор протона.
Й.-Н. Брёнстед
1879—1947
Сопряженные кислотно-основные пары
Кислота
Н+ + Сопряженноеоснование
Основание + Н+ Сопряженная кислота
СH3COOH (ж) + H2O CH3COO– (водн.) + H3O+ (водн.)
Т. М. Лоури
1874—1936
(СН3)3N + H2O (CH3)3NH+ + OH–
29
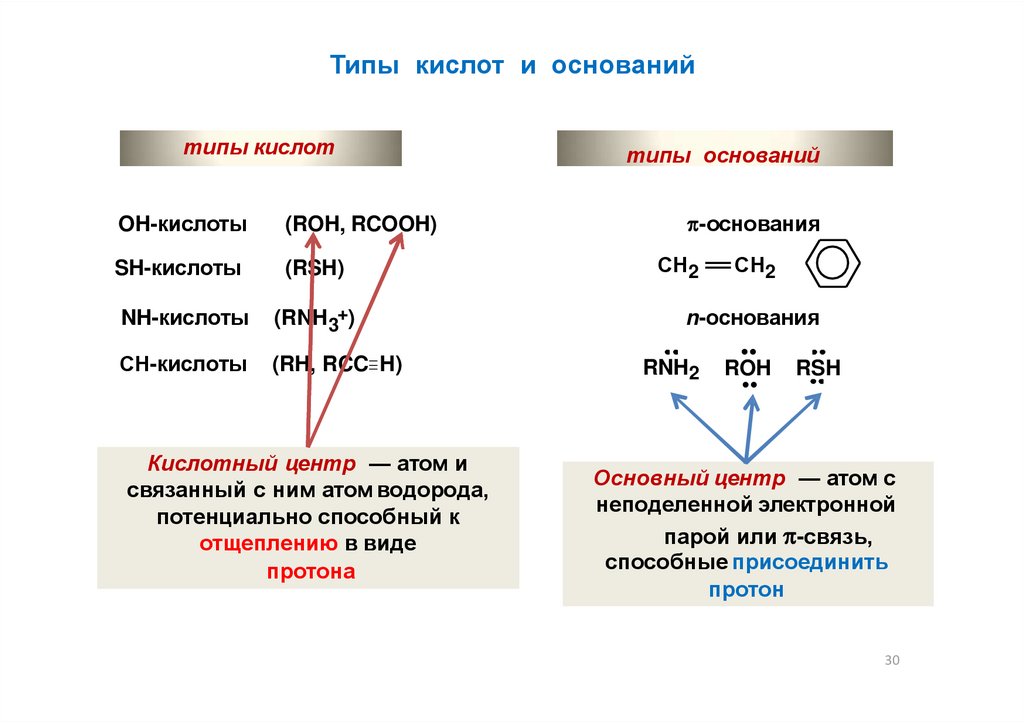
30.
Типы кислот и основанийтипы кислот
OH-кислоты
(ROH, RCOOH)
SH-кислоты
(RSH)
NH-кислоты
(RNH3+)
СН-кислоты
(RH, RCC H)
Кислотный центр — атом и
связанный с ним атом водорода,
потенциально способный к
отщеплению в виде
протона
типы оснований
-основания
СН2
СН2
n-основания
RNH2
ROH
RSH
Основный центр — атом с
неподеленной электронной
парой или -связь,
способные присоединить
протон
30
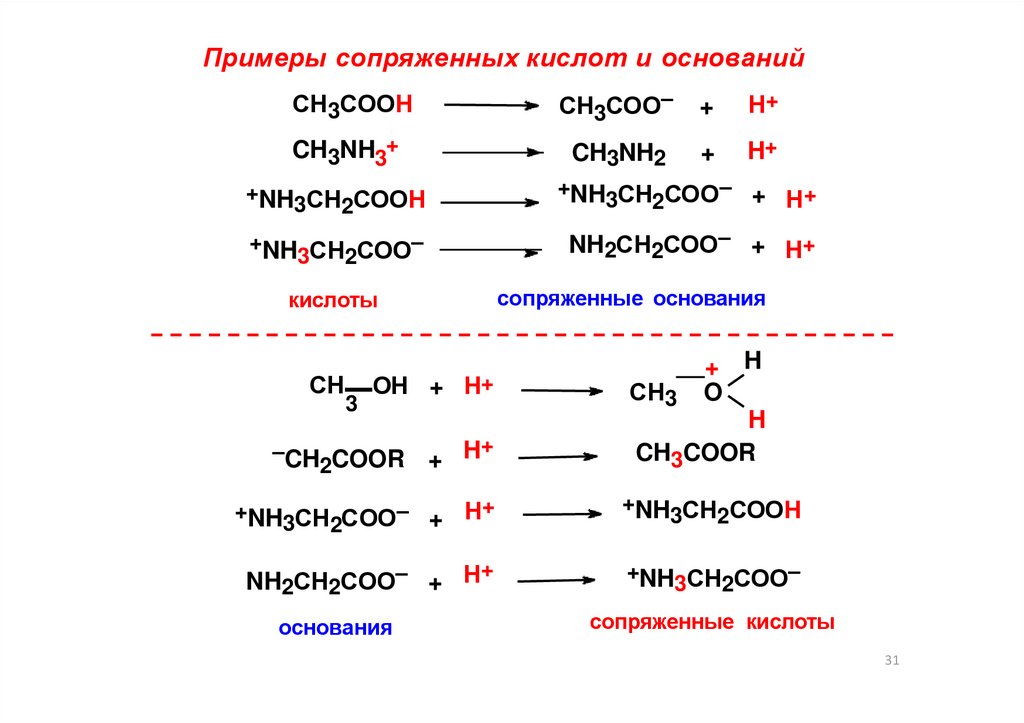
31.
Примеры сопряженных кислот и основанийСН3СООН
СН3СОО–
+
Н+
CH3NH3+
CH3NH2
+
H+
+NH СН СООН
3
2
+NH СН СОО– +
3
Н+
2
+NH СН СОО–
3
2
NH2СН2СОО– + Н+
сопряженные основания
кислоты
СН
3
ОН + Н+
–CH COOR
2
+
H
+
+ H
СН3 O
H
CH3COOR
+NH СН СОО– + Н+
3
2
+NH СН СООН
3
2
+
NH2СН2СОО– + Н
+NH СН СОО–
3
2
основания
сопряженные кислоты
31
32.
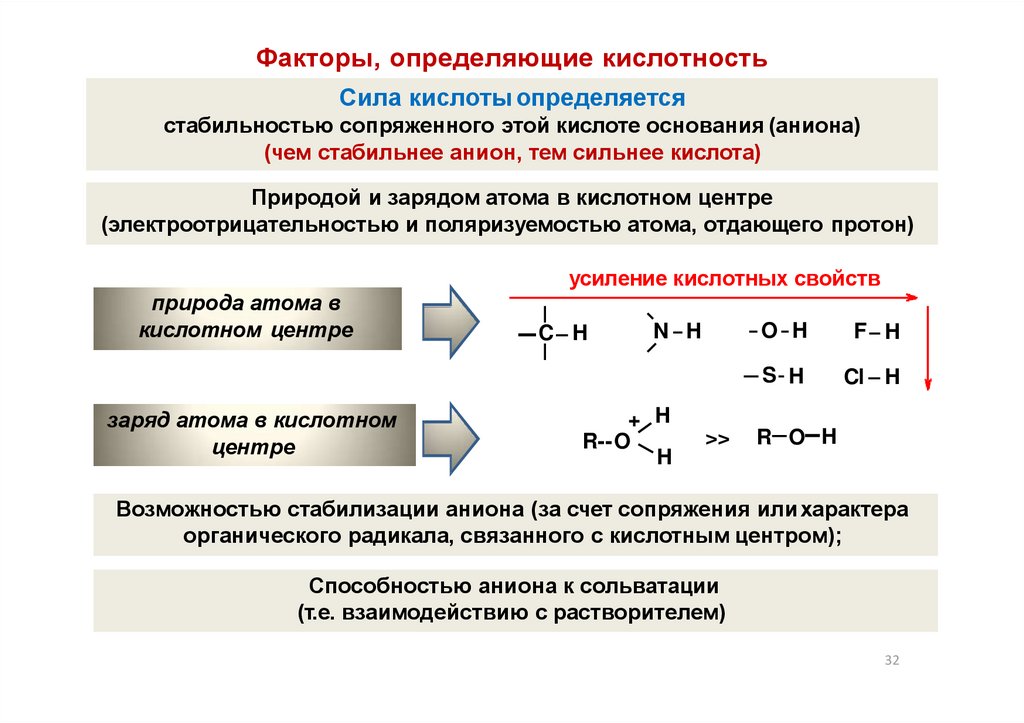
Факторы, определяющие кислотностьСила кислоты определяется
стабильностью сопряженного этой кислоте основания (аниона)
(чем стабильнее анион, тем сильнее кислота)
Природой и зарядом атома в кислотном центре
(электроотрицательностью и поляризуемостью атома, отдающего протон)
усиление кислотных свойств
природа атома в
кислотном центре
заряд атома в кислотном
центре
C H
N H
+ H
R--O
H
>>
O H
F H
S H
Cl H
R O H
Возможностью стабилизации аниона (за счет сопряжения илихарактера
органического радикала, связанного с кислотным центром);
Способностью аниона к сольватации
(т.е. взаимодействию с растворителем)
32
33.
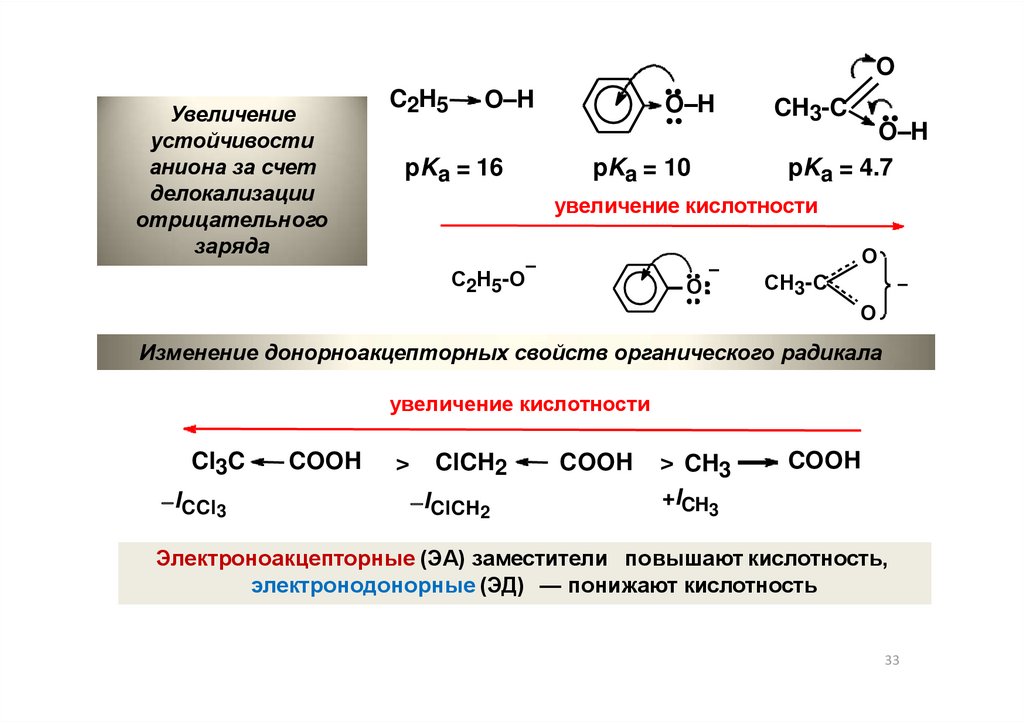
OУвеличение
устойчивости
аниона за счет
делокализации
отрицательного
заряда
C2H5
O–H
pKa = 16
O–H
pKa = 10
CH3-C
O–H
pKa = 4.7
увеличение кислотности
О
С2Н5-О
О
СН3-С
О
Изменение донорноакцепторных свойств органического радикала
увеличение кислотности
Cl3C
ICCl3
COOH
>
ClCH2
IClCH2
COOH
> CH3
COOH
+ICH3
Электроноакцепторные (ЭА) заместители повышают кислотность,
электронодонорные (ЭД) — понижают кислотность
33
34.
Факторы, определяющие основностьИх влияние, как правило, противоположно, влиянию факторов,
определяющих кислотность
увеличение основности
Природа атома
в основном
центре
N
O
F
S
Cl
Заряд основного центра
R O
>> R-O-H
Изменение донорноакцепторных свойств органического радикала
увеличение основности
CH3
CH3
NH2
>
NH2 >
NH3 >
NH2
NH2 > NO2
NH2
Электроноакцепторные (ЭА) заместители понижают основность,
электронодонорные (ЭД) – повышают основность
34





















 chemistry
chemistry








