Similar presentations:
Строение электронных оболочек атомов. 8 класс
1.
Тюменская область,Ханты-Мансийский автономный округ – Югра,
г. Когалым, МАОУ СОШ №7
8 класс
Разработала учитель химии высшей квалификационной категории
Вакенгут Ирина Эгоновна
При создании 3 и 4 слайда были использованы материалы из презентации учителя
химии из с. Охтеурье Нижневартовского района ХМАО-Югры Тюменской области
Баженова Алексея Анатольевича
2.
Содержание1.Орбитально-планетарная модель строения атома
2.Строение электронных оболочек атомов
3.Схемы строения электронных оболочек.1 период
4.Схемы строения электронных оболочек.2 период
5.Схемы строения электронных оболочек.3 период
6.Проверь свои знания
7.Домашнее задание
3.
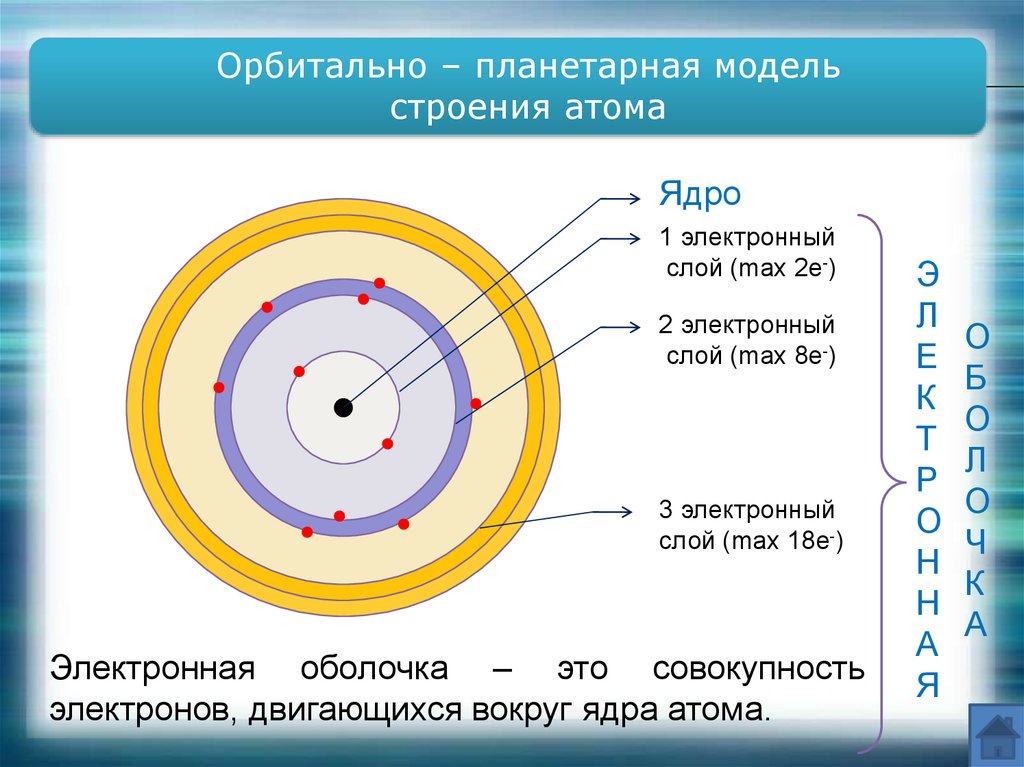
Орбитально – планетарная модельстроения атома
Ядро
1 электронный
слой (max 2e-)
2 электронный
слой (max 8e-)
3 электронный
cлой (max 18e-)
Электронная оболочка – это совокупность
электронов, двигающихся вокруг ядра атома.
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
О
Б
О
Л
О
Ч
К
А
4.
Строение электронных оболочек атомовЭлектроны
в(N)совпадает
электронной
оболочке
Номер
n
Число
Номер
– главное
электронов
группы
периода
квантовое
совпадает
число
на
уровне
с –числом
определяет
рассчитывается
с электронов
числом
число
располагаются
на
энергетических
уровнях.
энергетических
энергетических
по
на
формуле.
последнем энергетическом
уровней
уровней
элемента.
.
уровне.
N = 2n2
Период
3
3
Группа
n = 1, N = 2 . 12 = 22
V
5
n = 2, N = 2 . 22 = 88
15
Общее число электронов
е=
Р
30,9748
Фосфор
Проверка
15
5.
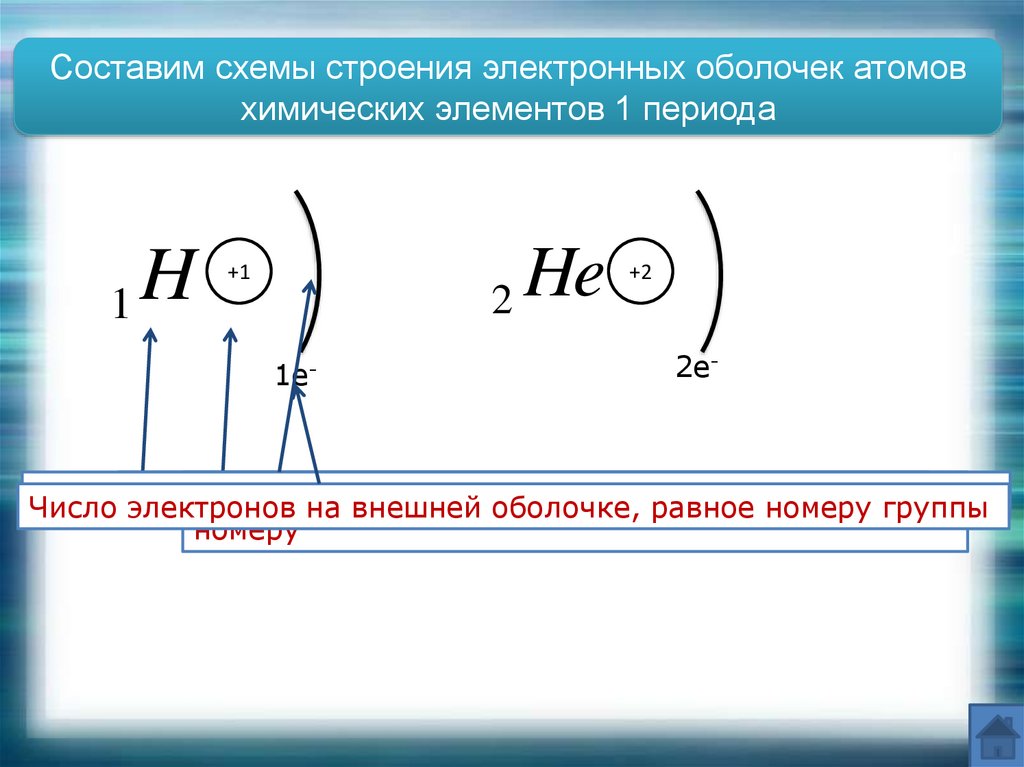
Составим схемы строения электронных оболочек атомовхимических элементов 1 периода
H
1
2 He
+1
1e-
+2
2e-
Электронная
Химический
Заряд
оболочка
ядра
знак
атома
(число
водорода
водорода,
оболочек
и его равный
порядковый
равно
номеру
порядковому
номер
периода)
Число
электронов
на
внешней
оболочке,
равное
номеру
группы
номеру
6.
Составим схемы строения электронных оболочек атомовхимических элементов 2 периода
3 Li
4 Be
+3
2e- 2e-
2e- 1e-
6C
+6
7
2e- 4e-
9F
5B
+4
N
2e- 7e-
2e- 3e-
8O
+7
2e- 5e-
10 Ne
+9
+5
+8
2e- 6e-
+10
2e- 8eАтом неона имеет завершенную
электронную оболочку
7.
Составим схемы строения электронных оболочек атомовхимических элементов 3 периода
11 Na
12 Mg
+11
2e- 8e- 1e-
14 Si
2e- 8e- 4e-
17 Cl
+13
2e- 8e- 3e-
2e- 8e- 2e-
15 P
+14
13 Al
+12
+15
16 S
+16
2e- 8e- 5e-
+17
2e- 8e- 7e-
18 Ar
2e- 8e- 6e+18
2e- 8e- 8e-
8.
Проверь свои знанияА1. Энергия электрона максимальна на энергетическом уровне
верно
4) 4
ошибка
1) 1
ошибка
2) 2
ошибка
3) 3
А2. Максимальное число электронов на второй электронной оболочке
верно
ошибка
1) 2
ошибка
2) 4
ошибка
3) 6
4) 8
А3. Максимальное число электронов на четвертой электронной оболочке
ошибка
1) 4
ошибка
2) 16
верно
3) 32
ошибка
4) 64
А4. Максимальное число электронов на пятой электронной оболочке
ошибка
1) 5
верно
2) 50
ошибка
3) 125
ошибка
4) 625
А5. Электронная оболочка атома натрия содержит энергетических уровней
2) 2
4) 4.
ошибка
1) 1
ошибка
верно
3) 3
ошибка
А6. Электронная оболочка атома бора содержит энергетических уровней
ошибка
1) 1
верно
2) 2
ошибка
3) 3
ошибка
4) 4
А7. На электронных уровнях атома магния 12Mg электроны распределяются
следующим образом
ошибка
ошибка
4) 2е,10е
3)
2е,8е,5е
2)ошибка
1е,10е,1е
1) верно
2е,8е,2е
А8. Сферическую форму имеет орбиталь
ошибка
1) f
ошибка
2) d
3) p
ошибка
верно
3) s
9.
Проверь свои знанияА9. На внешнем энергетическом уровне атома хлора содержится электронов
ошибка
ошибка
1) 3
2) 5
верно
3) 7
ошибка
4) 8
А10. На внешнем энергетическом уровне атома алюминия
содержится электронов
ошибка
верно
1) 3
ошибка
2) 5
3) 7
ошибка
4) 8
А11. Инертный газ может содержать на внешнем энергетическом уровне
электронов
ошибка
1) 3
ошибка
2) 5
ошибка
3) 7
верно
4) 8
10.
Проверь свои знанияВ1. Установите соответствие между распределением электронов по
уровням атома элемента и символом этого элемента. Ответ дайте в виде
последовательности цифр, соответствующей буквам по алфавиту.
РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ
А) 2е,8е,2е
Б) 2е,8е,4е
В) 2е,8е,6е
Г) 2е,8е,8е
СИМВОЛ ЭЛЕМЕНТА
1) S
2) Ar
3) Mg
4) Si
ответ
3412
11.
Домашнее заданиеЧитать §8 (страницы 46-50).
Выучить ключевые понятия темы на странице 52.
Выполнить письменно упражнения 1 и 2
на странице 52.









 chemistry
chemistry








