Similar presentations:
Строение электронных оболочек атомов химических элементов
1. «Строение электронных оболочек атомов химических элементов»
2. Цель урока:
• научиться составлять электронныеформулы атомов элементов первых
трех периодов ПСХЭ;
• объяснять зависимость и закономерные изменения свойств химических
элементов от электронного строения
их атомов.
3. Электронная оболочка
• Совокупность всех электронов в атоме,окружающих ядро
• Каждый электрон имеет свою траекторию
движения и запас энергии
• Электроны расположены на различном
расстоянии от ядра: чем ближе электрон к
ядру, тем он прочнее с ним связан, его труднее
вырвать из электронной оболочки
• По мере удаления от ядра запас энергии
электрона увеличивается, а связь с ядром
становится слабее
4. Электронная оболочка (энергетический уровень)
- это совокупность электронов,близких по значению энергии.
Число электронных оболочек у а
тома химического элемента рав
но номеру периода (n), в котор
ом он находится.
Максимальное число электронов
на уровне (N) = 2n2.
5. Запомните!
• Электроны, расположенные напоследней электронной оболочке,
называются внешними
• Число внешних электронов для
химических элементов главных
подгрупп равно номеру группы, в
которой находится элемент
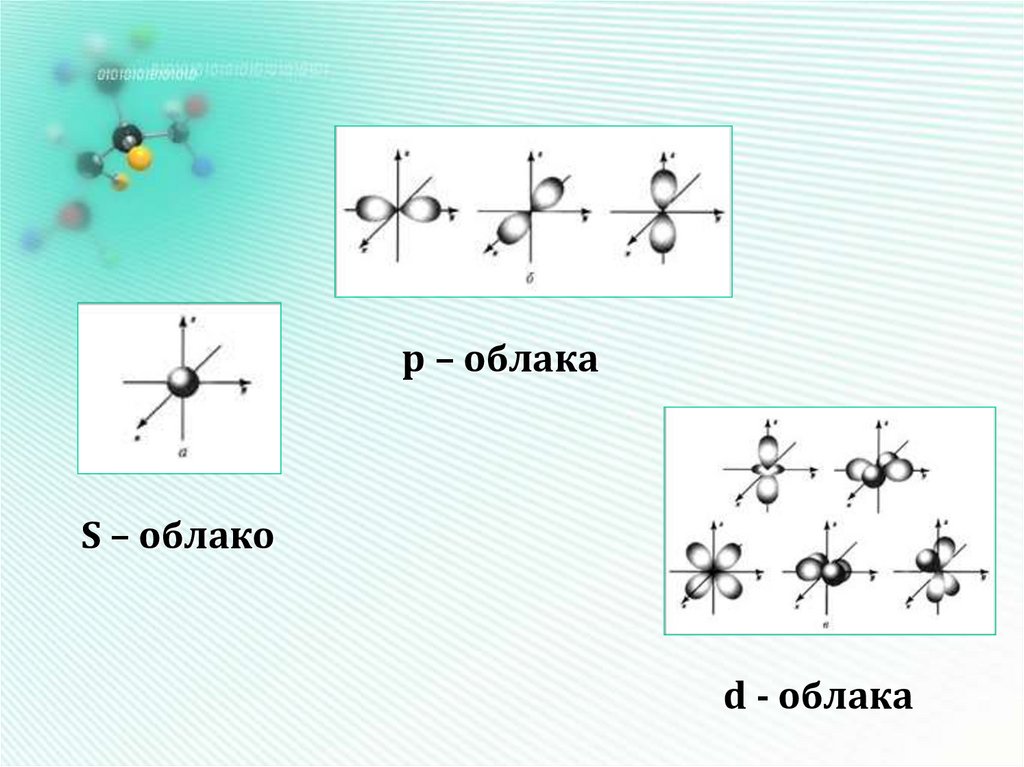
6. Форма электронных облаков (орбиталей)
Орбиталь – это область наиболее вероятного местонахождения электрона в пространстве7.
р – облакаS – облако
d - облака
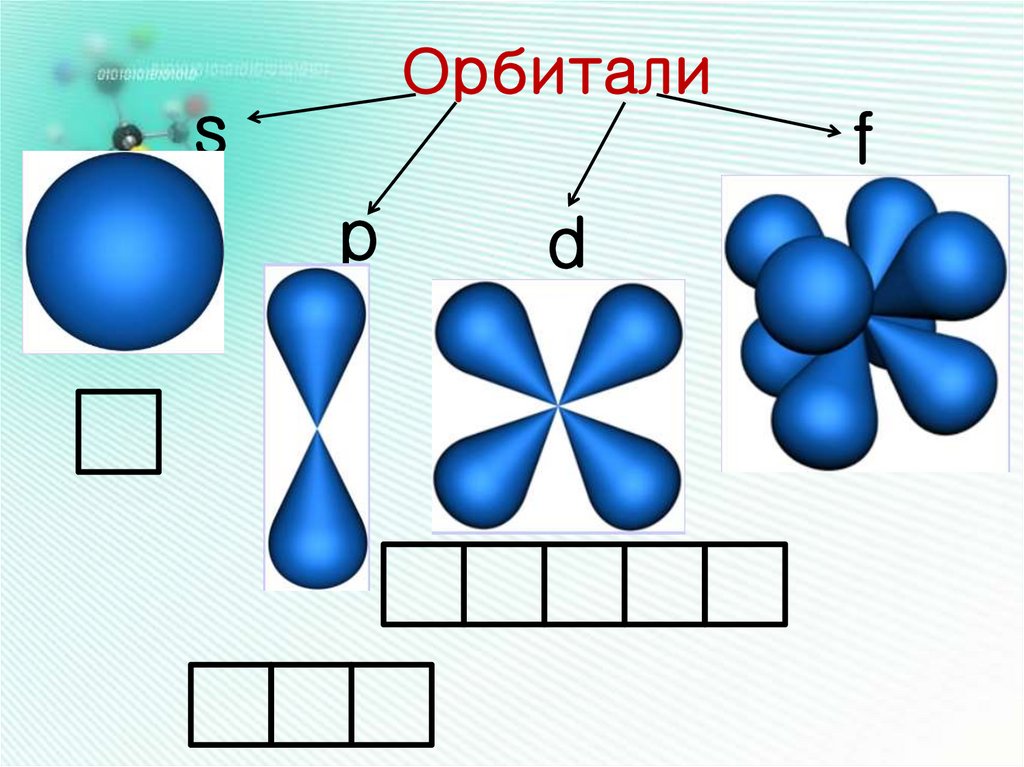
8.
Орбиталиs
f
p
d
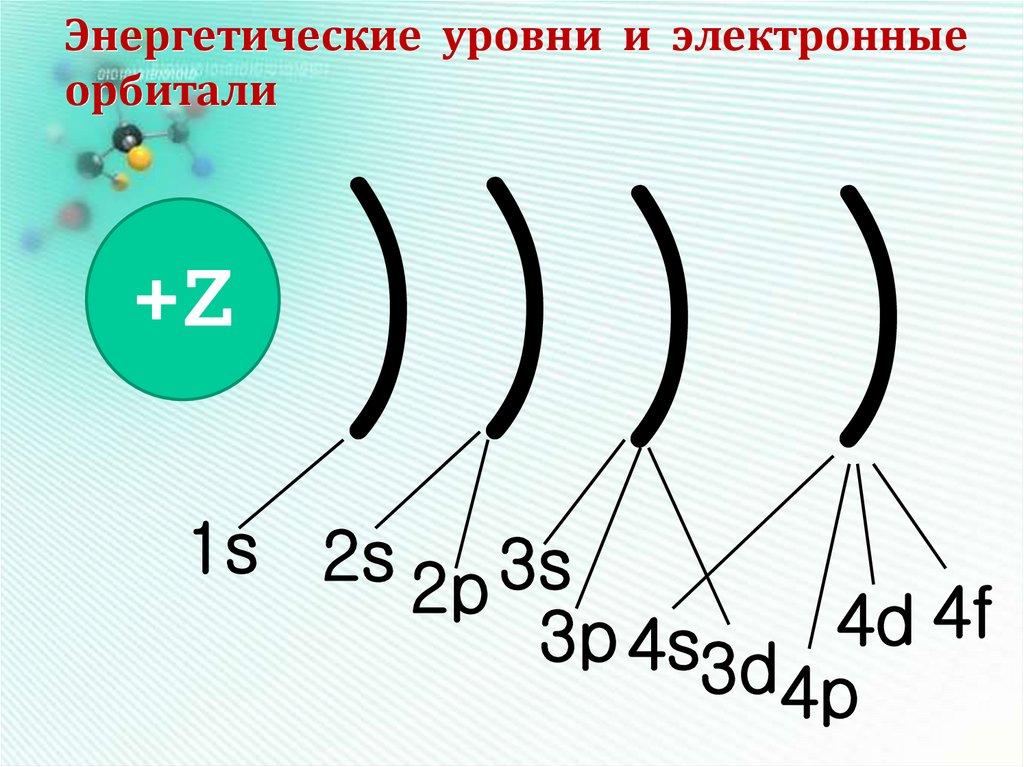
9. Энергетические уровни и электронные орбитали
+Z))) )
1s 2s 3s
2p
4f
4d
3p 4s3d
4p
10. Распределение электронов по орбиталям
Распределение электронов по орбиталям
1. s-орбитали заполняются в пер
вую очередь. Затем заполняются
р-орбитали
2. На каждой орбитали (клеточке
) может находиться не более 2 э
лектронов.
3. Электрон обозначается стрелоч
или
ками
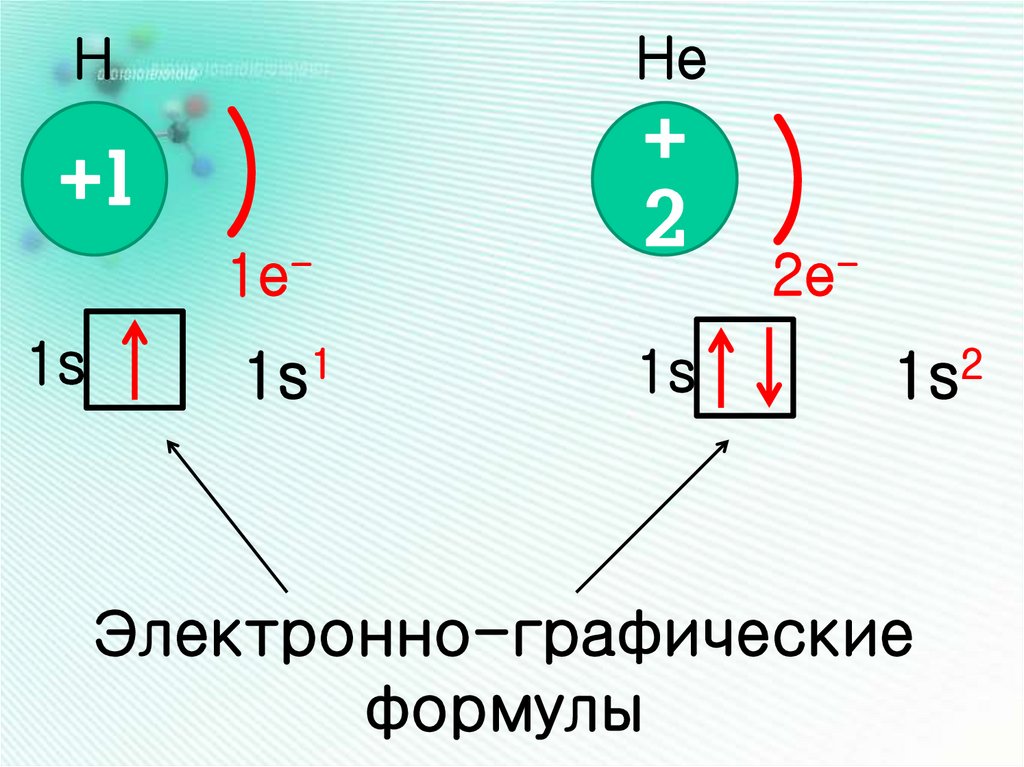
11.
НHe
+1
+
2
)
1e-
1s
1s1
1s
)
2e-
1s2
Электронно-графические
формулы
12.
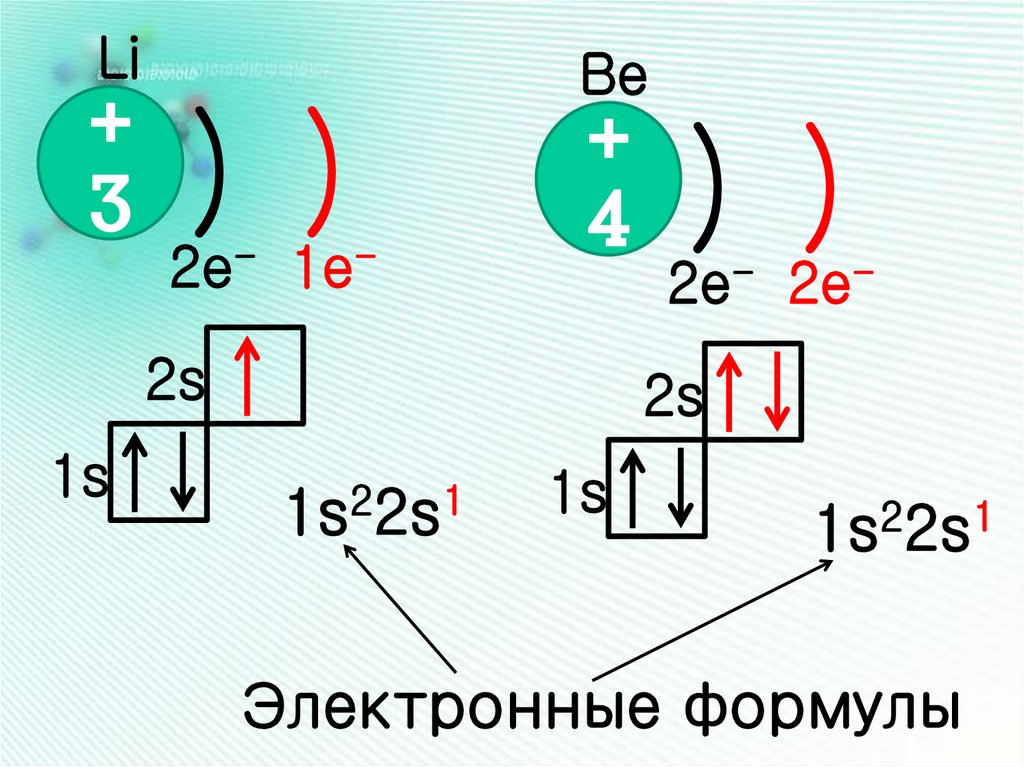
Li+
3
) )
2e- 1e-
Be
+
4
2s
1s
) )
2e- 2e2s
1s22s1
1s
1s22s1
Электронные формулы
13.
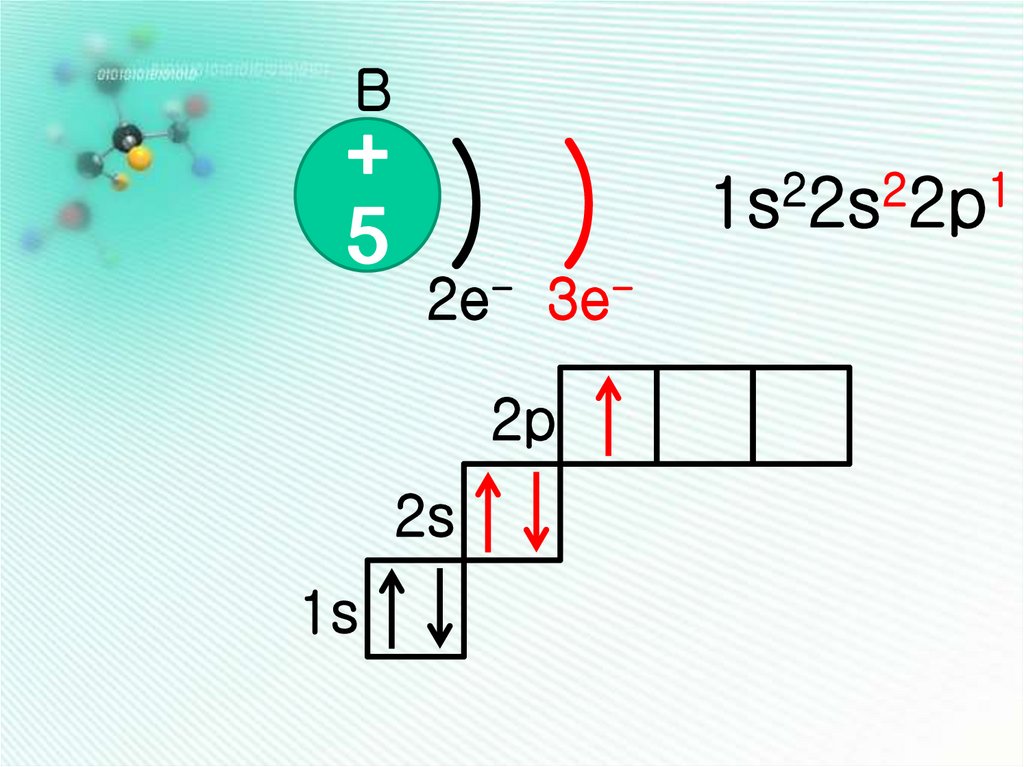
B+
5
) )
2e- 3e2p
2s
1s
1s22s22p1
14.
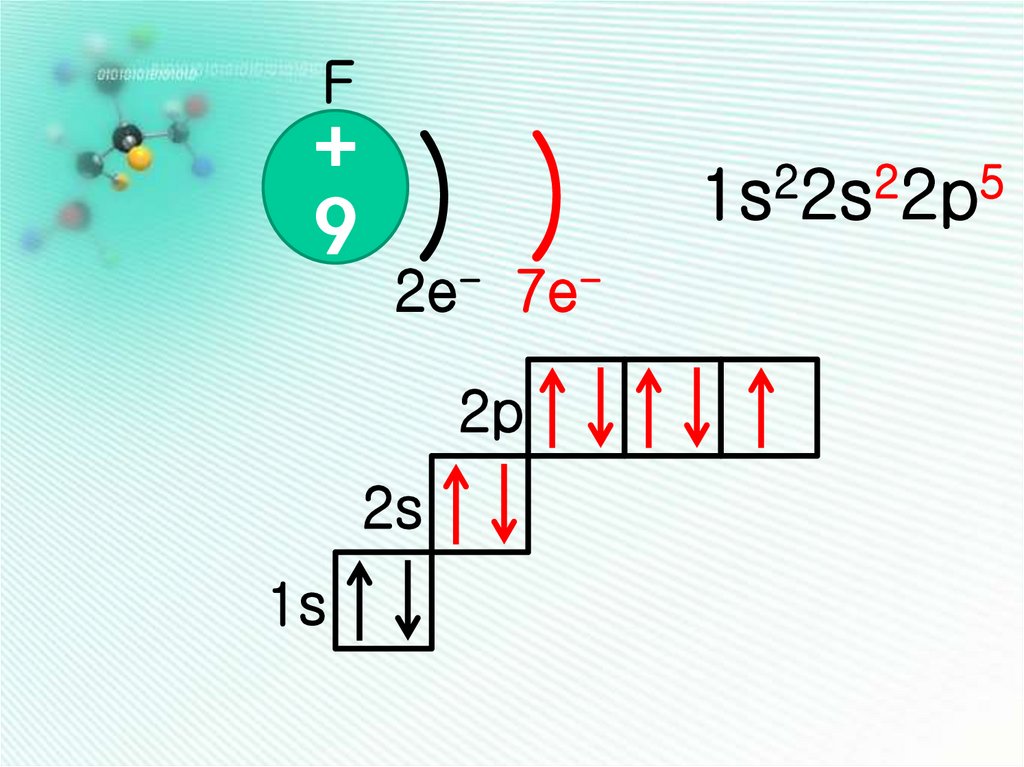
F+
9
) )
2e- 7e-
2p
2s
1s
2
2
5
1s 2s 2p
15.
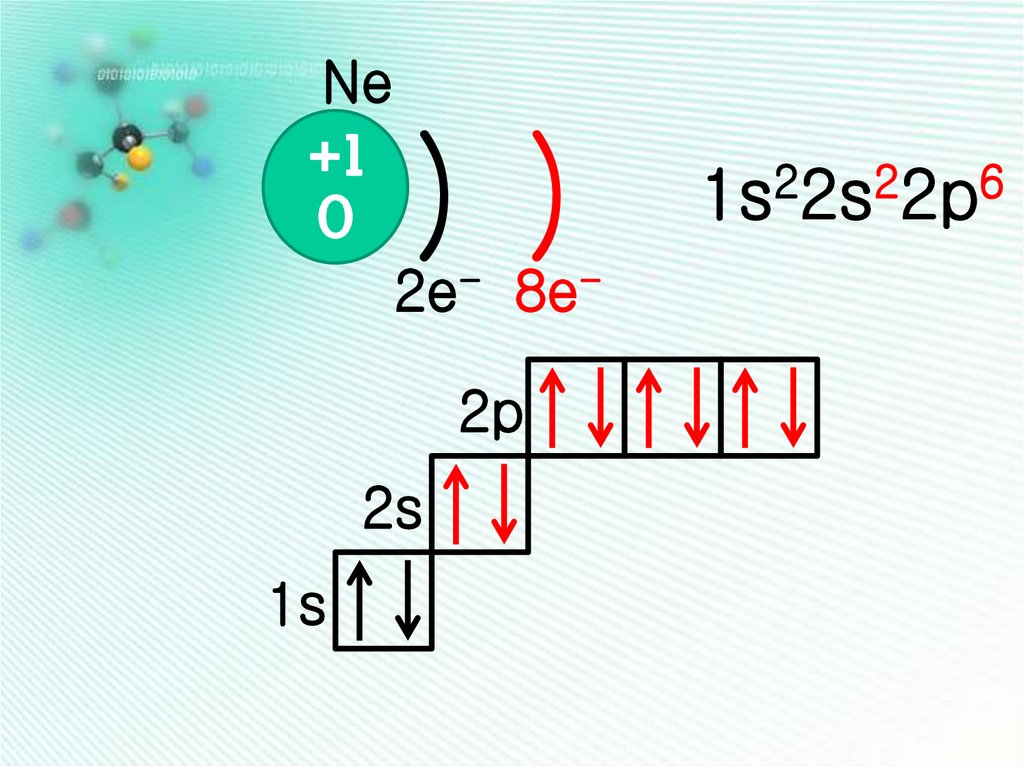
Ne+1
0
) )
2e- 8e-
2p
2s
1s
2
2
6
1s 2s 2p







 chemistry
chemistry








