Similar presentations:
Строение электронных оболочек атомов химических элементов
1. У нас все получится!
2.
Вспомните!• Чему равно общее количество
электронов в атоме?
• Что такое энергетический
уровень?
• Как определить число
энергетических уровней?
• Как определить число
электронов на внешнем уровне?
3. Запомните!
• Электроны, расположенные напоследней электронной оболочке,
называются внешними
• Число внешних электронов для
химических элементов главных
подгрупп равно номеру группы, в
которой находится элемент
4. Проверка домашнего задания
ЗаданияВариант 1
Вариант 1
1. По данным
определить, какой
это элемент
а)2e 8e 3e
б)2e 1e
в)2e 8e 8e
а)2e 4e
б)2e 8e 7e
в)1e
2. Определить
элемент по его
положению в ПСХЭ
а)2период
3 группа главная
подгруппа
б)5 период
1 группа побочная
подгруппа
а)4 период
3 группа побочная
подгруппа
б)2 период
6 группа главная
подгруппа
5. Проверьте себя и поставьте оценку, равную количеству правильных ответов:
Задание 1.Вариант 1. а) Al б) Li в)Ar
Вариант 2. а) С б) С l в)Н
Задание 2.
Вариант 1. а)В б)Аg
Вариант 2. а) Ga б) O
6. «Строение электронных оболочек атомов химических элементов»
7.
«Строение электронныхоболочек атомов
химических элементов»
8. Цель урока:
• научиться составлять электронныеформулы атомов элементов первых
трех периодов ПСХЭ;
• объяснять зависимость и закономерные изменения свойств химических
элементов от электронного строения
их атомов.
9. Электронная оболочка
• Совокупность всех электронов в атоме,окружающих ядро
• Каждый электрон имеет свою траекторию
движения и запас энергии
• Электроны расположены на различном
расстоянии от ядра: чем ближе электрон к
ядру, тем он прочнее с ним связан, его труднее
вырвать из электронной оболочки
• По мере удаления от ядра запас энергии
электрона увеличивается, а связь с ядром
становится слабее
10.
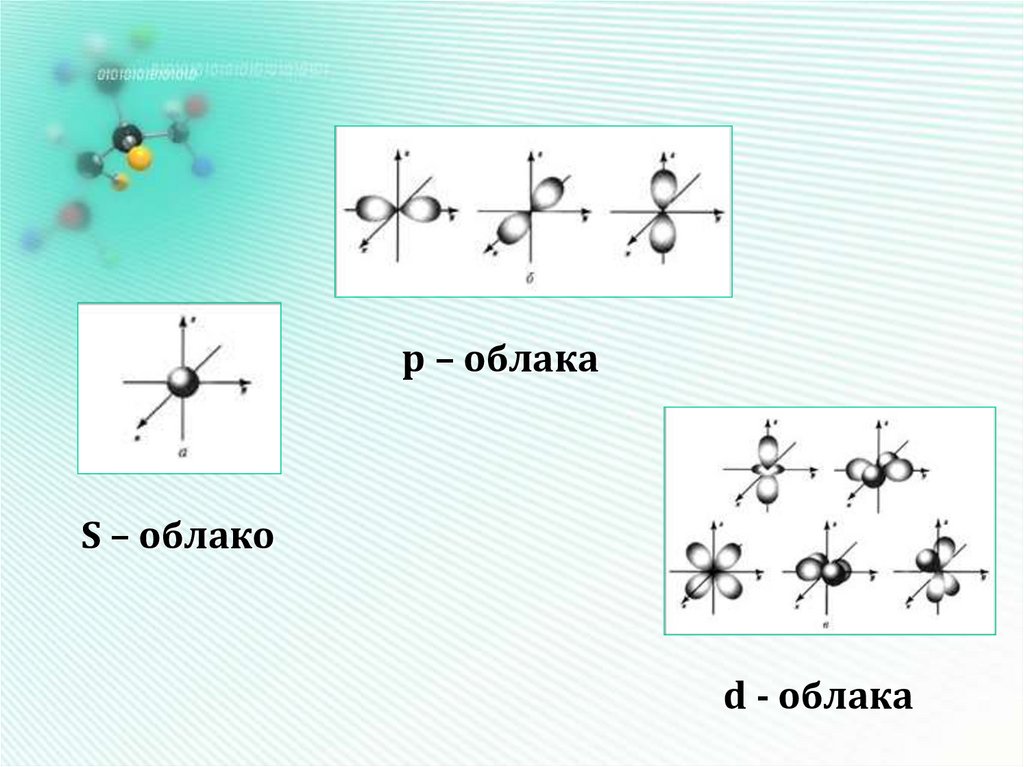
11. Форма электронных облаков (орбиталей)
Орбиталь – это область наиболее вероятного местонахождения электрона в пространстве12.
р – облакаS – облако
d - облака
13. Алгоритм составления электронных формул
• Записываем знак химического элемента изаряд ядра его атома – он равен порядковому
номеру элемента.
• Определяем количество энергетических
уровней (оно равно номеру периода) и количество электронов на каждом уровне.
• Составляем электронную схему и формулу.
14. 1 период
1ēН+1
1
2ē
Нe + 2
2
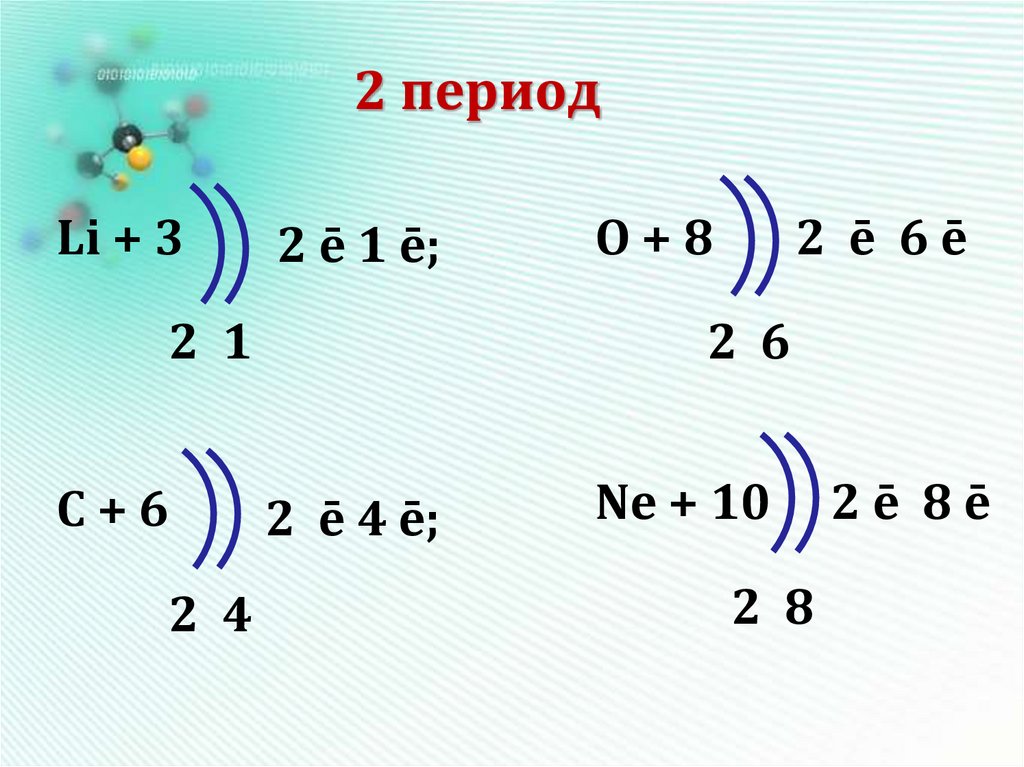
15. 2 период
Li + 32 ē 1 ē;
2 1
С+6
2 4
O+8
2 ē 6ē
2 6
2 ē 4 ē;
Ne + 10
2 8
2ē 8ē
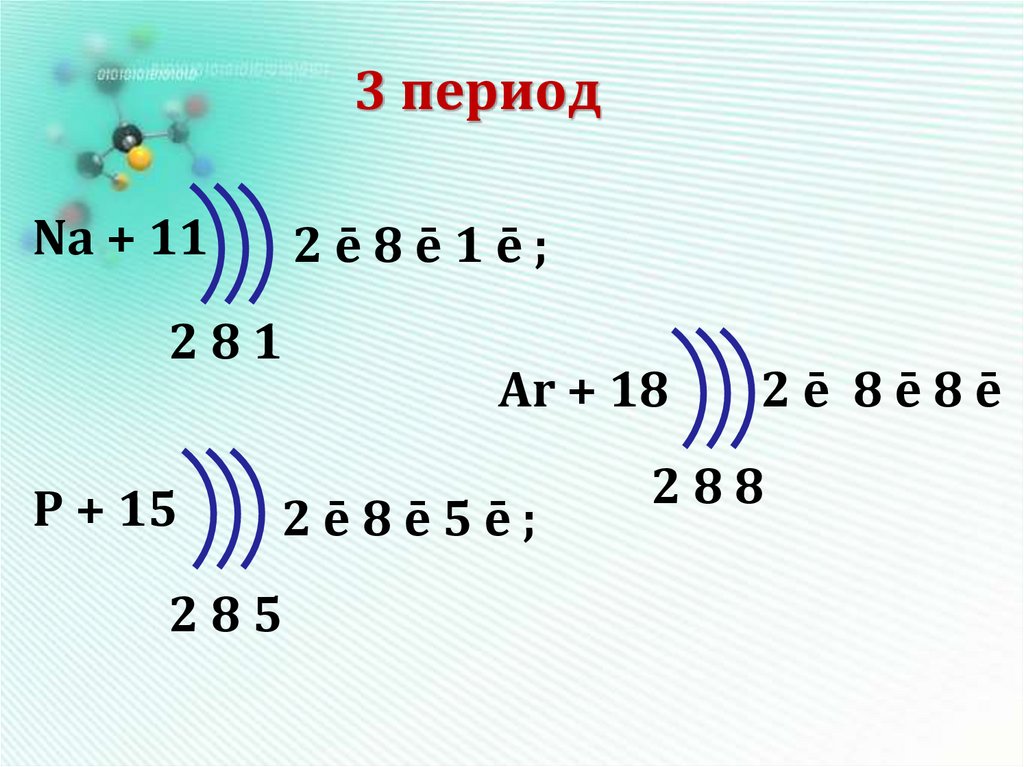
16. 3 период
Na + 112ē8ē1ē;
281
P + 15
Ar + 18
2ē8ē5ē;
285
2ē 8ē8ē
288
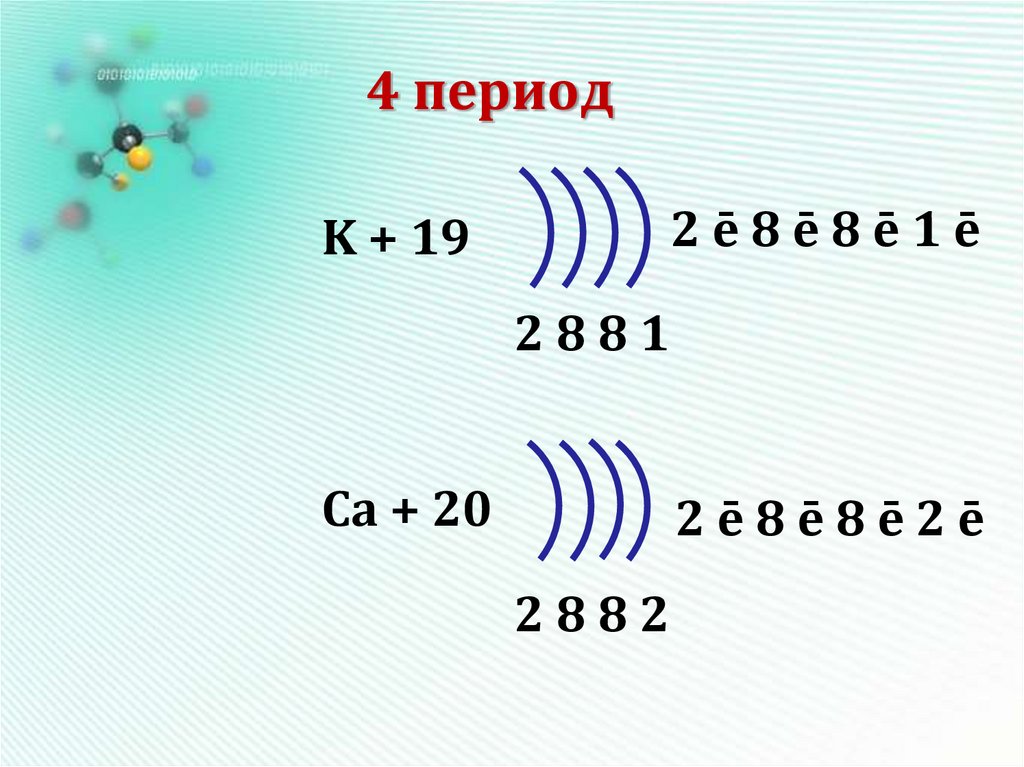
17. 4 период
2ē8ē8ē1ēK + 19
2881
Ca + 20
2ē8ē8ē2ē
2882
18. Физкультминутка
Руки подняли и покачали –Это деревья в лесу.
Руки согнули, кисти встряхнули –
Ветер сбивает росу.
В стороны руки, плавно помашем –
Это к нам птицы летят.
Как они тихо садятся, покажем –
Крылья сложили назад.
19. Игра «Крестики- нолики» выигрышный путь составляют :
а) элементы одного периода2ē2ē
2ē1ē
2ē8ē1ē
2ē4ē
2ē 8ē2ē
2ē6ē
2ē7ē
2ē 5ē
2ē
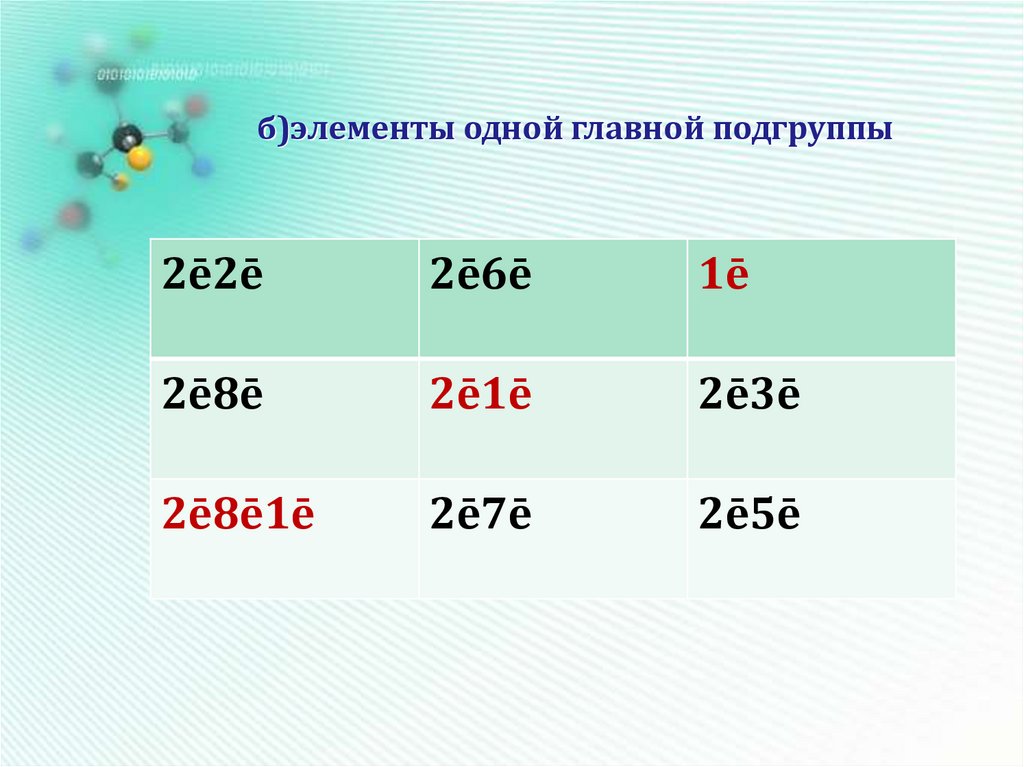
20. б)элементы одной главной подгруппы
2ē2ē2ē6ē
1ē
2ē8ē
2ē1ē
2ē3ē
2ē8ē1ē
2ē7ē
2ē5ē
21. в)элементы, расположенные рядом в ПСХЭ
2ē1ē2ē
2ē4ē
2ē7ē
2ē2ē
2ē6ē
2ē8ē
2ē5ē
2ē3ē
22. Рефлексия
Я все понял, могу объяснитьдругому
По данной теме у меня
остались вопросы
Недостаточно понял тему,
сам ошибаюсь
23. Ответьте на вопросы
• Какие данные об особенностях строения атома отражаетэлектронная формула?
• В чем заключается причина
сходства элементов, расположенных в одной группе?
24. Выводы
• Причина сходства элементов заключается в одинаковом строении внешнихэнергетических уровней их атомов
• Одинаковое строение внешних энергетических уровней периодически (т.е.
через определенные промежутки – периоды) повторяется, поэтому периодически
повторяются и свойства химических элементов
25. Домашнее задание
• §40 стр. 169 – 171.• Упражнение №1, 2 стр. 171.
• Составить электронные схемы и
формулы строения атомов 2 и 3
периодов.
26. Молодцы!
Вы сегодня хорошопотрудились.
Спасибо за урок!





















 chemistry
chemistry








