Similar presentations:
Строение электронных оболочек атомов. 8 класс
1. ВСПОМНИМ
Чему равно общее количествоэлектронов в атоме?
Что такое нуклоны?
Какие нуклоны вы знаете?
Что такое изотопы? Приведите примеры
изотопов.
2. ТЕМА УРОКА
«Строениеэлектронных
оболочек атомов»
3. ЗАПОМНИМ
Электроны, расположенные напоследней электронной
оболочке, называются внешними.
Число внешних электронов для
химических элементов главных
подгрупп равно номеру группы, в
которой находится элемент
4. Цель урока:
научиться составлять электронныеформулы атомов элементов первых
трех периодов ПСХЭ;
объяснять зависимость и
закономерные изменения свойств
химических элементов от
электронного строения их атомов.
5. Электронная оболочка
Совокупность всех электронов ватоме, окружающих ядро
Каждый электрон имеет свою
траекторию движения и запас энергии
Электроны расположены на
различном расстоянии от ядра: чем
ближе электрон к ядру, тем он
прочнее с ним связан, его труднее
вырвать из электронной оболочки
По мере удаления от ядра запас
энергии электрона увеличивается, а
связь с ядром становится слабее
6. S – облако p- облако d - облако
Форма электронныхоблаков (орбиталей)
Область наиболее вероятного
местонахождения электрона в
пространстве
S – облако
p- облако
d - облако
http://files.school-collection.edu.ru/dlrstore/bb14a035-aae7-11db-abbd-0800200c9a66/ch08_08_08.swf
7. Алгоритм составления электронных формул.
Записываем знак химическогоэлемента и заряд ядра его атома –
он равен порядковому номеру
элемента.
Определяем количество
энергетических уровней (оно равно
номеру периода) и количество
электронов на каждом уровне.
Составляем электронную формулу,
учитывая порядок заполнения
каждого уровня – сначала sэлектроны, затем – р-электроны:
номер уровня, вид орбитали и
количество электронов на ней.
8. 1 период
Н+1n=1
1
S
1 S1
Одиночный электрон на незавершенной оболочке
Нe + 2
n=1
2
S
1 S2
S - элементы
2 спаренных электрона на завершенной оболочке
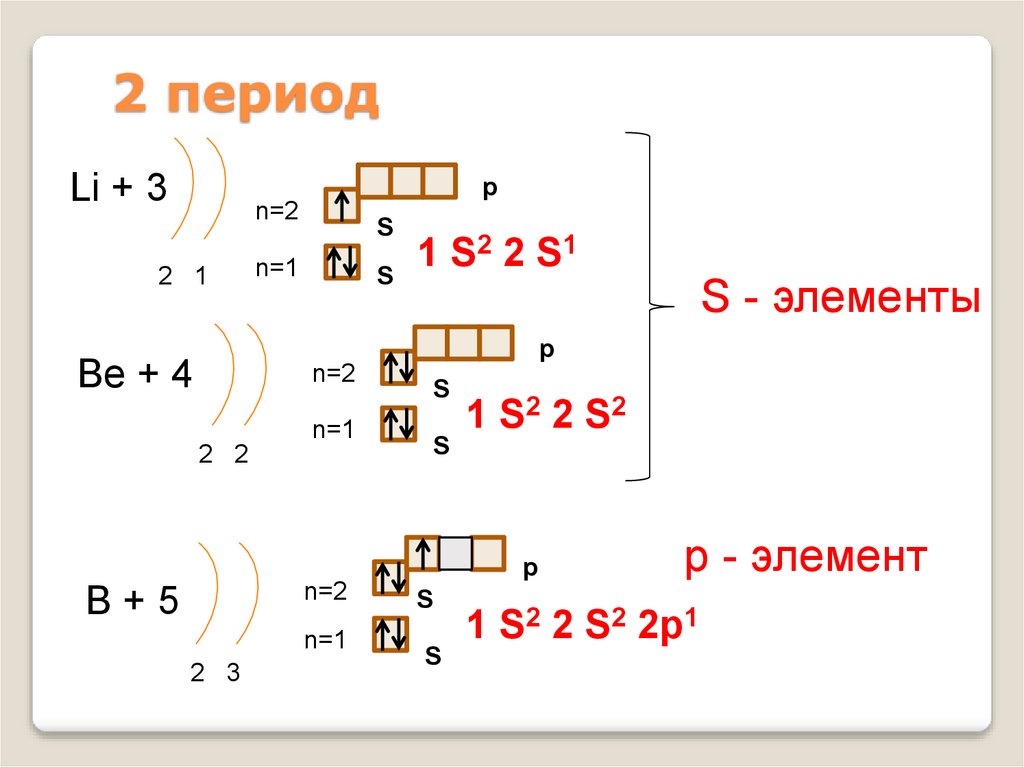
9. 2 период
Li + 3p
n=2
2 1
S
2 2 S1
1
S
S
n=1
S - элементы
p
Be + 4
n=2
n=1
2 2
S
S
1 S2 2 S 2
p
n=2
B+5
n=1
2 3
S
S
р - элемент
1 S2 2 S2 2p1
10. 2 период
С+6p
n=2
2 4
р - элементы
S
2 2 S2 2p2
1
S
S
n=1
p
N+7
n=2
n=1
2 5
S
1 S2 2 S2 2p3
S
p
n=2
O+8
n=1
2 6
S
S
1 S2 2 S2 2p4
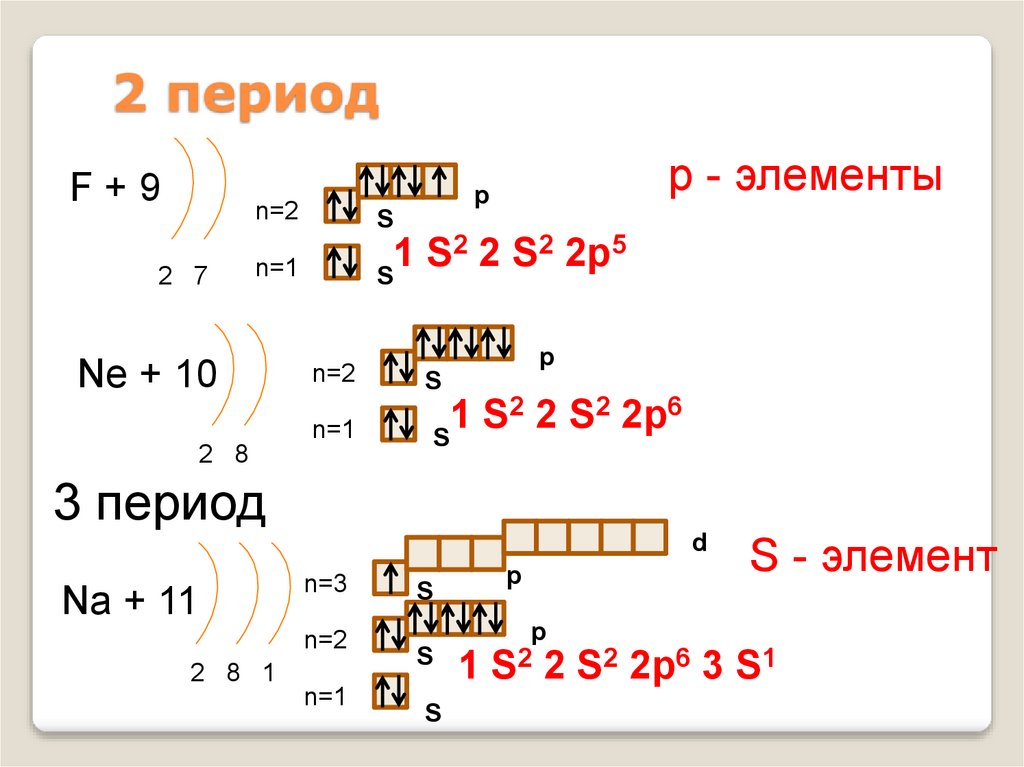
11. 2 период
F+92 7
р - элементы
p
n=2
S
n=1
2 2 S2 2p5
1
S
S
Ne + 10
p
n=2
S
n=1
2 2 S2 2p6
1
S
S
2 8
3 период
d
Na + 11
p
S - элемент
n=3
S
n=2
p
S
1 S2 2 S2 2p6 3 S1
2 8 1
n=1
S
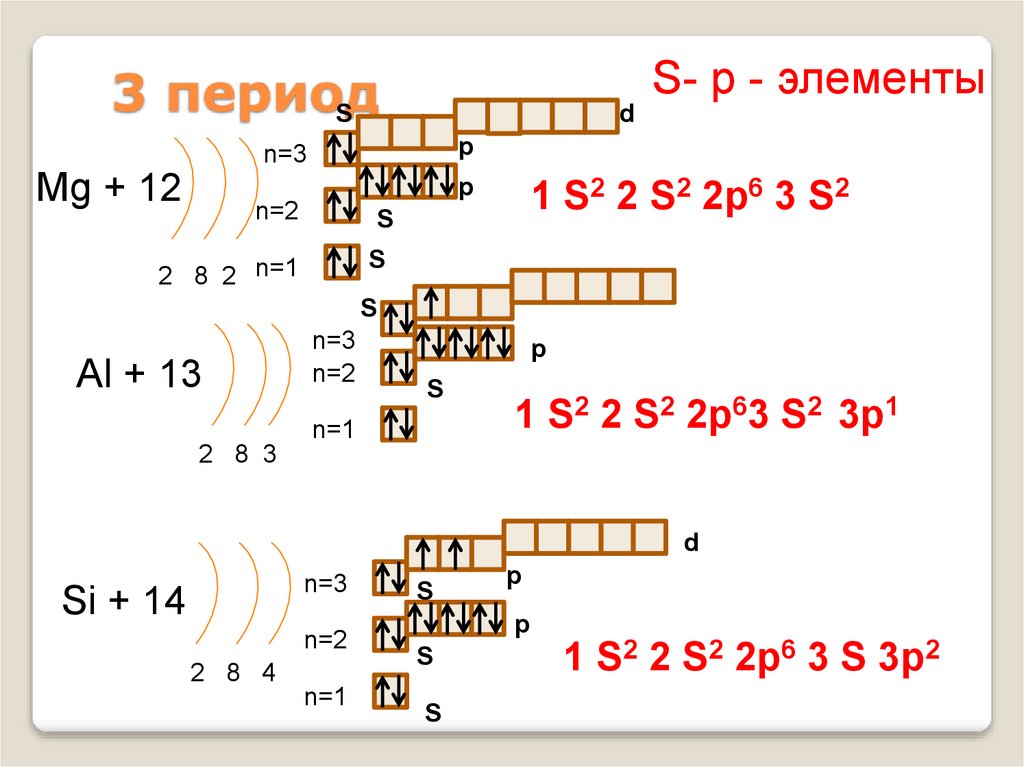
12. 3 период
S- р - элементы3 период
S
d
p
n=3
Mg + 12
p
n=2
S
2 8 2 n=1
S
1 S2 2 S2 2p6 3 S2
S
Al + 13
n=3
n=2
p
S
n=1
1 S2 2 S2 2p63 S2 3p1
2 8 3
d
n=3
Si + 14
n=2
2 8 4
n=1
S
p
p
S
S
1 S2 2 S2 2p6 3 S 3p2
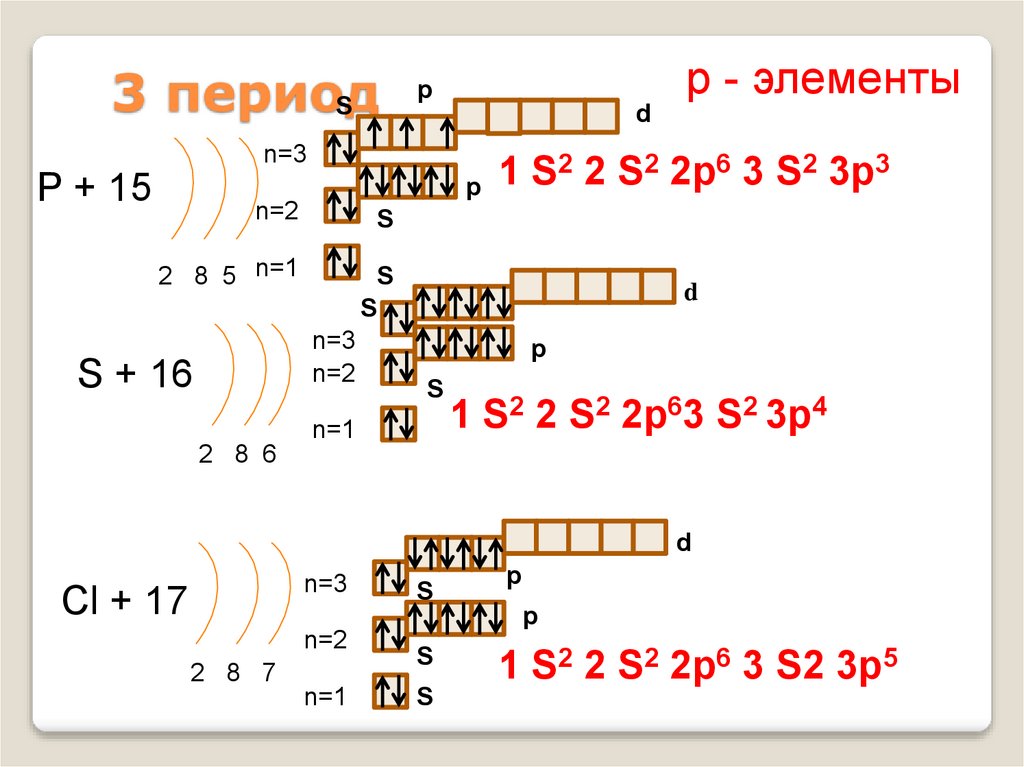
13. 3 период
Sd
n=3
P + 15
2 2 S2 2p6 3 S2 3p3
1
S
p
n=2
S
2 8 5 n=1
S
S
n=3
n=2
S + 16
р - элементы
p
d
p
S
n=1
1 S2 2 S2 2p63 S2 3p4
2 8 6
d
n=3
Cl + 17
S
p
p
n=2
2 8 7
n=1
S
S
1 S2 2 S2 2p6 3 S2 3p5
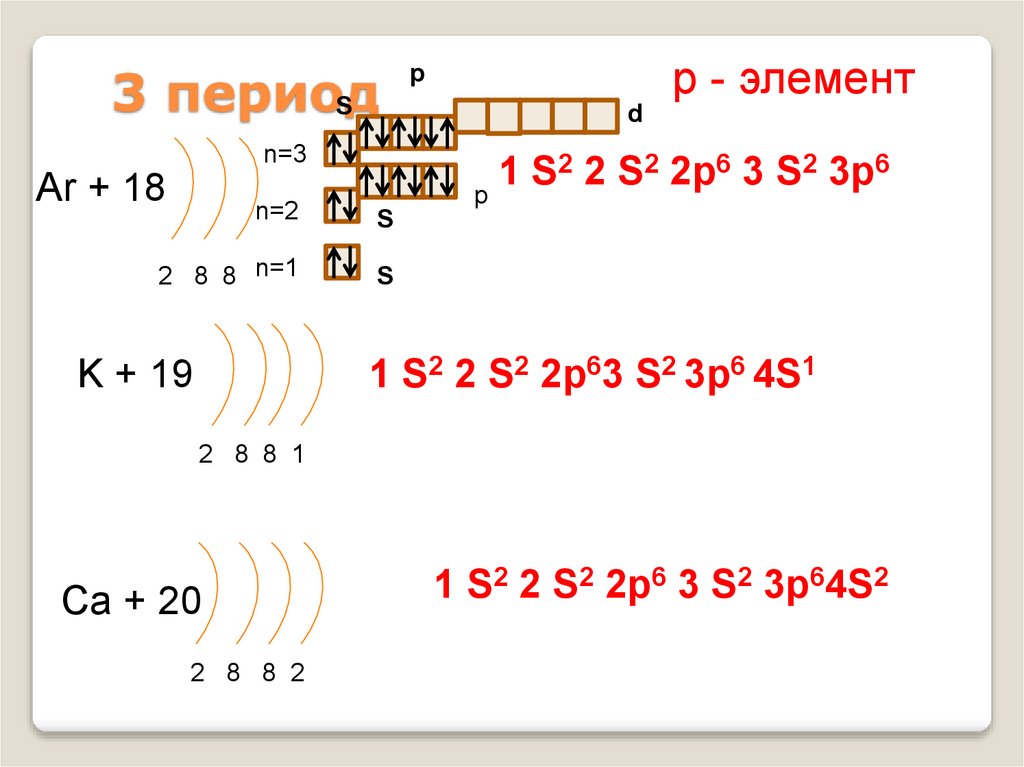
14. 3 период
Sn=3
Ar + 18
р - элемент
p
d
2 2 S2 2p6 3 S2 3p6
1
S
p
n=2
S
2 8 8 n=1
S
1 S2 2 S2 2p63 S2 3p6 4S1
K + 19
2 8 8 1
Ca + 20
2 8 8 2
1 S2 2 S2 2p6 3 S2 3p64S2
15. Ответьте на вопросы
Какие данные об особенностяхстроения атома отражает
электронная формула?
В чем заключается причина
сходства элементов,
расположенных в одной
группе?
16. Выводы
Причина сходства элементовзаключается в одинаковом
строении внешних энергетических
уровней их атомов
Одинаковое строение внешних
энергетических уровней
периодически (т.е. через
определенные промежутки периоды) повторяется, поэтому
периодически повторяются и
свойства химических элементов
17. Домашнее задание
Параграф 29, 31, 32, стр.143-144,в.1-4устно, 5-6 письменно.
Определить элементы из таблицы на
следующем слайде
18. домашнее задание
Задания1. По данным
определить, какой
это элемент
Вариант I
а)2e 8e 3e
б)2e 1e
в)2e 8e 8e
2. Определить
а)2период
элемент по его
3 группа главная
положению в ПСХЭ подгруппа
б)5 период
1 группа побочная
подгруппа
Вариант II
а)2e 4e
б)2e 8e 7e
в)1e
а)4 период
3 группа побочная
подгруппа
б)2 период
6 группа главная
подгруппа
19. Ресурсы
http://fcior.edu.ru – сайт Федерального центра информационнообразовательных ресурсов. ФЦИОР реализует концепцию "единогоокна" для доступа к любым электронным образовательным
ресурсам системы образования РФ и предоставление единой
современной технологической платформы для существующих и
вновь создаваемых электронных образовательных ресурсов.
http://rusedu.ru – Архив учебных программ и презентаций. На сайте
представлены разработки уроков с использованием ИКТ,
программы, пособия и методики.
http://openclass.ru – «Открытый класс».
http://school–collection.edu.ru - «Единая коллекция цифровых
образовательных ресурсов»
http://lyalyasirazhee.ucoz.ru - адрес личного сайта














 chemistry
chemistry








