Similar presentations:
Строение электронных оболочек атомов
1. Строение электронных оболочек атомов
СТРОЕНИЕ ЭЛЕКТРОННЫХОБОЛОЧЕК АТОМОВ
2.
.Упражнения – стр. 46
Я́дерная реа́кция — процесс образования
новых ядер или частиц при столкновениях ядер
или частиц. Впервые ядерную реакцию
наблюдал Резерфорд в 1919 году, бомбардируя
α-частицами ядра атомов азота
3.
Казимир Фаянс(1887-1975)
Фредерик Содди
(1877-1956), открыл
явление изотопии в
1910г.
(Нобелевская премия по
химии, 1921г.)
Правило смещения
(правило Содди-Фаянса):
Закон смещения дал возможность
предсказывать последовательность распада
многих радиоактивных элементов, определяя
образующиеся таким образом элементы на
основе вида излучения и включая их в таблицу
периодической системы.
При α – распаде радиоактивный
элемент превращается в другой,
отстоящий от исходного на 2
клеточки левее в периодической
системе химических элементов, а при
β – распаде получается химический
элемент с порядковым номером на
единицу большим, чем исходный.
4. ОБОЗНАЧЕНИЕ ЯДРА АТОМА
АЛЬФА α - РАСПАД- характерен для радиоактивных
элементов с порядковым номером
больше 83 - обязательно
выполняется закон сохранения
массового и зарядового числа.
- часто сопровождается гаммаизлучением.
Реакция альфа-распада:
БЕТА β - РАСПАД
- часто сопровождается гаммаизлучением.
- может сопровождаться
образованием антинейтрино
( легких электрически нейтральных
частиц, обладающих большой
проникающей способностью).
- обяэательно должен выполняться
закон сохранения массового и
зарядового числа.
Реакция бета-распада:
ГАММА γ -распад
– это поток
электромагнитного
излучения с очень короткой
длиной волны и очень
высокой (интенсивной)
частотой, при
этом массовое число и
заряд ядра не изменяются,
а энергия ядра
уменьшается.
Закон сохранения массового числа и заряда:
Сумма зарядов (массовых чисел) продуктов
распада равна заряду (массовому числу)
исходного ядра
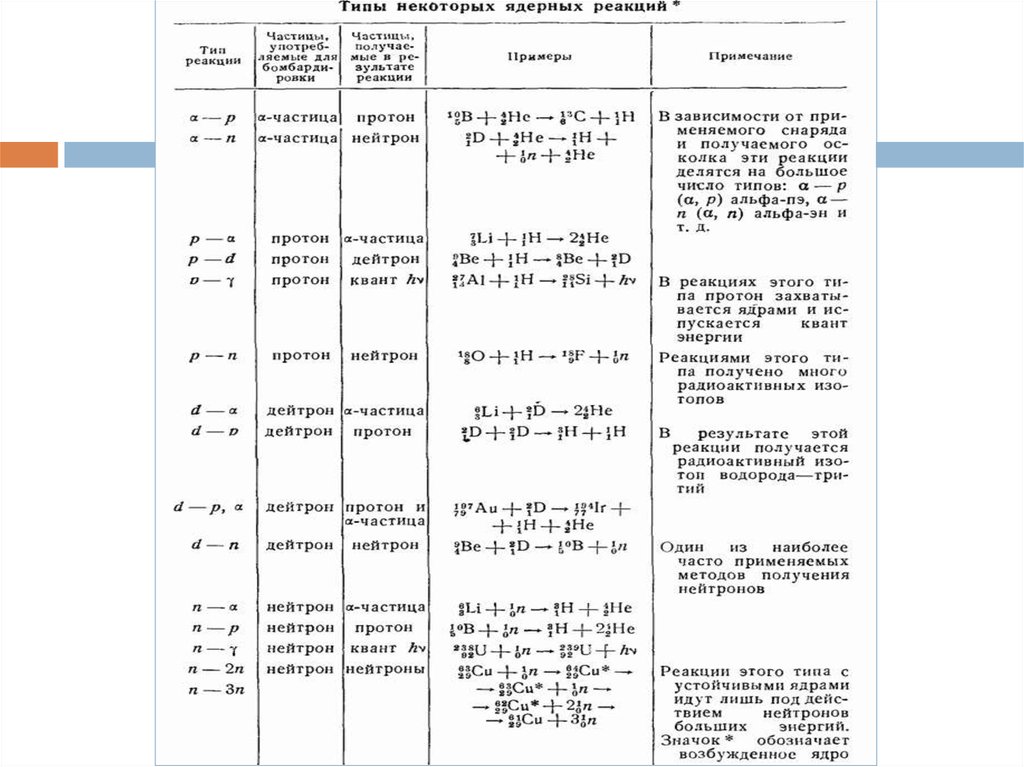
5. Написание уравнений ядерных реакций
6.
7. Ответьте на вопросы
Чем можно объяснить различие в свойствахэлементов?
- Причина – различие атомов (различное число
протонов и электронов)
Чем можно объяснить сходство некоторых
элементов?
- Причина – сходство внутреннего строения
атома
8. Электронная оболочка
Совокупность всех электронов в атоме,окружающих ядро
Каждый электрон имеет свою траекторию движения
и запас энергии
Электроны расположены на различном расстоянии
от ядра: чем ближе электрон к ядру, тем он прочнее
с ним связан, его труднее вырвать из электронной
оболочки
По мере удаления от ядра запас энергии электрона
увеличивается, а связь с ядром становится слабее
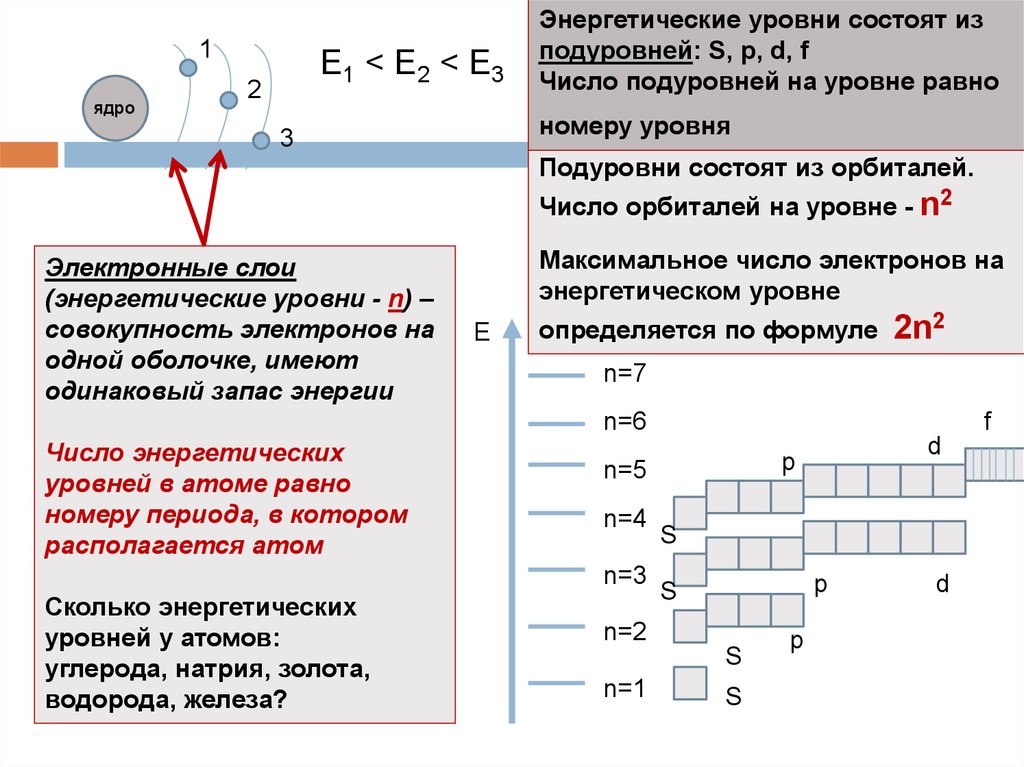
9.
1ядро
Е1 < E2 < E3
2
Энергетические уровни состоят из
подуровней: S, p, d, f
Число подуровней на уровне равно
номеру уровня
3
Подуровни состоят из орбиталей.
Число орбиталей на уровне - n2
Электронные слои
(энергетические уровни - n) –
совокупность электронов на
одной оболочке, имеют
одинаковый запас энергии
Максимальное число электронов на
энергетическом уровне
Е
определяется по формуле
2n2
n=7
n=6
Число энергетических
уровней в атоме равно
номеру периода, в котором
располагается атом
n=4
S
p
S
n=2
S
n=1
d
p
n=5
n=3
Сколько энергетических
уровней у атомов:
углерода, натрия, золота,
водорода, железа?
f
S
p
d
10.
Энергетические уровни, содержащиемаксимальное число электронов, называются
завершенными. Они обладают повышенной
устойчивостью и стабильностью
Энергетические уровни, содержащие меньшее
число электронов, называются
незавершенными
n=1 – 1 подуровень (S), 2 электрона
n=2 – 2 подуровня (S, р), 8 электронов
n=3 – 3 подуровня (S, р, d), 18 электронов
n=4 – 4 подуровня (S, р, d, f), 32 электрона
11. Запомните!
Электроны, расположенные напоследней электронной оболочке,
называются внешними.
Число внешних электронов для
химических элементов главных
подгрупп равно номеру группы, в
которой находится элемент
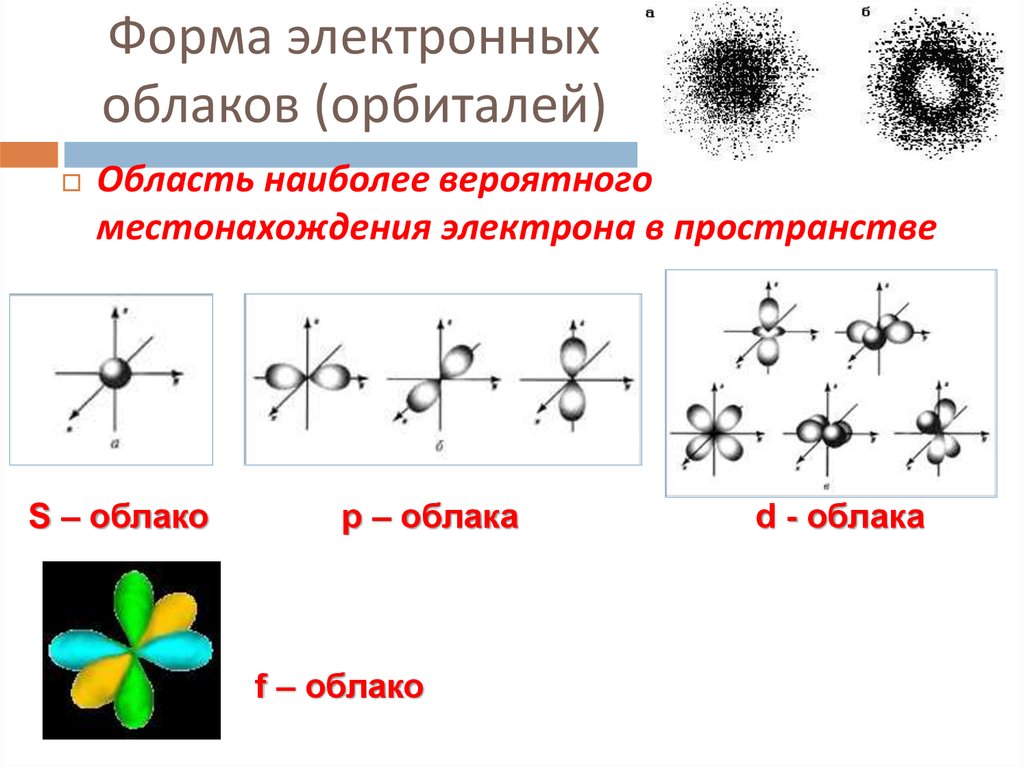
12. Форма электронных облаков (орбиталей)
Область наиболее вероятногоместонахождения электрона в пространстве
S – облако
р – облака
f – облако
d - облака
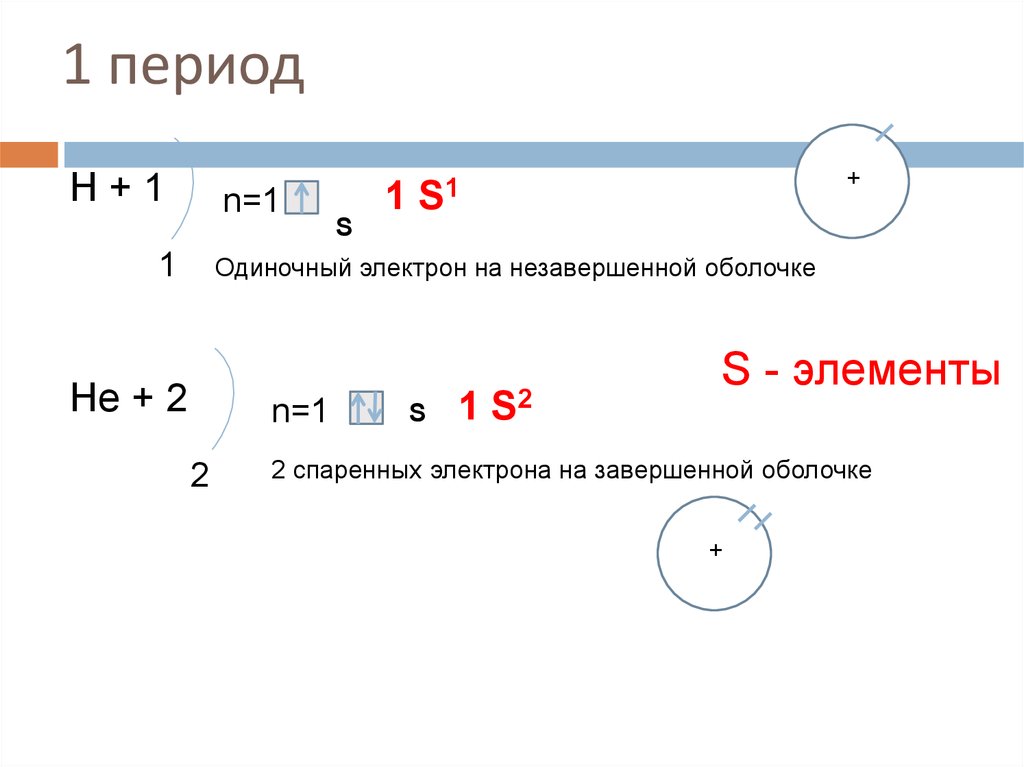
13. 1 период
Н+1n=1
1
S
+
1 S1
Одиночный электрон на незавершенной оболочке
Нe + 2
n=1
2
S
1 S2
S - элементы
2 спаренных электрона на завершенной оболочке
+
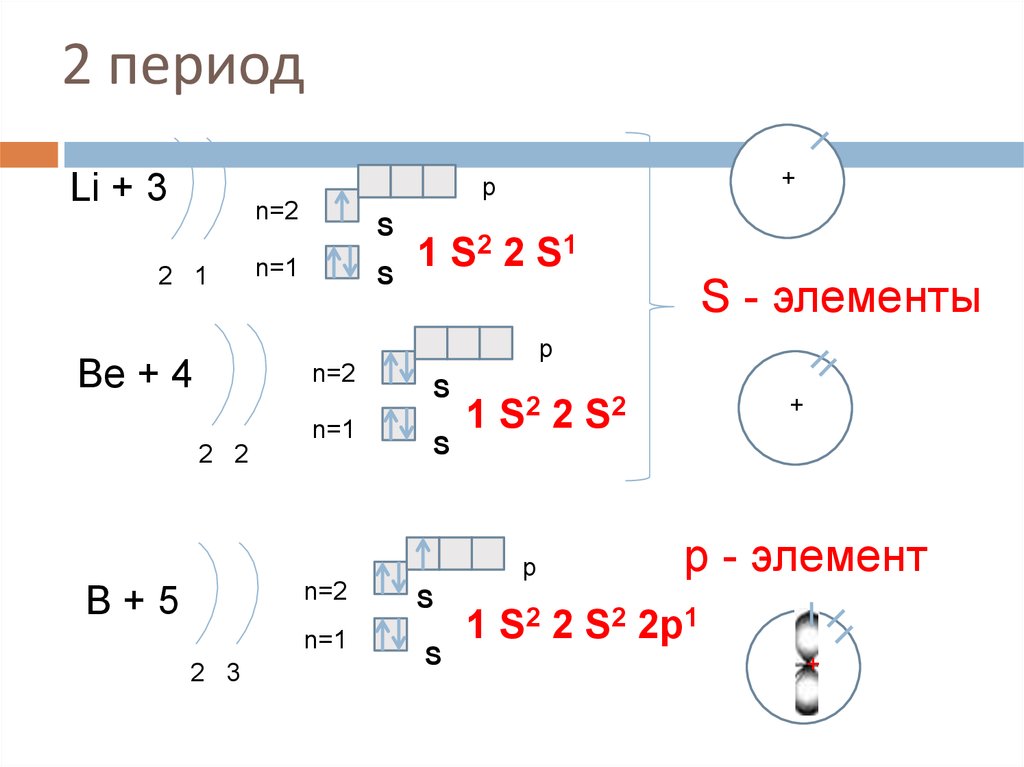
14. 2 период
Li + 3+
p
n=2
2 1
S
n=1
S
1 S2 2 S1
S - элементы
p
Be + 4
n=2
n=1
2 2
S
S
p
n=2
B+5
n=1
2 3
S
S
+
1 S2 2 S 2
р - элемент
1 S2 2 S2 2p1
++
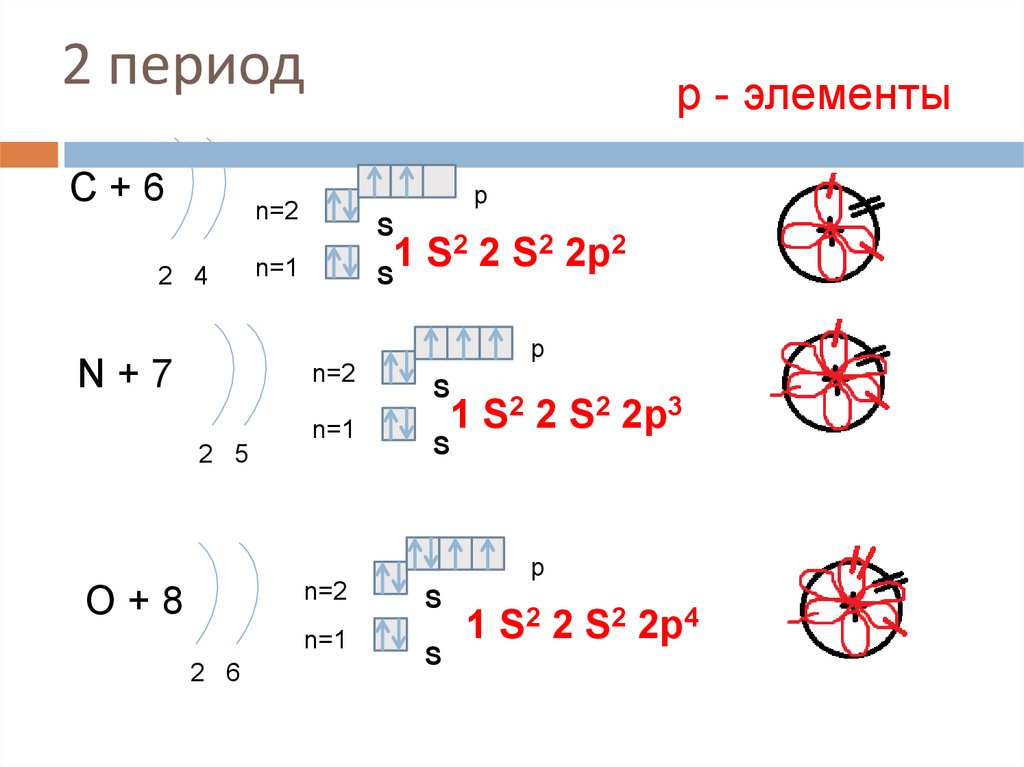
15. 2 период
С+6р - элементы
p
n=2
2 4
S
2 2 S2 2p2
1
S
S
n=1
p
N+7
n=2
n=1
2 5
S
1 S2 2 S2 2p3
S
p
n=2
O+8
n=1
2 6
S
S
1 S2 2 S2 2p4
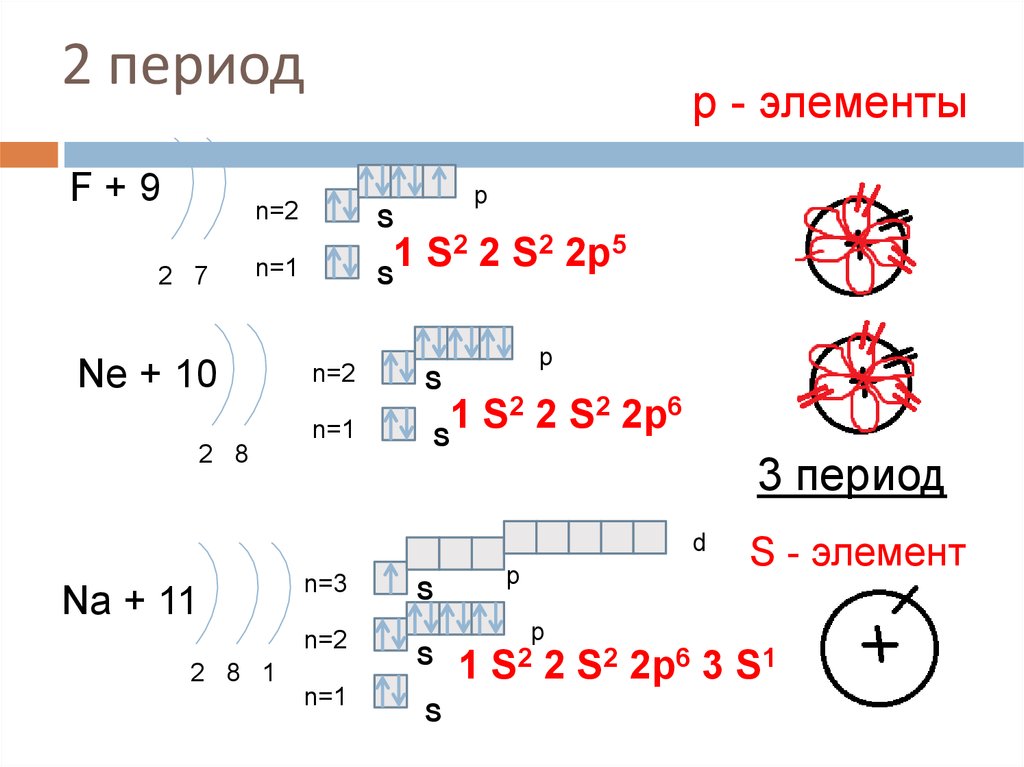
16. 2 период
F+92 7
р - элементы
p
n=2
S
n=1
2 2 S2 2p5
1
S
S
Ne + 10
n=2
n=1
2 8
p
S
2 2 S2 2p6
1
S
S
3 период
d
Na + 11
n=3
n=2
2 8 1
n=1
p
S
S
S
1
p
S2 2
S - элемент
S2 2p6 3 S1
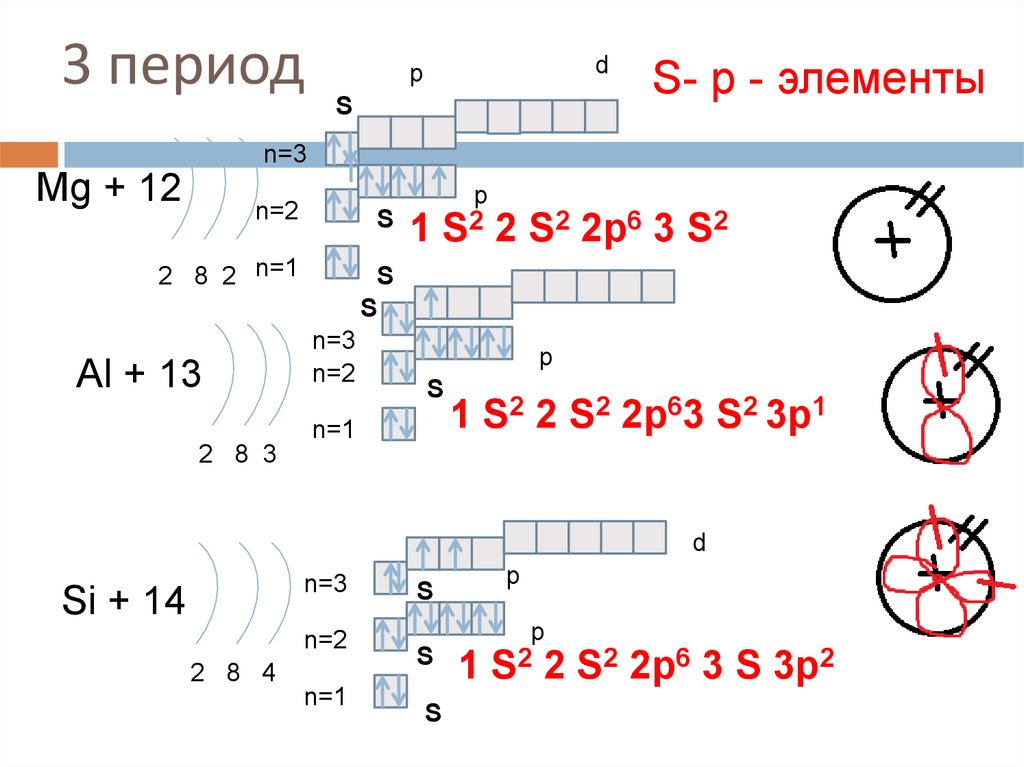
17. 3 период
dp
S
S- р - элементы
n=3
Mg + 12
n=2
S
2 8 2 n=1
S
S
Al + 13
n=3
n=2
1
p
S2 2
S2 2p6 3 S2
p
S
n=1
1 S2 2 S2 2p63 S2 3p1
2 8 3
d
n=3
Si + 14
n=2
2 8 4
n=1
p
S
S
S
1
p
S2 2
S2 2p6 3 S 3p2
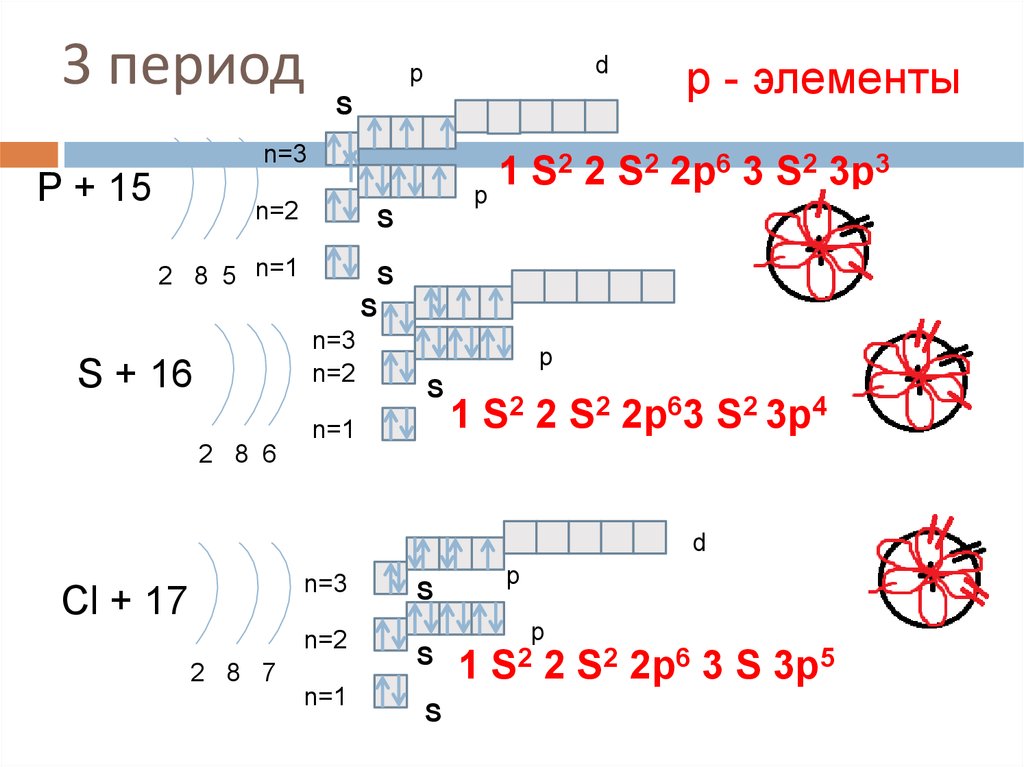
18. 3 период
dp
S
n=3
P + 15
2 2 S2 2p6 3 S2 3p3
1
S
p
n=2
S
2 8 5 n=1
S
S
n=3
n=2
S + 16
р - элементы
p
S
n=1
1 S2 2 S2 2p63 S2 3p4
2 8 6
d
n=3
Cl + 17
n=2
2 8 7
n=1
p
S
S
S
1
p
S2 2
S2 2p6 3 S 3p5
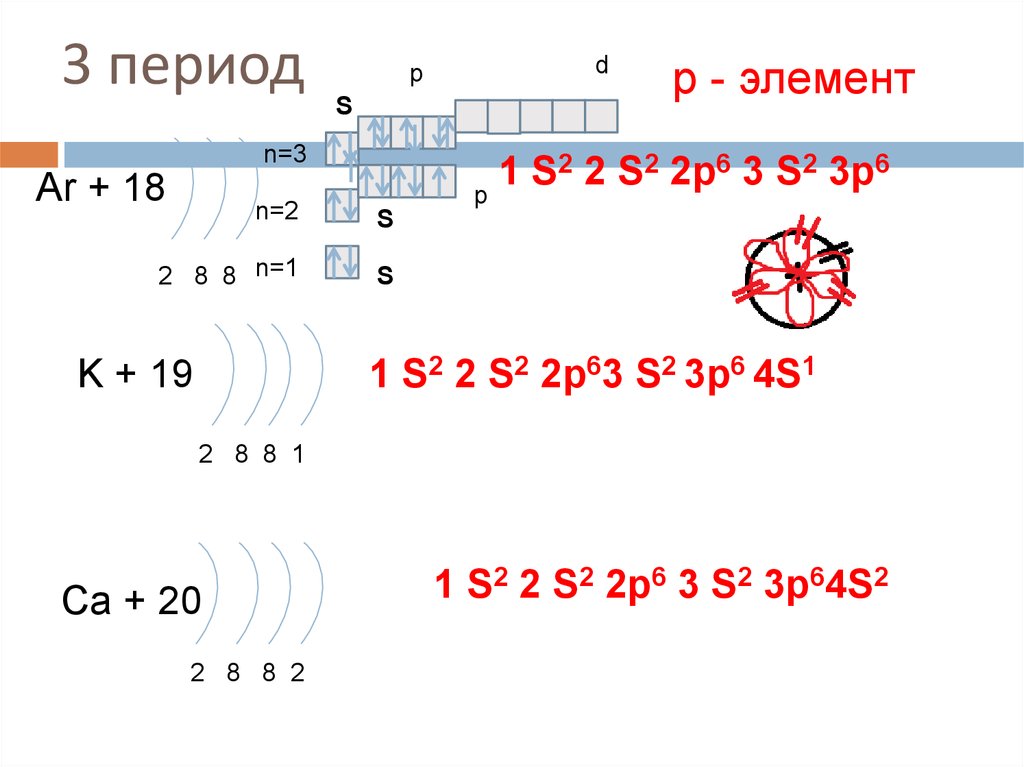
19. 3 период
pS
n=3
Ar + 18
d
р - элемент
2 2 S2 2p6 3 S2 3p6
1
S
p
n=2
S
2 8 8 n=1
S
1 S2 2 S2 2p63 S2 3p6 4S1
K + 19
2 8 8 1
Ca + 20
2 8 8 2
1 S2 2 S2 2p6 3 S2 3p64S2
20. Выводы
Причина сходства элементов заключается водинаковом строении внешних
энергетических уровней их атомов
Одинаковое строение внешних
энергетических уровней периодически (т.е.
через определенные промежутки - периоды)
повторяется, поэтому периодически
повторяются и свойства химических
элементов










 chemistry
chemistry








