Similar presentations:
Решение заданий ОГЭ по химии (1 - 15)
1.
РЕШЕНИЕ ЗАДАНИЙОГЭ ПО ХИМИИ (1 - 15)
2.
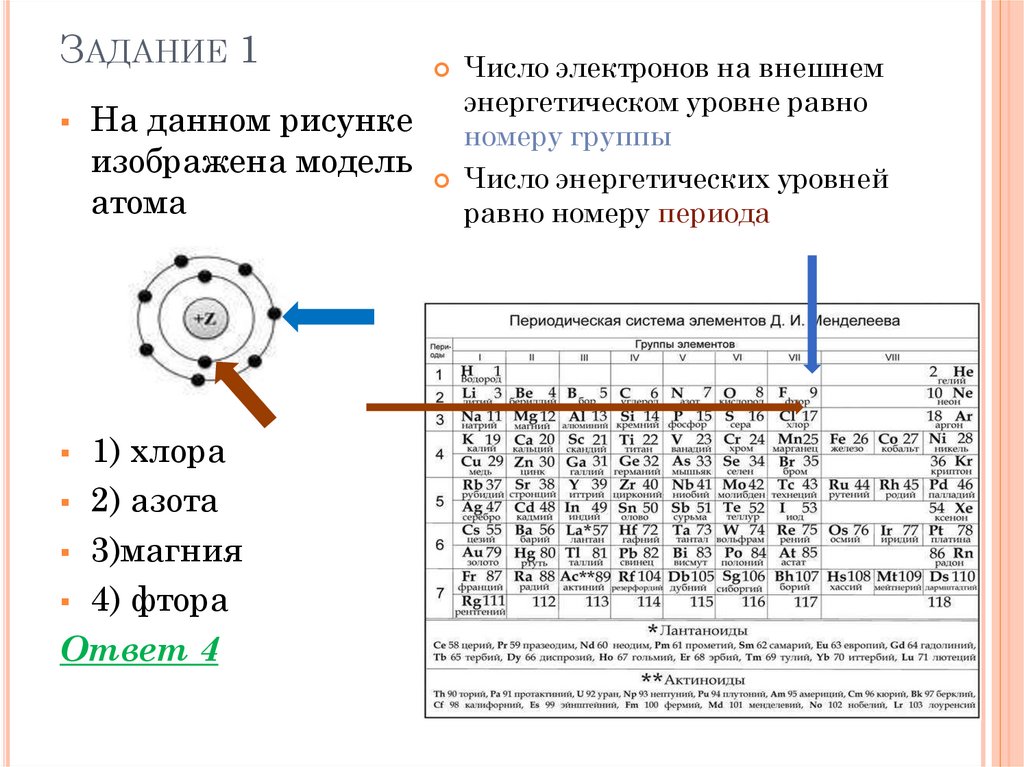
ЗАДАНИЕ 1На данном рисунке
изображена модель
атома
1) хлора
2) азота
3)магния
4) фтора
Ответ 4
Строение атома: ядро,
электронная оболочка,
электроны
Число электронов в атоме равно
порядковому номеру элемента в
Периодической системе
3.
ЗАДАНИЕ 1На данном рисунке
изображена модель
атома
1) хлора
2) азота
3)магния
4) фтора
Ответ 4
Число электронов на внешнем
энергетическом уровне равно
номеру группы
Число энергетических уровней
равно номеру периода
4.
ЗАДАНИЕ 2 В КАКОМ РЯДУ ХИМИЧЕСКИХ ЭЛЕМЕНТОВУСИЛИВАЮТСЯ НЕМЕТАЛИЧЕСКИЕ СВОЙСТВА
СООТВЕТСТВУЮЩИХ ИМ ПРОСТЫХ ВЕЩЕСТВ
1) Al-P-Cl
2) F-N-C
3)Cl-Br-I
4) Si-S-P
Ответ 1
Усиление
неметалличе
ских свойств
5.
ЗАДАНИЕ 3. В МОЛЕКУЛЕ ФТОРА ХИМИЧЕСКАЯ СВЯЗЬ1) ИОННАЯ
2) КОВАЛЕНТНАЯ ПОЛЯРНАЯ
3) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ
4) МЕТАЛЛИЧЕСКАЯ
Тип связи
Ковалентная
неполярная
Ковалентная
полярная
Ионная
Металлическая
Донорно-акцепторный
механизм
Ответ 3
Неметалл (донор) –
неметалл (акцептор)
Вещество
Простое,
неметалл
Сложное,
неметаллы
Сложное,
металлнеметалл
Простое, металл
Водородная связь –
межмолекулярное
взаимодействие
6.
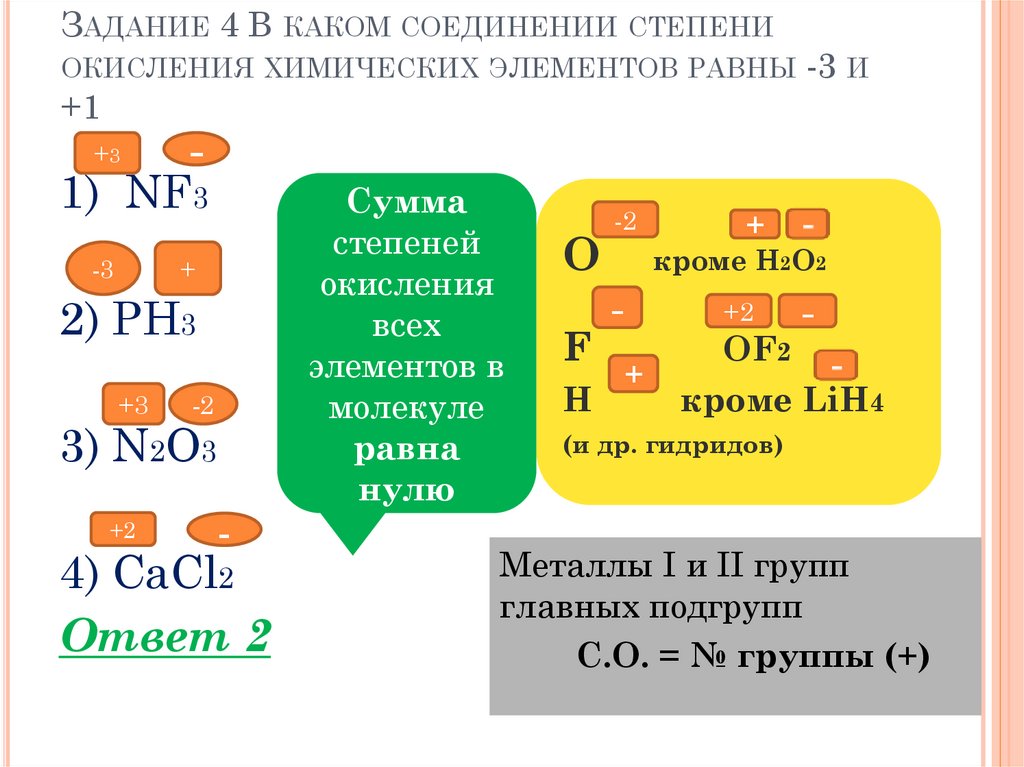
ЗАДАНИЕ 4 В КАКОМ СОЕДИНЕНИИ СТЕПЕНИОКИСЛЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ РАВНЫ
+1
+3
-
1) NF3
-3
+
2) PH3
+3
-3 И
-2
3) N2O3
4) CaCl2
Ответ 2
Сумма
степеней
окисления
всех
элементов в
молекуле
равна
нулю
O
F
H
-2
-
+
кроме H2O2
+2
+
-
OF2
кроме LiH4
(и др. гидридов)
+2
Металлы I и II групп
главных подгрупп
С.О. = № группы (+)
7.
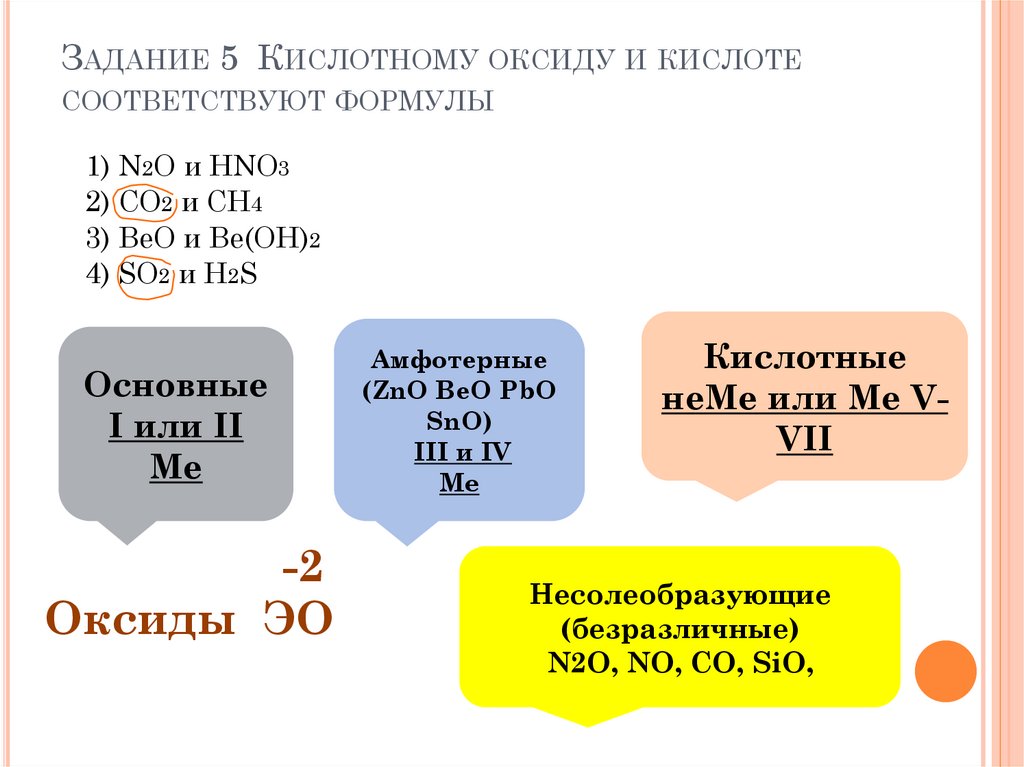
ЗАДАНИЕ 5 КИСЛОТНОМУ ОКСИДУ И КИСЛОТЕСООТВЕТСТВУЮТ ФОРМУЛЫ
1) N2O и HNO3
2) CO2 и CH4
3) BeO и Be(OH)2
4) SO2 и H2S
Основные
I или II
Мe
-2
Оксиды ЭO
Амфотерные
(ZnO BeO PbO
SnO)
III и IV
Me
Кислотные
неMe или Ме VVII
Несолеобразующие
(безразличные)
N2O, NO, CO, SiO,
8.
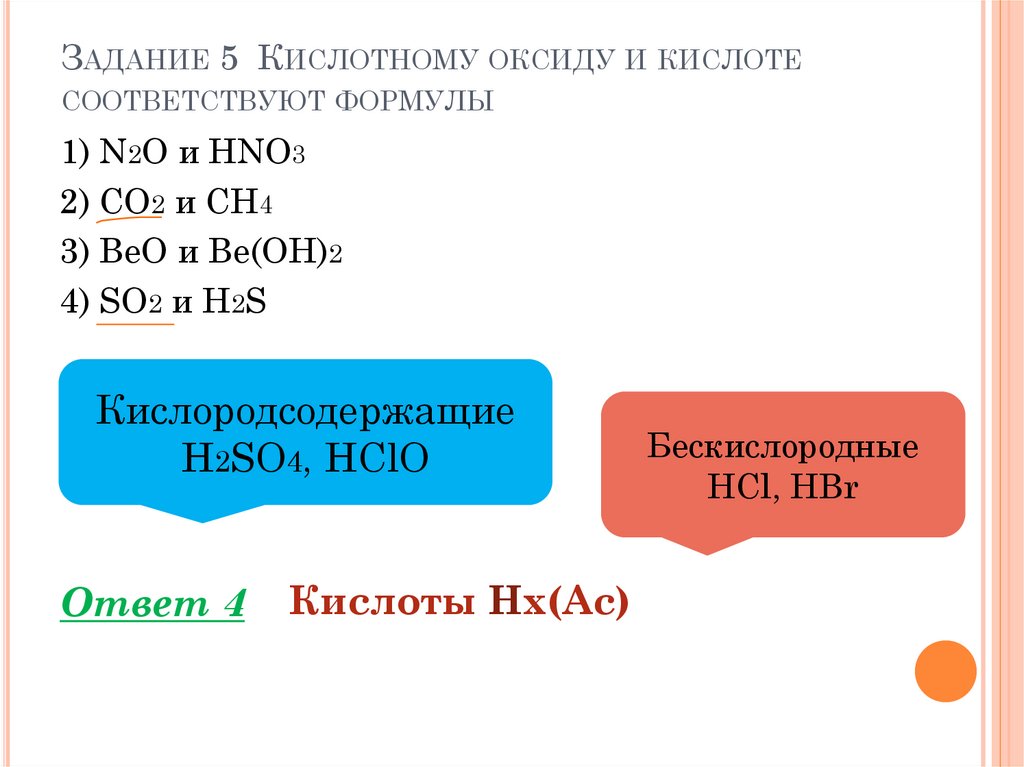
ЗАДАНИЕ 5 КИСЛОТНОМУ ОКСИДУ И КИСЛОТЕСООТВЕТСТВУЮТ ФОРМУЛЫ
1) N2O и HNO3
2) CO2 и CH4
3) BeO и Be(OH)2
4) SO2 и H2S
Кислородсодержащие
H2SO4, HClO
Ответ 4
Кислоты Hx(Ac)
Бескислородные
HCl, HBr
9.
ЗАДАНИЕ 6 ПРИЗНАКОМ ПРОТЕКАНИЯХИМИЧЕСКОЙ РЕАКЦИИ МЕЖДУ ГИДРОКСИДОМ
МЕДИ (II) И ХЛОРОВОДОРОДНОЙ КИСЛОТОЙ
ЯВЛЯЕТСЯ
1) выпадение осадка
3) выделение газа
2) появление запаха
4) растворение осадка
Cu(OH)2+HCl =CuCl2+H2O
Ответ 4
10.
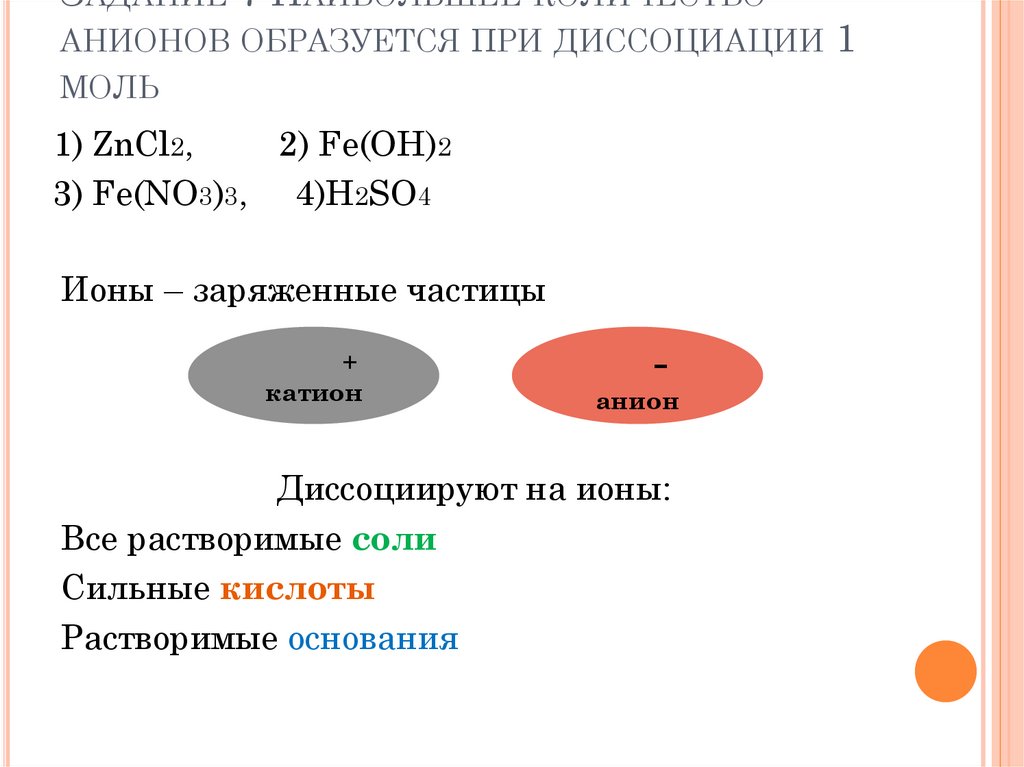
ЗАДАНИЕ 7 НАИБОЛЬШЕЕ КОЛИЧЕСТВОАНИОНОВ ОБРАЗУЕТСЯ ПРИ ДИССОЦИАЦИИ
МОЛЬ
1) ZnCl2,
2) Fe(OH)2
3) Fe(NO3)3, 4)H2SO4
Ионы – заряженные частицы
+
катион
анион
Диссоциируют на ионы:
Все растворимые соли
Сильные кислоты
Растворимые основания
1
11.
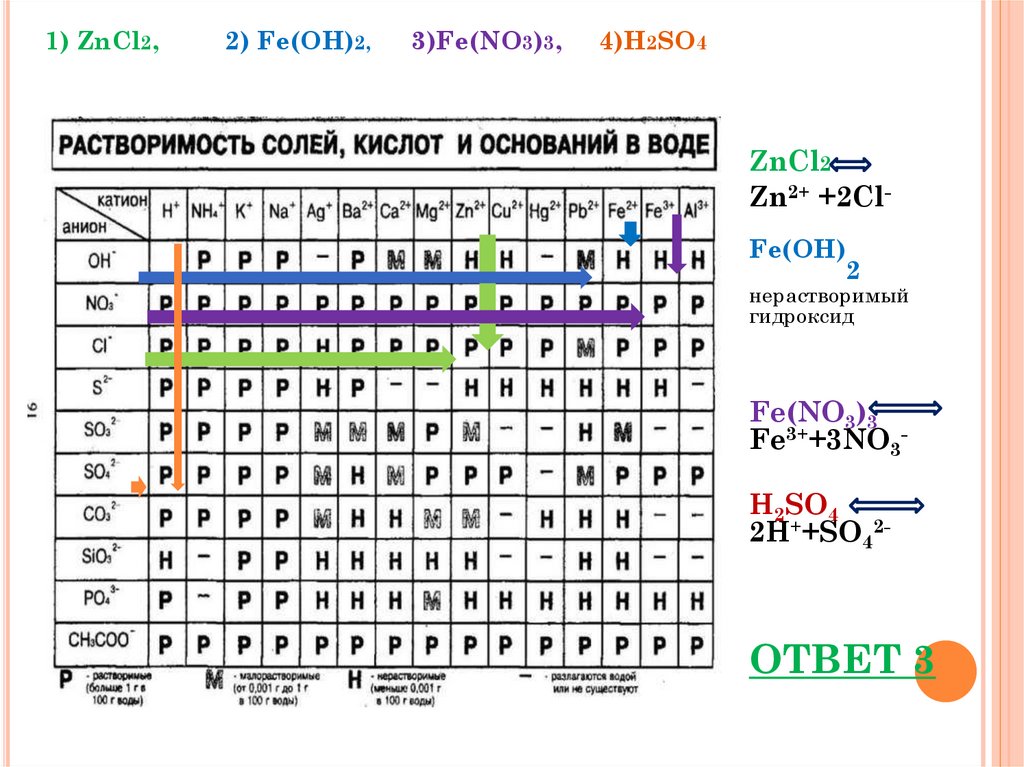
1) ZnCl2,2) Fe(OH)2,
3)Fe(NO3)3,
4)H2SO4
ZnCl2
Zn2+ +2ClFe(OH)
2
нерастворимый
гидроксид
Fe(NO3)3
Fe3++3NO3H2SO4
2H++SO42-
ОТВЕТ 3
12.
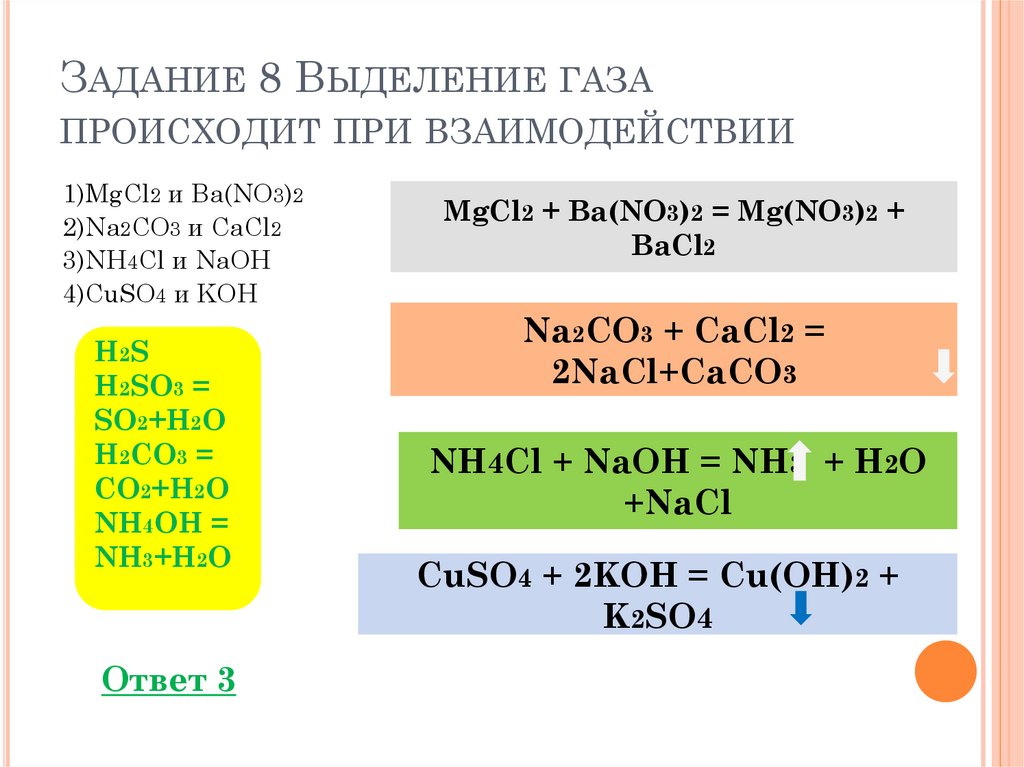
ЗАДАНИЕ 8 ВЫДЕЛЕНИЕ ГАЗАПРОИСХОДИТ ПРИ ВЗАИМОДЕЙСТВИИ
1)MgCl2 и Ba(NO3)2
2)Na2CO3 и CaCl2
3)NH4Cl и NaOH
4)CuSO4 и KOH
H2S
H2SO3 =
SO2+H2O
H2CO3 =
CO2+H2O
NH4OH =
NH3+H2O
Ответ 3
MgCl2 + Ba(NO3)2 = Mg(NO3)2 +
BaCl2
Na2CO3 + CaCl2 =
2NaCl+CaCO3
NH4Cl + NaOH = NH3 + H2O
+NaCl
CuSO4 + 2KOH = Cu(OH)2 +
K2SO4
13.
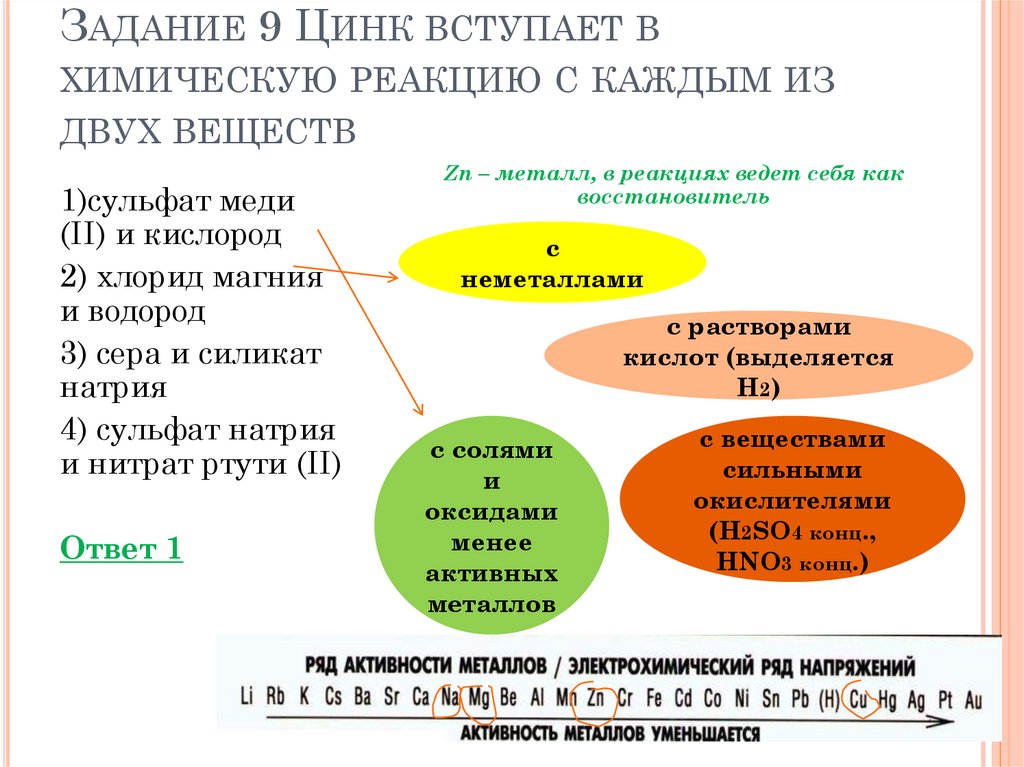
ЗАДАНИЕ 9 ЦИНК ВСТУПАЕТ ВХИМИЧЕСКУЮ РЕАКЦИЮ С КАЖДЫМ ИЗ
ДВУХ ВЕЩЕСТВ
1)сульфат меди
(II) и кислород
2) хлорид магния
и водород
3) сера и силикат
натрия
4) сульфат натрия
и нитрат ртути (II)
Ответ 1
Zn – металл, в реакциях ведет себя как
восстановитель
с
неметаллами
с растворами
кислот (выделяется
H2)
с солями
и
оксидами
менее
активных
металлов
с веществами
сильными
окислителями
(H2SO4 конц.,
HNO3 конц.)
14.
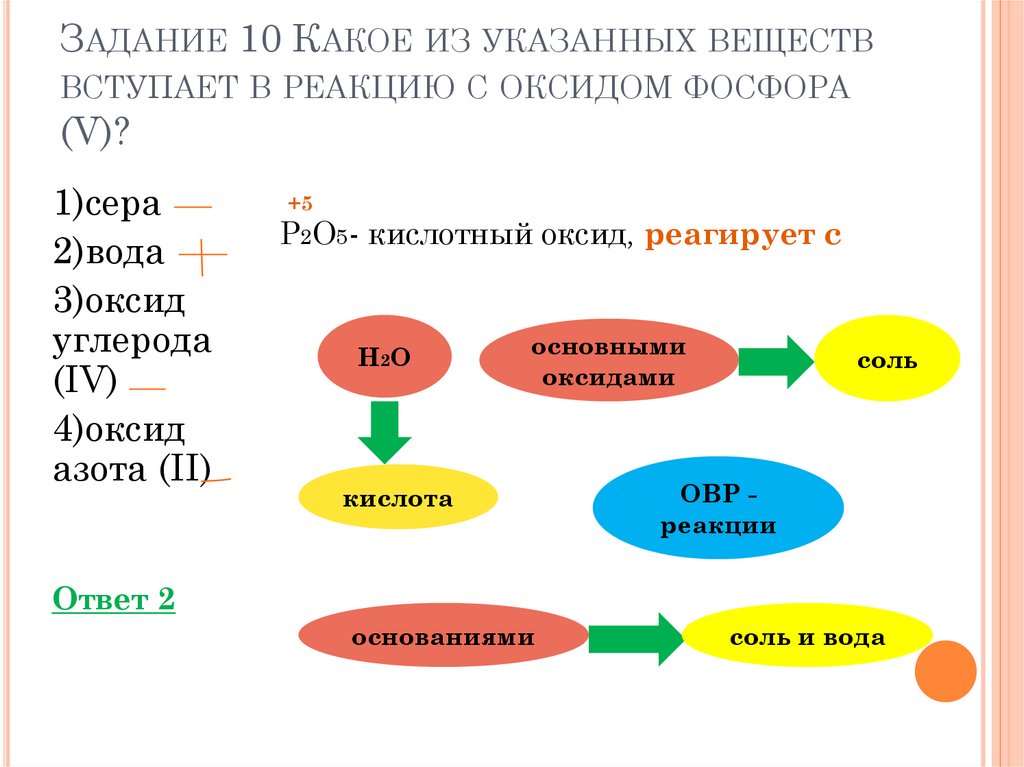
ЗАДАНИЕ 10 КАКОЕ ИЗ УКАЗАННЫХ ВЕЩЕСТВВСТУПАЕТ В РЕАКЦИЮ С ОКСИДОМ ФОСФОРА
(V)?
1)сера
2)вода
3)оксид
углерода
(IV)
4)оксид
азота (II)
+5
P2O5- кислотный оксид, реагирует с
H2O
основными
оксидами
кислота
соль
ОВР реакции
Ответ 2
основаниями
соль и вода
15.
ЗАДАНИЕ 11 С СОЛЯНОЙ КИСЛОТОЙВЗАИМОДЕЙСТВУЕТ КАЖДОЕ ИЗ ДВУХ
ВЕЩЕСТВ В РЯДУ
1)NaOH и Сu
2)Ba(OH)2 и CO
3)CuO и SO3
4)Cu(OH)2 и Mg
с HCl могут реагировать
Me, если стоят до H2
основания и основные оксиды
соли, если один из продуктов
реакции нерастворим в воде или
кислоте , или это газ
амфотерные оксиды и гидроксиды
окислители, окисляющие Cl- до Cl20
16.
ЗАДАНИЕ 11 С СОЛЯНОЙ КИСЛОТОЙ ВЗАИМОДЕЙСТВУЕТ КАЖДОЕ ИЗДВУХ ВЕЩЕСТВ В РЯДУ 1)NAOH И СU 2)BA(OH)2 И CO
3)CUO И SO3
4)CU(OH)2 И Mg
1а) NaOH - щелочь, р-я будет, NaOH + HCl = H2O + NaCl
1б) Cu – металл, после H2 =
2а) Ba(OH)2 - щелочь, р-я будет, Ba(OH)2 + 2HCl = BaCl2 + 2H2O
2б) CO – угарный газ, несолеобразующий оксид, р-я не идет.
CO + HCl =
3а) CuO – основный оксид, р-я будет, CuO + 2HCl = CuCl2 + H2O
3б) SO3 – кислотный оксид, р-я не идет, SO3 + + HCl =
4а) Cu(OH)2 – основание, р-я будет, Cu(OH)2 + 2HCl = CuCl2 +
2H2O
4б) Mg – металл до Н2, р-я будет Mg + 2HCl = MgCl2 + H2
Ответ 4
17.
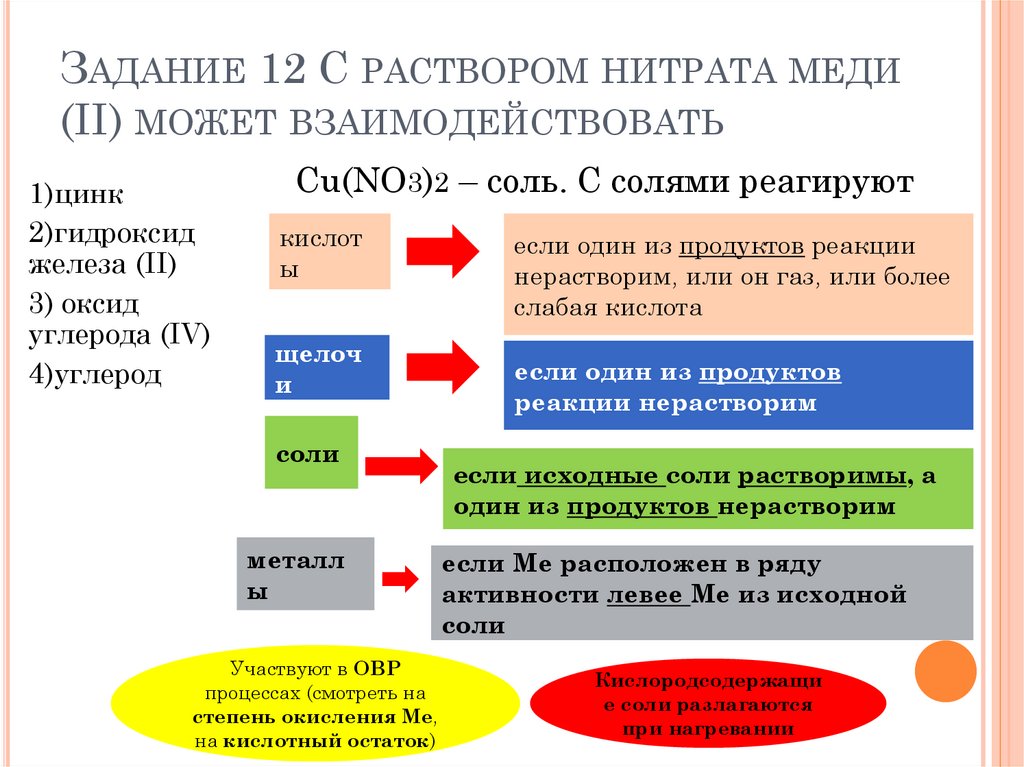
ЗАДАНИЕ 12 С РАСТВОРОМ НИТРАТА МЕДИ(II) МОЖЕТ ВЗАИМОДЕЙСТВОВАТЬ
1)цинк
2)гидроксид
железа (II)
3) оксид
углерода (IV)
4)углерод
Cu(NO3)2 – соль. С солями реагируют
кислот
ы
щелоч
и
соли
металл
ы
Участвуют в ОВР
процессах (смотреть на
степень окисления Ме,
на кислотный остаток)
если один из продуктов реакции
нерастворим, или он газ, или более
слабая кислота
если один из продуктов
реакции нерастворим
если исходные соли растворимы, а
один из продуктов нерастворим
если Ме расположен в ряду
активности левее Ме из исходной
соли
Кислородсодержащи
е соли разлагаются
при нагревании
18.
ЗАДАНИЕ 12 С РАСТВОРОМНИТРАТА МЕДИ
1)цинк
(II) МОЖЕТ
ВЗАИМОДЕЙСТВОВАТЬ
2)гидроксид железа (II)
3) оксид углерода (IV)
4)углерод
1) Zn - металл, в ряду напряжения ЛЕВЕЕ Cu, значит будет
реагировать,
Zn+Cu(NO3)2= Zn(NO3)2 + Cu
2) Fе(OH)3 – нерастворимый, амфотерный гидроксид, реагировать не будет,
Fе(OH)3 + Cu(NO3)2
3) CO2 –кислотный оксид, соответствует слабой угольной кислоте,
реагировать не будет
CO2 + Cu(NO3)2
С - неметалл
4) С + Cu(NO3)2
Ответ 1
19.
ЗАДАНИЕ 13 ОТДЕЛИТЬ БЕНЗИН ОТ ВОДЫМОЖНО С ПОМОЩЬЮ
1)фильтрования
воронки
2)делительной
3) магнита
Ответ 2
4)отстаивания
20.
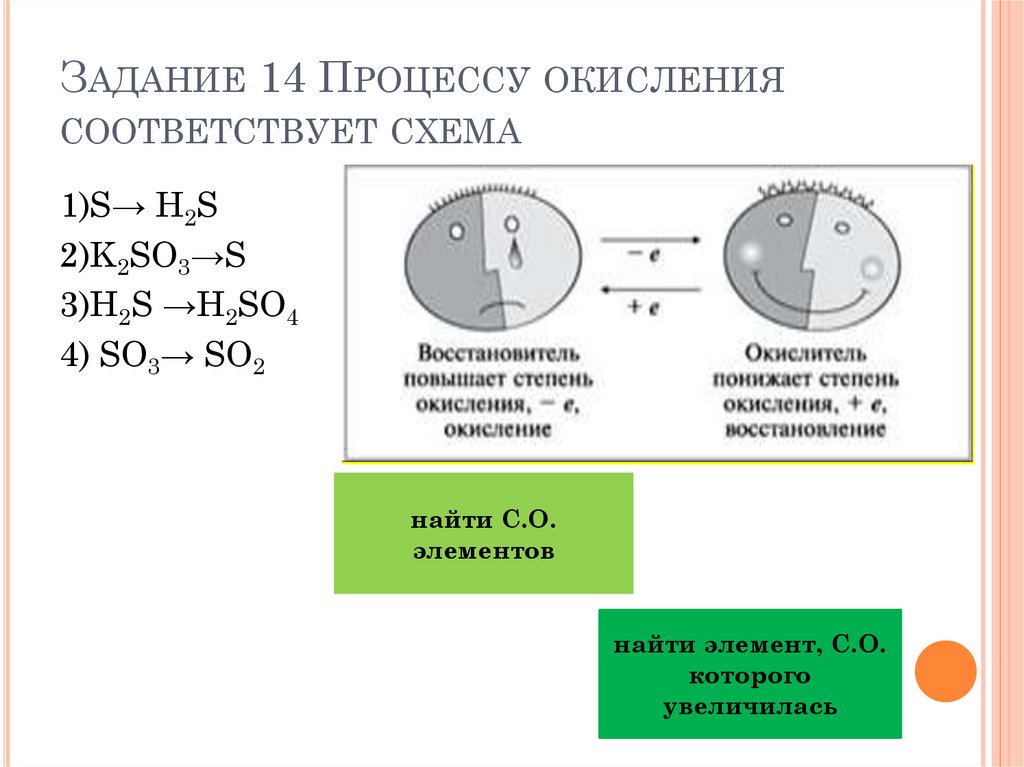
ЗАДАНИЕ 14 ПРОЦЕССУ ОКИСЛЕНИЯСООТВЕТСТВУЕТ СХЕМА
1)S→ H2S
2)K2SO3→S
3)H2S →H2SO4
4) SO3→ SO2
найти С.О.
элементов
найти элемент, С.О.
которого
увеличилась
21.
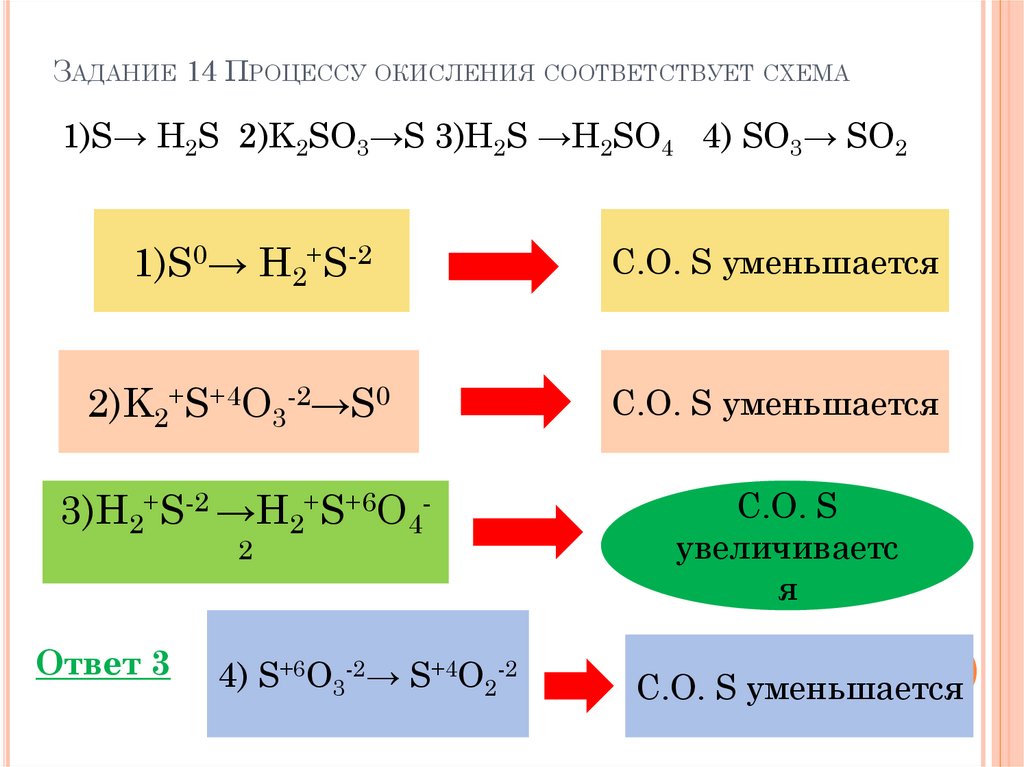
ЗАДАНИЕ 14 ПРОЦЕССУ ОКИСЛЕНИЯ СООТВЕТСТВУЕТ СХЕМА1)S→ H2S 2)K2SO3→S 3)H2S →H2SO4 4) SO3→ SO2
1)S0→ H2+S-2
2)K2+S+4O3-2→S0
3)H2+S-2 →H2+S+6O42
Ответ 3
4) S+6O3-2→ S+4O2-2
С.О. S уменьшается
С.О. S уменьшается
С.О. S
увеличиваетс
я
С.О. S уменьшается
22.
ЗАДАНИЕ 15 МАССОВАЯ ДОЛЯ ХЛОРА ВОКСИДЕ ХЛОРА (VII) РАВНА
1)19,4%
2)24.0% 3)30,5% 4)38,8%
ω(Э) =
масса всех атомов элемента
относительная молекулярная масса
100%
*
Формула оксида хлора (VII) Cl2O7
ω (Cl) = (35,5 * 2)*100% / 35,5*2+16*7) =38,8%
Ответ 4
23.
ПРИ ПОДГОТОВКЕ ПРЕЗЕНТАЦИИ ИСПОЛЬЗОВАНЫ СЛЕДУЮЩИЕМАТЕРИАЛЫ:
1) Химия. Подготовка к
ОГЭ-2017. 30
тренировочных
вариантов по
демоверсии 2017 года.
9-тый класс: учебнометодическое пособие /
Под ред. В.Д.
Доронькина. – Ростов
н/Д: Легион, 2016.-288с.
2) Официальная
демоверсия ФИПИ ОГЭ
по химии 2017г.
Фотоматериал
Периодическая система –http://simplehints.ru/wpcontent/uploads/2016/06/hello_html_40367d9a.png
Таблица растворимости –
https://im0-tubru.yandex.net/i?id=69a5823a569ccfc0ca621c81730acbea&n=33&h=215&w=312
Гидроксид меди (II) https://upload.wikimedia.org/wikipedia/commons/thumb/9/9c/Copper_%28II%29_hydroxide
.JPG/400px-Copper_%28II%29_hydroxide.JPG
Восстановитель-окислитель
https://yandex.ru/images/search?text=%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%
B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%
8C%20%D0%BA%D0%B0%D1%80%D1%82%D0%B8%D0%BD%D0%BA%D0%B0&img_ur
l=http%3A%2F%2Fforexaw.com%2Fstatic%2Fpreviews%2F000%2F112%2F000112395_48
0_3.jpg&pos=0&rpt=simage&lr=8
Делительная воронка https://lh3.googleusercontent.com/HjHHhL8y9WfVLnVJmNMkglR0lZ6IYQxX2HV7D8zOh
56jYXUyZDp87SUMoEZD2GOxLF7g_A=s85
Магнит https://lh3.googleusercontent.com/niqry3TvmSHEO9h_GNNZK5Kay8QE4W9UUf8XesOG5cfLw2RH5WMZINLq1WTndSDVE6WwQ=s114
Отстаивание https://lh3.googleusercontent.com/Jxs9d3btGr7R2zWfyne3k7JT6aIVOLhdM4kw8ukOQPo9ix17L4mh-2eOGt6tYpXpHCog=s113
Фильтрование https://lh3.googleusercontent.com/uJ9IZUw28v0i20km-hoCP11DiXJ8keqsYyDjdlprUQd3or6wxbhdqPgbV0tY3jqj2CVzw=s96











 chemistry
chemistry








