Similar presentations:
Химические свойства оксидов. Задания 8 (1-Б), 9,10 (2-П)
1.
Задания 8 (1-Б), 9,10 (2-П)Химические свойства оксидов
Кислотных
Основных
Кислотные оксиды взаимодействуют
с основными оксидами и
основаниями с образованием солей.
Кислотный оксид + основание = соль +
H2O
CO2 + 2NaOH = Na2CO3 + H2O
Основный оксид + кислотный оксид =
соль
CaO + CO2 = CaCO3
• Кислотные оксиды взаимодействуют
с водой с образованием кислот.
Кислотный оксид + H2O = кислота
SO3 + H2O = H2SO4
• Взаимодействие с кислотными
оксидами и кислотами.
Основный оксид + кислота = соль +
H2O
MgO + 2HCl = MgCl2 + H2O
Основный оксид + кислотный оксид
= соль
3Na2O + P2O5 = 2Na3PO4
• Взаимодействие с водой.
Оксид + вода = щёлочь
CaO + H2O = Ca(OH)2
Амфотерных
Амфотерные оксиды взаимодействуют с
кислотами и кислотными оксидами.
Амфотерный оксид + кислота = соль + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Амфотерный оксид + кислотный оксид =
соль
ZnO + CO2 = ZnCO3
• Амфотерные оксиды взаимодействуют с
основными оксидами и щелочами.
Амфотерный оксид + основный оксид =
соль
ZnO + Na2O = Na2ZnO2
Амфотерный оксид + щёлочь = соль + H2O
ZnO + 2KOH = K2ZnO2 + H2O
1
2.
Задания 8 (1-Б), 9,10 (2-П)Химические свойства оснований
Примеры
Действие на индикаторы
Метиловый оранжевый становится
жёлтым
Лакмус - синий
Фенолфталеин – малиновый
Взаимодействие с кислотами (реакция нейтрализации):
основание + кислота = соль + H2O
KOH + HCl = KCl + H2O
Взаимодействие щелочей с кислотными оксидами:
щелочь + кислотный оксид = соль + H2O
2NaOH + CO2 = Na2CO3 + H2O
Взаимодействие щелочей с растворами солей:
щелочь + соль = основание + соль
KOH + CuSO4 = Cu(OH)2 + K2SO4
Отношение к нагреванию:
Щелочи устойчивы, большинство оснований
разлагаются
Cu(OH)2 = СuO + H2O
Амфотерные гидроксиды проявляют свойства слабых
кислот и реагируют с щелочами (образуют комплексные
соединения):
Al(OH)3 + NaOH = Na[Al(OH)4]
2
3.
Задания 8 (1-Б), 9,10 (2-П)Химические свойства кислот
Примеры
Действие на индикаторы
Лакмус синий окрашивается в красный цвет
Метиловый оранжевый – в розовый
Фенолфталеин бесцветный
Взаимодействие с металлами, стоящими в ряду активности до
водорода:
Металл + кислота = соль + H2
Mg + 2HCl = MgCl2 + H2
Взаимодействие с основаниями, амфотерными оксидами и
гидроксидами и основными оксидами:
Основание + кислота = соль + H2O
Основный оксид + кислота = соль + H2O
Амфотерный оксид + кислота = соль + H2O
KOH + HCl = KCl + H2O
MgO + 2HCl = MgCl2 + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Взаимодействие с солями:
Соль + кислота = новая соль + новая кислота
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
При нагревании некоторые кислоты разлагаются
H2SO3 = H2O + SO2
Важно! С кислотами взаимодействуют только металлы, которые находятся в ряду активности левее
водорода. Т.е. неактивные металлы Cu, Hg, Ag, Au, Pt с кислотами не реагируют. Исключение составляют
HNO3 (конц, разбавл.), H2SO4 (конц.)
3
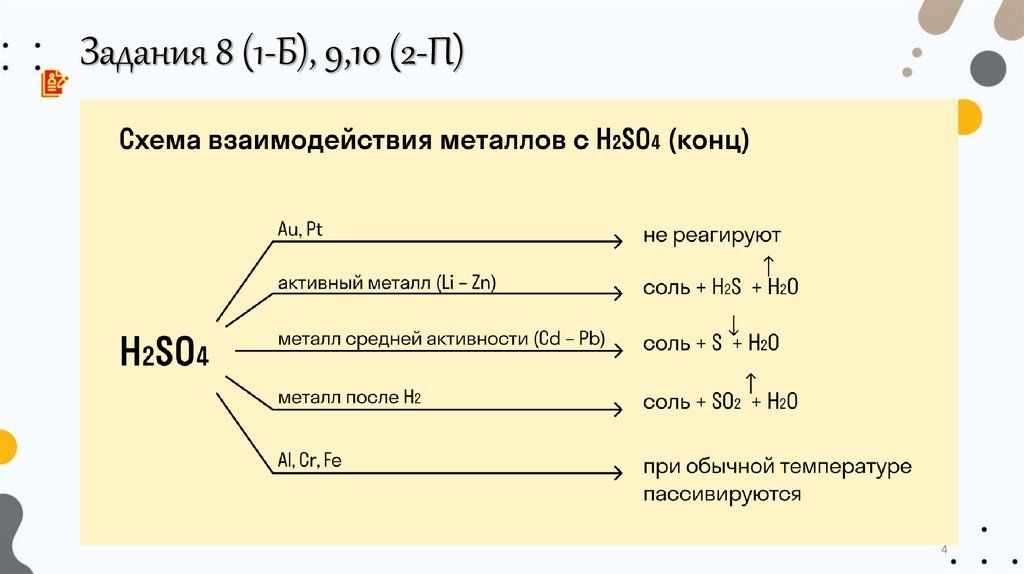
4.
Задания 8 (1-Б), 9,10 (2-П)4
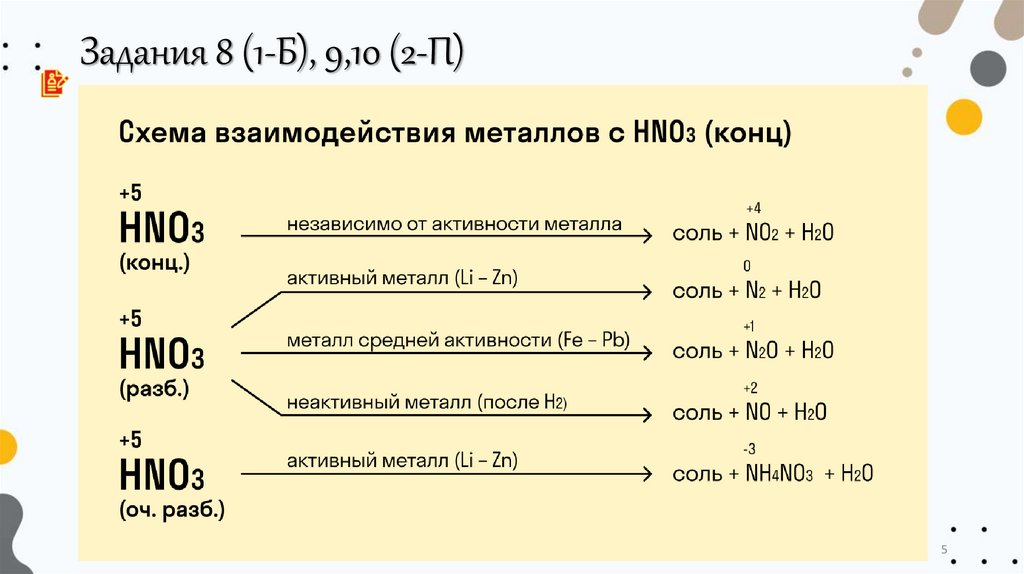
5.
Задания 8 (1-Б), 9,10 (2-П)5
6.
Задания 8 (1-Б), 9,10 (2-П)Химические свойства солей
Примеры
Отношение к нагреванию. Многие соли термически неустойчивы.
Разлагаются соли слабых кислот, соли аммония, а также
образованные сильными окислителями или восстановителями.
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
В лаборатории
• Электролиз щелочных водных растворов или водных
растворов кислородосодержащих солей
• Термическое разложение KMnO4, KClO3, нитратов
2KMnO4 = K2MnO4 + MnO2 + O2
2KClO3 = 2KCl + 3O2 (MnO2 – катализатор)
2KNO3 = 2KNO2 + O2
Взаимодействие с кислотными оксидами:
соль1 + кислотный оксид = соль2 + кислотный оксид
K2CO3 + SiO2 → K2SiO3 + CO2↑
Взаимодействие с кислотами:
Соль + кислота = новая соль + новая кислота
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Растворимые соли взаимодействуют с щелочами:
щелочь + соль = основание + соль
KOH + CuSO4 = Cu(OH)2 + K2SO4
Растворимые соли взаимодействуют с солями:
Растворимая соль1 + растворимая соль2 = соль3 + соль4
CuSO4 + BaCl2 → BaSO4↓+ CuCl2
Cоли взаимодействуют с более активными металлами:
Соль1 + металл1 = соль2 + металл2
CuSO4 + Fe = FeSO4 + Cu
6
7.
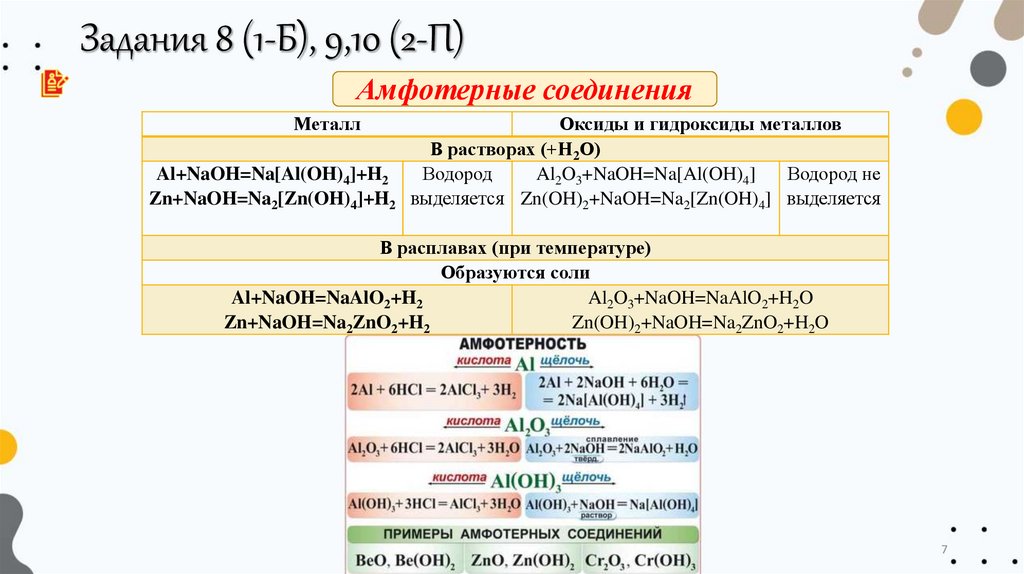
Задания 8 (1-Б), 9,10 (2-П)Амфотерные соединения
Металл
Al+NaOH=Na[Al(OH)4]+H2
Zn+NaOH=Na2[Zn(OH)4]+H2
Оксиды и гидроксиды металлов
В растворах (+Н2О)
Водород
Al2O3+NaOH=Na[Al(OH)4]
Водород не
выделяется Zn(OH)2+NaOH=Na2[Zn(OH)4] выделяется
В расплавах (при температуре)
Образуются соли
Al+NaOH=NaAlO2+H2
Al2O3+NaOH=NaAlO2+H2O
Zn+NaOH=Na2ZnO2+H2
Zn(OH)2+NaOH=Na2ZnO2+H2O
7
8.
Задание 8 (1-Б)Примеры:
Какие два из перечисленных веществ вступают в
реакцию с оксидом кальция?
1) H2O
2) O2
3) KOH
4) Na2SO4
5) Al2O3
Запишите номера выбранных ответов.
Какие два из перечисленных веществ вступают в
реакцию с хлором?
1) Cu
2) FeCl2
3) SiO2
4) H2SO4
5) Na2O
Запишите номера выбранных ответов.
CaO + H2O → Ca(OH)2
Cu + Cl2 → CuCl2
Al2O3+CaO → Ca(AlO2)2
2FeCl2 + Cl2 → 2FeCl3
8
9.
Задание 9 (2-П)Примеры:
Установите соответствие между исходными
веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА
А) Zn + HNO3(конц.) →
Б) Zn + HNO3(разб.) →
В) Zn(NO3)2
2 3 1
ПРОДУКТЫ РЕАКЦИИ
1) ZnO + NO2 + O2
2) Zn(NO3)2 + NO2 + H2O
3) Zn(NO3)2 + NH4NO3 + H2O
4) Zn(NO3)2 + H2
Установите соответствие между реагирующими
веществами и возможным(и) продуктом(-ами) их
взаимодействия: к каждой позиции, обозначенной
буквой, подберите соответствующую позицию,
обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe2(SO4)3 и NaOH
Б) P2O5 и NaOH
В) H3PO4 и NaOH
ПРОДУКТ(Ы)
ВЗАИМОДЕЙСТВИЯ
1) Fe(OH)2 и Na2SO4
2) Na3PO4 и H2O
3) Na3PO4 и H2
4) Na2SO4 и Fe(OH)3
5) Na2HPO3
4 2 2
9
10.
Задание 10 (2-П)Примеры:
Установите соответствие между веществом и
реагентами, с каждым из которых оно может
вступать в реакцию.
ВЕЩЕСТВО
РЕАГЕНТЫ
1) NaBr, H2
2) Cu, Na2CO3
3) HF, K2SO4
4) O2, Na2O
А) SO2
Б) HNO3
В) Cl2
4 2 1
2SO2 + O2 → 2SO3
SO2 + Na2O → Na2SO3
Cu + 4HNO3 (конц.) → Cu(NO3)2 + 2NO2 + 2H2O
2HNO3 + Na2CO3 → 2NaNO3 + CO2 + H2O
2NaBr + Cl2 → 2NaCl + Br2
Cl2 + H2 → 2HCl
Установите соответствие между веществом и
реагентами, с каждым из которых оно может вступать
в реакцию: к каждой позиции, обозначенной буквой,
подберите соответствующую позицию, обозначенную
цифрой.
ВЕЩЕСТВО
А) кислород
Б) аммиак
В) сульфат меди(II)
РЕАГЕНТЫ
1) NaOH (р-р), MgCl2 (р-р)
2) SO2, CH4
3) Zn, Ba(NO3)2 (р-р)
4) HCl (р-р), HNO3 (р-р)
2SO2 + O2 → 2SO3
2 4 3
CH4 + O2 → CO2 + H2O
NH4OH + HCl → NH4Cl + H2O
NH4OH+HNO3 → NH4NO3+H2O
Zn+CuSO4 → ZnSO4+Cu
CuSO4 + Ba(NO3)2 → BaSO4+ Cu(NO3)2
10







 chemistry
chemistry








