Similar presentations:
Классификация и химические свойства веществ
1.
КЛАССИФИКАЦИЯ ИХИМИЧЕСКИЕ
СВОЙСТВА ВЕЩЕСТВ
2.
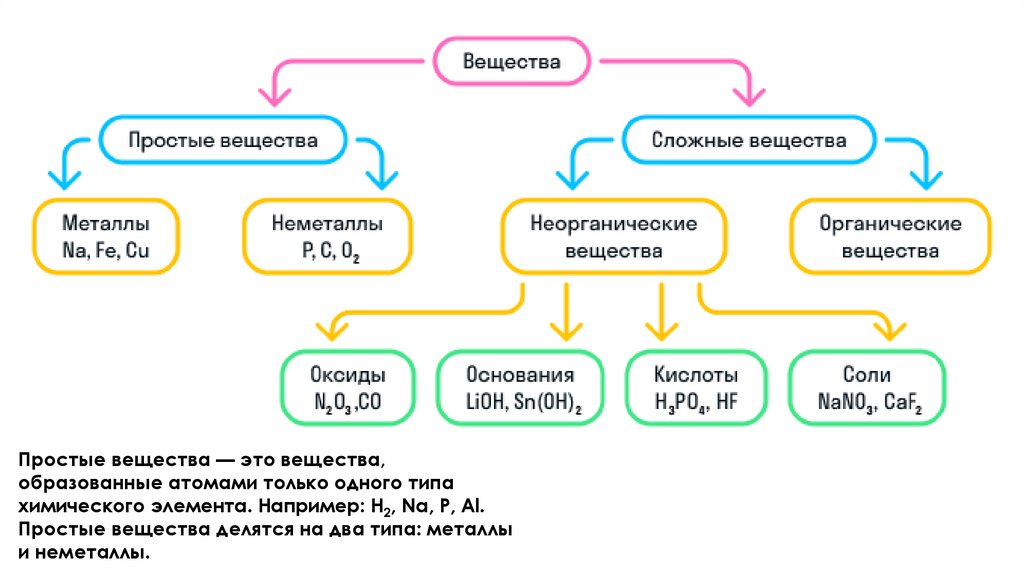
Простые вещества — это вещества,образованные атомами только одного типа
химического элемента. Например: H2, Na, P, Al.
Простые вещества делятся на два типа: металлы
и неметаллы.
3.
Некоторые неметаллы имеют немолекулярное(атомное) строение: красный фосфор,
кремний, алмаз и графит.
ПРОСТЫЕ ВЕЩЕСТВА
Металлы
- мет. крист решётка
Имеют общие между собой одинаковые
физические свойства. Обладают
металлическим блеском, высокой теплои электропроводностью, твердые (за
исключением ртути), пластичные и ковкие.
К простым веществам — металлам
относятся: Na, Ca, Fe и т. д.
Почти все металлы имеют
немолекулярное строение, т. е. состоят
из атомов или ионов - в узлах крист.
решётки.
Неметаллы
- Атомная и молекулярная крист. решётки
Среди неметаллов выделить общие физические свойства
практически невозможно. Они могут находиться в разных
агрегатных состояниях, обладать различным цветом и т. д.
К простым веществам — неметаллам относятся: P, C, F2 и
т. д.
Большинство неметаллов имеют молекулярное строение,
т. е. состоят из молекул. При этом молекулы могут быть:
одноатомные: He, Si, Ar и другие;
двухатомные: F2, O2, H2, N2, Cl2, Br2, I2. Эти простые вещества
всегда пишутся с индексом 2, их необходимо запомнить;
трехатомные — например, молекула озона O3;
и другие многоатомные.
4.
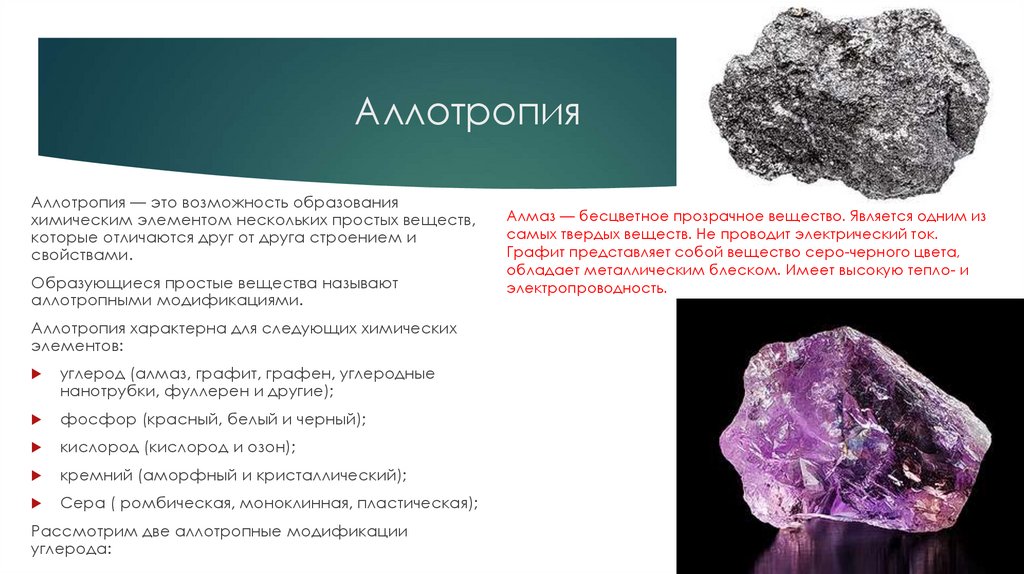
АллотропияАллотропия — это возможность образования
химическим элементом нескольких простых веществ,
которые отличаются друг от друга строением и
свойствами.
Образующиеся простые вещества называют
аллотропными модификациями.
Аллотропия характерна для следующих химических
элементов:
углерод (алмаз, графит, графен, углеродные
нанотрубки, фуллерен и другие);
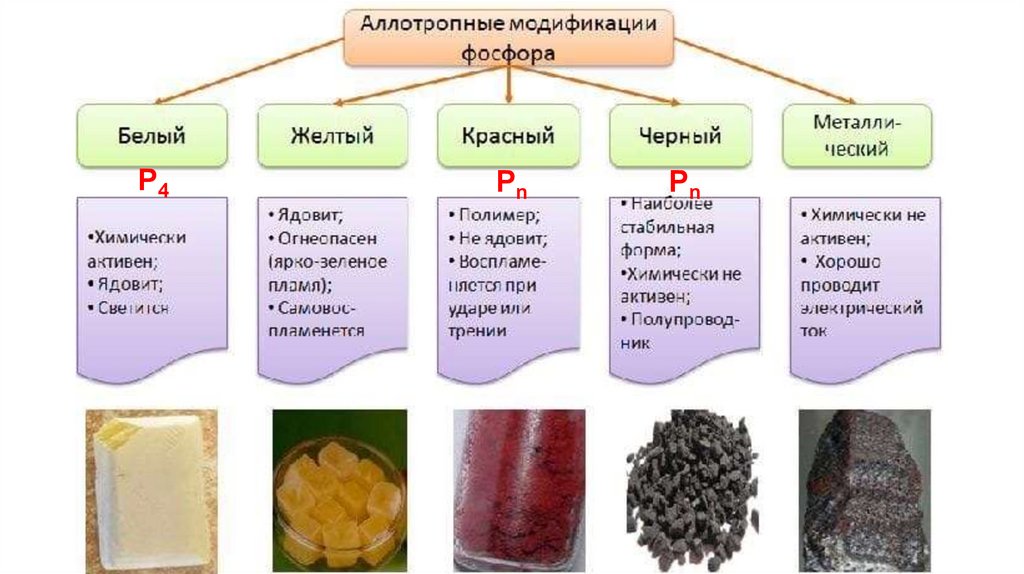
фосфор (красный, белый и черный);
кислород (кислород и озон);
кремний (аморфный и кристаллический);
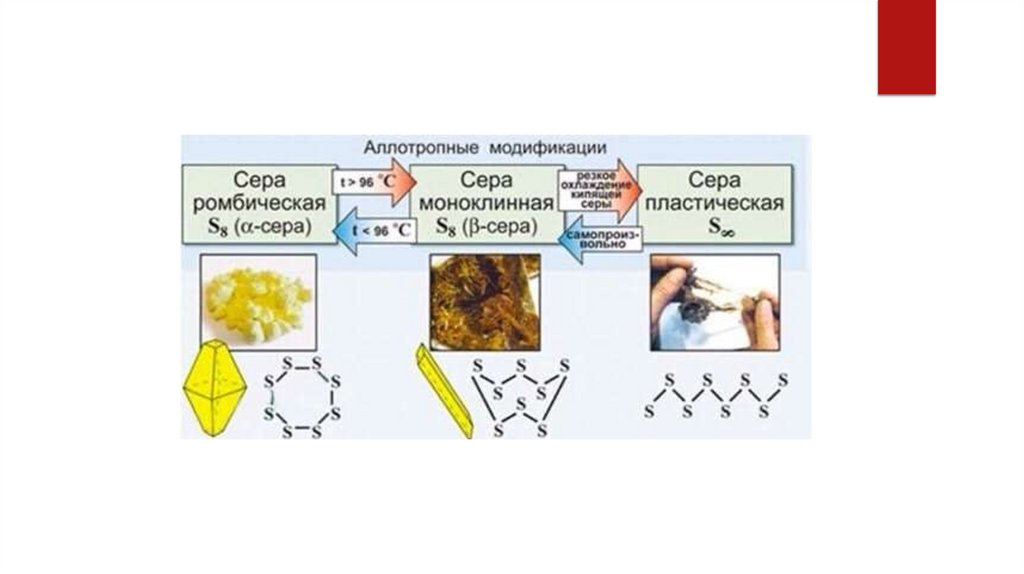
Сера ( ромбическая, моноклинная, пластическая);
Рассмотрим две аллотропные модификации
углерода:
Алмаз — бесцветное прозрачное вещество. Является одним из
самых твердых веществ. Не проводит электрический ток.
Графит представляет собой вещество серо-черного цвета,
обладает металлическим блеском. Имеет высокую тепло- и
электропроводность.
5.
P4Рn
Рn
6.
7.
8.
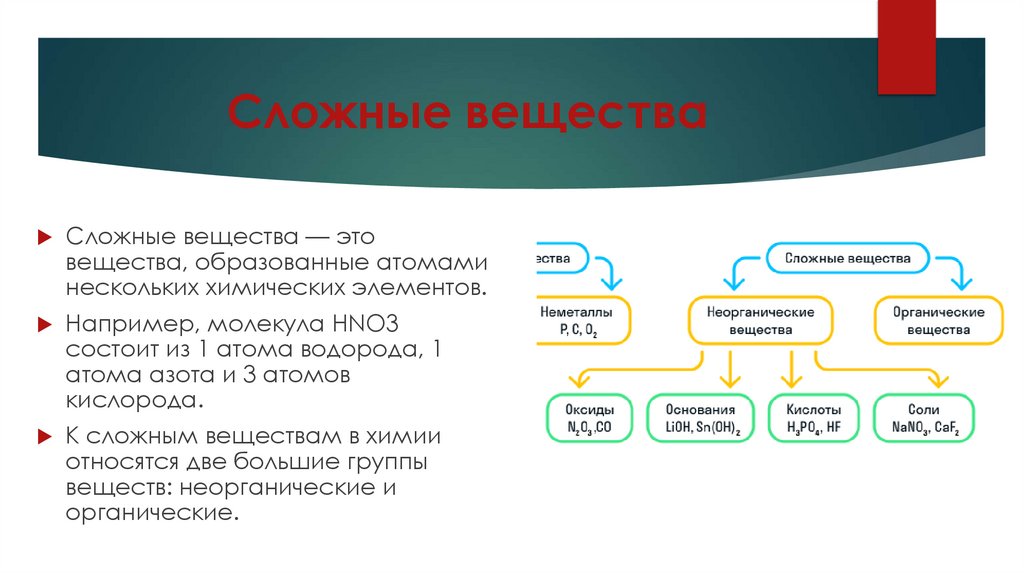
Сложные веществаСложные вещества — это
вещества, образованные атомами
нескольких химических элементов.
Например, молекула HNO3
состоит из 1 атома водорода, 1
атома азота и 3 атомов
кислорода.
К сложным веществам в химии
относятся две большие группы
веществ: неорганические и
органические.
9.
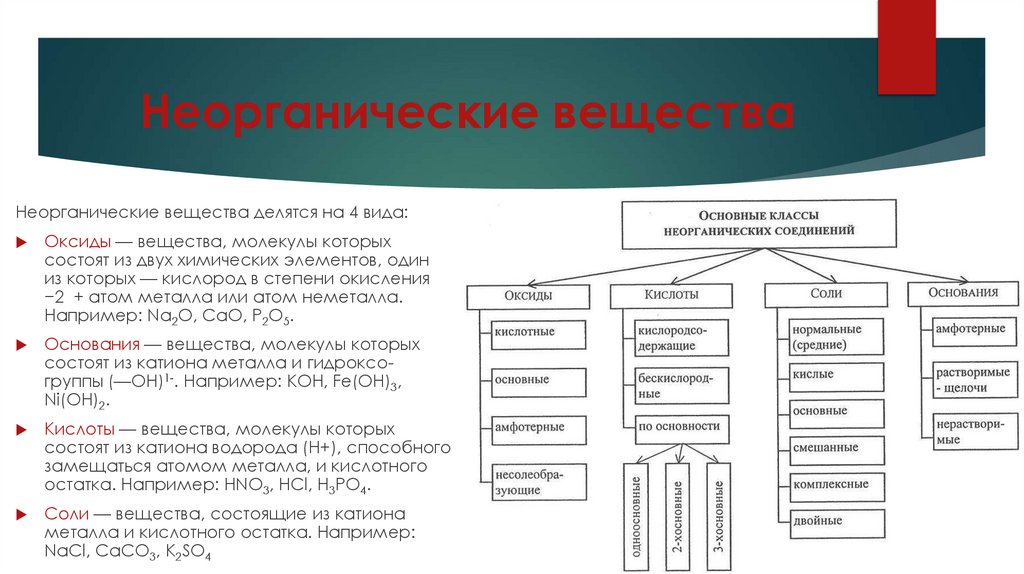
Неорганические веществаНеорганические вещества делятся на 4 вида:
Оксиды — вещества, молекулы которых
состоят из двух химических элементов, один
из которых — кислород в степени окисления
−2 + атом металла или атом неметалла.
Например: Na2O, CaO, P2O5.
Основания — вещества, молекулы которых
состоят из катиона металла и гидроксогруппы (—OH)1-. Например: KOH, Fe(OH)3,
Ni(OH)2.
Кислоты — вещества, молекулы которых
состоят из катиона водорода (H+), способного
замещаться атомом металла, и кислотного
остатка. Например: HNO3, HCl, H3PO4.
Соли — вещества, состоящие из катиона
металла и кислотного остатка. Например:
NaCl, CaCO3, K2SO4
10.
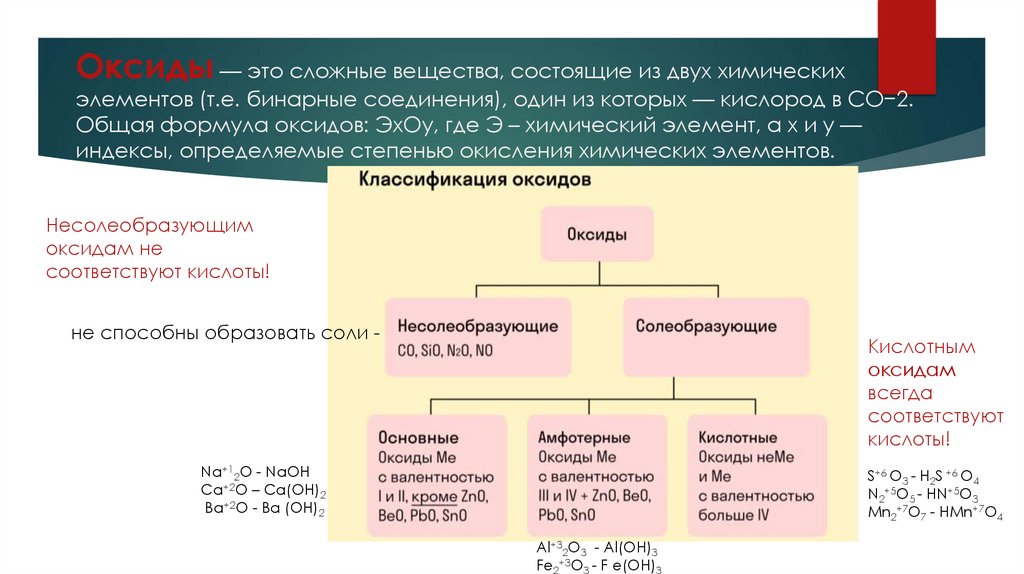
Оксиды — это сложные вещества, состоящие из двух химическихэлементов (т.е. бинарные соединения), один из которых — кислород в СО−2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y —
индексы, определяемые степенью окисления химических элементов.
Несолеобразующим
оксидам не
соответствуют кислоты!
не способны образовать соли -
Кислотным
оксидам
всегда
соответствуют
кислоты!
Na+12O - NaOH
Ca+2O – Ca(OH)2
Ba+2O - Ba (OH)2
S+6 O3 - H2S +6 O4
N2+5O5 - HN+5O3
Mn2+7O7 - HMn+7O4
Al+32O3 - Al(OH)3
Fe2+3O3 - F e(OH)3
11.
Виды оксидовВсе оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны
образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO – не соответствуют кислотам
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2, им соответствуют
основания или валентностью 1 или 2. Есть исключения.
Примеры основных оксидов: Na+12O - NaOH, Ca+2O – Ca(OH)2, Ba+2O - Ba (OH)2 .
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4, им соответсвуют
амфотерные основания. К амфотерным оксидам относят также: ZnO - Zn(OH)2 , BeO - Be (OH)2 , PbO - Pb (OH)2 , SnO Sn(OH)2. Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют
амфотерные свойства.
Примеры амфотерных оксидов: Al+32O3 - Al(OH)3 , F e2+3O3 - F e(OH)3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой
валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S+6 O3 - H2S +6 O4, N2+5O5 - HN+5O3, Mn2+7O7 - HMn+7O4.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисленияи
валентности основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
12.
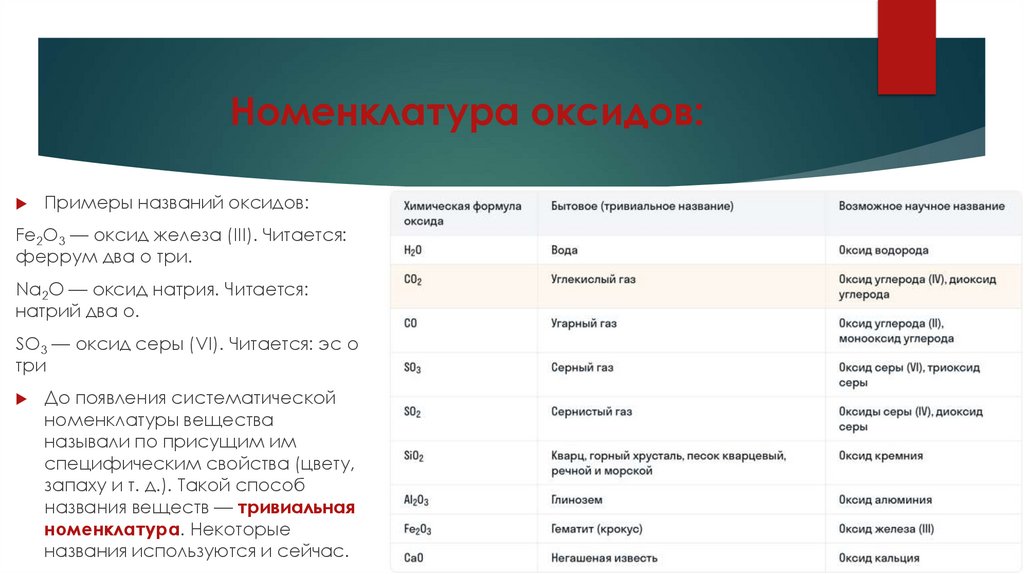
Номенклатура оксидов:Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается:
феррум два о три.
Na2O — оксид натрия. Читается:
натрий два о.
SO3 — оксид серы (VI). Читается: эс о
три
До появления систематической
номенклатуры вещества
называли по присущим им
специфическим свойства (цвету,
запаху и т. д.). Такой способ
названия веществ — тривиальная
номенклатура. Некоторые
названия используются и сейчас.
13.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВОсновные оксиды
С водой способны реагировать оксиды тех
металлов, которым соответствуют растворимые
гидроксиды. То есть с водой реагируют только
оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при
нагревании – напиши реакцию самостоятельно!
14.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВОсновные оксиды
Основный оксид + кислотный оксид = соль
Основный оксид + амфотерный оксид = соль
Основные оксиды, соответствующие
щелочам, взаимодействуют со всеми
кислотными оксидами и кислотами. Оксиды
неактивных металлов взаимодействуют только
с кислотными оксидами, соответствующими
сильным кислотам, или с сильными
кислотами.
В эту реакцию могут вступать только
основные оксиды щелочных или
щелочноземельных металлов. При
сплавлении двух оксидов образуется соль.
Например: BaO + SO3 = BaSO4
Основный оксид + кислота = соль + вода
Например: MgO + 2HNO3 = Mg(NO3)2 + 2H2O
Например: Na2O + Al2O3 = NaAlO2
Как составлять такие соли: металл в этой
соли берем из основного оксида, а
кислотный остаток из амфотерного оксида
(они проявляют более кислотные свойства).
15.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВКислотные оксиды
Кислотный оксид + вода = кислота
Кислотные оксиды взаимодействуют
с водой с образованием
соответствующих кислот. За
исключением SiO2, которому
соответствует нерастворимая
кремниевая кислота.
Например: SO3 + H2O = H2SO4
16.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВКислотные оксиды
Кислотный оксид + основный оксид = соль
Кислотный оксид + амфотерный оксид = соль
Кислотные оксиды сильных кислот способны
взаимодействовать с любыми основными
оксидами или основаниями.
С амфотерными оксидами в реакцию вступают
кислотные оксиды — как правило, сильных
кислот.
Например: SO3 + CuO = CuSO4
Например: SO3 + Al2O3 = Al2(SO4)3
Кислотный оксид + основание = соль + вода
Кислотный оксид + амфотерный гидроксид =
соль + вода
Например: N2O5 + 2NaOH = 2NaNO3 + H2O
Кислотные оксиды, соответствующие слабым
кислотам (такие как CO2, SO2), способны
взаимодействовать с основными оксидами,
соответствующим щелочам, а также с
щелочами.
Например: SO3 + Al(OH)3 = Al2(SO4)3 + H2O
17.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВАмфотерные оксиды
Амфотерные оксиды не взаимодействуют
с водой — даже при нагревании!
Амфотерный оксид + вода ≠
Амфотерные оксиды взаимодействуют только с
сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Например: Al2O3 + N2O5 = 2Al(NO3)3
Амфотерный оксид + кислота = соль + вода
Например: Al2O3 + 6HCl = 2AlCl3 + 3H2O
18.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВАмфотерные оксиды
Амфотерный оксид + основный оксид
Амфотерный оксид + щелочь (раствор) + вода =
(расплав) = соль
комплексная соль
Амфотерные оксиды взаимодействуют только
с теми оксидами, которые соответствуют
щелочам. Реакция протекает только в
расплаве, так как в растворе такие оксиды
взаимодействуют преимущественно с водой с
образованием щелочей.
Например: Al2O3 + Na2O = 2NaAlO2
Продукты взаимодействия амфотерных оксидов
со щелочами зависят от условий проведения
реакции. В растворе образуются комплексные
соли, а при сплавлении – средние соли.
Например: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Амфотерный оксид + щелочь (расплав) =
средняя соль + вода
Например: ZnO + 2KOH = K2ZnO2 + H2O
19.
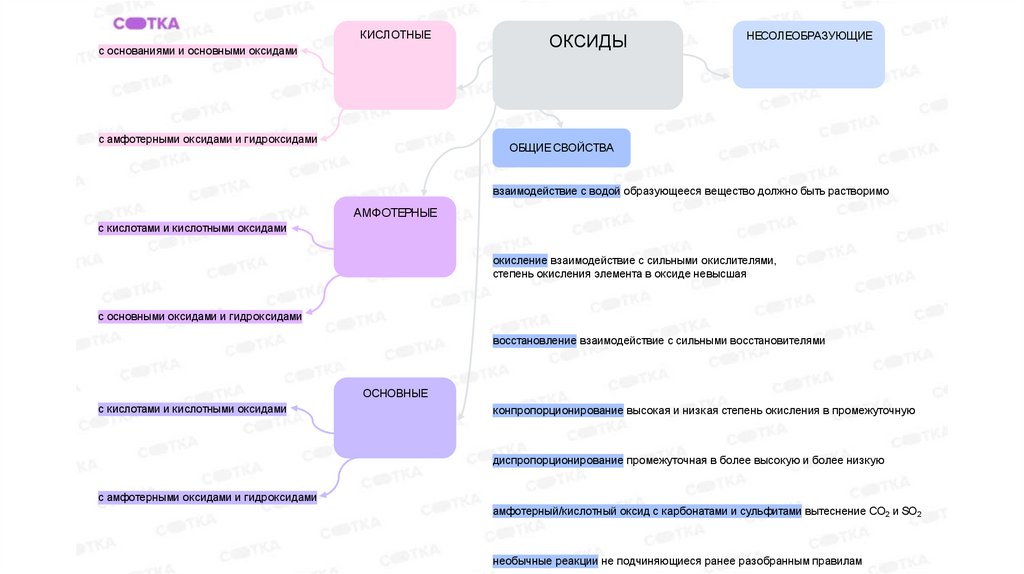
КИСЛОТНЫЕс основаниями и основными оксидами
с амфотерными оксидами и гидроксидами
ОКСИДЫ
НЕСОЛЕОБРАЗУЮЩИЕ
ОБЩИЕ СВОЙСТВА
взаимодействие с водой образующееся вещество должно быть растворимо
АМФОТЕРНЫЕ
с кислотами и кислотными оксидами
окисление взаимодействие с сильными окислителями,
степень окисления элемента в оксиде невысшая
с основными оксидами и гидроксидами
восстановление взаимодействие с сильными восстановителями
ОСНОВНЫЕ
с кислотами и кислотными оксидами
конпропорционирование высокая и низкая степень окисления в промежуточную
диспропорционирование промежуточная в более высокую и более низкую
с амфотерными оксидами и гидроксидами
амфотерный/кислотный оксид с карбонатами и сульфитами вытеснение CO2 и SO2
необычные реакции не подчиняющиеся ранее разобранным правилам
20.
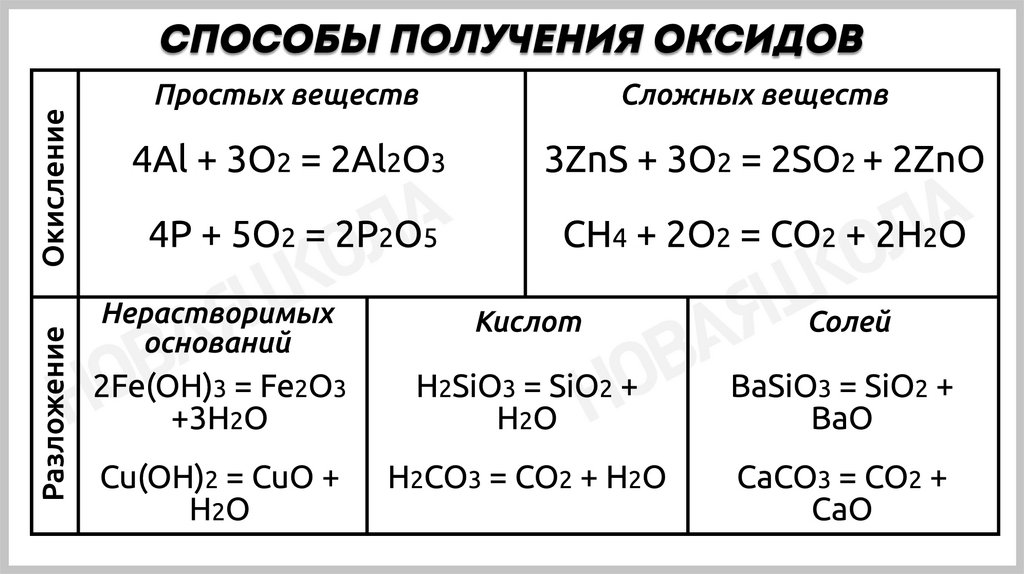
ПОЛУЧЕНИЕ ОКСИДОВ1. Окисление металлов
Почти все металлы окисляются кислородом до
устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Исключение
Не взаимодействуют с кислородом: платина, золото и
палладий.
Металлы с переменной степенью окисления, как
правило, образуют соединения в степени окисления
+3:
4Cr + 3O2 = 2Cr2O3
При взаимодействии щелочных металлов (элемента
IA группы) образуются пероксиды Me2O2 или
надпероксиды MeO2, где Ме — щелочной металл.
21.
ПОЛУЧЕНИЕ ОКСИДОВ2
. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются
высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень
окисления):
4P + 5O2 (избыток) = 2P2O5
При недостаточном количестве кислорода образуются оксиды неметаллов в
промежуточной степени окисления:
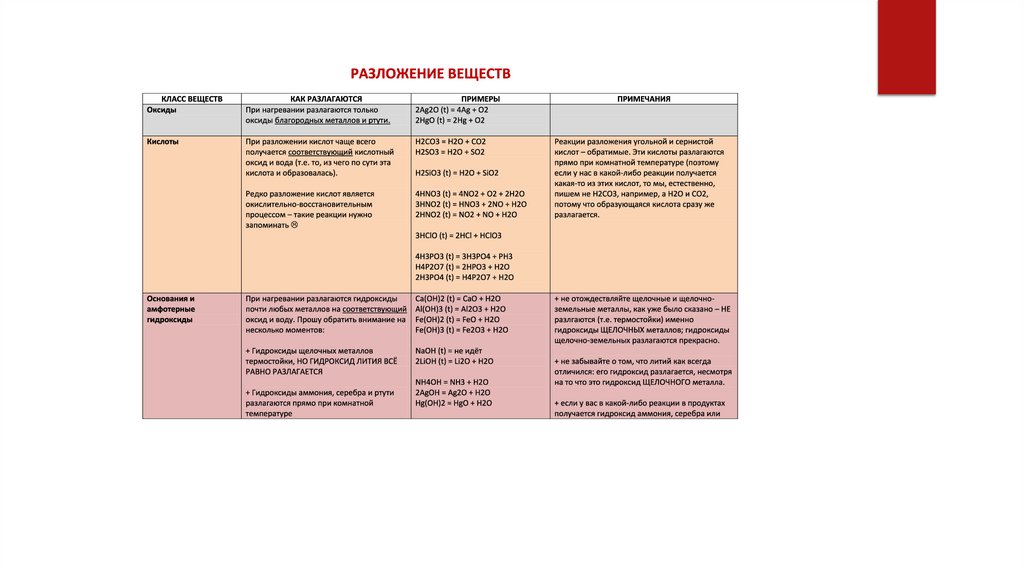
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно
разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Например:
H2SO3 = SO2↑ + H2O
H2CO3 = CO2↑ + H2O
4P + 3O2 (недостаток) = 2P2O3
Ag(OH) = Ag2O + H2O
Существуют и исключения. Например, сера окисляется лишь до оксида серы
(IV) даже в избытке кислорода:
S + O2 = SO2 и получаем SO3
таким способом: 2SO2 + O2 = 2SO3
Или азот, который взаимодействует с кислородом только при температуре 2
000̊С или под действием электрического разряда с образованием оксида азота
(II):
N2 + O2 = 2NO
и получаем
2NO + 3O2 = 2N2O3 / N2O5 в избытке O2
Запомнить
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так
же как и инертные газы (элементы VIIIA группы).
[NH4OH] = NH3↑ + H2O
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая
кислота разлагаются при нагревании по той же самой схеме.
Например:
22.
ПОЛУЧЕНИЕ ОКСИДОВ4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с
образованием двух оксидов этих элементов в устойчивых степенях окисления.
Например:
2H2S + 3O2 = 2SO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов
и т. д.
Например, Li2CO3 = Li2O + CO2↑
23.
24.
25.
26.
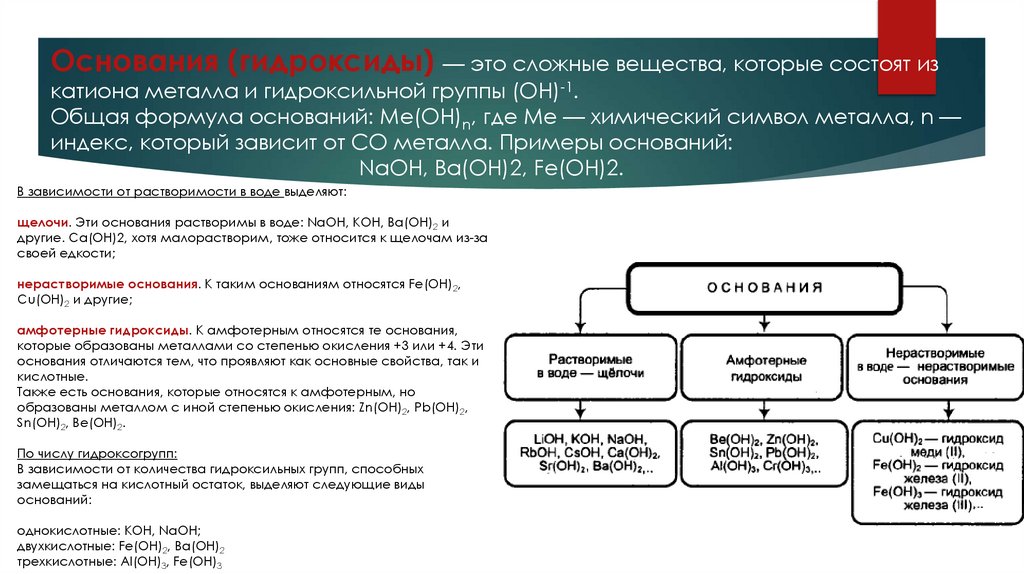
Основания (гидроксиды) — это сложные вещества, которые состоят изкатиона металла и гидроксильной группы (OH)-1.
Общая формула оснований: Me(OH)n, где Me — химический символ металла, n —
индекс, который зависит от СО металла. Примеры оснований:
NaOH, Ba(OH)2, Fe(OH)2.
В зависимости от растворимости в воде выделяют:
щелочи. Эти основания растворимы в воде: NaOH, KOH, Ba(OH)2 и
другие. Ca(OH)2, хотя малорастворим, тоже относится к щелочам из-за
своей едкости;
нерастворимые основания. К таким основаниям относятся Fe(OH)2,
Cu(OH)2 и другие;
амфотерные гидроксиды. К амфотерным относятся те основания,
которые образованы металлами со степенью окисления +3 или +4. Эти
основания отличаются тем, что проявляют как основные свойства, так и
кислотные.
Также есть основания, которые относятся к амфотерным, но
образованы металлом с иной степенью окисления: Zn(OH)2, Pb(OH)2,
Sn(OH)2, Be(OH)2.
По числу гидроксогрупп:
В зависимости от количества гидроксильных групп, способных
замещаться на кислотный остаток, выделяют следующие виды
оснований:
однокислотные: KOH, NaOH;
двухкислотные: Fe(OH)2, Ba(OH)2
трехкислотные: Al(OH)3, Fe(OH)3
27.
28.
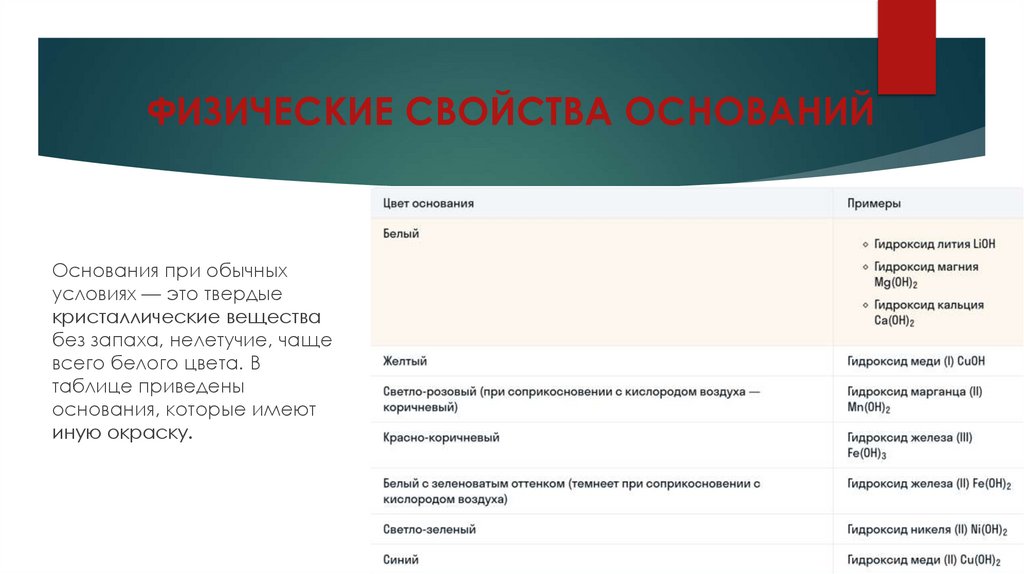
ФИЗИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙОснования при обычных
условиях — это твердые
кристаллические вещества
без запаха, нелетучие, чаще
всего белого цвета. В
таблице приведены
основания, которые имеют
иную окраску.
29.
ХИМИЧЕСКИЕ СВОЙСТВА ГИДРОКСИДОВОснования
Кислотный оксид + основание = соль + вода
Щелочи вступают в реакцию с любыми кислотными
оксидами. Нерастворимые основания взаимодействуют
только с кислотными оксидами, которые соответствуют
сильным кислотам.
Например: N2O5 + 2NaOH = 2NaNO3 + H2O
Щелочи вступают в реакцию со всеми кислотами.
Нерастворимые основания могут взаимодействовать
только с сильными кислотами.
Основание + кислота = соль + вода
Например: Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Взаимодействие основания с кислотой называют
реакцией нейтрализации — это частный случай
реакции обмена.
30.
ХИМИЧЕСКИЕ СВОЙСТВА ГИДРОКСИДОВОснования
Основание + соль = другое основание + другая соль
Основания взаимодействуют с растворимыми солями по обменному механизму. В результате такой
реакции должен выделиться осадок или газ (CO2, SO2, NH3).
Например: KOH + MgSO4 = Mg(OH)2↓ + K2SO4
Термическое разложение
При нагревании нерастворимые основания разлагаются на соответствующий оксид (степень
окисления металла остается неизменной) и воду.
31.
ХИМИЧЕСКИЕ СВОЙСТВА ГИДРОКСИДОВАмфотерные гидроксиды
Взаимодействие амфотерных гидроксидов со
щелочами
При сплавлении двух оснований:
Амфотерный гидроксид (тв) + щелочь (тв) = средняя
соль + вода
Например: Al(OH)3 + KOH = KAlO2 + 2H2O
Если реакция проводится в растворе:
Амфотерный гидроксид (р-р) + щелочь (р-р) =
комплексная соль
Например: Al(OH)3 + KOH = K[Al(OH)4]
32.
33.
34.
35.
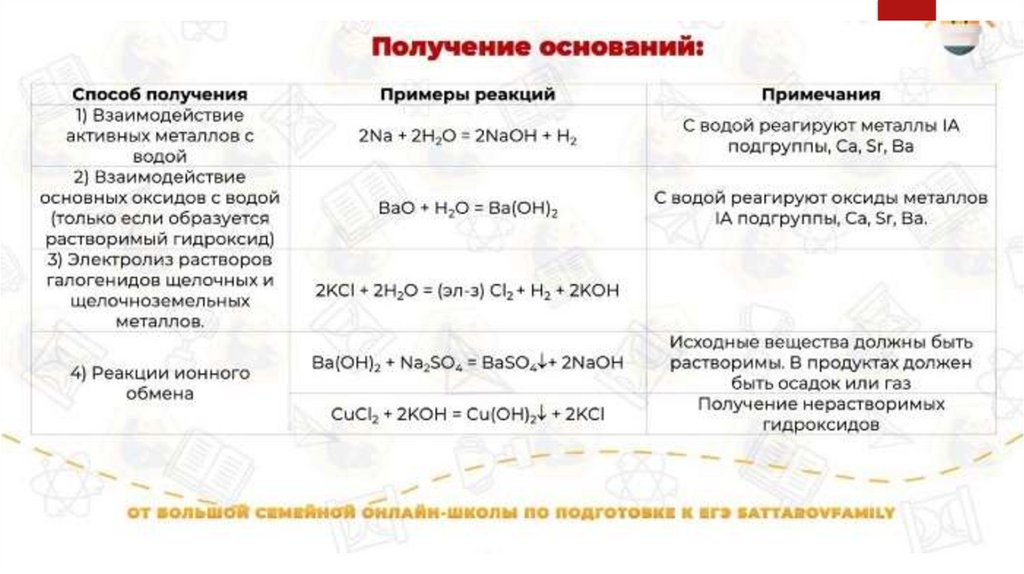
ПОЛУЧЕНИЕ ОСНОВАНИЙВзаимодействие металла с водой
Активные металлы (металлы групп IA и IIA,
кроме Be и Mg) активно взаимодействуют
с водой при обычных условиях с
образованием щелочей.
Нерастворимые основания данным
способом получить невозможно, за
исключением Mg(OH)2.
Металл + вода = гидроксид металла +
водород
Например: Na + H2O = NaOH + H2↑
Гидроксид магния можно получить
данным способом, но только при
нагревании:
*
36.
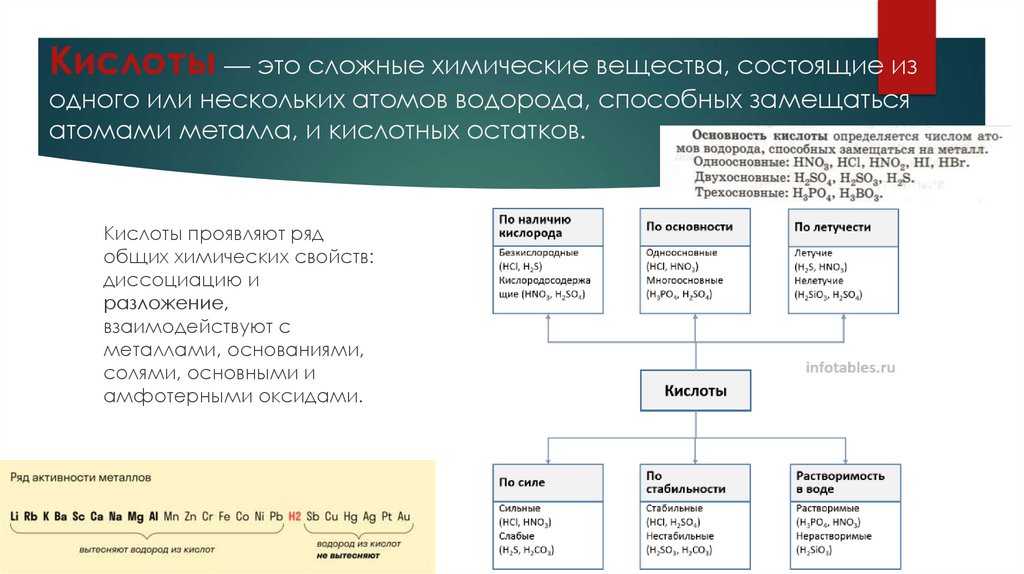
Кислоты — это сложные химические вещества, состоящие изодного или нескольких атомов водорода, способных замещаться
атомами металла, и кислотных остатков.
Кислоты проявляют ряд
общих химических свойств:
диссоциацию и
разложение,
взаимодействуют с
металлами, основаниями,
солями, основными и
амфотерными оксидами.
37.
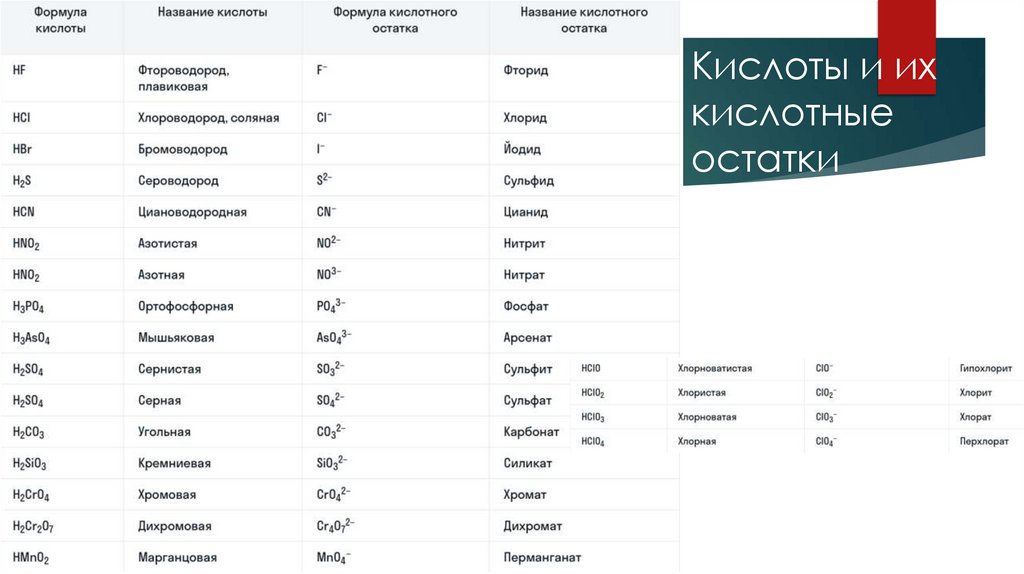
Кислоты и ихкислотные
остатки
38.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ39.
ДиссоциацияКислоты — это электролиты, которые при диссоциации образуют катионы водорода и
анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности
к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Малодиссоциирующие (слабые): H2CO3, H2SO3, H2SiO3.
H2SO4 = H+ +HSO4−
HSO4− = H+ + SO42−
40.
РазложениеВ результате реакций разложения кислородсодержащих кислот образуются кислотный
оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения
некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же
разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
H2CO3 = CO2 + H2O
2HCl = H2 + Cl2
41.
Восстановительные свойствабескислородных кислот
Бескислородные кислоты (кроме HF) проявляют
восстановительные свойства за счет химического
элемента, который входит в состав аниона, при
действии на них различных окислителей.
Из галогеноводородных кислот наибольшая
восстановительная активность — у йодоводородной. Ее
могут окислять оксид железа (III) и соль трехвалентного
железа.
Например, в качестве окислителей для всех
галогеноводородных кислот выступают диоксид
марганца MnO2, перманганат калия KMnO4, дихромат
калия K2Cr2O7.
6HI + Fe2O3 = 2FeI2 + I2 + 3H2O
Результат этих реакций — образование свободных
галогенов.
Высокая восстановительная активность характерна для
сероводородной кислоты, она может быть окислена
диоксидом серы.
4HCl + MnO2 =MnCl2 + Cl2 + 2H2O
2H2S + SO2 = 3S + 2H2O
14HBr + K2Cr2O7 = 2CrBr3 + 3Br2 + 2KBr + 7H2O
16HI + 2KMnO4 = 2MnI2 + 5I2 + 2KI + 8H2O
42.
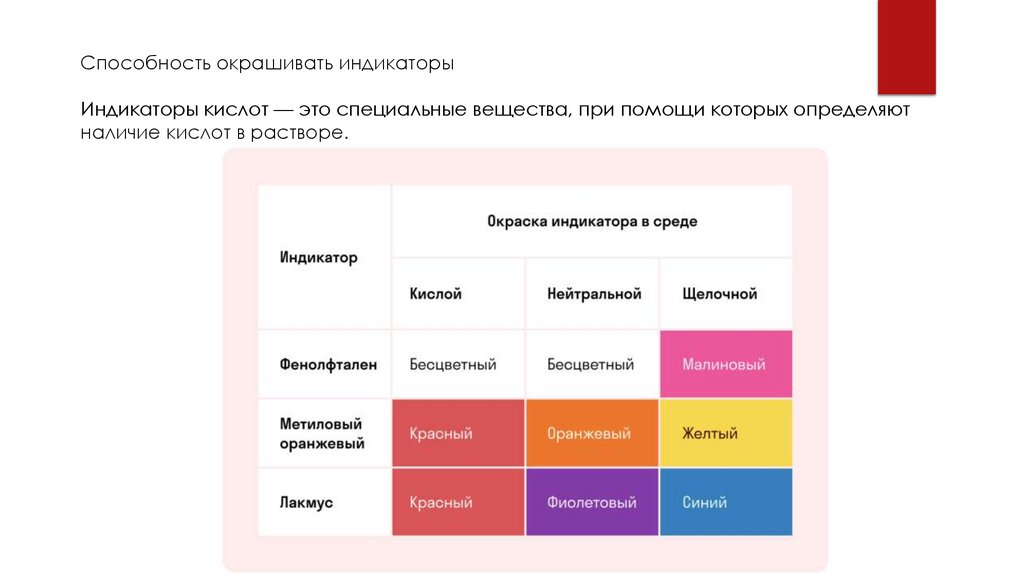
Способность окрашивать индикаторыИндикаторы кислот — это специальные вещества, при помощи которых определяют
наличие кислот в растворе.
43.
ПОЛУЧЕНИЕ КИСЛОТ44.
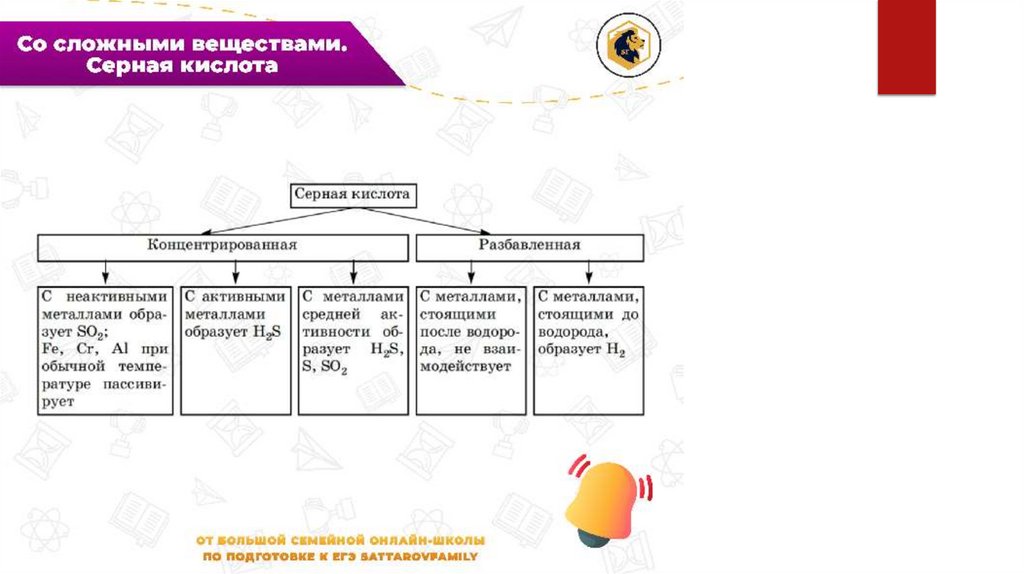
ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯКИСЛОТ С МЕТАЛЛАМИ
При взаимодействии с кислотамиокислителями: азотная концентрированная
или азотная разбавленная, серная
концентрированная кислоты – ОВР, а не
реакции замещения. Реакция с серной
разбавленной кислотой – реакция
замещения, как и с другими кислотами
средней силы, кислотами – неокислителями.
45.
ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯКИСЛОТ С МЕТАЛЛАМИ
46.
ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯКИСЛОТ С НЕМЕТАЛЛАМИ
47.
48.
49.
50.
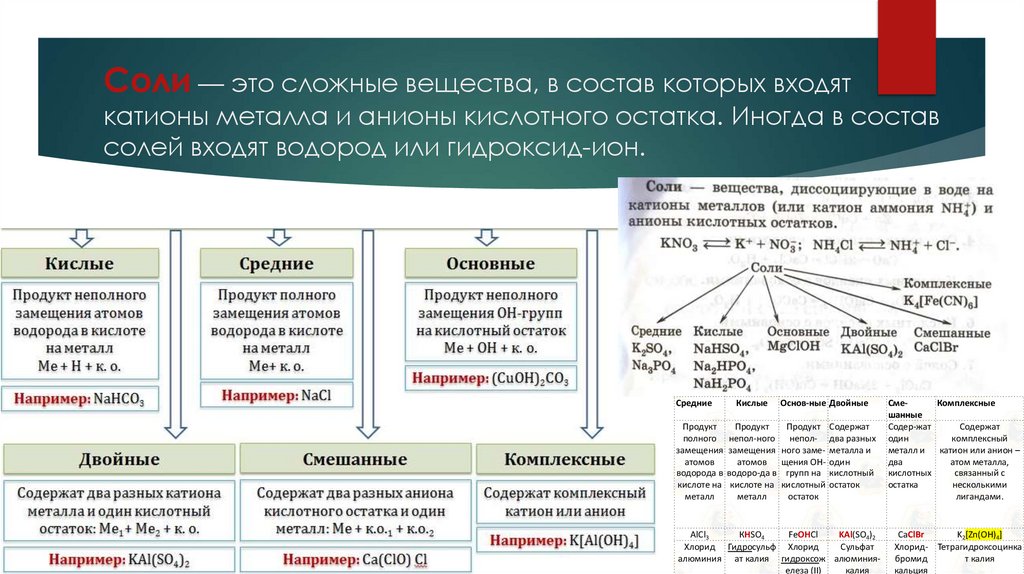
Соли — это сложные вещества, в состав которых входяткатионы металла и анионы кислотного остатка. Иногда в состав
солей входят водород или гидроксид-ион.
Соли
Соли – это сложные вещества, состоящие из одного (несколь
атомов металла (или более сложных катионных групп, напри
аммонийных групп NН4+) и одного (или нескольких) кислотны
остатков.
Классификация солей
3
Средние
3
Кислые
СОЛИ
Основ-ные Двойные
Продукт
Продукт
Продукт Содержат
полного непол-ного непол- два разных
замещения замещения ного заме- металла и
атомов
атомов щения ОН- один
водорода в водоро-да в групп на кислотный
кислоте на кислоте на кислотный остаток
металл
металл
остаток
СмеКомплексные
шанные
Содер-жат
Содержат
один
комплексный
металл и
катион или анион –
два
атом металла,
кислотных
связанный с
остатка
несколькими
лигандами.
AlCl3
КHSO4
FeOHCl
KAl(SO4)2
Хлорид Гидросульф Хлорид
Сульфат
алюминия ат калия гидроксож алюминияелеза (II)
калия
CaClBr
K2[Zn(OH)4]
Хлорид- Тетрагидроксоцинка
бромид
т калия
кальция
51.
СолиКислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку "гидро":
NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные
группы. Основные соли образуются при неполной нейтрализации основания. Названия
основных солей образуют с помощью приставки "гидроксо":
2
Mg(OH)Cl - гидроксохлорид
магния (основная соль)
3
3
Двойные соли – имеют два разных катиона металла или аммония. В названии их
перечисляют через дефис:
(NH4)Fe(SO4)2 – сульфат железа (III)-аммония.
Смешанные соли – имеют два разных аниона кислотных остатков. В названии их
называют через дефис: СаOCl2 или CaCl(OCl) - хлорид-гипохлорит кальция
(традиционное название хлорная известь).
Комплексные соли – содержат сложный комплексный анион (или реже катион),
состоящий из металла-комплексообразователя и нескольких лигандов (отрицательно
заряженные ионы или молекулы аммиака или воды).
K[Al(OH)4] – тетрагидроксоалюминат калия
K4[Fe(CN)6] – гексацианоферрат калия
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди (II)
3
52.
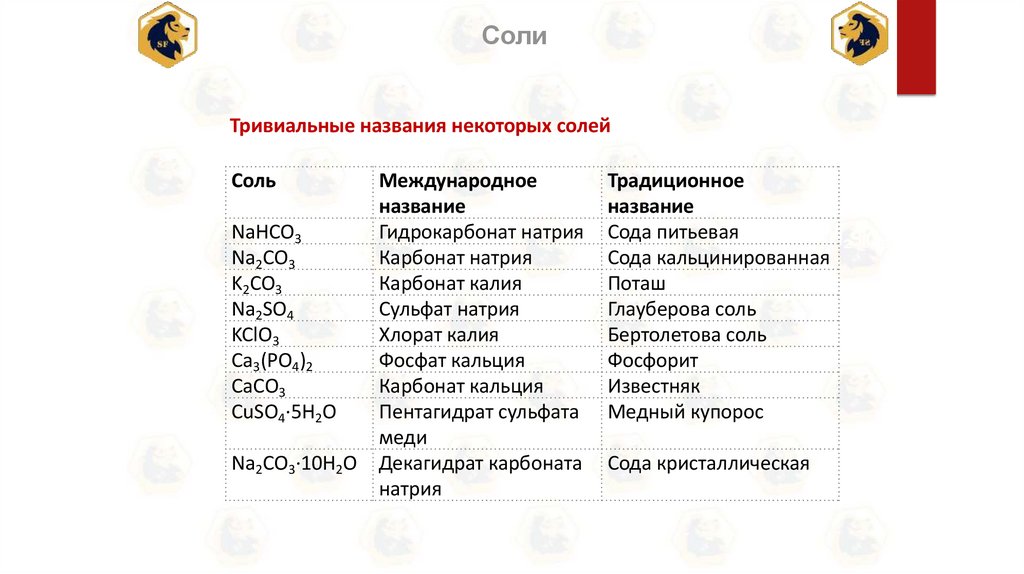
СолиТривиальные названия некоторых солей
Соль
Международное
название
NaHCO3
Гидрокарбонат натрия
3
3 Карбонат натрия
Na2CO3
K2CO3
Карбонат калия
Na2SO4
Сульфат натрия
KClO3
Хлорат калия
Ca3(PO4)2
Фосфат кальция
СаСО3
Карбонат кальция
CuSO4·5H2O
Пентагидрат сульфата
меди
Na2CO3·10Н2О Декагидрат карбоната
натрия
Традиционное
название
Сода питьевая
2
Сода кальцинированная
Поташ
Глауберова соль
Бертолетова соль
Фосфорит
Известняк
Медный купорос
Сода кристаллическая
3
53.
КЛАССИФИКАЦИЯКислые соли
Средние соли
Образованы неполным замещением атомов
водорода на металл в кислоте.
Образованы полным замещением атомов
водорода в кислоте на металл.
В наименованиях кислых солей указывают
количество водорода приставками «гидро-» или
«дигидро-», название кислотного остатка и
название металла. Если металл имеет
переменную валентность, то в скобках
указывают валентность.
Наименования средних солей складываются из
названий кислотного остатка и металла. При
необходимости указывают валентность.
Примеры средних солей с названиями:
CuSO4 — сульфат меди (II),
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
CaCl2 — хлорид кальция.
54.
КЛАССИФИКАЦИЯОсновные соли
Двойные соли
Продукт неполного замещения гидроксогрупп
на кислотный остаток.
В состав входят два разных металла и один
кислотный остаток.
В наименованиях основных солей указывают
количество гидроксид-ионов приставкой
«гидроксо-» или «дигидроксо-», название
кислотного остатка и название металла с
указанием валентности.
Наименование складывается из названия
аниона кислотного остатка и названий
металлов с указанием валентности (если
металл имеет переменную валентность).
Пример: Mg(OH)Cl — гидроксохлорид магния.
Примеры двойных солей и их наименования:
KNaSO4 — сульфат калия-натрия,
KAl(SO4)2 — сульфат калия-алюминия.
55.
КЛАССИФИКАЦИЯСмешанные соли
Содержат один металл и два разных кислотных
остатка.
Наименования смешанных солей
складываются из названия кислотных остатков
(по усложнению) и названия металла с
указанием валентности (при необходимости).
Примеры смешанных солей с
наименованиями:
CaClOCl — хлорид-гиполхорит кальция,
PbFCl — фторид-хлорид свинца (II).
Комплексные соли
Образованы комплексным катионом или
анионом, связанным с несколькими
лигандами.
Называют комплексные соли по схеме:
координационное число + лиганд с
окончанием «-о» + комплексообразователь с
окончанием «-ат» и указанием валентности +
внешняя сфера, простой ион в родительном
падеже.
Пример: K[Al(OH)4] —
тетрагидроксоалюминат калия.
56.
КЛАССИФИКАЦИЯГидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют
название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
57.
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ58.
ПОЛУЧЕНИЕ СОЛЕЙ59.
Разложение солейТермическое разложение:
CaCO3 = CaO + CO2
Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион,
проявляет окислительные свойства. В остальных случаях разложение солей аммония
сопровождается выделением аммиака:
NH4Cl = NH3 + HCl
Нитраты разлагаются в зависимости от активности металла соли:
60.
Получение кислых солейКислые соли образуются при взаимодействии:
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
Кислот с металлами:
Zn + 2H2SO4 = H2 + Zn(HSO4)2
Аммиака с кислотами:
NH3 + H3PO4 = NH4H2PO4
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O
Получение кислых солей возможно, если кислота в
избытке.
Гидроксидов металлов с кислотами:
Также кислые соли образуются в ходе реакции
основания с избытком кислотного оксида:
Ba(OH)2 + H3PO4 = BaHPO4 + 2H2O
KOH + CO2 = KHCO3
2SO2 + Ca(OH)2 = Ca(HSO3)2
61.
Получение основных солейВзаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Добавление (по каплям) небольших количеств щелочей к растворам средних
солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3
Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
62.
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙХимические свойства
кислых солей
Диссоциация. Кислые соли диссоциируют
ступенчато:
NaHCO3 → Na+ +HCO3−
HCO3− → H+ + CO32−
Термическое разложение с образованием средней
соли:
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Взаимодействие солей со щелочью. В результате
образуется средняя соль:
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
Химические свойства
основных солей
Термическое разложение:
[Cu(OH)]2CO3 = 2CuO + CO2 + H2O
Реакции солей с кислотами — образование средней
соли:
Sn(OH)Cl + HCl = SnCl2 + H2O
Диссоциация — так же как и кислые соли, основные
соли диссоциируют ступенчато.
63.
Получение солейПолучение комплексных
солей
Реакции солей с лигандами:
AgCl + 2NH3 = [Ag(NH3)2]Cl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
Получение двойных солей
Двойные соли получают совместной
кристаллизацией двух солей:
Cr2(SO4)3 + K2SO4 + 24H2O = 2[KCr(SO4) 2
12H2O]
64.
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙИзбыток сильной кислоты приводит к разрушению
комплекса и образованию двух средних солей и
воды:
При действии углекислого или сернистого газа
получаются кислая соль активного металла и
амфотерный гидроксид:
Na[Al(OH)4] + 4HCl(изб.) = NaCl + AlCl3 + 4H2O,
K3[Cr(OH)6] + 3SO2 = 3KHSO3 + Cr(OH)3,
Недостаток сильной кислоты приводит к
образованию средней соли активного металла,
амфотерного гидроксида и воды:
Реакция солей, образованных сильными кислотами с
катионами Fe3+, Al3+ и Cr3+, приводит к взаимному
усилению гидролиза. Продукты реакции — два
амфотерных гидроксида и соль активного металла:
Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + H2O,
Взаимодействие слабой кислоты с солью образует
кислую соль активного металла, амфотерный
гидроксид и воду:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O,
K3[Cr(OH)6] +Al(NO3)3 = Al(OH)3 + Cr(OH)3 + 3KNO3
Разлагаются при нагревании:
K3[Cr(OH)6] =KCrO2 + 2H2O + 2KOH
65.
ГИДРОЛИЗ СОЛЕЙ66.
ГИДРОЛИЗ СОЛЕЙ67.
ОКРАСКИ ИНДИКАТОРОВ В РАЗЛИЧНЫХСРЕДАХ
Растворы щелочей изменяют окраску
индикатора
Гидроксид-ионы, которые содержатся в
растворе щелочи, взаимодействуют с
индикатором, образуя новые
соединения. Признак реакции —
окраска раствора.
68.
69.
Соли азотной кислотыФизические свойства
Нитраты – вещества с преимущественно ионным
типом кристаллических решёток. При обычных
3
3
условиях это твёрдые кристаллические вещества,
все нитраты хорошо растворимы в воде, сильные
электролиты.
2
3
70.
Соли азотной кислотыХимические свойства нитратов
I. Общие с другими солями
1) C металлами
Металл, стоящий в ряду активности левее, вытесняет
последующие из их солей:
Cu(NO3)2 + Zn =3 Cu3 + Zn(NO3)2
2) С кислотами
AgNO3 + HCl = AgCl↓ + HNO3
3) Со щелочами
Cu(NO3)2 + 2NaOH = Cu(OH)2 ↓ + 2NaNO3
4) C cолями
2AgNO3 + BaCl2 = Ba(NO3)2 + 2AgCl↓
2
3
71.
Соли азотной кислотыНитраты образуются при взаимодействии:
1) Металл + Азотная кислота
Cu + 4HNO3(k) = Cu(NO3)2 + 2NO2↑ + 2H2O
2) Основный оксид + Азотная кислота
CuO + 2HNO3 = Cu(NO3)2 + H2O
3) Основание + Азотная кислота
3
3
HNO3 + NaOH = NaNO3 + H2O
4) Аммиак + Азотная кислота
NH3 + HNO3 = NH4NO3
5) Соль слабой кислоты + Азотная кислота
2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2 ↑
6) Оксид азота (IV) + щёлочь
2NO2 + NaOH = NaNO2 + NaNO3 + H2O
в присутствии кислорода 4NO2 + O2 + 4NaOH = 4NaNO3 + 2H2O
2
3
72.
Соли азотной кислотыВсе нитраты термически неустойчивы. При
нагревании они разлагаются с образованием кислорода. Характер
других продуктов реакции зависит от положения металла,
образующего нитрат, в электрохимическом ряду напряжений:
1) Нитраты щелочных (исключение - нитрат лития) и щелочноземельных металлов разлагаются
до нитритов:
2
2NaNO3 = 2NaNO2 +3O2↑3
2КNO3 = 2KNO2 + O2
2) Нитраты менее активных металлов от Mg до Cu включительно и нитрат лития разлагаются
до оксидов:
2Mg(NO3)2 = 2MgO + 4NO2↑ + O2↑
2Cu(NO3)2 =2CuO + 4NO2 ↑+ O2↑
3) Нитраты наименее активных металлов (правее меди) разлагаются до металлов:
Hg(NO3)2 = Hg + 2NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2 ↑+ O2↑
4) Нитрат и нитрит аммония:
Нитрат аммония разлагается в зависимости от температуры так:
NH4NO3 = N2O ↑+ 2H2O (190-245°C)
Нитрит аммония:
NH4NO2 = N2 ↑+ 2H2O
3
73.
74.
75.
СолиСоли азотной
кислоты
(нитраты)
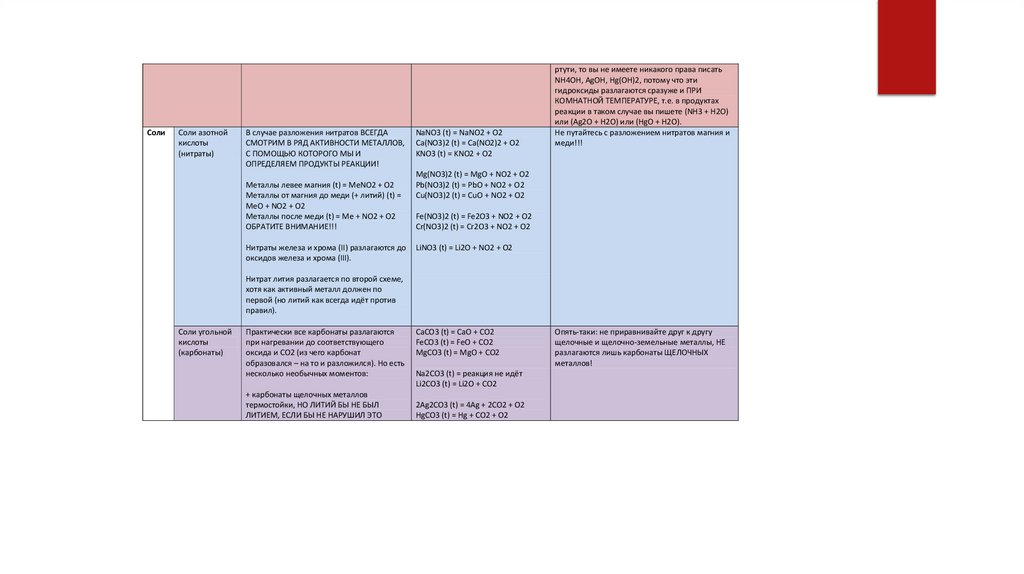
В случае разложения нитратов ВСЕГДА
СМОТРИМ В РЯД АКТИВНОСТИ МЕТАЛЛОВ,
С ПОМОЩЬЮ КОТОРОГО МЫ И
ОПРЕДЕЛЯЕМ ПРОДУКТЫ РЕАКЦИИ!
Металлы левее магния (t) = MeNO2 + O2
Металлы от магния до меди (+ литий) (t) =
MeO + NO2 + O2
Металлы после меди (t) = Me + NO2 + O2
ОБРАТИТЕ ВНИМАНИЕ!!!
Нитраты железа и хрома (II) разлагаются до
оксидов железа и хрома (III).
NaNO3 (t) = NaNO2 + O2
Ca(NO3)2 (t) = Ca(NO2)2 + O2
KNO3 (t) = KNO2 + O2
ртути, то вы не имеете никакого права писать
NH4OH, AgOH, Hg(OH)2, потому что эти
гидроксиды разлагаются сразуже и ПРИ
КОМНАТНОЙ ТЕМПЕРАТУРЕ, т.е. в продуктах
реакции в таком случае вы пишете (NH3 + H2O)
или (Ag2O + H2O) или (HgO + H2O).
Не путайтесь с разложением нитратов магния и
меди!!!
Mg(NO3)2 (t) = MgO + NO2 + O2
Pb(NO3)2 (t) = PbO + NO2 + O2
Cu(NO3)2 (t) = CuO + NO2 + O2
Fe(NO3)2 (t) = Fe2O3 + NO2 + O2
Cr(NO3)2 (t) = Cr2O3 + NO2 + O2
LiNO3 (t) = Li2O + NO2 + O2
Нитрат лития разлагается по второй схеме,
хотя как активный металл должен по
первой (но литий как всегда идёт против
правил).
Соли угольной
кислоты
(карбонаты)
Практически все карбонаты разлагаются
при нагревании до соответствующего
оксида и CO2 (из чего карбонат
образовался – на то и разложился). Но есть
несколько необычных моментов:
+ карбонаты щелочных металлов
термостойки, НО ЛИТИЙ БЫ НЕ БЫЛ
ЛИТИЕМ, ЕСЛИ БЫ НЕ НАРУШИЛ ЭТО
CaCO3 (t) = CaO + CO2
FeCO3 (t) = FeO + CO2
MgCO3 (t) = MgO + CO2
Na2CO3 (t) = реакция не идёт
Li2CO3 (t) = Li2O + CO2
2Ag2CO3 (t) = 4Ag + 2CO2 + O2
HgCO3 (t) = Hg + CO2 + O2
Опять-таки: не приравнивайте друг к другу
щелочные и щелочно-земельные металлы, НЕ
разлагаются лишь карбонаты ЩЕЛОЧНЫХ
металлов!
76.
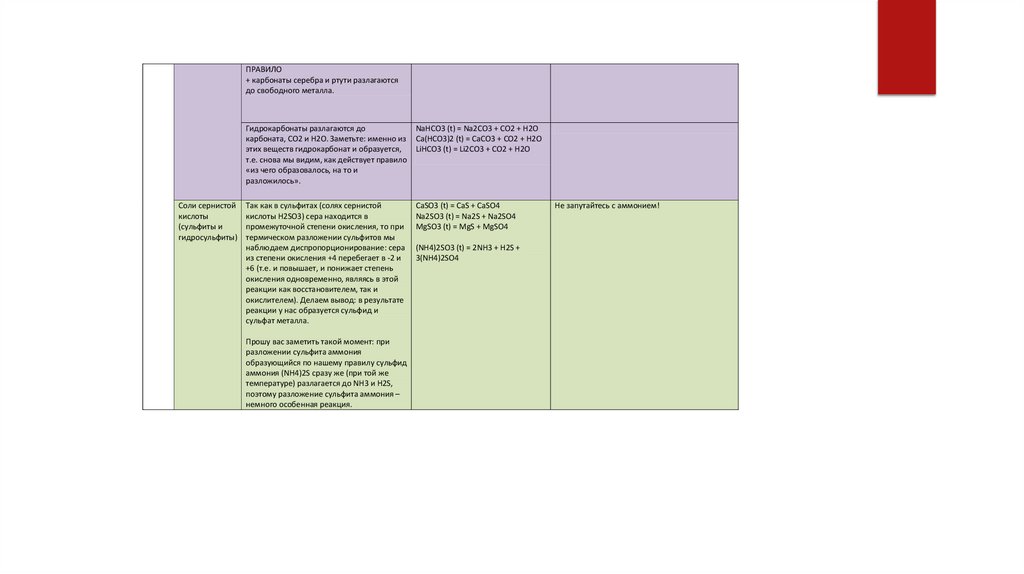
ПРАВИЛО+ карбонаты серебра и ртути разлагаются
до свободного металла.
Соли сернистой
кислоты
(сульфиты и
гидросульфиты)
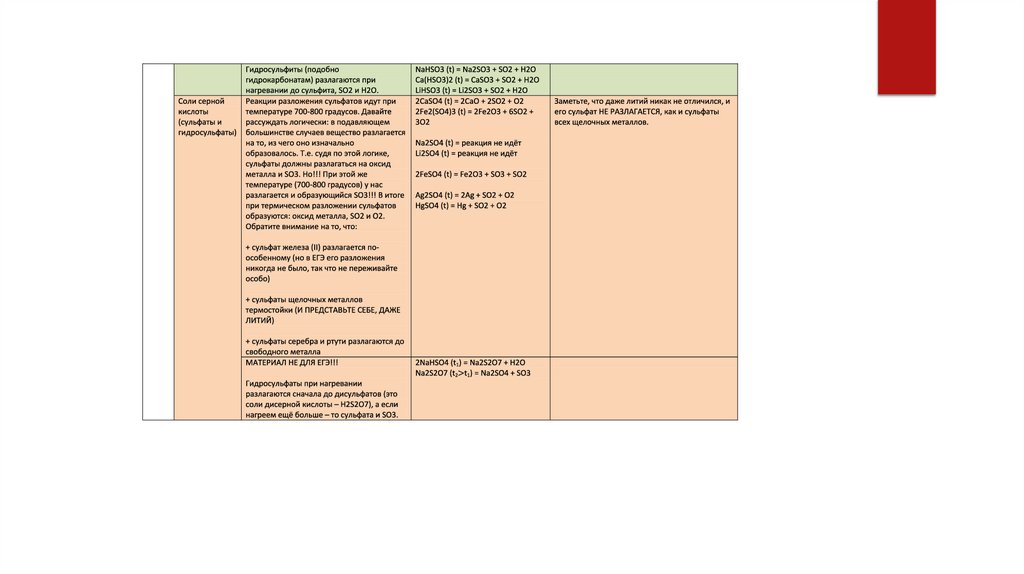
Гидрокарбонаты разлагаются до
карбоната, CO2 и H2O. Заметьте: именно из
этих веществ гидрокарбонат и образуется,
т.е. снова мы видим, как действует правило
«из чего образовалось, на то и
разложилось».
NaHCO3 (t) = Na2CO3 + CO2 + H2O
Ca(HCO3)2 (t) = CaCO3 + CO2 + H2O
LiHCO3 (t) = Li2CO3 + CO2 + H2O
Так как в сульфитах (солях сернистой
кислоты H2SO3) сера находится в
промежуточной степени окисления, то при
термическом разложении сульфитов мы
наблюдаем диспропорционирование: сера
из степени окисления +4 перебегает в -2 и
+6 (т.е. и повышает, и понижает степень
окисления одновременно, являясь в этой
реакции как восстановителем, так и
окислителем). Делаем вывод: в результате
реакции у нас образуется сульфид и
сульфат металла.
CaSO3 (t) = CaS + CaSO4
Na2SO3 (t) = Na2S + Na2SO4
MgSO3 (t) = MgS + MgSO4
Прошу вас заметить такой момент: при
разложении сульфита аммония
образующийся по нашему правилу сульфид
аммония (NH4)2S сразу же (при той же
температуре) разлагается до NH3 и H2S,
поэтому разложение сульфита аммония –
немного особенная реакция.
(NH4)2SO3 (t) = 2NH3 + H2S +
3(NH4)2SO4
Не запутайтесь с аммонием!
77.
78.
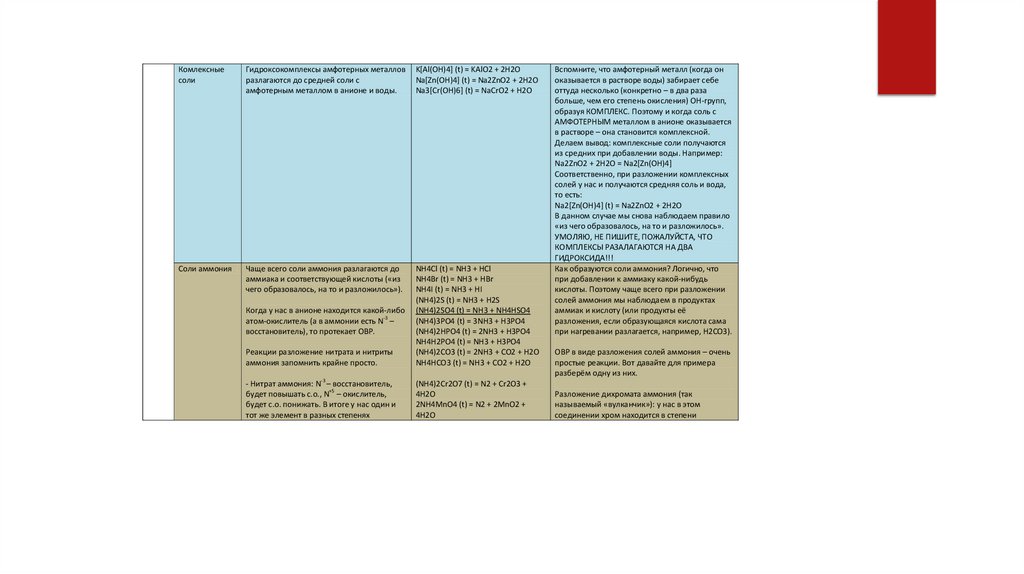
Комлексныесоли
Гидроксокомплексы амфотерных металлов
разлагаются до средней соли с
амфотерным металлом в анионе и воды.
K[Al(OH)4] (t) = KAlO2 + 2H2O
Na[Zn(OH)4] (t) = Na2ZnO2 + 2H2O
Na3[Cr(OH)6] (t) = NaCrO2 + H2O
Соли аммония
Чаще всего соли аммония разлагаются до
аммиака и соответствующей кислоты («из
чего образовалось, на то и разложилось»).
Реакции разложение нитрата и нитриты
аммония запомнить крайне просто.
NH4Cl (t) = NH3 + HCl
NH4Br (t) = NH3 + HBr
NH4I (t) = NH3 + HI
(NH4)2S (t) = NH3 + H2S
(NH4)2SO4 (t) = NH3 + NH4HSO4
(NH4)3PO4 (t) = 3NH3 + H3PO4
(NH4)2HPO4 (t) = 2NH3 + H3PO4
NH4H2PO4 (t) = NH3 + H3PO4
(NH4)2CO3 (t) = 2NH3 + CO2 + H2O
NH4HCO3 (t) = NH3 + CO2 + H2O
- Нитрат аммония: N-3 – восстановитель,
будет повышать с.о., N+5 – окислитель,
будет с.о. понижать. В итоге у нас один и
тот же элемент в разных степенях
(NH4)2Cr2O7 (t) = N2 + Cr2O3 +
4H2O
2NH4MnO4 (t) = N2 + 2MnO2 +
4H2O
Когда у нас в анионе находится какой-либо
атом-окислитель (а в аммонии есть N-3 –
восстановитель), то протекает ОВР.
Вспомните, что амфотерный металл (когда он
оказывается в растворе воды) забирает себе
оттуда несколько (конкретно – в два раза
больше, чем его степень окисления) OH-групп,
образуя КОМПЛЕКС. Поэтому и когда соль с
АМФОТЕРНЫМ металлом в анионе оказывается
в растворе – она становится комплексной.
Делаем вывод: комплексные соли получаются
из средних при добавлении воды. Например:
Na2ZnO2 + 2H2O = Na2[Zn(OH)4]
Соответственно, при разложении комплексных
солей у нас и получаются средняя соль и вода,
то есть:
Na2[Zn(OH)4] (t) = Na2ZnO2 + 2H2O
В данном случае мы снова наблюдаем правило
«из чего образовалось, на то и разложилось».
УМОЛЯЮ, НЕ ПИШИТЕ, ПОЖАЛУЙСТА, ЧТО
КОМПЛЕКСЫ РАЗАЛАГАЮТСЯ НА ДВА
ГИДРОКСИДА!!!
Как образуются соли аммония? Логично, что
при добавлении к аммиаку какой-нибудь
кислоты. Поэтому чаще всего при разложении
солей аммония мы наблюдаем в продуктах
аммиак и кислоту (или продукты её
разложения, если образующаяся кислота сама
при нагревании разлагается, например, H2CO3).
ОВР в виде разложения солей аммония – очень
простые реакции. Вот давайте для примера
разберём одну из них.
Разложение дихромата аммония (так
называемый «вулканчик»): у нас в этом
соединении хром находится в степени
79.
окисления является и окислителем, ивосстановителем. Что мы здесь
NH4NO3 (t) = N2O + 2H2O
наблюдаем? Конечно, реакцию усреднения NH4NO2 (t) = N2 + 2H2O
(или по-другому –
конпропорционирования). Так как это
реакции УСРЕДНЕНИЯ, то давайте и найдём
число, СРЕДНЕЕ между -3 и +5. Это число
+1. Значит, азот в продуктах будет иметь
с.о. +1, т.е. он превратится в N2O. Ну и не
забудьте в продуктах написать водичку для
приличия.
ОснОвные соли
- Нитрит аммония: N-3 – восстановитель, N+3
– окислитель. Точно так же ищем
серединку: это 0. Значит, азот в продуктах
примет степень окисления 0, т.е.
превратится в простое вещество N2. Про
водичку сами понимаете.
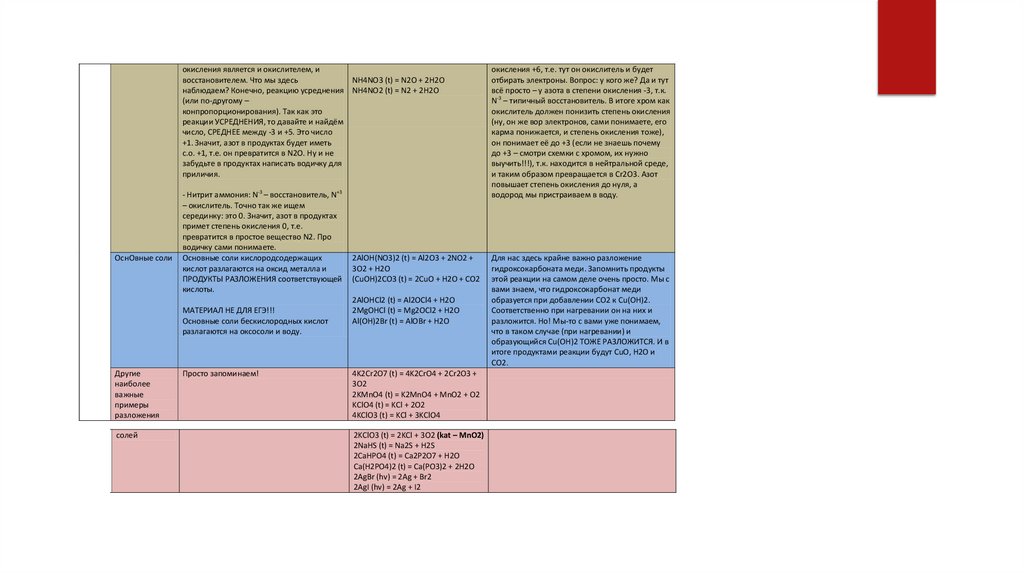
Основные соли кислородсодержащих
кислот разлагаются на оксид металла и
ПРОДУКТЫ РАЗЛОЖЕНИЯ соответствующей
кислоты.
МАТЕРИАЛ НЕ ДЛЯ ЕГЭ!!!
Основные соли бескислородных кислот
разлагаются на оксосоли и воду.
Другие
наиболее
важные
примеры
разложения
солей
Просто запоминаем!
2AlOH(NO3)2 (t) = Al2O3 + 2NO2 +
3O2 + H2O
(CuOH)2CO3 (t) = 2CuO + H2O + CO2
2AlOHCl2 (t) = Al2OCl4 + H2O
2MgOHCl (t) = Mg2OCl2 + H2O
Al(OH)2Br (t) = AlOBr + H2O
4K2Cr2O7 (t) = 4K2CrO4 + 2Cr2O3 +
3O2
2KMnO4 (t) = K2MnO4 + MnO2 + O2
KClO4 (t) = KCl + 2O2
4KClO3 (t) = KCl + 3KClO4
2KClO3 (t) = 2KCl + 3O2 (kat – MnO2)
2NaHS (t) = Na2S + H2S
2CaHPO4 (t) = Ca2P2O7 + H2O
Ca(H2PO4)2 (t) = Ca(PO3)2 + 2H2O
2AgBr (hv) = 2Ag + Br2
2AgI (hv) = 2Ag + I2
окисления +6, т.е. тут он окислитель и будет
отбирать электроны. Вопрос: у кого же? Да и тут
всё просто – у азота в степени окисления -3, т.к.
N-3 – типичный восстановитель. В итоге хром как
окислитель должен понизить степень окисления
(ну, он же вор электронов, сами понимаете, его
карма понижается, и степень окисления тоже),
он понимает её до +3 (если не знаешь почему
до +3 – смотри схемки с хромом, их нужно
выучить!!!), т.к. находится в нейтральной среде,
и таким образом превращается в Cr2O3. Азот
повышает степень окисления до нуля, а
водород мы пристраиваем в воду.
Для нас здесь крайне важно разложение
гидроксокарбоната меди. Запомнить продукты
этой реакции на самом деле очень просто. Мы с
вами знаем, что гидроксокарбонат меди
образуется при добавлении CO2 к Cu(OH)2.
Соответственно при нагревании он на них и
разложится. Но! Мы-то с вами уже понимаем,
что в таком случае (при нагревании) и
образующийся Cu(OH)2 ТОЖЕ РАЗЛОЖИТСЯ. И в
итоге продуктами реакции будут CuO, H2O и
CO2.
80.
ОБЩИЕПРИНЦИПЫ
ОБМЕННЫХ
РЕАКЦИЙ























































 chemistry
chemistry








