Similar presentations:
Основные классы неорганических соединений
1.
Основныеклассы
неорганических
соединений
2.
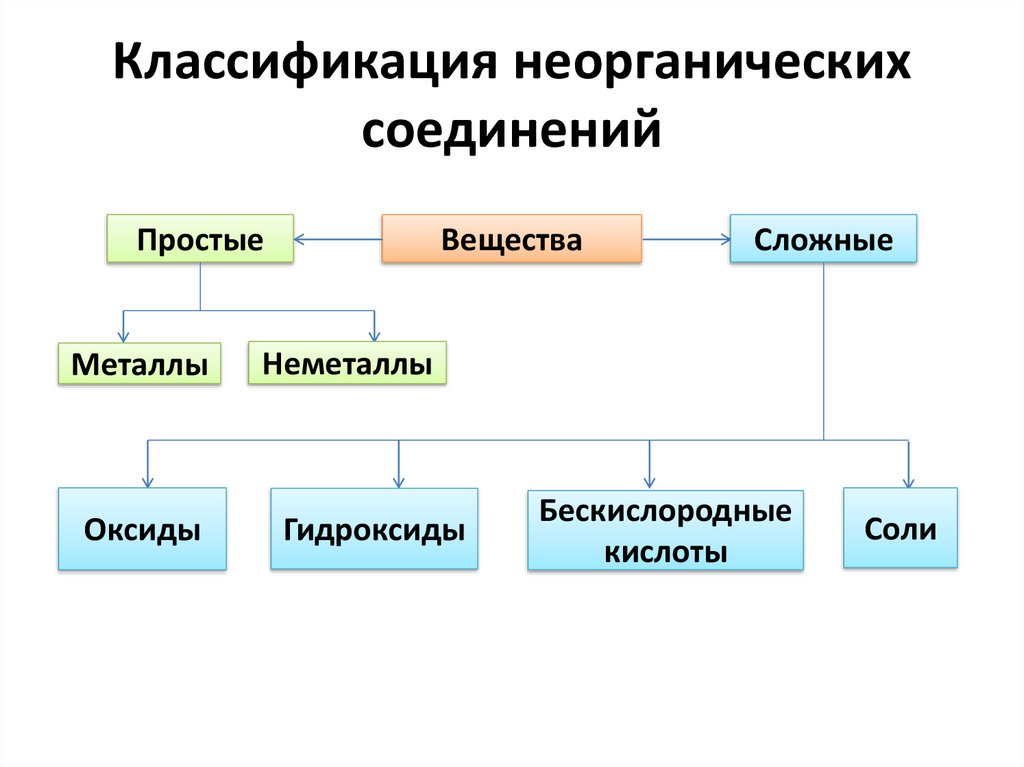
Классификация неорганическихсоединений
Простые
Металлы
Оксиды
Вещества
Сложные
Неметаллы
Гидроксиды
Бескислородные
кислоты
Соли
3.
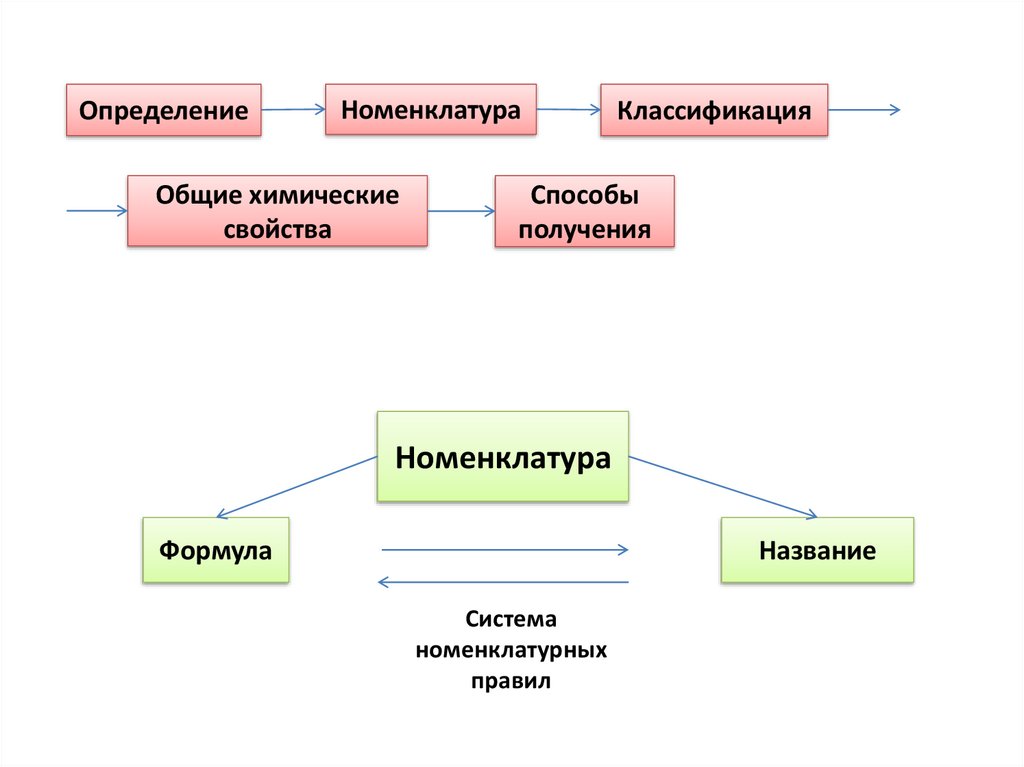
ОпределениеНоменклатура
Общие химические
свойства
Классификация
Способы
получения
Номенклатура
Формула
Название
Система
номенклатурных
правил
4.
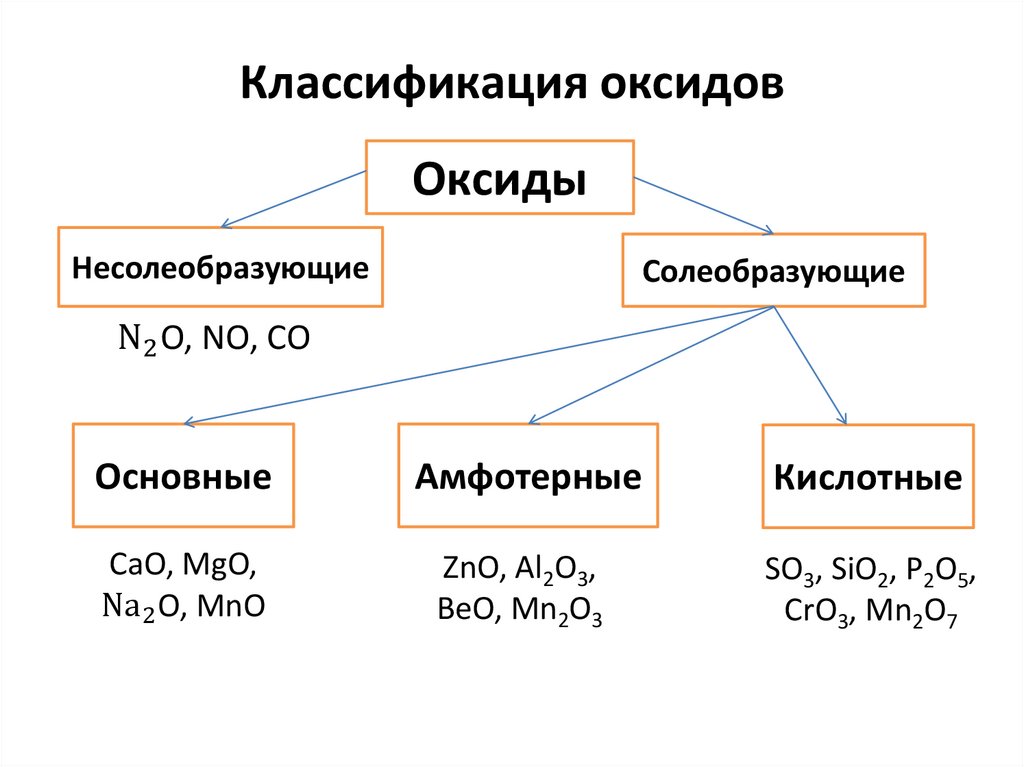
Классификация оксидовОксиды
Несолеобразующие
Солеобразующие
N2 O, NO, CO
Основные
Амфотерные
Кислотные
CaO, MgO,
Na2 O, MnO
ZnO, Al2O3,
BeO, Mn2O3
SO3, SiO2, P2O5,
CrO3, Mn2O7
5.
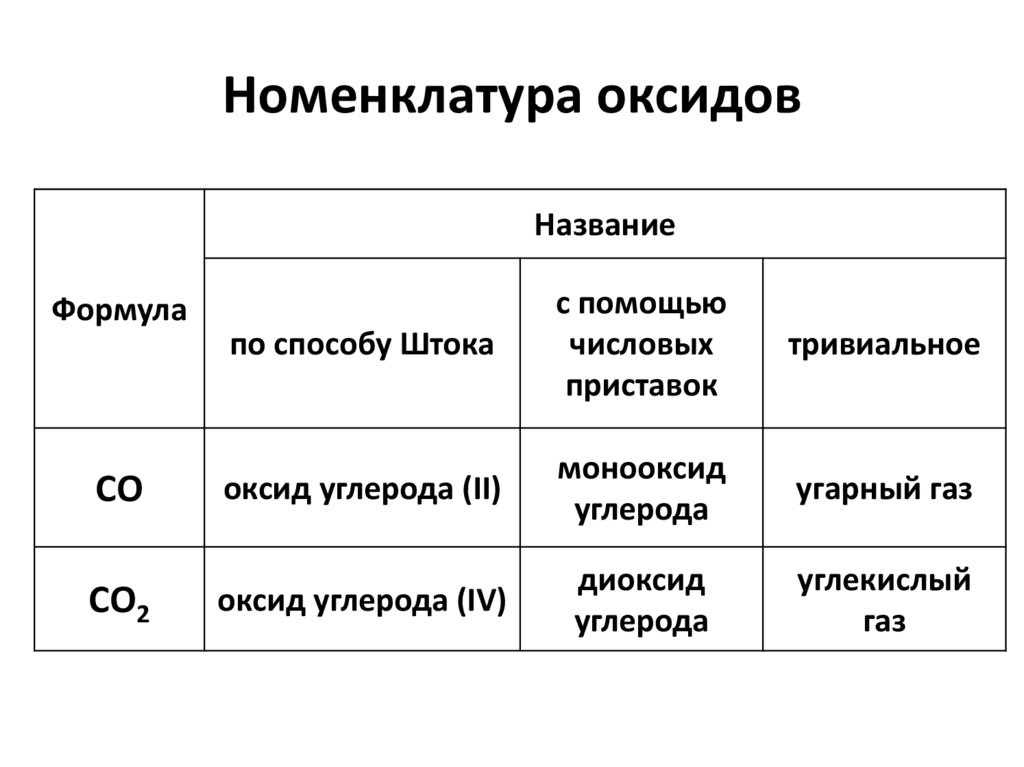
Номенклатура оксидовНазвание
по способу Штока
с помощью
числовых
приставок
тривиальное
оксид углерода (II)
монооксид
углерода
угарный газ
оксид углерода (IV)
диоксид
углерода
углекислый
газ
Формула
СО
СО2
6.
Химические свойства основных оксидовВзаимодействие с водой
(только оксиды ЩМ и
ЩЗМ)
Взаимодействие с
кислотами
Взаимодействие с
кислотными оксидами
Na2O + H2O = 2NaOH
CuO + H2SO4 = CuSO4 + H2O
Li2O + SO2 = Li2SO3
MnO + SiO2 = MnSiO3
7.
Химические свойства кислотных оксидовВзаимодействие с водой
(большинство)
Взаимодействие
со щелочами
Взаимодействие с
основными оксидами
SO2 + H2O = H2SO3
CrO3 + 2NaOH = Na2CrO4 + H2O
CO2 + CaO = CaCO3
8.
Химические свойства амфотерных оксидовВзаимодействие
с кислотами
Взаимодействие
со щелочами
ZnO + H2SO4 = ZnSO4 +H2O
а) в растворе
ZnO + 2NaOH + H2O =Na2[Zn(OH)4]
б) при сплавлении
ZnO + 2NaOH = Na2ZnO2 + H2O
9.
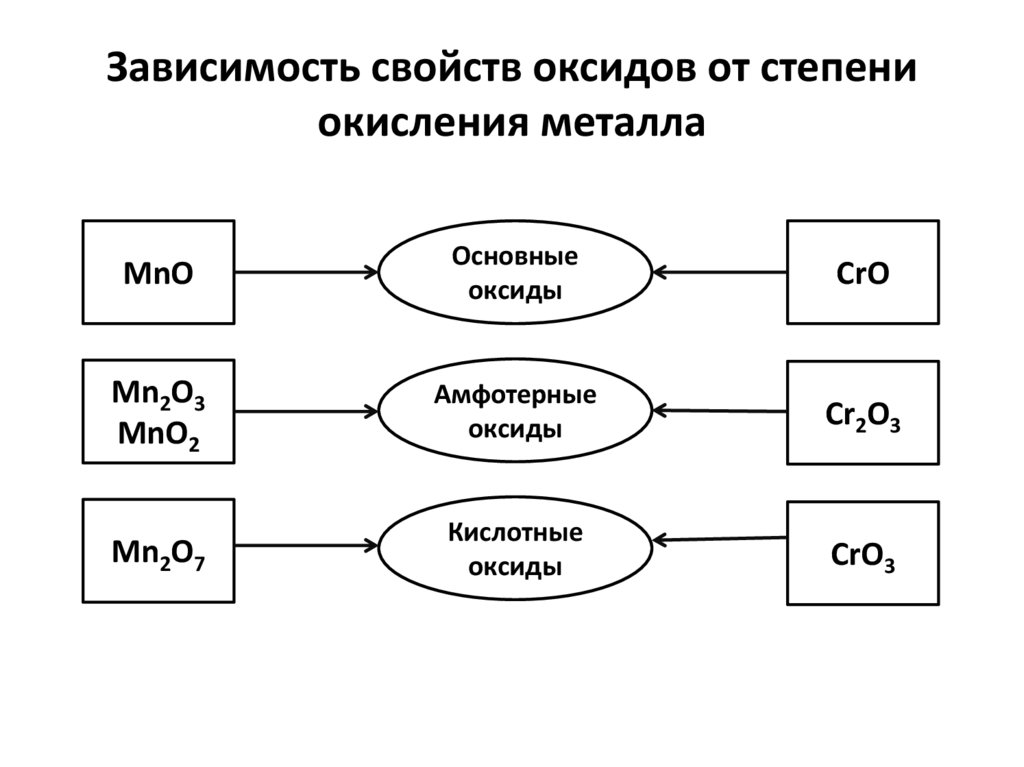
Зависимость свойств оксидов от степениокисления металла
MnO
Основные
оксиды
CrO
Mn2O3
MnO2
Амфотерные
оксиды
Cr2O3
Mn2O7
Кислотные
оксиды
CrO3
10.
Способы получения оксидовВзаимодействие простых
веществ с кислородом
2Cu + O2 = 2CuO
Косвенные способы
Разложение нерастворимых
оснований
Cu(OH)2 = CuO + H2O
Разложение оксокислот
4HNO3 = 4NO2 + O2 + 2H2O
Разложение солей
NH4NO3 = N2O + 2 H2O
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Взаимодействие металлов и
неметаллов с кислотамиокислителями
C + 2H2SO4(конц) = СO2 + 2SO2 + 2 H2O
Cu + 4HNO3(конц) = Сu(NO3)2 +2 NO2 +
+2 H2O
Горение сложных веществ
2H2S + 3O2 = 2 H2O + 2SO2
11.
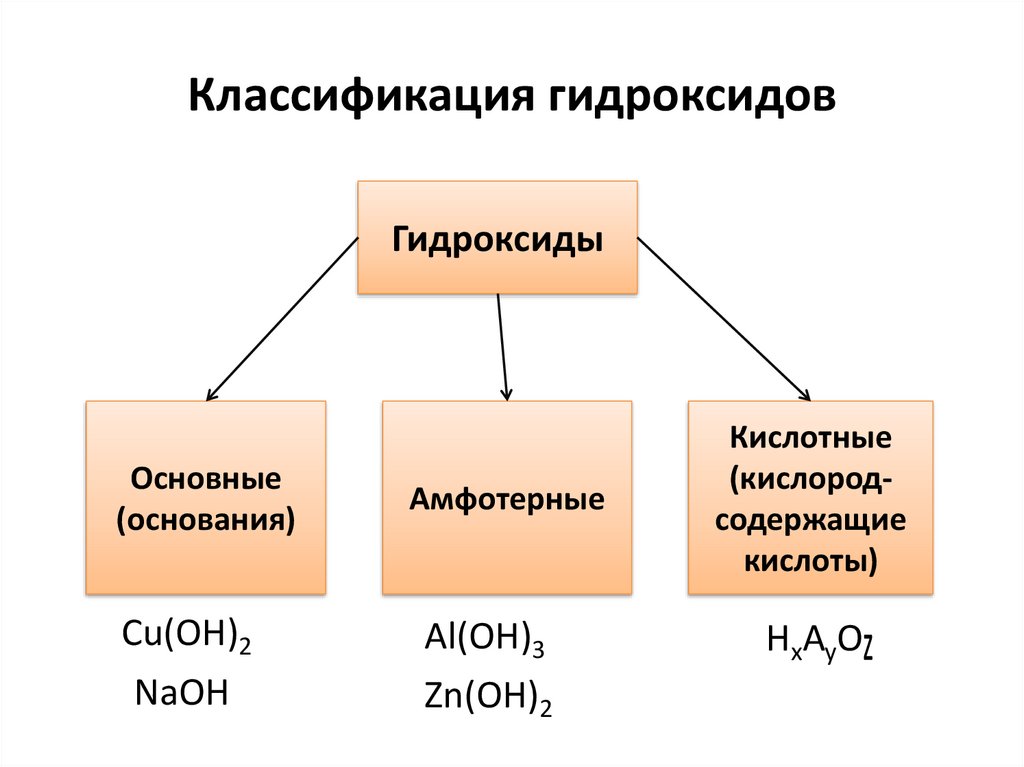
Классификация гидроксидовГидроксиды
Основные
(основания)
Cu(OH)2
NaOH
Амфотерные
Al(OH)3
Zn(OH)2
Кислотные
(кислородсодержащие
кислоты)
HxAyO
12.
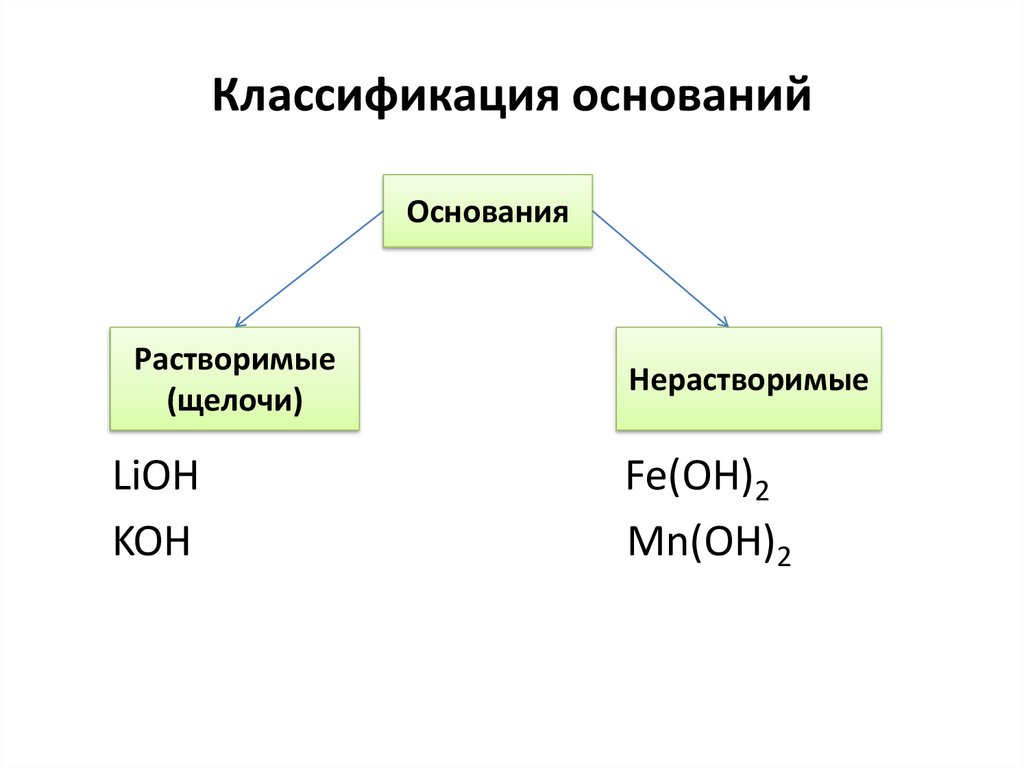
Классификация основанийОснования
Растворимые
(щелочи)
LiOH
KOH
Нерастворимые
Fe(OH)2
Mn(OH)2
13.
Химические свойства основанийОбщие свойства оснований
Взаимодействие с кислотами Cu(OH)2 + 2HCl = CuCl2 + 2 H2O
Взаимодействие с
кислотными оксидами
Свойства щелочей
2NaOH + SO3 = Na2SO4 + H2O
Взаимодействие с
амфотерными оксидами и
гидроксидами
Взаимодействие с солями
2KOH + ZnO + H2O = K2[Zn(OH)4]
2NaOH + CuCl2 = Cu(OH)2!+2NaCl
Свойства нерастворимых оснований
Разложение при нагревании
Cu(OH)2 = CuO + H2O
14.
Получение основанийРастворимые основания
Взаимодействие ЩМ и
ЩЗМ с водой
Взаимодействие оксидов
ЩМ и ЩЗМ с водой
2Na + 2H2O = 2NaOH + H2
Электролиз
концентрированных
растворов солей
2NaCl +2H2O = 2NaOH + Cl2 + H2
CaO + H2O = Ca(OH)2
Нерастворимые основания
Реакции ионного обмена MnCl2 + 2NaOH = Mn(OH)2!+ 2NaCl
15.
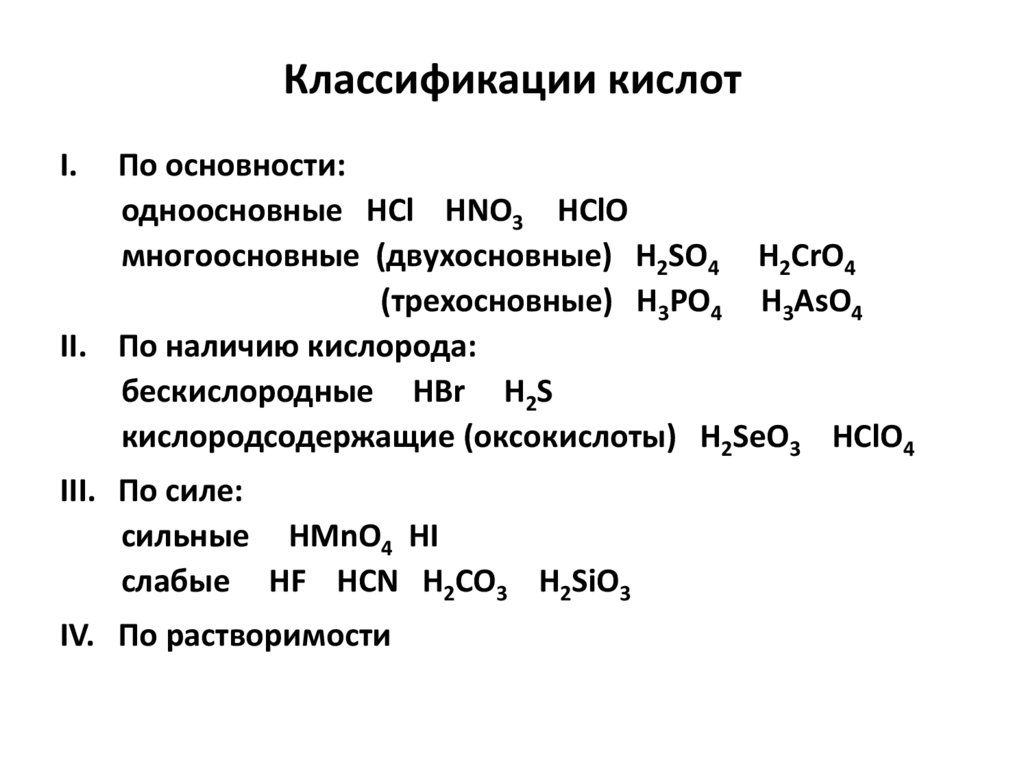
Классификации кислотI.
По основности:
одноосновные HCl HNO3 HClO
многоосновные (двухосновные) H2SO4 H2CrO4
(трехосновные) H3РO4 H3AsO4
II. По наличию кислорода:
бескислородные HBr H2S
кислородсодержащие (оксокислоты) H2SeO3 HClO4
III. По силе:
сильные HMnO4 HI
слабые HF HCN H2CO3 H2SiO3
IV. По растворимости
16.
Номенклатура кислотНА
HxAyOz
Cтепень окисления
элемента А
Суффикс
Формула
Название
Высшая или любая
единственная
-н-, -ов-, -ев-
H2SO4
HMnO4
H2GeO3
серная
марганцовая
германиевая
Промежуточная +5
-новат-
HClO3
хлорноватая
Промежуточная +4, +3
-(ов)ист-
HClO2
H3AsO3
хлористая
мышьяковистая
Низшая
положительная
-новатист-
HClO
H2N2O2
хлорноватистая
азотноватистая
HPO3 метафосфорная
H3PO4 ортофосфорная
H4P2O7 дифосфорная
H2S2O7 дисерная
17.
Химические свойства кислотВзаимодействие с металлами,
расположенными до Н в ряду
напряжений (кислота проявляет
окислительные свойства за счет
иона Н+)
Zn + H2SO4(p-p) = ZnSO4 + H2
Взаимодействие с основаниями и
амфотерными гидроксидами
HCl + KOH =KCl + H2O
Взаимодействие с основными и
амфотерными оксидами
H2SO4 + MgO = MgSO4 + H2O
Взаимодействие с солями (если
образуется более слабая или летучая
кислота)
2HCl +Na2SiO3 = H2SiO3 +2 NaCl
Взаимодействие с металлами,
расположенными после Н в ряду
напряжений (кислота проявляет
окислительные свойства за счет
аниона )
Cu + 2H2SO4(конц) = CuSO4 + SO2 +
+2H2O
18.
Способы получения кислотВзаимодействие кислотных
оксидов с водой
SO3 + H2O = H2SO4
2NO2 + H2O = HNO2 + HNO3
Взаимодействие солей с
кислотами (используемая
кислота должна быть более
сильной и менее летучей, чем
получаемая)
NaNO2 + H2SO4 = Na2SO4 + HNO2
Окисление простых веществ
сильными окислителями
3P + 5HNO3 +2H2O = 3H3PO4 +5NO
Взаимодействие простых
веществ (для бескислородных
кислот)
H2 + Cl2 = 2HCl
19.
Свойства амфотерных гидроксидовВзаимодействие с кислотами Al(OH)3 + 3HCl = AlCl3 + 3H2O
Взаимодействие
со щелочами
Al(OH)3 + NaOH = Na[Al(OH)4]
20.
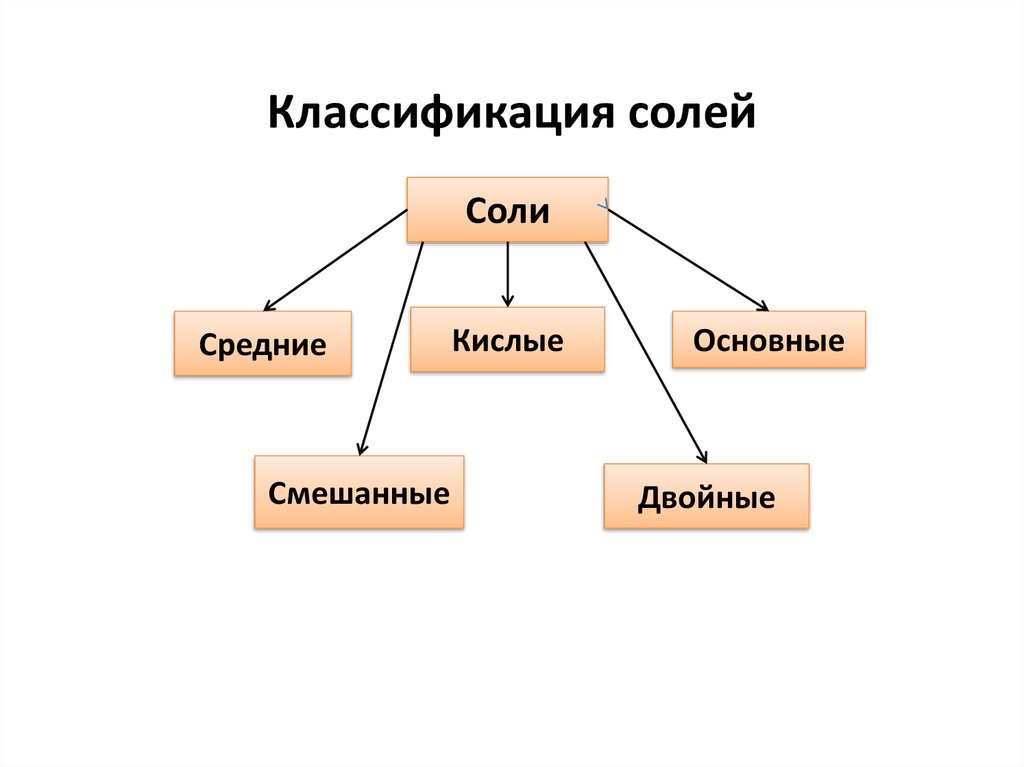
Классификация солейСоли
Средние
Смешанные
Кислые
Основные
Двойные
21.
Средние солиH2SO4 + 2NaOH = Na2SO4 + 2H2O
FeSO4 – сульфат железа (II)
NH4NO3 – нитрат аммония
UO2SO4 – сульфат уранила
NONO3 – нитрат нитрозила
Na2S – сульфид натрия
CrCl3 – хлорид хрома (III)
22.
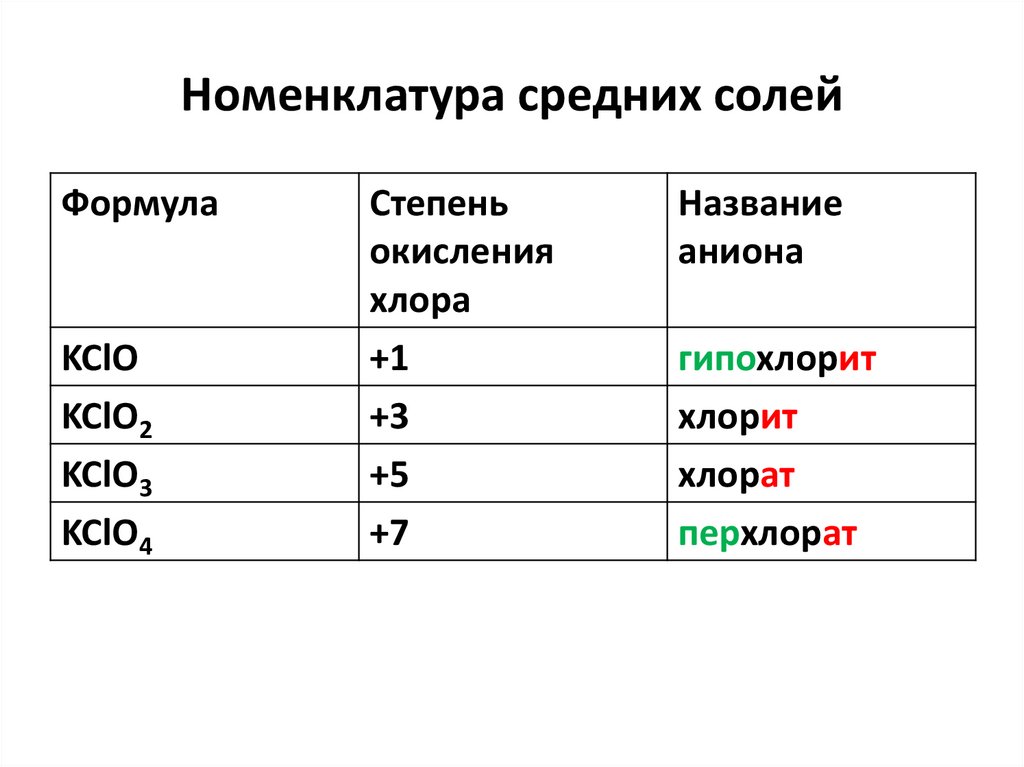
Номенклатура средних солейФормула
KClO
KClO2
KClO3
KClO4
Степень
окисления
хлора
+1
+3
+5
+7
Название
аниона
гипохлорит
хлорит
хлорат
перхлорат
23.
Кислые солиH2SO4 + NaOH = NaHSO4 + H2O
Ba(HSO3)2 – гидросульфит бария
Ca(H2PO4)2 – дигидроортофосфат кальция
NaHS – гидросульфид натрия
Основные соли
Fe(OH)3 + 2HCl = (FeOH)Cl2 + 2H2O
(CuOH)2CO3 – гидроксокарбонат меди(II)
Al(OH)Cl2 – гидроксохлорид алюминия
24.
Двойные солиKCr(SO4)2 – сульфат хрома(III)-калия
NaNH4Cl2 – хлорид аммония-натрия
Смешанные соли
Ca5(PO4)3F – фторид-ортофосфат кальция
25.
Свойства солейВзаимодействуют с
металлами
Взаимодействуют со
щелочами
Взаимодействуют с
кислотами
Соли взаимодействуют
друг с другом
Некоторые соли при
нагревании разлагаются
Некоторые соли
подвергаются гидролизу
Zn + Hg(NO3)2 = Zn(NO3)2 = Hg
FeCl3 + 3KOH = Fe(OH)3 + 3KCl
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
CuCl2 + H2O = CuOHCl + HCl
26.
Способы получения солей1. Взаимодействие
оснований с кислотами
KOH + HNO3 = KNO3 + H2O
2. Взаимодействие
металлов с кислотами
Hg + 4HNO3(K)= Hg(NO3)2 + 2NO2+
+2H2O
6Hg + 8HNO3(p)= 3Hg2(NO3)2 +
+2NO + 4H2O
3. Взаимодействие
основных или амфотерных CaO + 2HCl = CaCl2 + H2O
оксидов с кислотами
4. Взаимодействие
кислотных оксидов с
основаниями
6NaOH + P2O5 = 2Na3PO4 + 3H2O
27.
5. Взаимодействиеосновных и кислотных
оксидов
6. Взаимодействие солей с
кислотами
7. Взаимодействие солей со
щелочами
8. Взаимодействие двух
солей
9. Взаимодействие соли с
металлом
10. Взаимодействие
неметаллов со щелочами
CaO +SiO2 = CaSiO3
MgCO3 + 2HCl = MgCl2 + CO2 + H2O
Fe(NO3)2 + 3NaOH = 3NaNO3 +
+Fe(OH)3
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
CuSO4 + Fe = FeSO4 + Cu
Cl2 + 2KOH = KCl + KClO + H2O
28.
11. Взаимодействиеметаллов и неметаллов
2Fe + 3Cl2 =2FeCl3
12.Термическое разложение
некоторых солей
2KNO3 = 2KNO2 + O2
29.
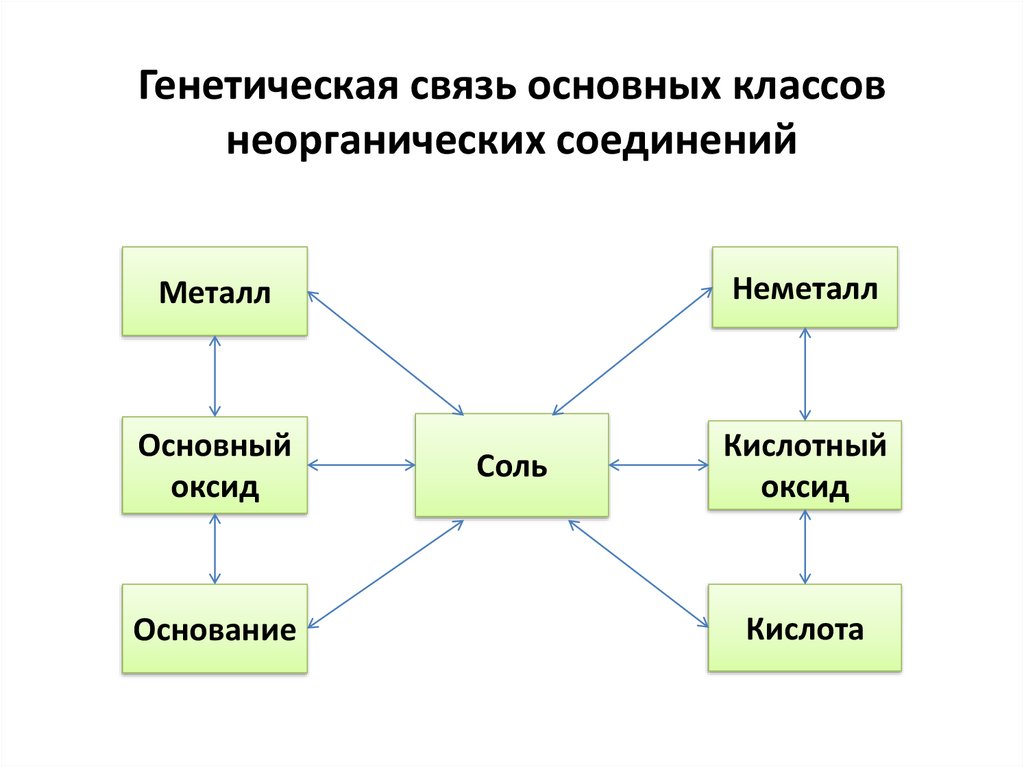
Генетическая связь основных классовнеорганических соединений
Неметалл
Металл
Основный
оксид
Основание
Соль
Кислотный
оксид
Кислота


















 chemistry
chemistry








