Similar presentations:
Подготовка к ЕГЭ по химии
1.
Подготовка к ЕГЭ по химииДемо-версия ЕГЭ-2009
Галенко Алексей Михайлович
Волгоград, 2010
2.
А1А11
А21
В1
А2
А12
А22
В2
А3
А13
А23
В3
С1
С2
А4
А14
А24
В4
А5
А15
А25
В5
С3
А6
А16
А26
В6
А7
А17
А27
В7
С4
А8
А18
А28
В8
А9
А19
А29
В9
С5
А10
А20
А30
В10
3.
А1. Число электронов в ионе железа Fe2+ равно1) 54
2) 28
3) 58
4) 24
4.
А2. Среди элементов VIА группы максимальныйрадиус атома имеет
1) кислород
2) сера
3) теллур
4) полоний
5.
А3. Водородная связь образуется междумолекулами
1) этана
2) бензола
3) водорода
4) этанола
6.
А4. Степень окисления, равную + 4, атом серыимеет в соединении
1) H2SO4
2) FeS2
3) H2SO3
4) NaHSO4
7.
А5. Веществом молекулярного строения являетс1) озон
2) оксид бария
3) графит
4) сульфид калия
8.
А6. Амфотерным гидроксидом и кислотойсоответственно являются
1) H2SO4 и Zn(OH)Cl
2) Ca(OH)2 и HCl
3) KHSO4 и NaOH
4) Al(OH)3 и HNO3
9.
А7. В каком ряду химические элементырасположены в порядке усиления
металлических свойств?
1) Na, Mg, Al
2) Al, Mg, Na
3) Cа, Mg, Be
4) Mg, Be, Cа
10.
А8. Формула высшего оксида хлора1) Cl2O
2) ClO2
3) Cl2O6
4) Cl2O7
11.
А. Для меди характерны степени окисления + 1и+2
Б. Медь вытесняет цинк из раствора сульфата
цинка
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
12.
А10. Оксид кальция взаимодействует с каждымтрех веществ:
1) кислород, вода, серная кислота
2) соляная кислота, углекислый газ, вода
3) оксид магния, оксид серы (IV), аммиак
4) железо, азотная кислота, оксид фосфора (V)
13.
А11. Гидроксид хрома (III) взаимодействует скаждым из двух веществ:
1) СО2 и HCl
2) SiО2 и Cu(OH)2
3) NО и NaNO3
4) H2SO4 и NaOH
14.
А12. Карбонат кальция реагирует с1) HCl
2) MgO
3) Pb
4) H2O
15.
А13. В схеме превращенийX
Y
Ba
Ba(OH)2
BaCl2
веществами «X» и «Y» соответственно являются
1) KOH и HCl
2) NaOH и Cl2
3) H2O и KCl
4) H2O и HCl
16.
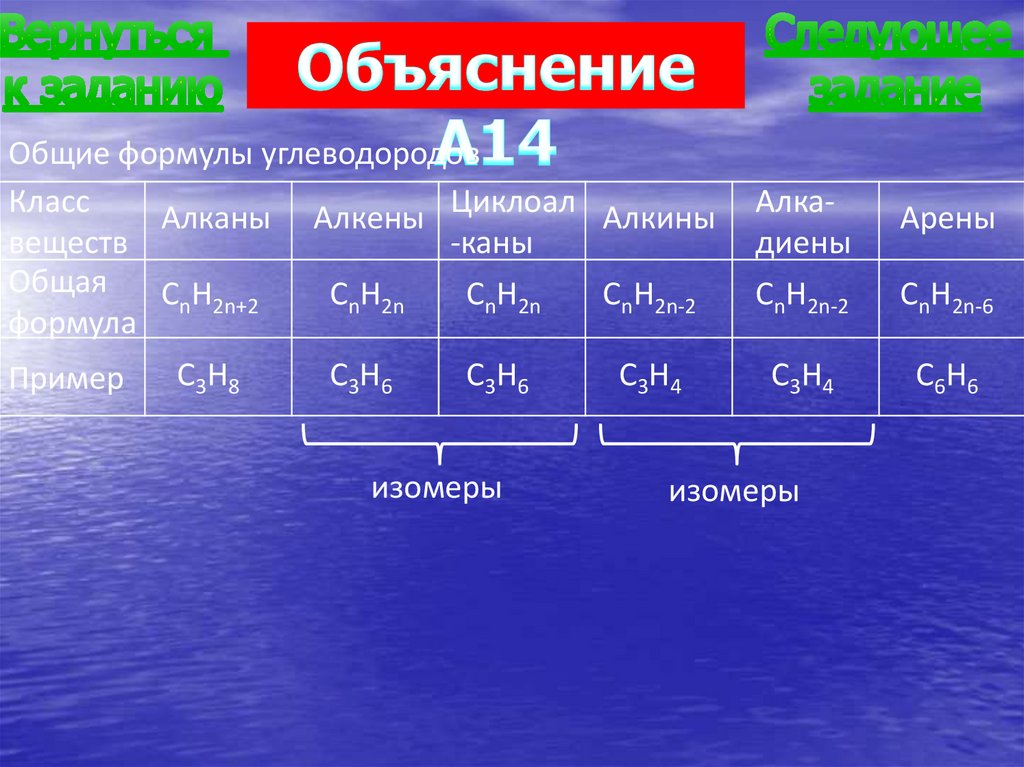
А14. Алкины являются структурными изомерами1) алкадиенов
2) алканов
3) циклоалканов
4) алкенов
17.
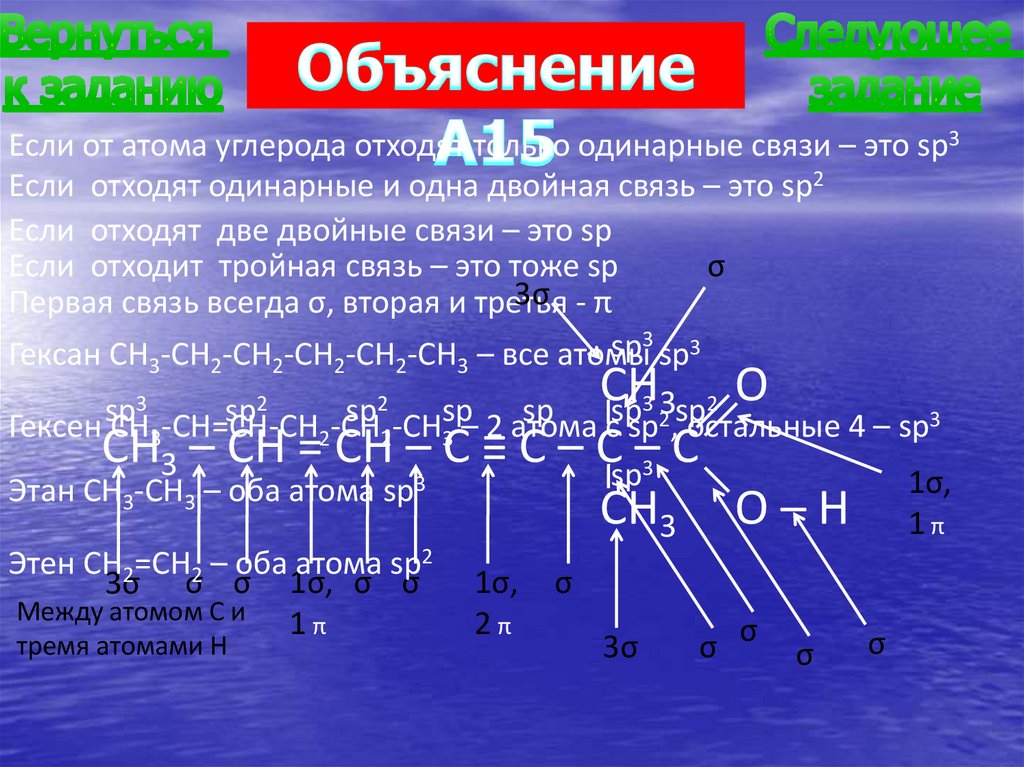
А15. В молекуле какого вещества все атомыуглерода находятся в состоянии sp2-гибридизац
1) гексана
2) гексена
3) этана
4) этена
18.
А16. Характернойреакцией
многоатомных взаимодействие с
1) H2
2) Сu
3) Ag2O (NH3
4) Cu(OH)2
р-р)
для
19.
А17. Уксусная кислота не взаимодействует с1) CuO
2) Cu(OH)2
3) Na2CO3
4) Na2SO4
20.
А18. В схеме превращенийC6H5CH3 → X → C6H5 - CH2 - OH
веществом «Х» является
1) C6H5OH
2) C6H5 - CH2Cl
3) C6H5Cl
4) C6H5COOH
21.
А19. К реакциям замещения относитсявзаимодействие
1) этена и воды
2) брома и водорода
3) брома и пропана
4) метана и кислорода
22.
А20. С наибольшей скоростью при комнатнойтемпературе протекает реакция между
1) AgNO3(р-р) и NaCl(р-р)
2) CaСО3 и HCl (р-р)
3) Zn и H2SO4
4) Mg и O2
23.
А21. В системе 2CO (г) + O2 (г) <=>2CO2 (г) +смещению химического равновесия в сторону
исходных веществ будет способствовать
1) увеличение давления
2) увеличение концентрации оксида углерода (I
3) уменьшение температуры
4) увеличение концентрации кислорода
24.
А22. В каком ряду все указанные веществаявляются неэлектролитами?
1) этанол, хлорид калия, сульфат бария
2) рибоза, гидроксид калия, ацетат натрия
3) сахароза, глицерин, метанол
4) сульфат натрия, глюкоза, уксусная кислота
25.
А23. С выпадением осадка протекает реакцияионного обмена между растворами
1) гидроксида натрия и хлорида бария
2) сульфата хрома (III) и гидроксида калия
3) нитрата кальция и бромида натрия
4) хлорида аммония и нитрата алюминия
26.
А24. В какой реакции оксид серы (IV) являетсявосстановителем?
1)SO2 + 2NaOH = Na2SO3 + H2O
2)SO2 + 2H2S = 3S + 2H2O
3)SO2 + H2O <=> H2SO3
4)2SO2 + O2 <=> 2SO3
27.
А25. Щелочную реакцию среды имеет растворкаждой из двух солей:
1) КCl и Na2S
2) К2SiO3 и Na2CO3
3) FeCl2 и NН4Cl
4) CuSO4 и Na2SO4
28.
свойствахуглеводородов?
А. Алканы вступают в реакции полимеризации
Б. Этилен обесцвечивает раствор
перманганата
калия
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
29.
А27. Пропанол-1 образуется в результате реакцсхема которой
1) СН3СН2СНО + H2 →
2) СН3СН2СНО + Cu(OH)2 →
3) СН3 - СН2Сl + H2O →
4) СН3СН2СНО + Ag2O →
30.
А28. Белки приобретают желтую окраскупод действием
1) HNO3 (конц.)
2) Cu(OH)2
3) H2SO4 (конц.)
4) [Ag(NH3)2]OH
31.
А29. Сырьем для получения метанола впромышленности служат
1) CO и H2
2) HCHO и H2
3) CH3Cl и NaOH
4) HCOOH и NaOH
32.
А30. Согласно термохимическому уравнениюреакции 2СО(г) + О2(г) = 2СО2(г) + 566 кДж при
сжигании оксида углерода (II) выделилось 152 к
теплоты. Объем (н.у.) сгоревшего газа составил
1) 6 л
2) 12 л
3) 44,8 л
4) 120 л
33.
В1. Установите соответствие между названиеморганического соединения и классом, к которому
оно принадлежит
A) 1,2-диметилбензол
Б) гексанол-3
B) метилформиат
Г) стирол
(2 балла)
1)
2)
3)
4)
5)
6)
сложные эфиры
углеводороды
спирты
карбоновые кислоты
аминокислоты
простые эфиры
34.
В2. Установите соответствие между формулойвещества и степенью окисления углерода в нем
А) CH2Cl2
Б) HCHO
В) HCOONa
Г) CBr4
(2 балла)
1) – 4
2) – 2
3) 0
4) + 2
5) + 4
35.
В3. Установите соответствие между формулойвещества и продуктом, который образуется на
катоде в результате электролиза его водного
раствора
A) Cu(NO3)2
1) металл
Б) AgNO3
2) водород
B) СaCl2
3) кислород
Г) Na2SO4
4) хлор
5) оксид серы (IV)
6) оксид азота (IV)
(2 балла)
36.
В4. Установите соответствие между названием солии её способностью к гидролизу
A) карбонат натрия
Б) хлорид аммония
B) сульфат калия
Г) сульфид алюминия
(2 балла)
1) гидролиз по катиону
2) гидролиз по аниону
3) гидролиз по катиону и аниону
4) гидролизу не подвергается
37.
В5. Установите соответствие между реагирующимивеществами и продуктами реакций
A) KHCO3 + KOH →
Б) KHCO3 + HCl→
B) K2CO3 + HNO3→
Г) K2CO3 + ВаCl2→
(2 балла)
1)
2)
3)
4)
5)
KNO3 + CO2 + H2O
KNO3 + CO + H2O
K2CO3 + H2O
KCl + H2O + CO2
ВаСO3+KCl
38.
В6. С водородом взаимодействует каждое издвух веществ:
1) бензол, пропан;
2) бутен, этан;
3) дивинил, этен;
4) стирол, бутадиен-1,3;
5) дихлорэтан, бутан;
6) этин, бутин-1.
(2 балла)
39.
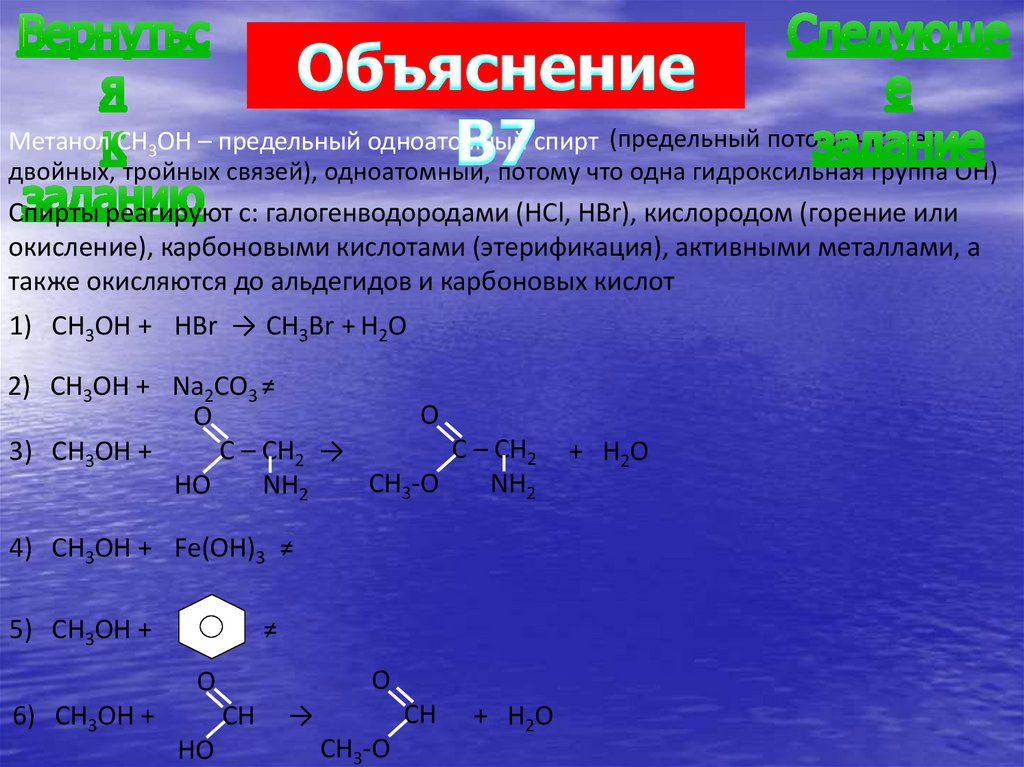
В7. Метанол взаимодействует с веществами:1) бромоводород;
2) карбонат натрия;
3) глицин;
4) гидроксид железа (III);
5) бензол;
6) метановая кислота.
(2 балла)
40.
В8. И с анилином, и с аланином способныреагировать
1) кислород;
2) бромоводород;
3) этан;
4) пропен;
5) серная кислота;
6) гидроксид калия.
(2 балла)
41.
В9. Определите массу воды, которую надодобавить к 20 г раствора уксусной кислоты с
массовой долей 70% для получения раствора
уксуса с массовой долей 3%
(Запишите число с точностью до целых)
(1 балл)
42.
В10. Рассчитайте массу свинца, полученного врезультате взаимодействия 6,6 г цинка с избытком
раствора нитрата свинца
Ответ: __________ г.
(Запишите число с точностью до целых)
(1 балл)
43.
С1. Используя метод электронного баланса,составьте уравнение реакции
KMnO4+H2S + H2SO4→MnSO4+S+ ... + ... .
Определите окислитель и восстановитель.
(3 балла)
44.
С2. Даны вещества:- алюминий;
- оксид марганца (IV);
-водный раствор сульфата меди (II);
- концентрированная соляная кислота.
Напишите уравнения четырех возможных
реакций между этими веществами.
(4 балла)
45.
С3. Напишите уравнения реакций, с помощьюкоторых можно осуществить следующие
превращения:
t
,H
CaC2→этин→этаналь KMnO
X
X
X3
CaCO
1
2
(5 баллов)
4
3
46.
С4. Сероводород объемом 5,6 л (н.у.)прореагировал без остатка с 59,02 мл раствора
КOH с массовой долей 20% (плотность 1,186 г/мл)
Определите массу соли, полученной в результате
этой химической реакции
(4 балла)
47.
С5. При взаимодействии 25,5 г предельнойодноосновной кислоты с избытком раствора
гидрокарбоната натрия выделилось 5,6 л (н.у.) газа
Определите молекулярную формулу кислоты.
(3 балла)
48.
49.
Заряд ядра атома равен порядковому номеру хим.элемента (у Fe №26)Количество электронных слоев (энергетических уровней) равно номеру периода
(у железа их 4, т.к. четвертый период)
Количество электронов во внешнем электронном слое (внешнем энергетическом
уровне) равно:
для элементов главных подгрупп: номеру группы;
для элементов побочных подгрупп: 2
Fe – элемент побочной подгруппы, значит на внешнем уровне имеет 2 электрона
Количество протонов равно порядковому номеру элемента (у железа 26 протонов)
Количество электронов тоже равно порядковому номеру (у железа 26 электронов)
Количество нейтронов равно: масса атома минус порядковый номер
(у железа: 56 – 26 = 30 нейтронов)
Заряд «2+» означает, что в атоме железа недостает 2 электронов:
Fe0 +26
Fe2+
+26
2 8 14 2
2 8 12 2
Fe0 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Fe2+1s2 2s2 2p6 3s2 3p6 3d4 4s2
50.
51.
Для металлов главных подгрупп:Чем ближе к Fr, тем:
- больше радиус атома;
- сильнее металлические свойства;
-меньше электроотрицательность;
-сильнее основные
свойства гидроксида.
Чем ближе к F, тем:
- меньше радиус атома;
-сильнее неметаллические свойства;
- больше электроотрицательность.
Чем ближе к At, тем:
- сильнее кислотные
свойства бескислородных кислот
У металлов из побочных подгрупп металлические свойства слабее, чем у
соседних металлов из главных подгрупп (например: Cu – ближе к Fr, чем K, но K
проявляет более сильные металлические свойства, у него больше радиус атома,
меньше электроотрицательность)
Из элементов VIА (то есть главной подгруппы шестой группы) ближе
всех к Fr находится полоний Po
52.
53.
Ионная связь – между металлом и неметаллом или междуметаллом и кислотным остатком. Примеры: Na2O, K2CO3
Металлическая связь – металлы. Примеры: Ba, Al
Ковалентная полярная связь – между разными неметаллами.
Примеры: SO2, HBr
Ковалентная неполярная связь – между одинаковыми
неметаллами. Примеры: O3, H2
Донорно-акцепторная связь – за счет неподеленной электронной
пары. Примеры: NH4Cl и другие соединения аммония.
Водородная – это связь между ионом водорода одном молекулы и
ионом N, O или F другой молекулы. Возникает между молекулами:
а) воды H2O; б) аммиака NH3; в) фтороводорода HF; г) спиртов.
1) этан CH3-CH3
- водородные связи не образует
2) бензол
- водородные связи не образует
3) водород H2
- водородные связи не образует
4) этанол (этиловый спирт) C2H5OH -образует водородные связи
54.
55.
Степень окисления – это условный заряд атома. Пример: Na+1Сумма степеней окисления всех атомов в молекуле равна 0
Валентность – это число связей, которыми атом соединяется с
другими атомами. Пример: в CH4 валентность углерода равна 4
У Н валентность всегда равна 1, степень окисления почти всегда +1
У О валентность всегда равна 2, степень окисления почти всегда -2
У щелочных (Li, Na, K, Rb, Cs и Fr) металлов степень окисления
всегда +1, валентность 1; у щелочноземельных металлов (Ca, Sr, Ba,
Ra) степень окисления всегда +2, валентность 2
1) серная кислота H2SO4. Степ. окисл. серы +6
2) серный колчедан FeS2. Степ. окисл. серы -1
3) сернистая кислота H2SO3. Степ. окисл. серы +4
4) гидросульфат натрия NaHSO4. Степ.окисл. серы +6
56.
57.
Существует 4 типа строения (кристаллических решеток):Тип
Вещества с такой решеткой
Свойства
ковкость, пластичность, тягучесть, металлический блеск, электро- и
металлическая металлы и сплавы
теплопроводность
большинство солей,
высокие твердость и прочность, высокие
основания,
температуры плавления и кипения, часто
ионная
оксиды металлов
хорошая растворимость
алмаз, графит; B, Si, Ge (крист); высокие твердость и прочность, высокие
SiO2 (кремнезем, кварц,
температуры плавления и кипения,
атомная
горный хрусталь); P (красный)
нерастворимость
органические вещества; P(белый) малые твердость и прочность, низкие
температуры плавления и кипения,
молекулярная прост.в-ва – неметаллы;
H2O, CO2, HCl, H2S и т.д.
летучесть, низкая электропроводность
1) Озон O3 – простое вещество-неметалл, значит молекулярное строение
2) Оксид бария BaO – оксид металла, значит ионное строение
3) Графит С – атомное строение
4) Сульфид калия K2S – соль, значит ионное строение
58.
59.
Амфотерные оксиды:Амфотерные гидроксиды:
BeO, ZnO, PbO, Al2O3, Cr2O3, Fe2O3
Be(OH)2, Zn (OH)2, Pb (OH)2,
Al (OH)3, Cr (OH)3, Fe (OH)3
Основные оксиды:
оксиды металлов
Несолеобразующие оксиды:
N2O, NO, CO, SiO
Кислотные оксиды:
оксиды неметаллов и
металлов в степенях
окисления +5, +6, +7
Основания:
Cu(OH)2, NaOH, Ca(OH)2 и т.д.
Щелочи – гидроксиды щелочных
(LiOH, NaOH, KOH, CsOH и RbOH) и
щелочноземельных (Ca(OH)2,
Sr(OH)2 и Ba(OH)2) металлов
Кислоты:
H3PO4, HCl, H2SO4 и т.д.
1) H2SO4 – кислота
Zn(OH)Cl – основная соль
2) Ca(OH)2 – основание, щелочь
HCl - кислота
3) KHSO4 – кислая соль
NaOH – основание, щелочь
4) Al(OH)3 – амфотерный гидроксид
HNO3 - кислота
60.
61.
Чем ближе к Fr, тем:- больше радиус атома
- сильнее металлические свойства
-меньше электроотрицательность
-сильнее основные
свойства гидроксида
Чем ближе к F, тем:
- меньше радиус атома
-сильнее неметаллические свойства
- больше электроотрицательность
Чем ближе к At, тем:
-сильнее кислотные
свойства бескислородной кислоты
1) Na, Mg, Al – приближение к F, мет.свойства ослабевают
2) Al, Mg, Na– приближение к Fr, мет.свойства усиливаются
3) Cа, Mg, Be– приближение к F, мет.свойства ослабевают
4) Mg, Be, Cа– приближение к F, мет.свойства ослабевают
62.
63.
Высший – это оксид элемента в максимальной степениокисления
Примеры: SO3 – высший оксид серы, т.к. сера находится в
степени окисления +6, а это ее максимальная степень
окисления (S находится VIA группе)
Na2O – высший оксид натрия, т.к. натрий находится в
степени окисления +1, а это его максимальная степень
окисления (Na находится IA группе)
Cl находится в VIIA группе, значит его максимальная
степень окисления +7
+7 -2
Cl 2О 7
У О валентность всегда равна 2,
степень окисления почти всегда -2
64.
65.
Некоторые степени окисления элементов побочных подгруппЖелезо: Fe0 Fe+2 Fe+3 Fe+6
Хром: Cr0 Cr+2 Cr+3 Cr+6
Марганец: Mn0 Mn+2 Mn+3 Mn+4 Mn+5 Mn+6 Mn+7
Цинк: Zn0 Zn+2
Медь: Cu0 Cu+1 Cu+2
Ряд напряжений металлов показывает активность металлов
Li, K, Ba, Ca, Na – очень активные металлы: реагируют с водой без нагревания; с
кислотами реагируют очень бурно;
От Mg до Pb – металлы средней активности: реагируют с водой при нагревании; с
кислотами реагируют относительно медленно;
Правее H2 – неактивные металлы: с водой не реагируют даже при нагревании;
с обычными кислотами не реагируют;
с необычными (H2SO4 (конц.) и HNO3) реагируют медь, ртуть и серебро;
Золото – почти ни с чем не реагирует
Более активные металлы вытесняют менее активные из их солей
Медь – менее активный металл, чем цинк, значит не вытесняет его из солей
66.
67.
Оксид кальция CaO – основный оксид.С кислородом реагируют оксиды, в которых элемент находится не в
CaO + O2 ≠ максимальной степени окисления
Оксиды реагируют с водой, если образуется
CaO + H2O = Ca(OH)2 растворимый гидроксид
CaO + H2SO4 = CaSO4 + H2O CaO – основный оксид, H2SO4 - кислота
CaO + 2 HCl = CaCl2 + H2O CaO – основный оксид, HCl - кислота
CaO + CO2 = CaCO3 CaO – основный оксид, CO2 – кислотный оксид
CaO + MgO ≠
CaO – основный оксид, MgO – тоже основный оксид
CaO + SO2 = CaSO3 CaO – основный оксид, SO2 – кислотный оксид
CaO + NH3 ≠ Аммиак NH3 реагирует только с водой, кислотами и кислородом
CaO + Fe ≠ Fe–менее активный металл, чем Ca, значит не вытесняет его
CaO – основный оксид, HNO3 - кислота
CaO + 2 HNO3 = Ca(NO3)2 + H2O
3 CaO + P2O5 = Ca3(PO4)2 CaO – основный оксид, P2O5 – кислотный оксид
68.
69.
Гидроксид хрома (III) Cr(OH)3 – амфотерный гидроксидАмфотерные гидроксиды реагируют только с оксидами,
Cr(OH)3 + CO2 ≠ которым соответствуют сильные гидроксиды
Амфотерные гидроксиды
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
реагируют с кислотами
Амфотерные гидроксиды реагируют только с оксидами,
Cr(OH)3 + SiO2 ≠ которым соответствуют сильные гидроксиды
Амфотерные гидроксиды реагируют только со щелочами
Cr(OH)3 + Cu(OH)2 ≠ (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH) , Sr(OH) , Ba(OH) )
2
2
2
NO – несолеобразующий оксид, вступает только в
Cr(OH)3 + NO ≠ окислительно-восстановительные реакции
Cr(OH)3 + NaNO3 ≠ Амфотерные гидроксиды не реагируют с солями
Амфотерные гидроксиды
2 Cr(OH)3 +3 H2SO4 = Cr2(SO4)3 + 3H2O реагируют с кислотами
Cr(OH)3 + NaOH = NaCrO2 +2H2O
Амфотерные гидроксиды
реагируют со щелочами
70.
71.
Карбонат кальция CaCO3 - сольCaCO3 + 2HCl = CaCl2 +
Реакция возможна, т.к.
H2O
CO+3 CO2 образуется газ
CaCO3 + MgO ≠
Соли с оксидами не
реагируют
CaCO3 + Pb
Pb – менее активный металл, чем Ca
≠
CaCO3 + H2O ≠
Соли в воде растворяются, многие подвергаются
гидролизу. CaCO3 – нерастворимая соль,
гидролизу не подвергаются
72.
73.
XY
Ba
Ba(OH)2
BaCl2
Ba + KOH ≠
Металлы с основаниями не реагируют
Ba + NaOH ≠ Металлы с основаниями не реагируют
Металлы левее H реагируют
Ba + 2H2O = Ba(OH)2 + H2 с водой и кислотами
Ba(OH)2 + 2 HCl = BaCl2 +2H2O Ba(OH)2 – основание, щелочь
HCl - кислота
Некоторые неметаллы
+
Ba(ClO)
+
2Ba(OH)2 +2Cl2 = BaCl2
2 2 H2O реагируют со щелочами
Ba(OH)2 + KCl ≠ Реакция невозможна, т.к. не образуется ни
осадка, ни газа, ни воды
74.
75.
Общие формулы углеводородовКласс
Алканы Алкены Циклоал Алкины
веществ
-каны
Общая
CnH2n+2
CnH2n
CnH2n
CnH2n-2
формула
Пример
C3H8
C3H6
C3H6
изомеры
C3H4
Алкадиены
Арены
CnH2n-2
CnH2n-6
C3H4
C6H6
изомеры
76.
77.
Если от атома углерода отходят только одинарные связи – это sp3Если отходят одинарные и одна двойная связь – это sp2
Если отходят две двойные связи – это sp
Если отходит тройная связь – это тоже sp
σ
3σ - π
Первая связь всегда σ, вторая и третья
3
sp
Гексан CH3-CH2-CH2-CH2-CH2-CH3 – все атомы sp3
CH
O
3
2
3
sp
Гексен CH3-CH=CH-CH2-CH2-CH3sp– 2 атома
сspsp2,sp
остальные 4 – sp3
CH3 – CH = CH – C ≡ C – Csp–3 C
1σ,
Этан CH3-CH3 – оба атома sp3
CH3 O – H 1 π
sp3
sp2
sp2
Этен CH2=CH2 – оба атома sp2
3σ σ σ 1σ, σ σ
Между атомом С и
1π
тремя атомами Н
1σ,
2π
σ
3σ
σ σ
σ
σ
78.
79.
Характерные (качественные) – это реакции, с помощью которых можноразличить вещества
бромная вода
обесцвечавание р-ра
Алкены
р-р KMnO4
обесцвечавание р-ра
Многоатомные
Cu(OH)2
синее окрашивание
спирты
амм.р-р оксида серебра [Ag(NH3)2]OH «серебряное зеркало»
Альдегиды
Cu(OH)2
красный осадок Cu2O
Карбоновые метилоранж, лакмус
появление красной окраски
кислоты
карбонаты
выделение газа CO2
Белки
HNO3
желтое окрашивание
Глюкоза – это одновременно многоатомный спирт и альдегид.
Характерные реакции – с Cu(OH)2 и [Ag(NH3)2]OH
Аминокислоты проявляют свойства аминов (реагируют с O2, H2O и кислотами) и
свойства карбоновых кислот (реагируют с металлами левее Н, оксидами
металлов, основаниями, карбонатами
Олеиновая и линолевая кислоты имеют двойную связь, поэтому проявляют
свойства кислот и алкенов (реагируют с H2, бромной водой, раствором KMnO4)
80.
81.
OУксусная кислота CH3COOH
CH3 – C
OH
1) 2 CH3COOH + CuO → (CH3COO)2Cu + H2O
Кислоты реагируют с основными оксидами
2) 2 CH3COOH + Cu(OH)2 → (CH3COO)2Cu +2 H2O
Кислоты реагируют с основаниями
3) 2 CH3COOH + Na2CO3 → 2 CH3COONa + H2O
CO+3 CO2
Кислоты реагируют с карбонатами, образуется газ CO2
4) CH3COOH + Na2SO4 →
Не образуется ни осадка, ни газа, ни воды
82.
83.
C6H5CH3 → X → C6H5 - CH2 - OH1) C6H5OH
2) C6H5 - CH2Cl
3) C6H5Cl
4) C6H5COOH
X – вещество, из которого можно получить C6H5-CH2-OH
Из предложенных вариантов подходит C6H5 - CH2Cl
CH3
CH2Cl
+ Cl2 →
+ HCl
CH2OH
CH2Cl
+ NaOH →
+ NaCl
84.
85.
1)2)
CH2=CH2 + H2O → CH3-CH2OH - реакция соединения
этен, этилен
Br2 + H2 → 2 HBr
- реакция соединения
3) CH3-CH2-CH3 + Br2 → CH3-CHBr-CH3 + HBr
пропан
бром заместил
водород, реакция
замещения
4) CH4 +2O2 → CO2 + 2H2O - не реакция замещения
86.
87.
1. С наибольшей скоростью протекают реакции в растворах.Пример: реакция BaCl2 (р-р) + H2SO4 (р-р) = BaSO4 + 2HCl (р-р) протекает
почти мгновенно
В ионном виде записываются только взаимодействующие ионы:
Ba2+ + SO42- = BaSO4
Если в реакции один раствор, такая реакция идет с меньшей
скоростью, чем между двумя растворами
2. В реакциях замещения с большей скоростью реагируют более
активные металлы
Пример:
кальций взаимодействует с соляной кислотой быстрее, чем цинк
88.
89.
При увеличении давления, равновесие реакции смещается в тусторону, где меньше моль газов
Если в реакции тепло выделяется (+Q), то увеличение
температуры смещает равновесие в обратную сторону
При увеличении концентраций исходных веществ, равновесие
смещается в сторону продуктов реакции
2CO (г) + O2 (г) <=>2CO2 (г) + Q
1) В левой части 3 моль газов, а в правой 2. Значит увеличение
давления будет смещать равновесие вправо (образование CO2)
2) Увеличение концентрации оксида углерода (IV), т.е. CO2 будет
смещать равновесие влево (образование CO и O2)
3) В реакции тепло выделяется (+Q). Значит уменьшение температуры будет смещать равновесие вправо (образование CO2)
4) Увеличение концентрации кислорода О2 (исходного вещества)
будет смещать равновесие вправо (образование CO2)
90.
91.
C2H5OH (этанол) – органическое вещество, неэлектролит1) KCl (хлорид калия)– растворимая соль, сильный электролит
BaSO4 (сульфат бария) – нерастворимая соль, слабый электролит
C5H10O5 (рибоза) – органическое вещество, неэлектролит
2) KOH (гидроксид калия) – щелочь, сильный электролит
CH3COONa (ацетат натрия) – растворимая соль, сильный электролит
C12H22O11 (сахароза) – органическое вещество, неэлектролит
3) CH2(OH)-CH(OH)-CH2(OH) (глицерин)–органическое вещество, неэлектролит
CH3OH (метанол) – органическое вещество, неэлектролит
Na2SO4 (сульфат натрия) – растворимая соль, сильный электролит
4) C6H12O6 (глюкоза) – органическое вещество, неэлектролит
CH3COOH (уксусная кислота)–слабая кислота, слабый электролит
92.
93.
1) гидроксид натрия и хлорид барияреакция невозможна, т.к. не образуется
NaOH + BaCl2 ≠
ни осадка, ни газа, ни воды
2) сульфат хрома (III) и гидроксид натрия
реакция возможна, т.к.
Cr2(SO4)3 +6KOH = 2Cr(OH)3 +3K2SO4 образуется осадок Cr(OH)
3
3) нитрат кальция и бромид натрия
реакция невозможна, т.к. не образуется
Ca(NO3)2 + NaBr ≠
ни осадка, ни газа, ни воды
4) хлорид аммония и нитрат алюминия
реакция невозможна, т.к. не образуется
NH4Cl + Al(NO3)3 ≠
ни осадка, ни газа, ни воды
94.
95.
Окислитель – отбирает электроныВосстановитель – отдает электроны
Например: Cu+2 + 2e → Cu0
N+5 + 3e → N+2
Например: Na0 – 1e → Na+1
S-2 – 8e → S+6
1) S+4O2 + 2NaOH = Na2S+4O3 + H2O
2) S+4O2 + 2H2S = 3S0 + 2H2O
степ. окисл. не изменились
сера перешла из степ.окисл.+4 в 0,
т.е. S+4 + 4e → S0
забирают электроны окислители
3) SO2 + H2O <=> H2SO3
степ. окисл. не изменились
4) 2S+4O2 + O2 <=> 2S+6O3
сера перешла из степ.окисл.+4 в +6, т.е.
S+4 - 2e → S+6
отдают электроны восстановители
96.
97.
Сильные кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4Сильные основания (щелочи) - гидроксиды щелочных и щелочноземельных
металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2 и Ba(OH)2
образована из сильного основания KOH
- нейтральная среда
KCl
и
сильной
кислоты
HCl
1)
образована из сильного основания NaOH
Na2S
- щелочная среда
и слабой кислоты H S
2
2)
3)
4)
K2SiO3
Na2CO3
FeCl2
NH4Cl
CuSO4
Na2SO4
образована из сильного основания KOH
и слабой кислоты H2SiO3
образована из сильного основания NaOH
и слабой кислоты H2CO3
образована из слабого основания
Fe(OH)2 и сильной кислоты HCl
образована из слабого основания NH4OH
и сильной кислоты HCl
образована из слабого основания
Cu(OH)2 и сильной кислоты H2SO4
образована из сильного основания NaOH
и сильной кислоты H2SO4
- щелочная среда
- щелочная среда
- кислая среда
- кислая среда
- кислая среда
- нейтральная среда
98.
99.
Алканы вступают в реакции: 1) горения;2) дегидрирования;
3) замещение (с галогенами, азотной кислотой); 4) изомеризации
2) окисления;
Алкены вступают в реакции: 1) горения;
3) дегидрирования;
4) полимеризации;
5) присоединения по двойной связи (гидрогалогенирования, гидрирования,
гидратации, галогенирования)
6)качественные реакции (обесцвечивает р-ры KMnO4 и бромной воды)
Алкины вступают в реакции: 1) горения; 2) тримеризации;
3) окисления;
4) в реакцию Кучерова
5) присоединения по тройной связи (гидрогалогенирования, гидрирования,
гидратации, галогенирования)
6)качественные реакции (обесцвечивает р-ры KMnO4 и бромной воды)
Алкадиены вступают в реакции: 1) горения; 2) окисления;
3) дегидрирования;
4) полимеризации;
5) присоединения по двойной связи (гидрогалогенирования, гидрирования,
гидратации, галогенирования)
6)качественные реакции (обесцвечивает р-ры KMnO4 и бромной воды)
1) алканы не вступают в реакции полимеризации, т.к. не имеют двойных связей
2) этилен – алкен, значит обесцвечивает раствор KMnO4
100.
101.
O-CHO – сокращенная запись - C
O
-COOH – сокращенная запись - C
H
O
OH
+ H2 → CH3CH2CH2OH
1) CH3CH2C
пропанол-1
H
O
O
+ 2Cu(OH)2 → CH3CH2C
2) CH3CH2C
пропановая
OH
кислота
H
+ Cu2O + 2 H2O
3) СН3 - СН2Сl + H2O → СН3 - СН2OH + HCl
O
4) CH3CH2C
O
+ Ag2O
H
→ CH3CH2C
пропановая
OH
кислота
+ 2 Ag
102.
103.
Характерные (качественные) – это реакции, с помощью которых можноразличить вещества
бромная вода
обесцвечавание р-ра
Алкены
р-р KMnO4
обесцвечавание р-ра
Многоатомные
Cu(OH)2
синее окрашивание
спирты
амм.р-р оксида серебра [Ag(NH3)2]OH «серебряное зеркало»
Альдегиды
Cu(OH)2
красный осадок Cu2O
Карбоновые метилоранж, лакмус
появление красной окраски
кислоты
карбонаты
выделение газа CO2
Белки
HNO3
желтое окрашивание
104.
105.
Получение некоторых веществ:Водород H2 - из воды (электролизом)
Азот N2 из воздуха
Кислород O2- из воздуха
Аммиак NH3 - из азота N2 и водорода H2
Серная кислота H2SO4 - из серы и серосодержащих веществ по схеме:
FeS2
O2
O2
S
SO2
SO3
H 2S
Метанол CH3OH - из синтез-газа (смеси CO и H2)
106.
107.
2СО(г) + О2(г) = 2СО2(г) + 566 кДжВ уравнении: угарного газа – 2 моль, выделяется 566 кДж теплоты
В условии: выделяется 152 кДж теплоты
2 моль CO - 566 кДж
Х моль CO - 152 кДж
2 ×152 = 0,537 моль
Х=
566
V (CO) = n × Vm = 0,537 × 22,4 = 12 л
108.
CH31)
CH3
- ароматический углеводород (арен)
1,2-диметилбензол
о-ксилол
- спирт (предельный – нет двойных,
2) CH3-CH2-CH-CH2-CH2-CH3 тройных связей; одноатомный – одна
гексанол-3 группа –OH)
OH
O
3) H-C
- сложный эфир
O – CH3
метилформиат
метиловый эфир муравьиной кислоты
CH=CH2
4)
- ароматический углеводород (арен)
винилбензол
стирол
109.
А) CH2Cl2Б) HCHO
Cl ближе к F, значит перетягивает к себе электроны от C
C ближе к F, чем H, значит перетягивает электроны от 2 атомов H,
но 2 атома хлора перетягивают электроны от C
0 +1 -1
значит: C H2 Cl2
O ближе к F, значит перетягивает к себе электроны от C
C ближе к F, чем H, значит перетягивает электроны от 2 атомов H,
но атом кислорода перетягивает 2 электрона от C
+1 0 +1 -2
значит: H C H O
O ближе к F, значит перетягивает к себе электроны от C и Na
В) HCOONa C ближе к F, чем H, значит перетягивает электрон от атома H
Один атом O перетягивает 2 электрона от атома C, другой
перетягивает 1 электрон от C и 1 электрон от H
+1+2-2 -2 +1
значит: H C O O Na
Г) CBr4
Br ближе к F, значит перетягивает к себе электроны от атома C
+4 -1
значит: CBr4
110.
Электролиз растворовактивные металлы,
не выделяются на
катоде, вместо них
выделяется H2
металлы средней
активности,
на катоде выделяются
одновременно металл и H2
OH-, NO2-, NO3-, SO32-, SO42-, CO32-, SiO32-, PO43-… и Fвыделяется O2
A) Cu(NO3)2
Б) AgNO3
В) СaCl2
Г) Na2SO4
неактивные
металлы,
выделяются
на катоде
Cl-, Br-, I-, S2выделяются:
Cl2, Br2, I2, S
Cu – неактивный металл, выделяется на катоде
Ag – неактивный металл, выделяется на катоде
Ca – активный металл, на катоде выделяется H2
Na – активный металл, на катоде выделяется H2
111.
Сильные кислоты:HCl
HBr
HI
HNO3 H2SO4
HClO4
Сильные основания (щелочи):
LiOH NaOH KOH RbOH CsOH
Ca(OH)2 Sr(OH)2 Ba(OH)2
Гидролизу подвергаются катионы слабых (нерастворимых) оснований и анионы слабых кислот
Гидролиз катиона Al3+
I стадия
Гидролиз аниона CO32-
Al3+ + HOH = Al(OH)2+ + H+
CO32- + HOH = HCO3- + OH2+
+
+
HCO3- + HOH = H2O
CO+3 CO2 + OHII стадия Al(OH) + HOH = Al(OH)2 + H
Al(OH)2+ + HOH = Al(OH)3 + H+
—
III
стадия
Na+ – катион сильного основания, гидролизу не подвергается
А) карбонат натрия Na2CO3 - гидролиз по аниону
CO32- – анион слабой кислоты, подвергается гидролизу
NH4+ – катион слабого основания, подвергается гидролизу
Б) хлорид аммония NH4Cl - гидролиз по катиону
Cl- – анион сильной кислоты, гидролизу не подвергается
K+ – катион сильного основания, гидролизу не подвергается
- гидролизу не подвергается
В) сульфат калия K2SO4
SO42- – анион сильной кислоты, гидролизу не подвергается
Al3+ – катион слабого основания, подвергается гидролизу
Г) сульфид алюминия Al2S3 - гидролиз по катиону и аниону
S2- – анион слабой кислоты, подвергается гидролизу
112.
A) KHCO3 + KOH →K2CO3 + H2O
Б) KHCO3 +
KCl
HCl→
+
H
H22O
CO+3CO2
В)
K2CO3 + 2 HNO3→ 2KNO3 +
H
H22O
CO+3CO2
Г)
K2CO3 +
ВаCl2→ KCl
+ BaCO3
113.
H2 реагирует только с органическими веществами, содержащими двойные или тройные связи.1)
+ 3 H2 → C6H12
циклогексан
бензол
CH3-CH2-CH3 + H2 ≠
пропан
2) CH2=CH-CH2-CH3 +H2 →CH3-CH2-CH2-CH3
бутен-1
бутан
CH3-CH3 + H2 ≠
этан
3) CH2=CH-CH=CH2 +H2 →CH3-CH2-CH=CH2
бутадиен-1,3, дивинил
бутен-1
CH2=CH2 + H2 → CH3-CH3
этен, этилен
этан
-CH=CH2 H →
-CH2-CH3
4)
2
винилбензол, стирол
этилбензол
CH2=CH-CH=CH2 +H2 →
→ CH3-CH2-CH=CH2
5) CH2Cl-CH2Cl + H2 ≠
дихлорэтан
6) CH≡CH + H2 → CH2=CH2
этин, ацетилен
этен, этилен
CH3-CH2-CH2-CH3 + H2 ≠
бутан
CH≡C-CH2-CH3+H2 →CH2=CH-CH2-CH3
бутин-1
бутен-1
114.
Метанол CH3OH – предельный одноатомный спирт (предельный потому что нетдвойных, тройных связей), одноатомный, потому что одна гидроксильная группа OH)
Спирты реагируют с: галогенводородами (HCl, HBr), кислородом (горение или
окисление), карбоновыми кислотами (этерификация), активными металлами, а
также окисляются до альдегидов и карбоновых кислот
1) CH3OH + HBr → CH3Br + H2O
2) CH3OH + Na2CO3 ≠
O
O
C – CH2
C – CH2 →
3) CH3OH +
CH3-O
NH2
HO
NH2
4) CH3OH + Fe(OH)3 ≠
5) CH3OH +
≠
O
O
CH
6) CH3OH +
HO
CH
→
CH3-O
+ H2O
+ H2O
115.
-NH2 +31O →24 CO + 14H O + 2N2
2
2
2
O
+15O2 → 12CO2 + 14H2O + 2N2
4 CH3-CH-C
NH2 OH
2) C6H5NH2 +HBr → C6H5NH3+BrCH3CH(NH2)COOH +HBr → CH3CH(NH3+)COOH
Br3) C6H5NH2 +CH3-CH3 ≠
CH3CH(NH2)COOH +CH3-CH3 ≠
1) 4
-NH2
-CH-CH3
CH3
≠
CH3CH(NH2)COOH +CH3-CH=CH2
5) C6H5NH2 + H2SO4 →C6H5NH3+HSO4CH3CH(NH2)COOH +H2SO4 → CH3CH(NH3+)COOH
HSO4CH3CH(NH2)COOH + KOH = CH3CH(NH2)COOK + H2O
6) C6H5NH2 +KOH ≠
4)
-NH2 +CH3-CH=CH2 →
116.
mвеществаω=
mраствора (смеси)
mв-ва = mр-ра (смеси) × ω
m (CH3COOH) = mр-ра 1 × ω1= 20 × 0,7 = 14 г
mвещества
mраствора (смеси) =
ω
m(CH3COOH)
14
mраствора (смеси)2 =
=
= 466,67 г
ω2
0,03
m (воды) = 466,67 - 20 = 446,67 г
Ответ с точностью до целых: 447
117.
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb65
m 6,6
n(Zn) =
=
= 0,1 моль
M 65
n(Zn) = n(Pb)
0,1 = n(Pb)
1
1
1
1
n(Pb) = 0,1 моль
207
m(Pb)= n M= 0,1 207 = 20,7г
Ответ с точностью до целых: 21
118.
2 KMnO4+ 5 H2S + 3 H2SO4→2 MnSO4+ 5S+ K2SO4+ 8 H2O+7
+2
Mn +5e → Mn
S
-2
-2e → S
0
2
окислитель, восстановление
5
восстановитель, окисление
Сначала определим неизвестные продукты
В правой части уравнения не хватает K. Калий соединится с
молекулами среды, т.е. с SO42В ОВР почти всегда присутствует вода. Один из продуктов – H2O
Составим схемы окисления и восстановления
Поставим полученные цифры в уравнение
Уравняем остальное
119.
AlMnO2
CuSO4
HCl
6 Al +2MnO2 = 3Al2O3 +2Mn Al – более активный металл, чем Mn,
значит вытесняет его из соединений
2 Al +3CuSO4 = Al2(SO4)3 +3Cu
Al – более активный металл, чем Cu,
значит вытесняет его из соединений
2 Al + 6 HCl =2AlCl3 +3H2 Al –активный металл (левее H), значит
вытесняет водород из кислот
амфотерные оксиды не
MnO2 + CuSO4 ≠ реагируют с солями
2
MnO2 проявляет
окислительные свойства
1 окислитель, восстановление
2
1 восстановитель, окисление
MnO2 + 4HCl = Cl2 + MnCl2 + 2 H2O
+4
Mn
+2e
-1
2 Cl
-2e
CuSO4 + HCl
→
→
≠
+2
Mn
0
Cl2
реакции обмена возможны, только
если получаются осадок, газ или вода
120.
KMnO4 , HCaC2→этин→этаналь X 1 X2
CaCO3
CaC2 + 2H2O → CH≡CH + Ca(OH)2
карбид кальция
ацетилен, этин
2
Hg
CH3-C
CH≡CH + H2O
ацетилен, этин
O
CH3-C
O
этаналь, H
ацетальдегид, уксусный альдегид
4 ,H
KMnO
этаналь,
H
ацетальдегид, уксусный альдегид
O
CH3-C
OH
уксусная (этановая) кислота
2CH3-COOH + CaCO3 → (CH3-COO)2Ca + H2O
CO+3 CO2
уксусная (этановая) кислота
(CH3-COO)2Ca
ацетат кальция
ацетат кальция
CaCO3 + CH3-C-CH3
t
O ацетон
t
X
3
121.
Сероводород объемом 5,6 л (н.у.) прореагировал без остатка с 59,02 мл раствора КOH с массовой долей 20%(плотность 1,186 г/мл). Определите массу соли, полученной в результате этой химической реакции
Порядок решения задач С4:
Решение:
1.Дано:
Записать уравнения реакций (иногда для
этого
требуется рассчитать количества
V
5,6
возможные
реакции
V(H
=
= 0,25
моль
nОпределим
(H2S) =
веществ)
2S)=17,4 л
ВариантовVm2: 22,4
V2.рРассчитать
(KOH) = 59,02
мл
количества известных веществ
H2S(KOH)
+ 2KOH
ω (KOH) = 20% г
= V=р•Kρ2Sр += 2H
2O или
m
59,02
• 1,186 = 70 г
р
3.
Определить
количество
неизвестного
вещества
(по
уравнению
реакции)
ρр (KOH) = 1,186 г/мл
H2S + KOH = KHS + H2O
= mр• С4
ω второй
= 70 • 0,2
m
(KOH)
= 14 вероятнее)
г
(для
задания
вариант
4.
Определить
требуемую
величину
m (соли) - ?
39 16 1
mколичества
= 14 = известных
0,25 моль веществ
nРассчитаем
(KOH) =
M
56
Vm – молярный объем
HПри
KOHмолярный
= KHS + H2O
2S + н.у.
объем любого газа равен
n22,4
(KHS)
л/моль
= n (KOH) = 0,25 моль
39 1 32
Выбираем
вариант уравнения (т.к. в
m (KHS) = nвторой
• M = 0,25• 72 = 18 г
первом варианте KOH должно быть в 2 раза
Ответ:
18 аг в расчетах KOH 0,25 моль и H S
больше,
2
тоже 0,25 моль)
122.
При взаимодействии 25,5 г предельной одноосновной кислоты с избытком раствора гидрокарбонатанатрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты
Порядок
С5:
Дано: решения задачРешение:
1. Записать
уравнение
в общем виде
m
(CnH2nO2)=25,5
г
+ NaHCO(иногда
O2Na +H
CnH2nO2 веществ
3 = CnH2n-1
2O +CO2
2. Найти количества известных
в общем
виде)
V
мл
25,5
m
2) = 59,02 количества
3.(CO
Приравнять
веществ
и
решить
= уравнение
n (CnH2nO2)=
Чтобы
записать
уравнение нужно определить
общую формулы
m
(соли)
-?
M 14n+32
предельной одноосновной кислоты
– нет двойных,
5,6
V (предельная
= 0,25 моль
n (CO2) –= одна= карбоксильная
тройных связей, одноосновная
группа -COOH)
22,4
V
m
Для
примера
кислоту:
CH3-CH
-COOH
2-CH2их
1 атом
C имеетвозьмем
массу 12, бутановую
в Cn25,5
H2nO2 атомов
C n штук,
вместе
масса 12n
Молекулярная
формула:
HO
или CnH
H2n
Oштук,
8O
2
1 атом H имеет массу
1, в CnCH42n
2n
вместе их масса 2n
2 2атомов
0,25
=
Любая
реагирует с карбонатами с
1 атом Oкарбоновая
имеет массукислоты
16, в C14n+32
nH2nO2 атомов O два, вместе их масса 32
Итого:
молярнаяуглекислого
масса CnH2nO2газа
равна
= 14n+32
образованием
CO12n+2n+32
2
0,25 •газа
(14n+32)
= 25,5
Vm (молярный объем) любого
при н.у.
равен 22,4 л/моль
3,5n + 8 = 25,5
3,5n = 17,5
n = 5
Ответ: C5H10O2























































































































 chemistry
chemistry








