Similar presentations:
Сераорганические соединения
1.
Министерство науки и высшего образования РФ ФГБОУ ВО«Самарский государственный технический университет»
Химико-технологический факультет
Кафедра органической химии
Направление подготовки
18.03.01 «Химическая
технология»
04.03.02 «Химия, физика и
механика материалов»
Органическая химия
Тема: Сераорганические соединения.
Преподаватель: д.х.н., профессор Климочкин Ю.Н
1
2.
Сераорганические соединенияКлассификация:
Тиоспирты
RSH
Тиоэфиры (сульфиды) RSR’
Дисульфиды
RS2R’
Полисульфиды
RSnR’
Сульфеновые кислоты RSOH
Сульфиновые кислоты RS(О)OH
Сульфокислоты
RSO3H
Сульфоксиды
RSOR’
Сульфоны
RSO2R’
232
3.
Тиоспирты (тиолы)Тиолы
можно
рассматривать
как
производные
сероводорода, в котором один атом водорода замещен
углеводородным остатком. Они являются аналогами спиртов
и фенолов, в молекулах которых атом кислорода замещен
серой.
метантиол (метилмеркаптан)
CH
3SH
меркаптобензол (тиофенол)
C6H5SH
SHCH
2CH
2SH
1,2-этандитиол
H3C CH
2 CH CH
2 SH
CH3
2-метил-1-бутантиол
SH
1,2-димеркаптобензол
SH
H3C CH
2 CH CH
2 CH3
SH
3-пентантиол
-
+
C2H5SNa
этантиолят натрия (этилмеркаптид натрия)
333
4.
НоменклатураНоменклатура
тиолов
подобна
номенклатуре
гидроксипроизводных, только вместо суффикса олприменяется -тиол или вместо префикса гидрокси(окси-) применяется меркапто-.
Иногда эти соединения называют меркаптанами,
тиоспиртами, тиофенолами.
Номенклатура ИЮПАК использование этих названий
не рекомендует.
434
5.
Методы полученияАлкантиолы получают реакциями алкилирования
сероводорода и его солей. Реакция протекает по механизму
бимолекулярного нуклеофильного замещения:
R
R
X + Na -SH
OH + H2S
R
o
400 C
ThO 2
SH + Na X
R
SH + H2O
535
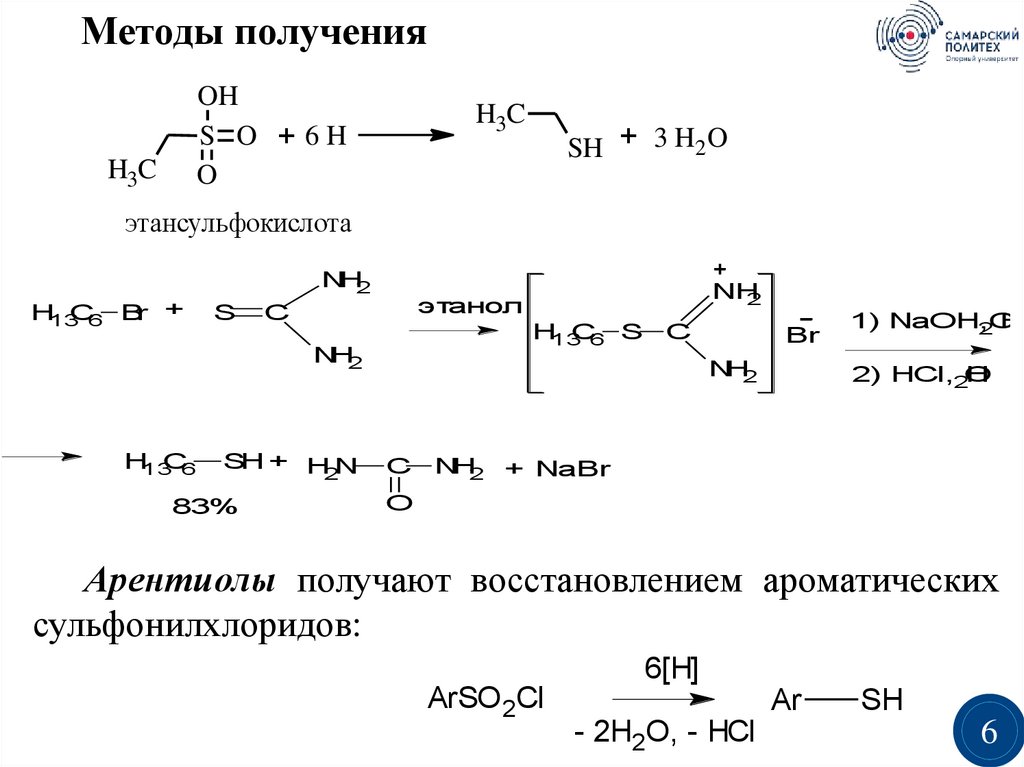
6.
Методы полученияOH
S O + 6H
O
H3C
H3C
SH + 3 H2 O
этансульфокислота
NH2
H13C6
Br +
S
C
H13C6 S C
NH2
H13C6
SH + H N
2
83%
NH
2
этанол
Br
NH2
C
1) NaOH,2O
H
2) HCl,2O
H
NH2 + NaBr
O
Арентиолы получают восстановлением ароматических
сульфонилхлоридов:
6[H]
ArSO 2Cl
- 2H2O, - НСl
Ar
SH
636
7.
Физические свойстваТиолы представляют собой соединения с чрезвычайно
неприятным запахом, который обнаруживается даже в
малых концентрациях.
Запах метантиола (метилмеркаптана) в воздухе
чувствуется уже в разбавлении 1 : 4·108.
Связь S-H менее полярна, чем связь О-Н, поэтому у
тиолов слабее межмолекулярные водородные связи и
ниже температуры кипения, чем у соответствующих
кислородных аналогов.
Дипольные моменты алкантиолов чуть меньше, чем
дипольные моменты спиртов, но поляризуемость
значительно больше.
737
8.
Химические свойстваРеакции тиолов обусловлены главным образом
участием связи S-H и нуклеофильными свойствами атома
серы.
Тиолы являются SH-кислотами, при этом значительно
более сильными, чем аналогичные ОН-кислоты:
R
S
H + :B
R
S
+ HB
+
Для С2Н5SH pKa=10.6, для С6Н5SH pKa=6.5.
Кислотность тиолов на 4-5 порядков выше, чем у спиртов
(для С2Н5ОH pKa=15.9), несмотря на то, что связь S-H
является менее полярной.
838
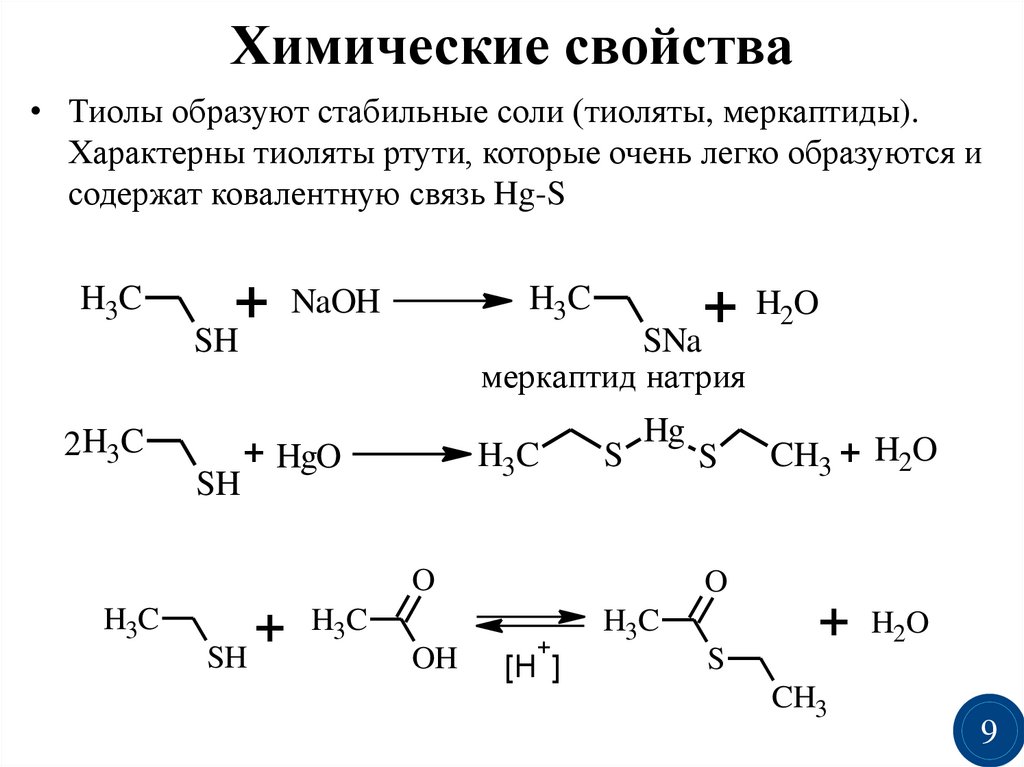
9.
Химические свойства• Тиолы образуют стабильные соли (тиоляты, меркаптиды).
Характерны тиоляты ртути, которые очень легко образуются и
содержат ковалентную связь Hg-S
H3C
+
SH
2H3C
SH
H2O
+
SNa
H3C
NaOH
меркаптид натрия
+ HgO
H3C
S
Hg
O
H3C
+
SH
H3C
OH
S
CH3 + H2O
O
+
[H ]
H3C
S
+
CH3
H2O
93
10.
Тиолы и особенно тиоляты легко окисляются. Первичным продуктомокисления является дисульфид, который может подвергаться дальнейшим
превращениям:
I2
R S S
R
2 R
SH
KMnO 4
2 RSO 3H
Тиолят-ионы являются сильными нуклеофилами, легко алкилируются с
образованием тиоэфиров (сульфидов) – реакция Вильямсона:
2
RS + R X
H3C
(CH2)3
R'
S
o
этанол, 78 С
S Na + CH3J
H3C
R'' + X
(CH2)3
S
71%
CH3 + NaJ
10
310
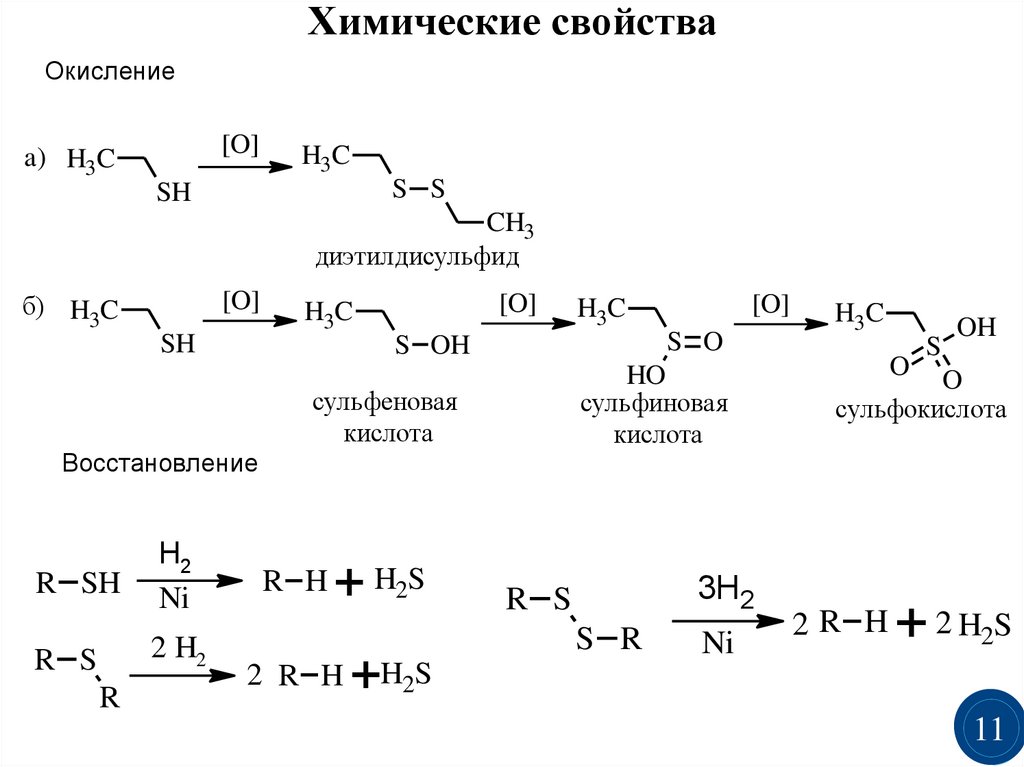
11.
Химические свойстваОкисление
[O]
a) H3C
H3C
S S
SH
CH3
диэтилдисульфид
[O]
б) H3C
[O]
H3C
SH
S O
S OH
HO
сульфиновая
кислота
сульфеновая
кислота
Восстановление
R SH
H2
Ni
2 H2
R S
R
R H
+ H2S
2 R H
+H2S
[O]
H3C
3H2
R S
S R
Ni
H3C
O
S
OH
O
сульфокислота
2R H
+ 2 H2S
11
3
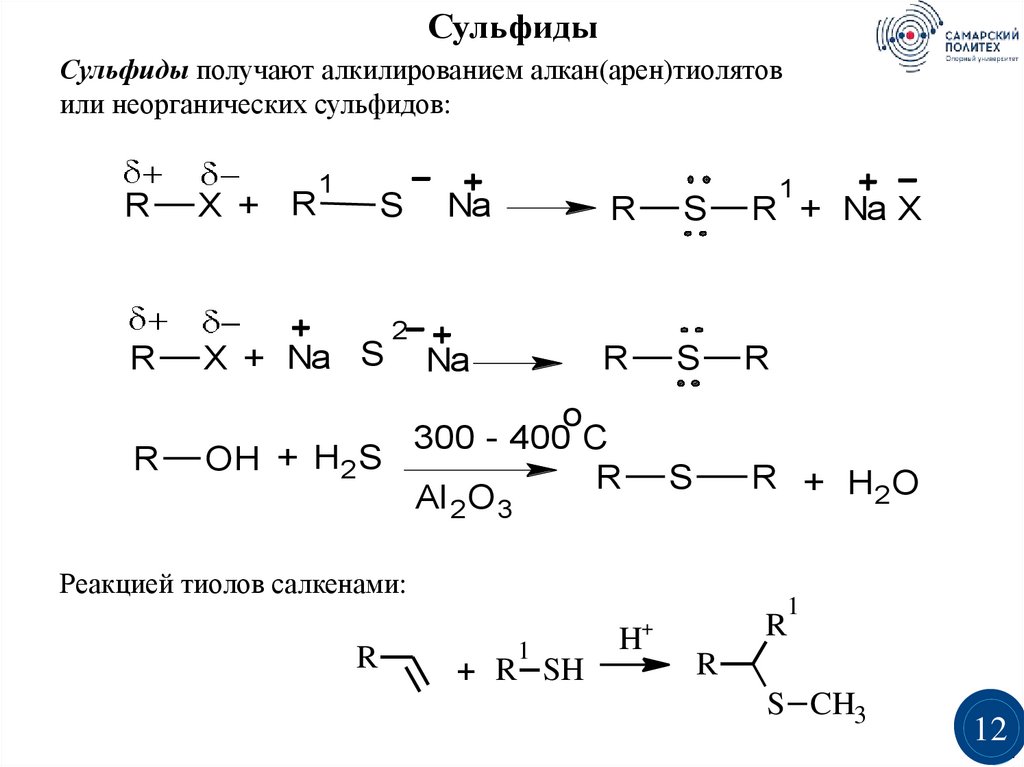
12.
СульфидыСульфиды получают алкилированием алкан(арен)тиолятов
или неорганических сульфидов:
R
X + R
1
S
Na
R
S
R + Na X
R
S
R
S
R + H2O
2
R
X + Na S
R
o
300 - 400 C
OH + H2S
R
Al 2O 3
Na
Реакцией тиолов салкенами:
R
1
1
1
+ R SH
H+
R
R
S CH3
12
312
13.
Сульфиды• Для получения диарилсульфидов используют реакцию
галогенидов серы с аренами в присутствии кислот
Льюиса:
2 Ar - H + S2Cl 2
AlCl 3
Ar
S
Ar + S + 2HCl
• Дисульфиды получают окислением тиолятов или
алкилированием неорганических дисульфидов:
R
2 R
S Na
[O]
X + Na S
R
S Na
S
S
R
R
S
S
R + 2Na X
13
3
14.
Физические свойстваСульфиды и дисульфиды являются веществами с
неприятным запахом.
Их температуры кипения выше, чем у аналогичных
простых эфиров и пероксидов. Диметилсульфид кипит при
38оС, диэтилсульфид – 92оС.
Полярность подобна полярности простых эфиров, хотя
связь C-S менее полярна, чем связь С-О. Причинами
большого дипольного момента являются меньший
валентный угол связи C-S-C (≈100о) и эффект неподеленных
электронных пар атома серы.
Неподеленные электронные пары являются весьма
подвижными, сульфиды характеризуются более сильными
электронодонорными свойствами.
Например, С2Н5ОС2Н5 имеет ПИ 9.6 эВ, а С2Н5SC2H5 –
8.5 эВ.
14
3
14
15.
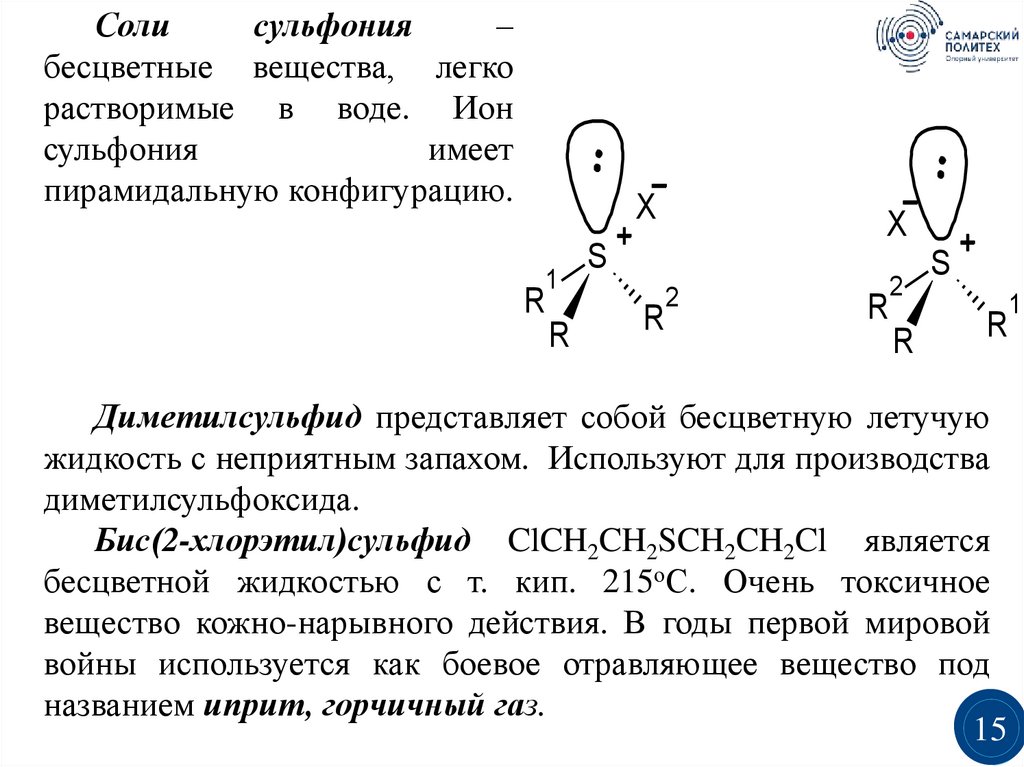
Солисульфония
–
бесцветные вещества, легко
растворимые в воде. Ион
сульфония
имеет
пирамидальную конфигурацию.
X
R
1
R
X
S
R
2
R
2
R
S
R
1
Диметилсульфид представляет собой бесцветную летучую
жидкость с неприятным запахом. Используют для производства
диметилсульфоксида.
Бис(2-хлорэтил)сульфид ClCH2CH2SCH2CH2Cl является
бесцветной жидкостью с т. кип. 215оС. Очень токсичное
вещество кожно-нарывного действия. В годы первой мировой
войны используется как боевое отравляющее вещество под
названием иприт, горчичный газ.
15
315
16.
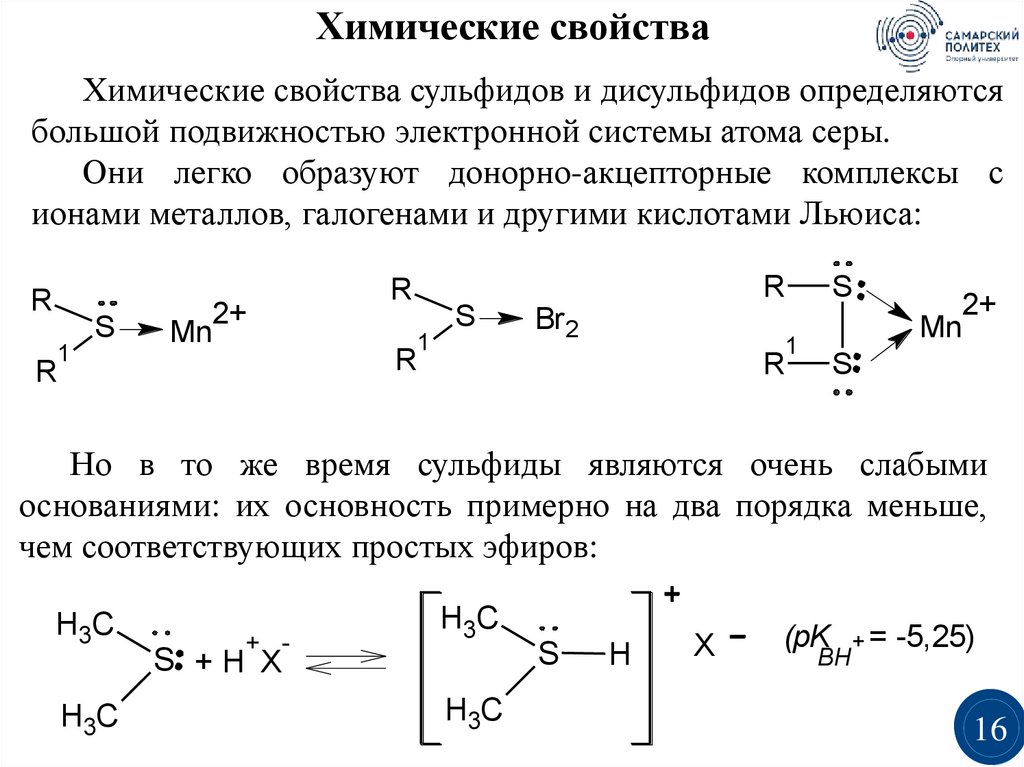
Химические свойстваХимические свойства сульфидов и дисульфидов определяются
большой подвижностью электронной системы атома серы.
Они легко образуют донорно-акцепторные комплексы с
ионами металлов, галогенами и другими кислотами Льюиса:
R
R
1
S
2+
Mn
R
R
R
1
S
Br 2
R
S
1
2+
Mn
S
Но в то же время сульфиды являются очень слабыми
основаниями: их основность примерно на два порядка меньше,
чем соответствующих простых эфиров:
H3C
H3C
+ -
H3C
S +H X
H3C
S
H
X
(pK
BH
+=
-5,25)
16
316
17.
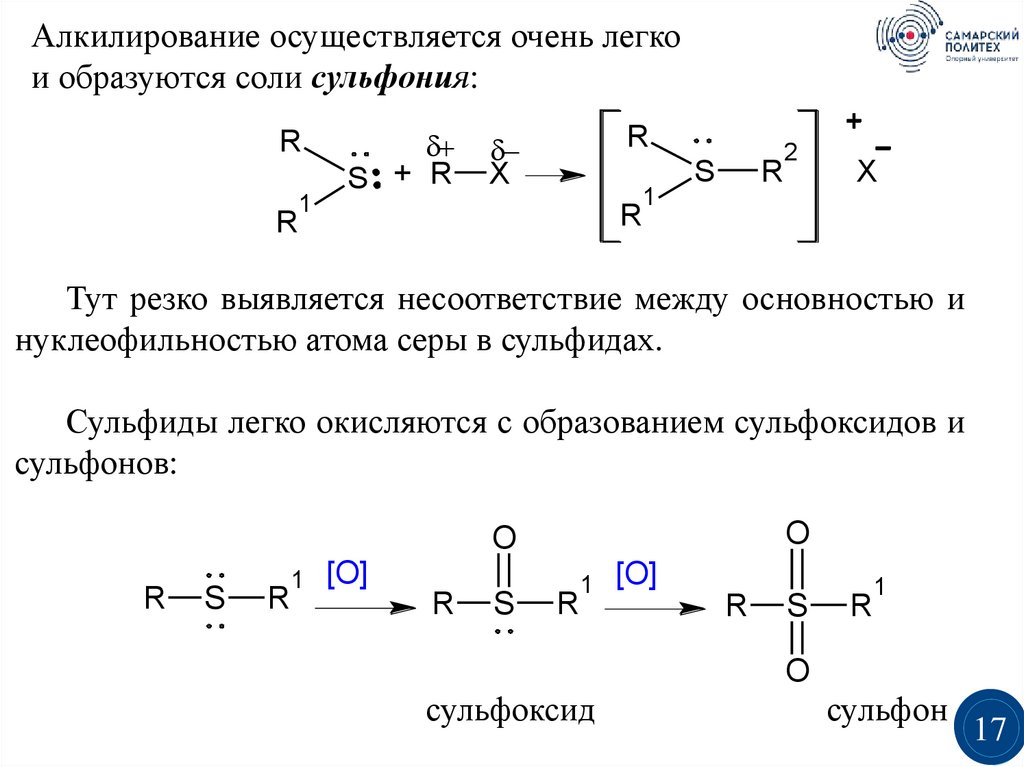
Алкилирование осуществляется очень легкои образуются соли сульфония:
R
R
1
S + R
R
X
R
1
S
R
2
X
Тут резко выявляется несоответствие между основностью и
нуклеофильностью атома серы в сульфидах.
Сульфиды легко окисляются с образованием сульфоксидов и
сульфонов:
O
O
R
S
R
1
[O]
R
S
R
1
[O]
R
S
R
1
O
сульфоксид
сульфон
17
317
18.
СульфоксидыОбладают свойствами слабых оснований и очень слабых
СН-кислот.
Диметилсульфоксид (CH3)2S=O – бесцветная жидкость.
Кипит при 189оС с постепенным разложением.
Полярное соединение: дипольный момент μ=3.9 D,
диэлектрическая постоянная ε=48.9.
С водой смешивается неограниченно.
Получают
в
промышленности
окислением
диметилсульфида.
Диметилсульфоксид широко используют в качестве
растворителя – он растворяет и неорганические соли.
Биполярный апротонный растворитель.
В растворе диметилсульфокисда хорошо протекают
реакции нуклеофильного замещения.
Используется в медицине
18
318
19.
Сульфоны. Химические свойства.Сульфоны образуются в качестве побочных продуктов и
реакциях сульфирования. При повышении температуры
реакции и использовании более эффективных сульфирующих
реагентов удается превращать арены в диарилсульфоны:
2 Ar
H
H2SO 4/SO3
(ClSO 3H)
O
Ar S
Ar
O
Сульфоны легко образуются в результате сульфонилирования
(аналог ацилирования по Фриделю-Крафтсу):
AlCl 3
ArSO 2Cl + Ar 1
H
Ar SO 2
Ar 1 + HCl
19
319
20.
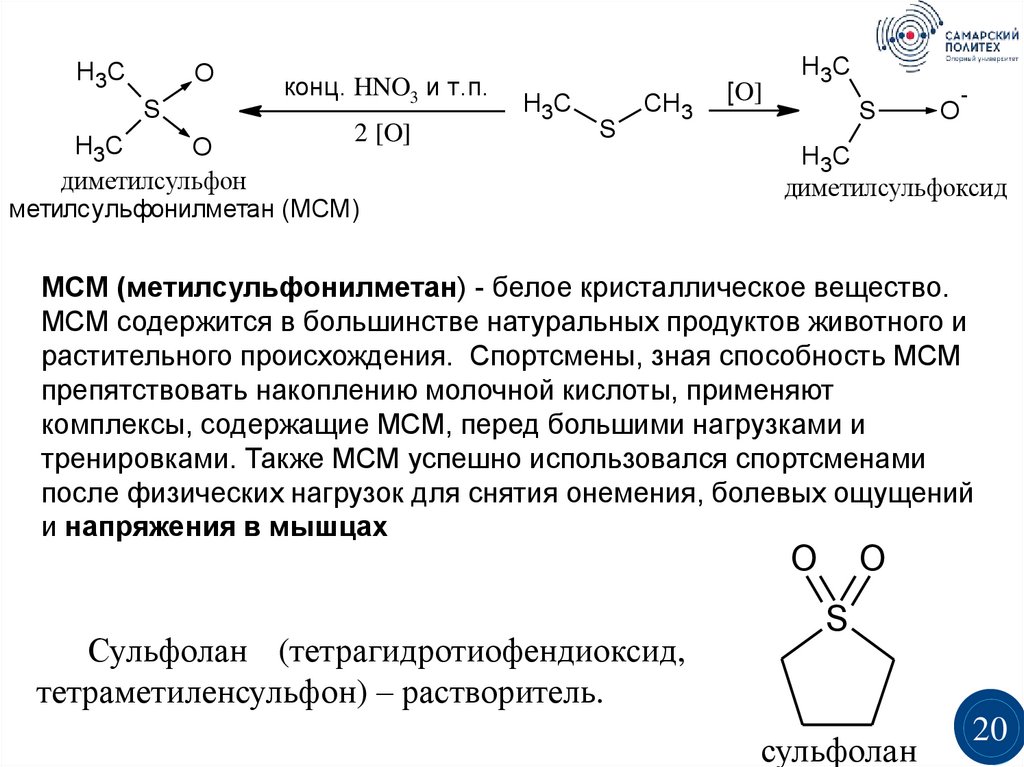
H3CO
S
конц. HNO3 и т.п.
2 [O]
H3C
O
диметилсульфон
метилсульфонилметан (МСМ)
H3C
S
CH3
[O]
H3C
S
O
-
H3C
диметилсульфоксид
МСМ (метилсульфонилметан) - белое кристаллическое вещество.
МСМ содержится в большинстве натуральных продуктов животного и
растительного происхождения. Спортсмены, зная способность МСМ
препятствовать накоплению молочной кислоты, применяют
комплексы, содержащие МСМ, перед большими нагрузками и
тренировками. Также МСМ успешно использовался спортсменами
после физических нагрузок для снятия онемения, болевых ощущений
и напряжения в мышцах
O
Сульфолан (тетрагидротиофендиоксид,
тетраметиленсульфон) – растворитель.
O
S
сульфолан
20
320












 chemistry
chemistry








