Similar presentations:
Кислотноcть и основность органических соединений. Инфракрасная спектроскопия. Лекция № 2
1. Лекция № 2 Кислотноcть и основность органических соединений. Инфракрасная спектроскопия.
Кафедра общей и медицинской химииЛекция № 2
Кислотноcть и основность
органических соединений.
Инфракрасная спектроскопия.
2.
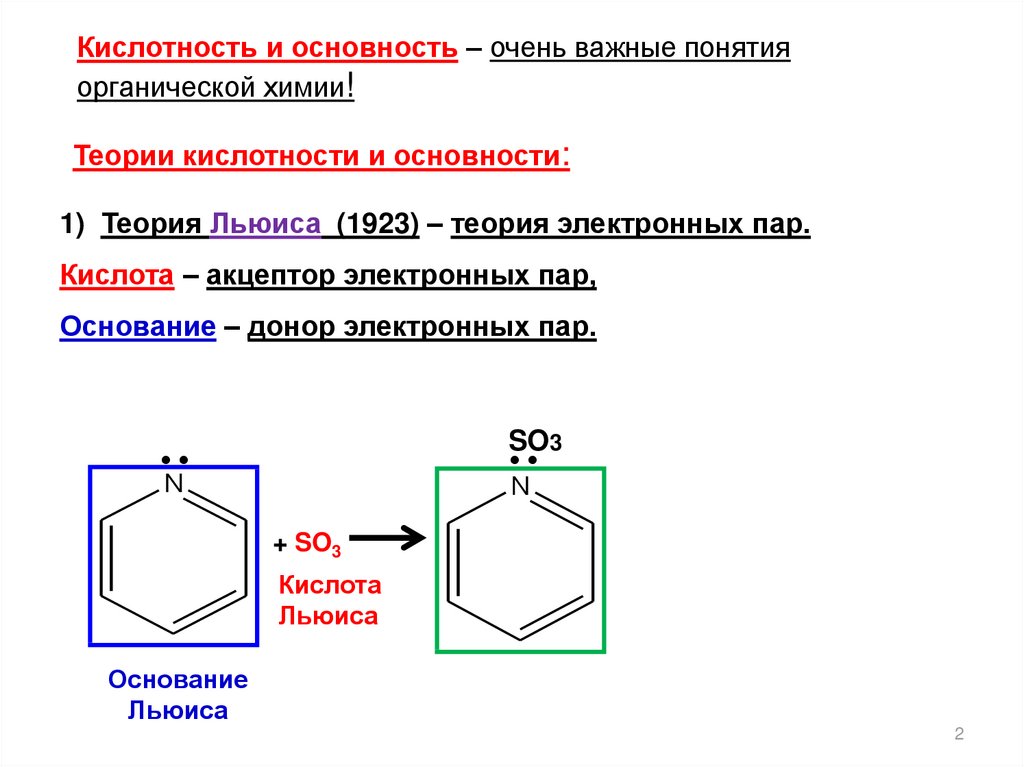
Кислотность и основность – очень важные понятияорганической химии!
Теории кислотности и основности:
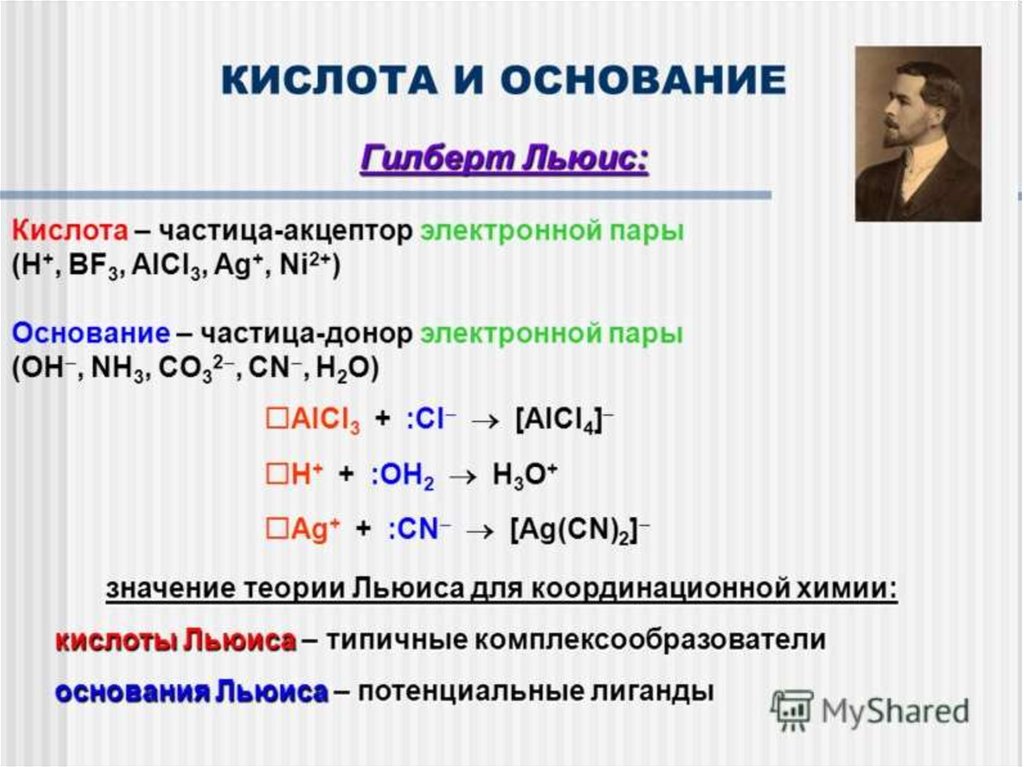
1) Теория Льюиса (1923) – теория электронных пар.
Кислота – акцептор электронных пар,
Основание – донор электронных пар.
SO3
•
•
N
N
+ SO3
Кислота
Льюиса
Основание
Льюиса
2
3.
34.
2) Протолитическая теория Бренстеда-Лоури (1923 год)связывает кислотность и основность с участием
протонов
АН + В
кислота основание
Иоханнес – Николаус
Бренстед
(1879-1947)
А
+
ВН
Сопряженное Сопряженная
основание
кислота
Томас - Мартин Лоури
(1874-1936)
4
5.
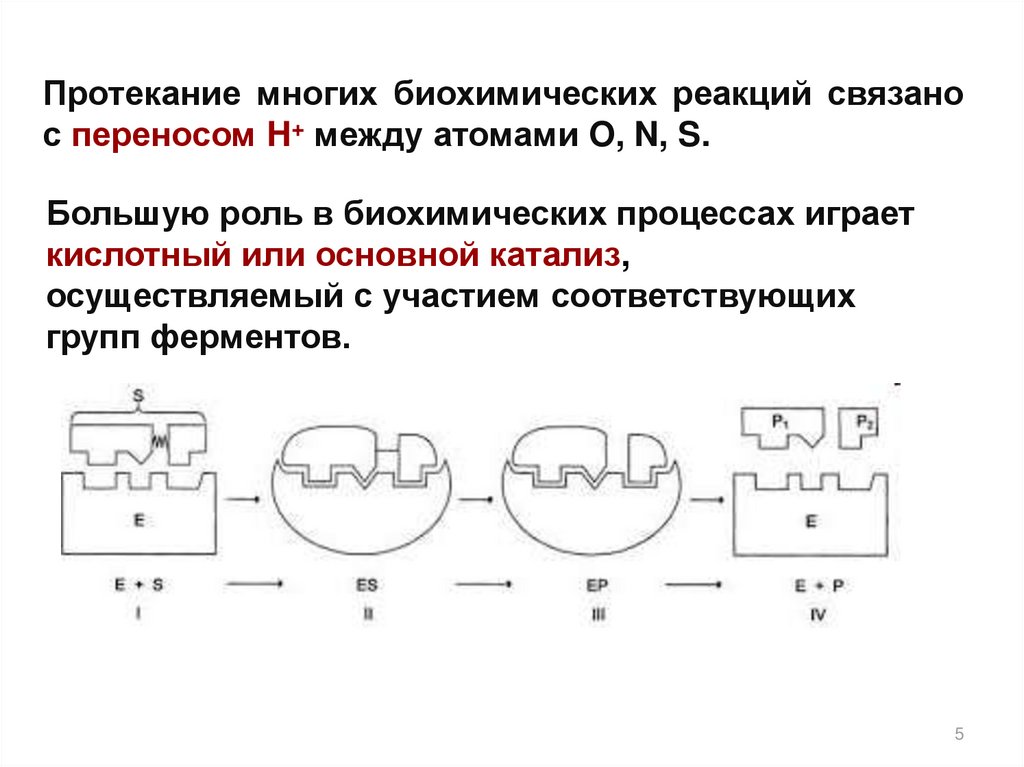
Протекание многих биохимических реакций связанос переносом H+ между атомами O, N, S.
Большую роль в биохимических процессах играет
кислотный или основной катализ,
осуществляемый с участием соответствующих
групп ферментов.
5
6.
Кислоты Бренстеда.Кислота Бренстеда – вещество, способное
отдавать протоны, т.е. донор H+.
В зависимости от природы элемента, с которым
связан H , кислоты делятся на:
C–H
(углеводороды и их производные: алканы,
алкены, алкины, арены)
N–H
(амины, амиды, имины)
S–H
(тиоспирты)
O–H
(спирты, фенолы, карбоновые кислоты)
H и атом элемента называют кислотным центром.
6
7.
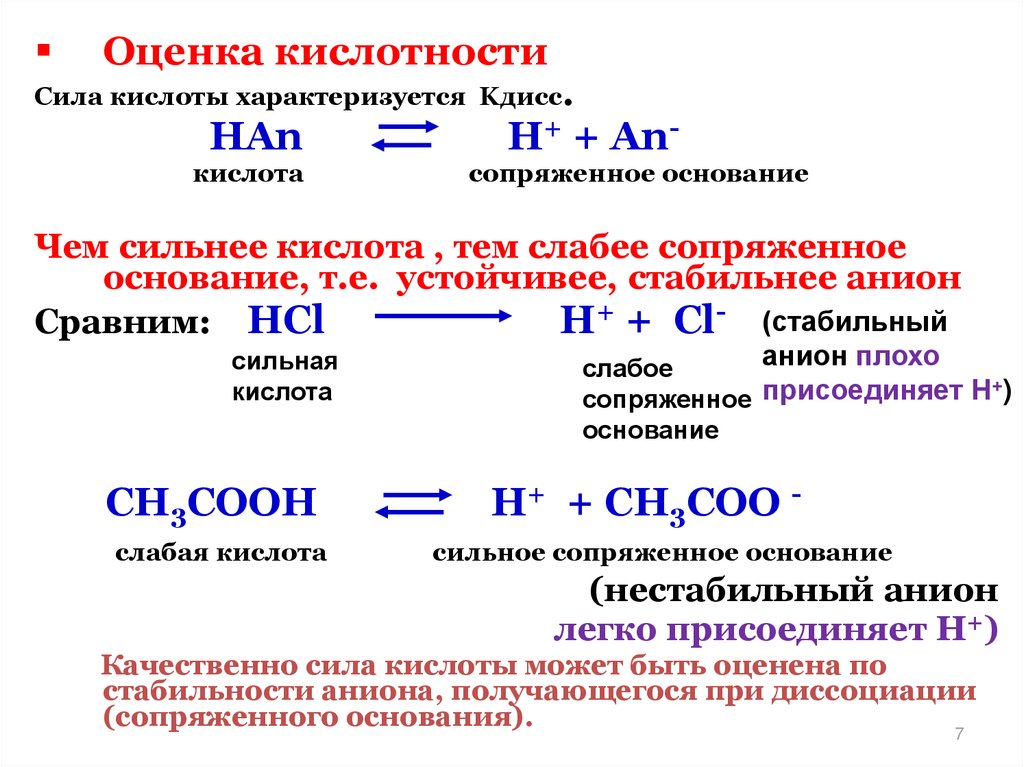
Оценка кислотностиСила кислоты характеризуется Kдисс.
HAn
H+ +
кислота
An-
сопряженное основание
Чем сильнее кислота , тем слабее сопряженное
основание, т.е. устойчивее, стабильнее анион
Сравним: HCl
H+ + Cl- (стабильный
сильная
кислота
CH3COOH
слабая кислота
анион плохо
слабое
+
сопряженное присоединяет Н )
основание
H+ + CH3COO сильное сопряженное основание
(нестабильный анион
легко присоединяет Н+)
Качественно сила кислоты может быть оценена по
стабильности аниона, получающегося при диссоциации
(сопряженного основания).
7
8.
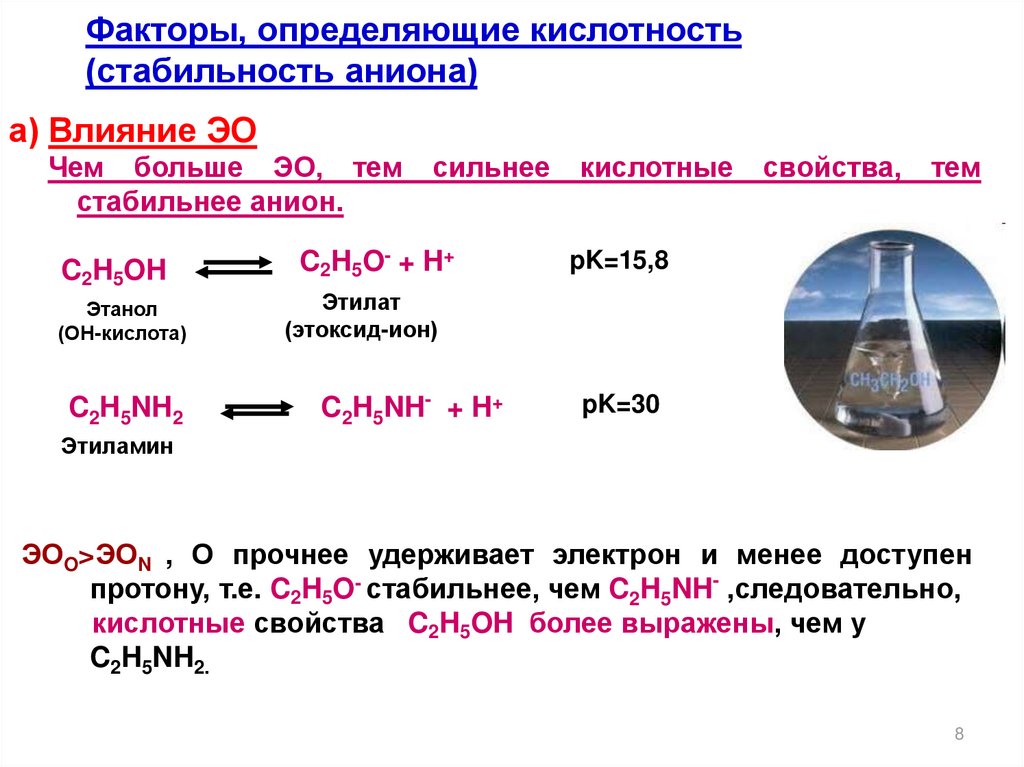
Факторы, определяющие кислотность(стабильность аниона)
а) Влияние ЭО
Чем больше ЭО, тем
стабильнее анион.
C2H5OH
Этанол
(ОН-кислота)
C2H5NH2
сильнее
C2H5O- + H+
кислотные
свойства,
тем
pK=15,8
Этилат
(этоксид-ион)
C2H5NH- + H+
pK=30
Этиламин
ЭОO>ЭОN , О прочнее удерживает электрон и менее доступен
протону, т.е. C2H5O- стабильнее, чем C2H5NH- ,следовательно,
кислотные свойства C2H5OH более выражены, чем у
C2H5NH2.
8
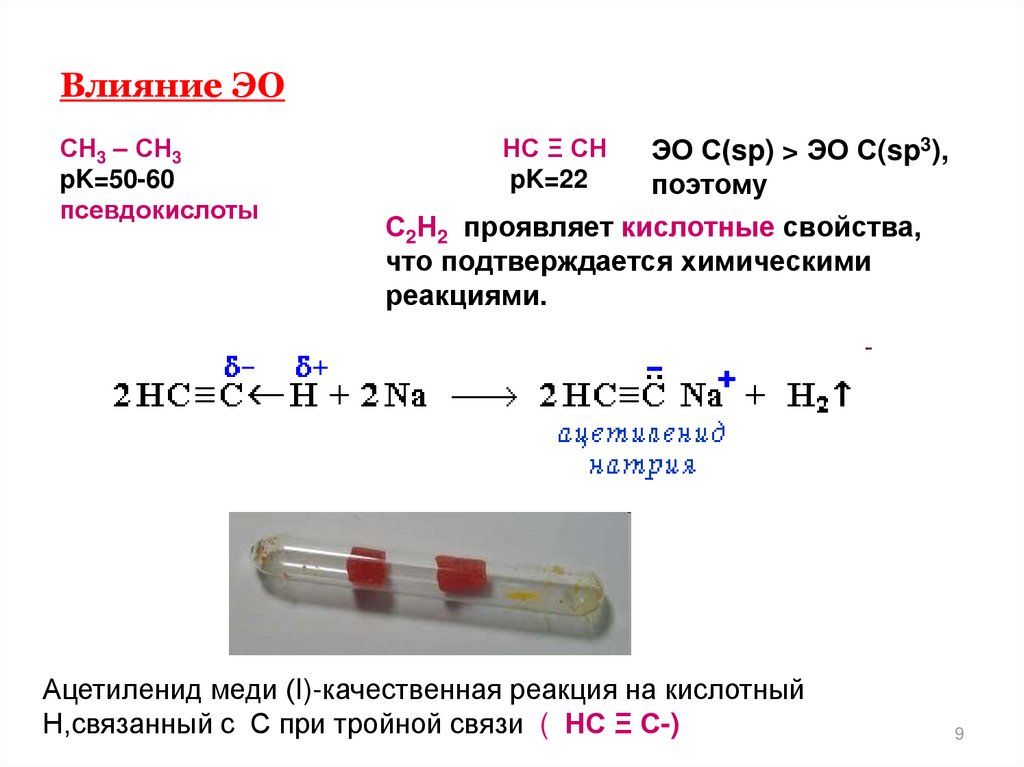
9. Влияние ЭО
СН3 – СН3pK=50-60
псевдокислоты
ЭО С(sp) > ЭО С(sp3),
поэтому
С2Н2 проявляет кислотные свойства,
что подтверждается химическими
реакциями.
НС Ξ СН
pK=22
Ацетиленид меди (I)-качественная реакция на кислотный
Н,связанный с С при тройной связи ( НС Ξ С-)
9
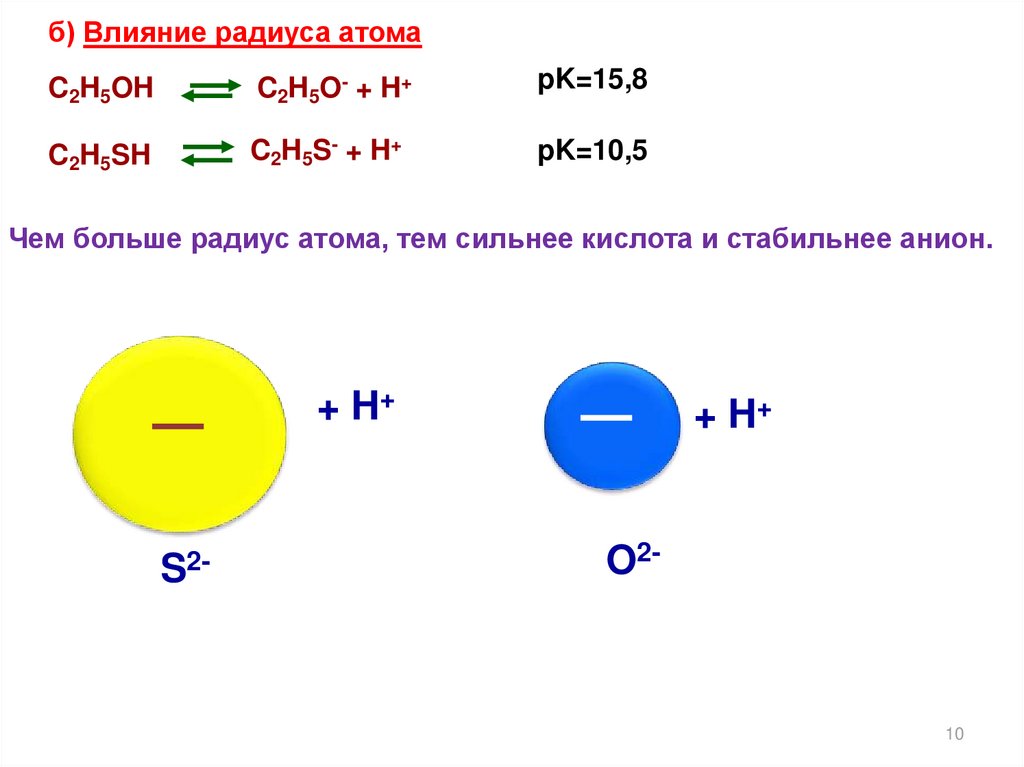
10.
б) Влияние радиуса атомаC2H5OH
C 2 H 5 O- + H +
pK=15,8
C2H5SH
C2H5S- + H+
pK=10,5
Чем больше радиус атома, тем сильнее кислота и стабильнее анион.
+ H+
S2-
+ H+
O2-
10
11.
в) Влияние заместителейC2H5OH
CBr3CH2OH
нарколан
Br
Br
Br
C
CH2
CF3 - CH2OH
C2H5O- + H+
CBr3CH2O- + H+
Br
Br
Br
OH
CF3 - CH2O- + H+
C
pK=15,8
pK=12,4
CH2
O
+
+
H
pK=11,4
Заместители с –I эфф усиливают кислотность, а с + I эфф –
ослабляют.
ЭД
ЭА
(+ М > - I)
OH, OR, NH2, NHR, NR2,
SH
(+ I )
R
(- I, - M)
COOH, CHO, NO2, CN,
SO3Н
(- I > + M)
(- I > + M)
11
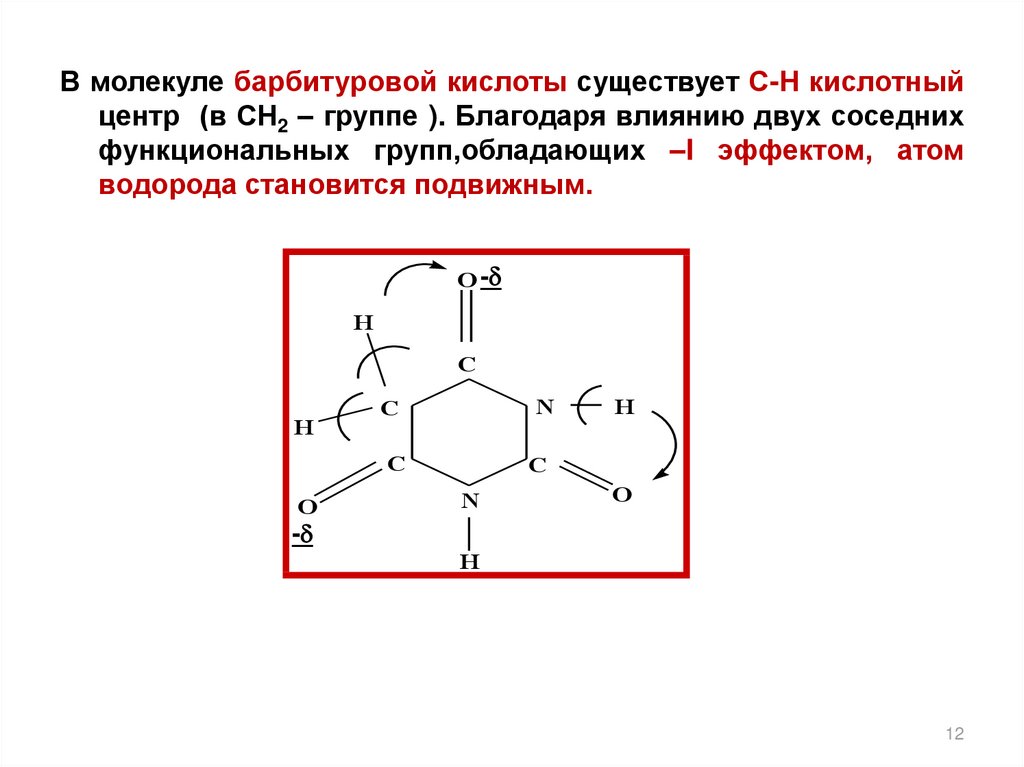
12.
В молекуле барбитуровой кислоты существует С-Н кислотныйцентр (в СН2 – группе ). Благодаря влиянию двух соседних
функциональных групп,обладающих –I эффектом, атом
водорода становится подвижным.
O -
H
C
H
N
C
C
O
H
C
N
O
-
H
12
13.
г) Влияние сопряженияC2H5OH
pK=15,8
C2H5O- + H+
..
O
..
O
H
pk=10
+
+
H
Введение ЭА заместителей в кольцо усиливает кислотные
свойства.
O
п-нитрофенол
N
..
O
H
O
OH
2,4,6 – тринитрофенол
(Пикриновая кислота)
NO 2
O2N
pk=0.68
NO2
13
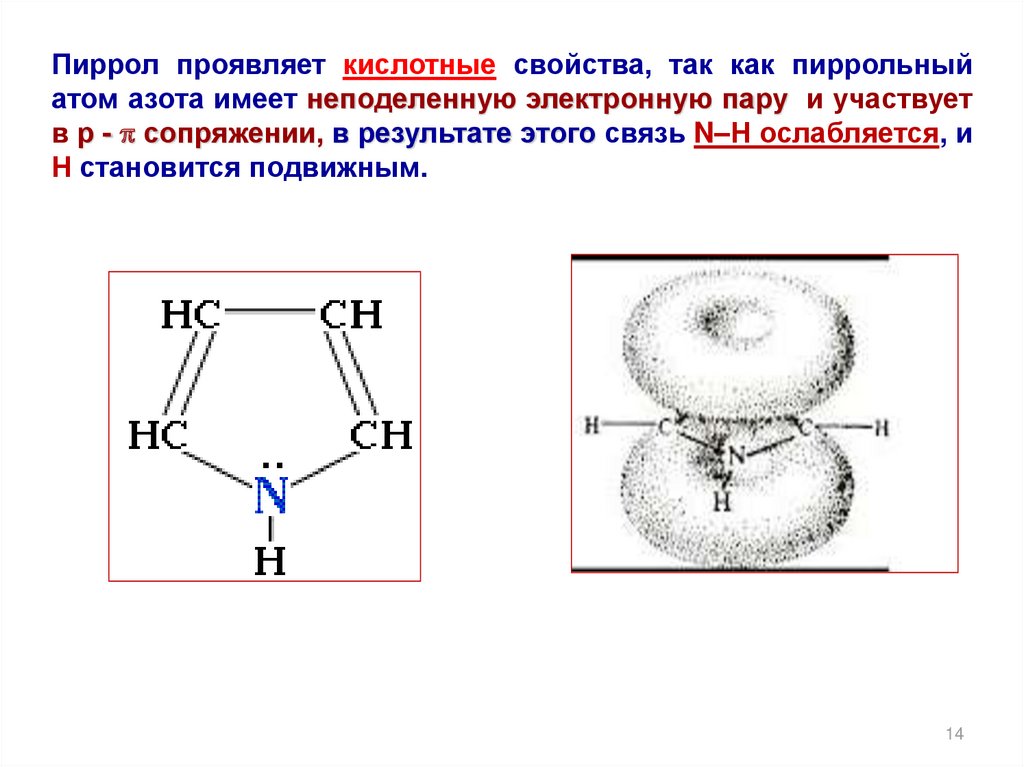
14.
Пиррол проявляет кислотные свойства, так как пиррольныйатом азота имеет неподеленную электронную пару и участвует
в р - p сопряжении, в результате этого связь N–Н ослабляется, и
Н становится подвижным.
14
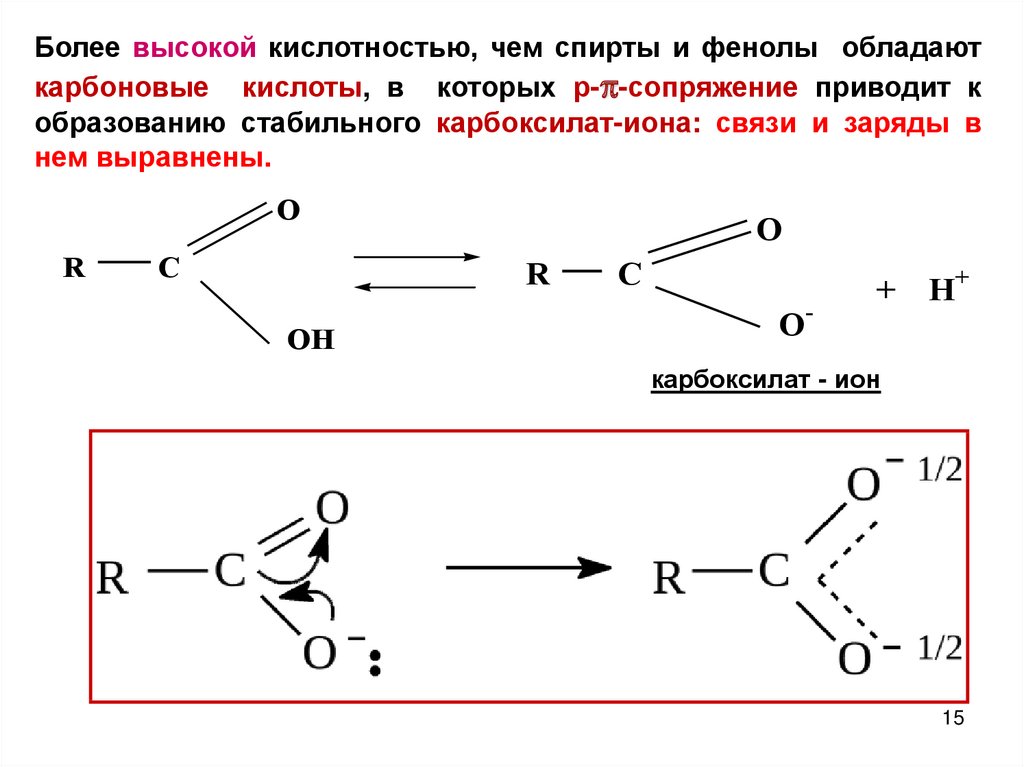
15.
Более высокой кислотностью, чем спирты и фенолы обладаюткарбоновые кислоты, в которых р-p-сопряжение приводит к
образованию стабильного карбоксилат-иона: связи и заряды в
нем выравнены.
O
R
C
O
R
OH
C
O-
+
H+
карбоксилат - ион
15
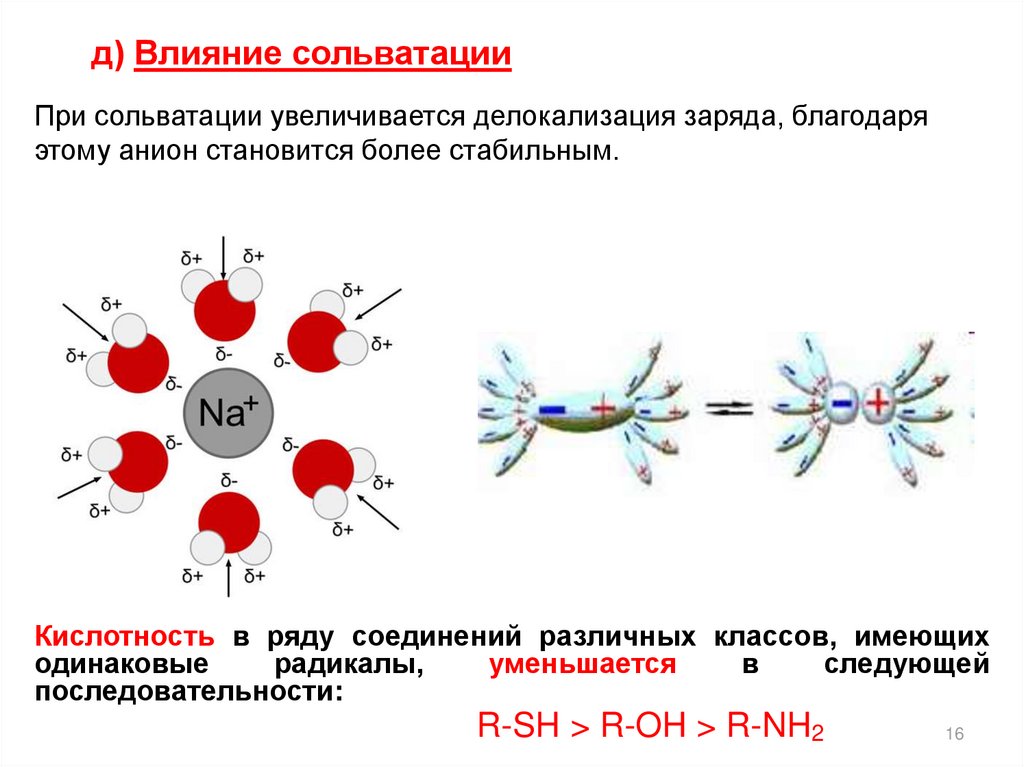
16.
д) Влияние сольватацииПри сольватации увеличивается делокализация заряда, благодаря
этому анион становится более стабильным.
Кислотность в ряду соединений различных классов, имеющих
одинаковые
радикалы,
уменьшается
в
следующей
последовательности:
R-SH > R-OH > R-NH2
16
17.
Кислотные свойства спиртов, фенолов, тиоловСпирт можно рассматривать как углеводород, в котором один
или более атомов H замещены на OH группы.
Спирты классифицируются
1.
по природе радикала (по характеру радикала):
предельные, непредельные - алифатические,
алициклические, ароматические
2.
по характеру атома C с которым связана OH – группа:
первичные, вторичные, третичные
3.
по количеству OH: одноатомные, двухатомные,
трехатомные, многоатомные
17
18.
I. Спирты1. Одноатомные спирты – очень слабые кислоты
C2H5OH + Na
C2H5ONa + 1/2 H2
этилат Na
или этоксид Na
Кислотность спиртов уменьшается в следующей
последовательности:
CH3
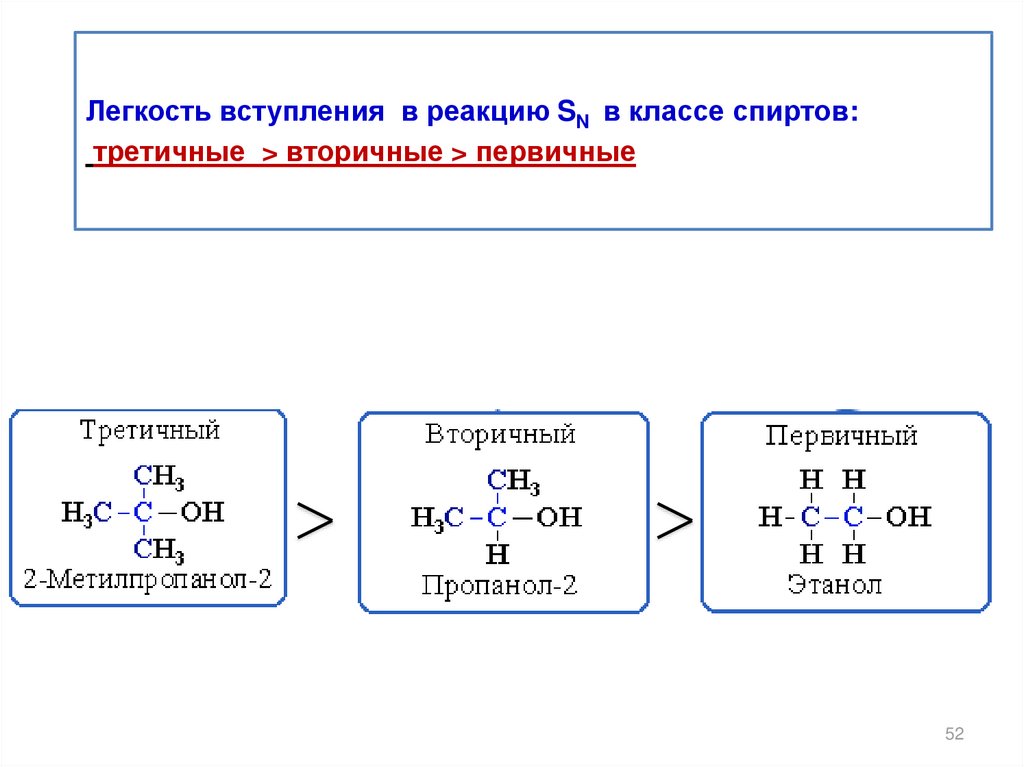
CH3OH > CH3 - CH2OH > CH3 – CH - CH3 > CH3 – C - CH3
OH
OH
метанол
этанол
пропанол-2
2-метилпропанол-2
pK =15,2
pK =15,8
pK =16,9
pK =19,2
+I эфф.
ROH + NaOH
, но C2H5ONa + H2O
+I эфф.
C2H5OH + NaOH
18
19.
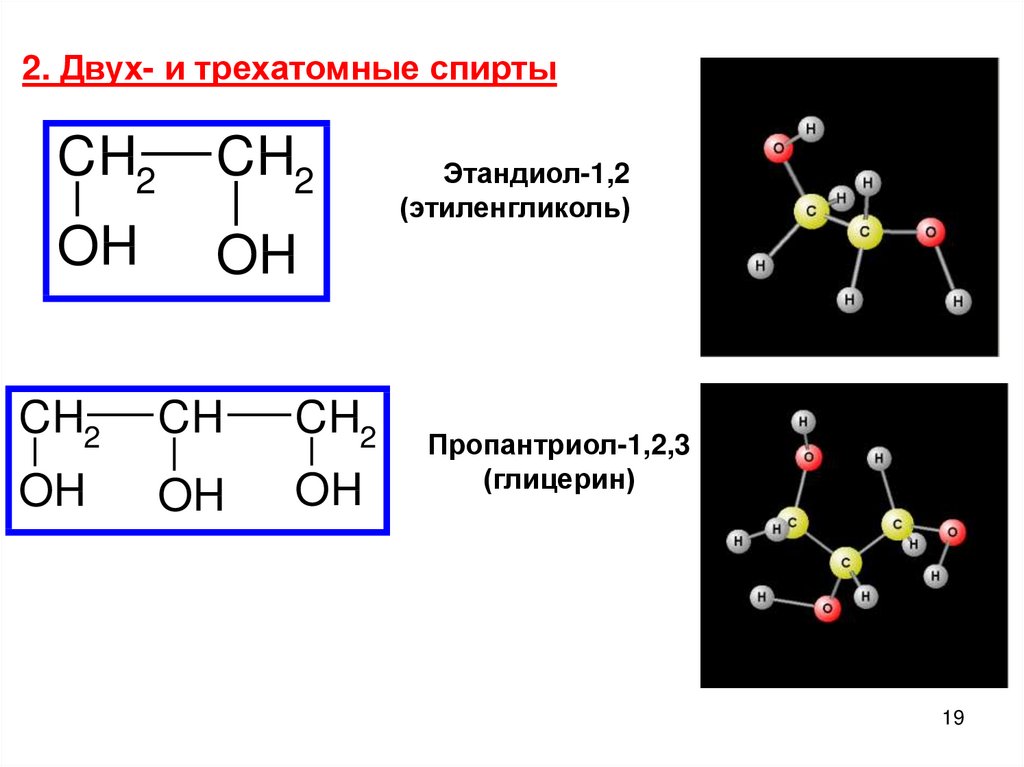
2. Двух- и трехатомные спиртыCH2
CH2
OH
OH
CH2
CH
CH2
OH
OH
OH
Этандиол-1,2
(этиленгликоль)
Пропантриол-1,2,3
(глицерин)
19
20.
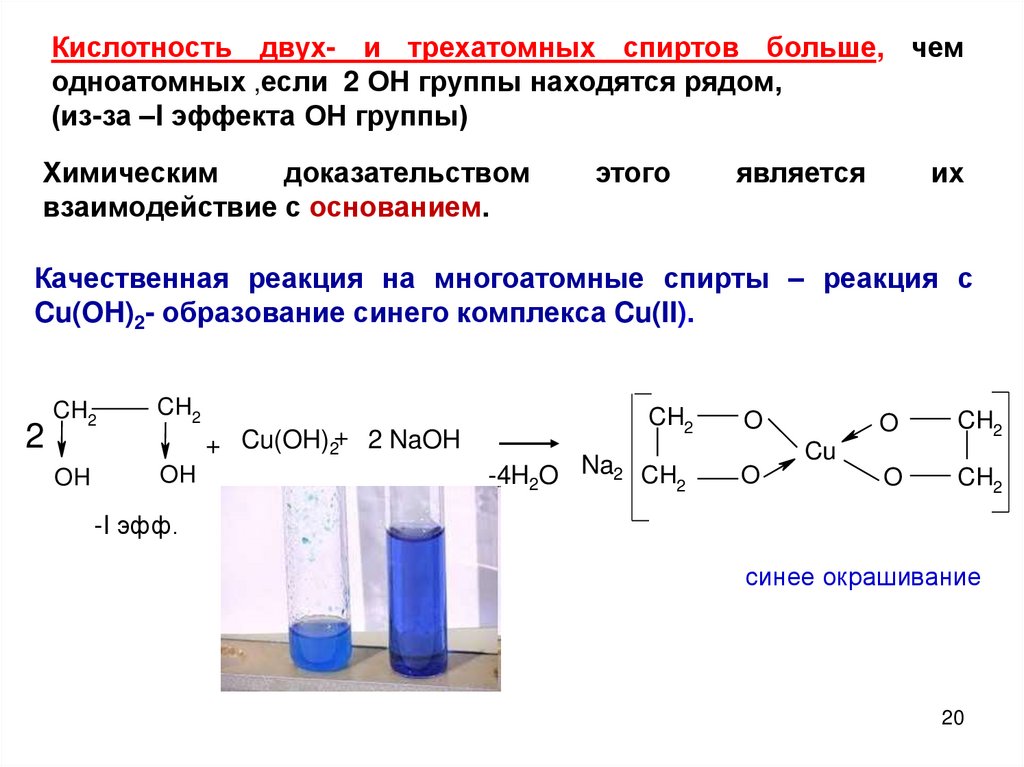
Кислотность двух- и трехатомных спиртов больше, чемодноатомных ,если 2 ОН группы находятся рядом,
(из-за –I эффекта ОН группы)
Химическим
доказательством
взаимодействие с основанием.
этого
является
их
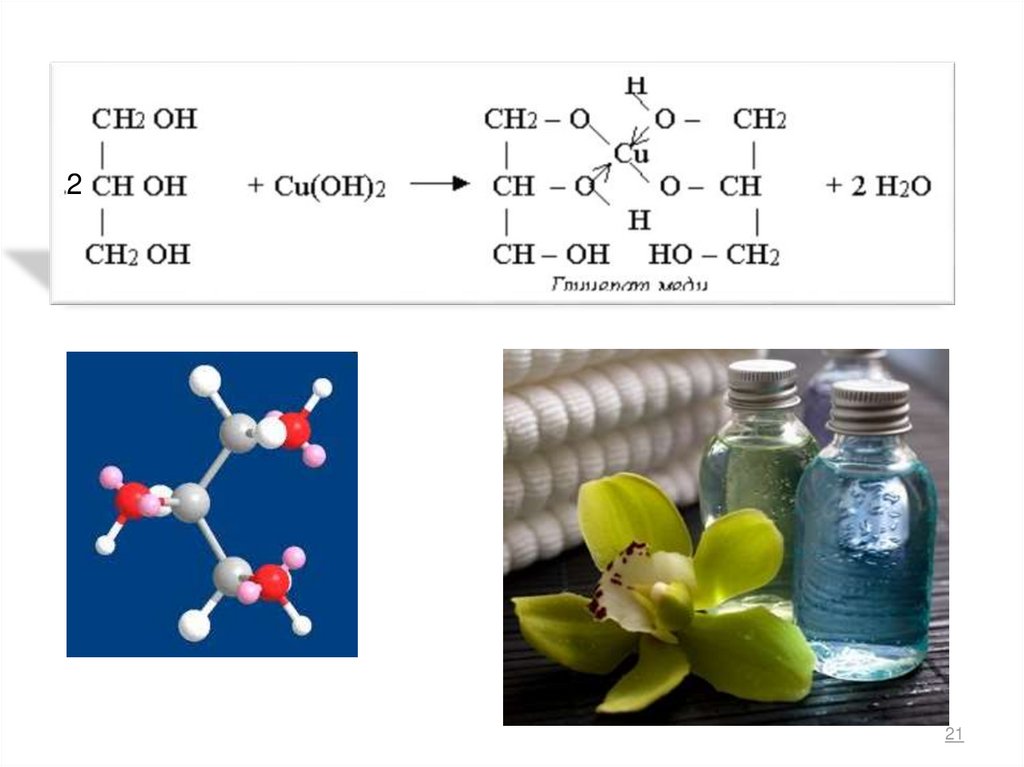
Качественная реакция на многоатомные спирты – реакция с
Cu(OH)2- образование синего комплекса Cu(II).
2
CH2
OH
CH2
+ Cu(OH)2+ 2 NaOH
OH
CH2
-4H2O Na2 CH2
O
O
CH2
O
CH2
Cu
O
-I эфф.
синее окрашивание
20
21.
221
22.
3) Многоатомные спиртыНакопление ОН групп ведет к появлению сладкого вкуса:
CH2
CH
CH
CH
CH2
OH
OH
OH
OH
OH
ксилит
пентанпентаол-1,2,3,4,5
CH
CH2 CH
CH CH
CH CH
CH
CH
CH
CH
CH2
CH2
OH OH
OH OH
OH OH
OH
OH
OH
OH
OH
OH
OH
гексангексаол-1,2,3,4,5,6
сорбит
Ксилит и сорбит – это заменители сахара,
используются при заболевании
сахарным диабетом.
22
23.
2324. 4.Многоатомный циклический спирт - Инозит
циклогексангексаол шестиатомный спирт.Из 9 возможных
стереоизомеров
инозита свойствами
витамина обладает
только мезоинозит.
24
25.
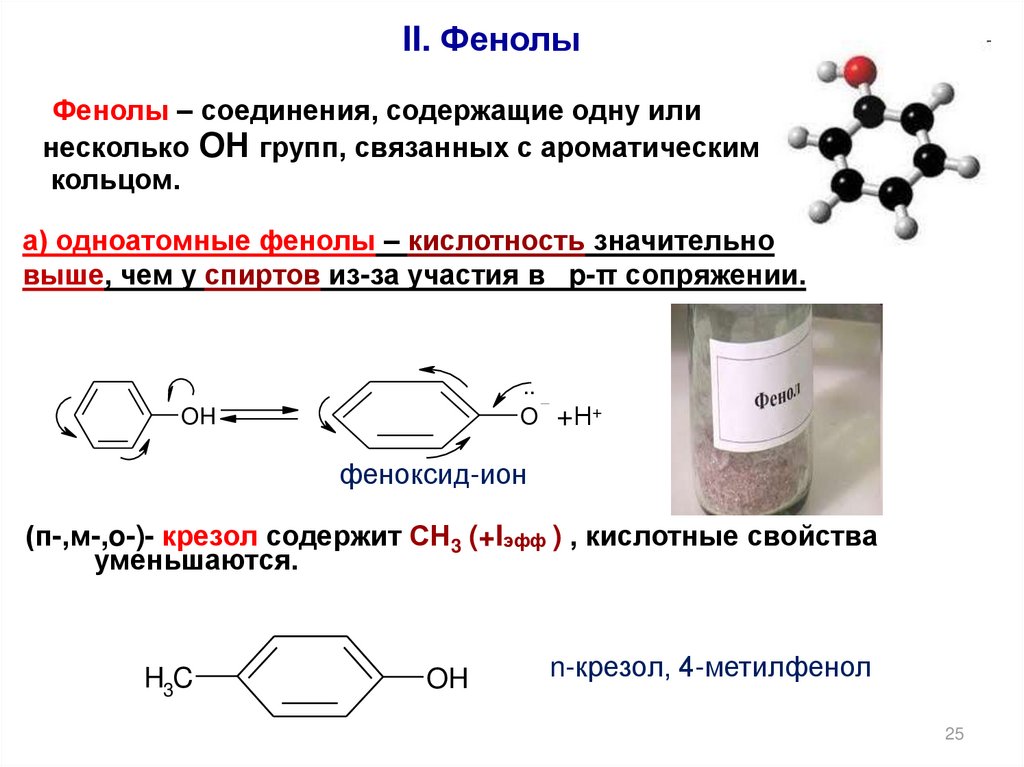
II. ФенолыФенолы – соединения, содержащие одну или
несколько ОН групп, связанных с ароматическим
кольцом.
а) одноатомные фенолы – кислотность значительно
выше, чем у спиртов из-за участия в p-π сопряжении.
..
O
OH
+Н+
феноксид-ион
(п-,м-,o-)- крезол содержит СН3 (+Iэфф ) , кислотные свойства
уменьшаются.
H3C
OH
n-крезол, 4-метилфенол
25
26.
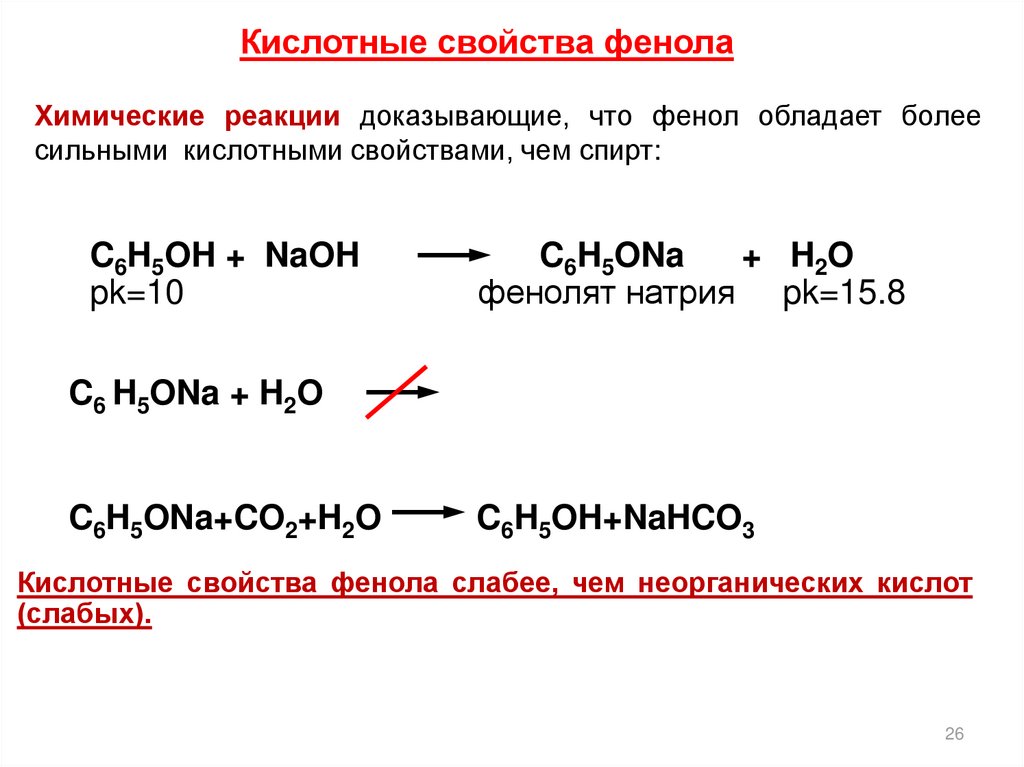
Кислотные свойства фенолаХимические реакции доказывающие, что фенол обладает более
сильными кислотными свойствами, чем спирт:
C6H5OH + NaOH
pk=10
C6H5ONa
+ H2O
фенолят натрия pk=15.8
C6 H5ONa + H2O
C6H5ONa+CO2+H2O
C6H5OH+NaHCO3
Кислотные свойства фенола слабее, чем неорганических кислот
(слабых).
26
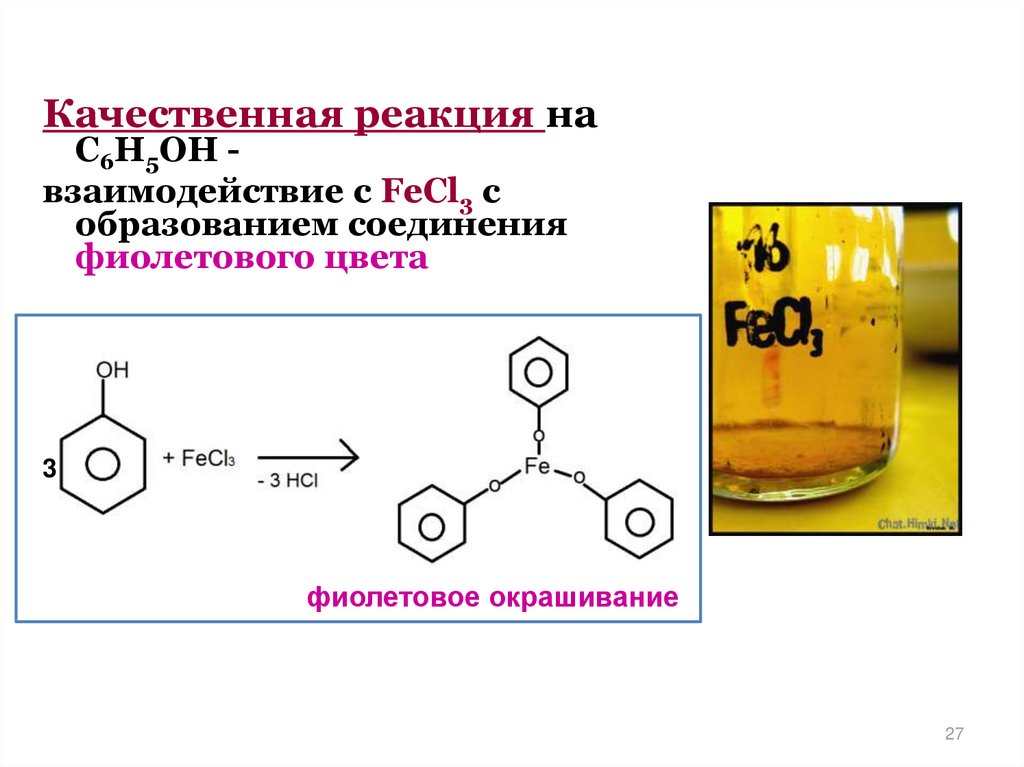
27.
Качественная реакция наС6Н5ОН взаимодействие с FeCl3 с
образованием соединения
фиолетового цвета
3
фиолетовое окрашивание
27
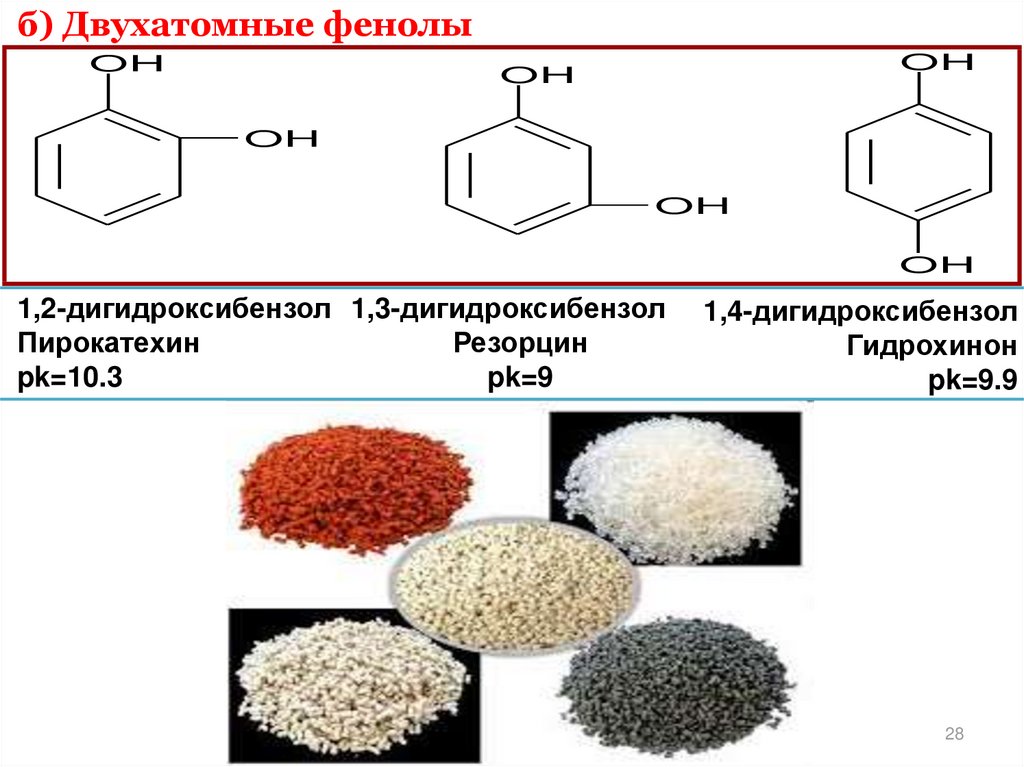
28.
б) Двухатомные фенолыOH
OH
OH
OH
OH
OH
1,2-дигидроксибензол 1,3-дигидроксибензол
Пирокатехин
Резорцин
pk=10.3
pk=9
1,4-дигидроксибензол
Гидрохинон
pk=9.9
28
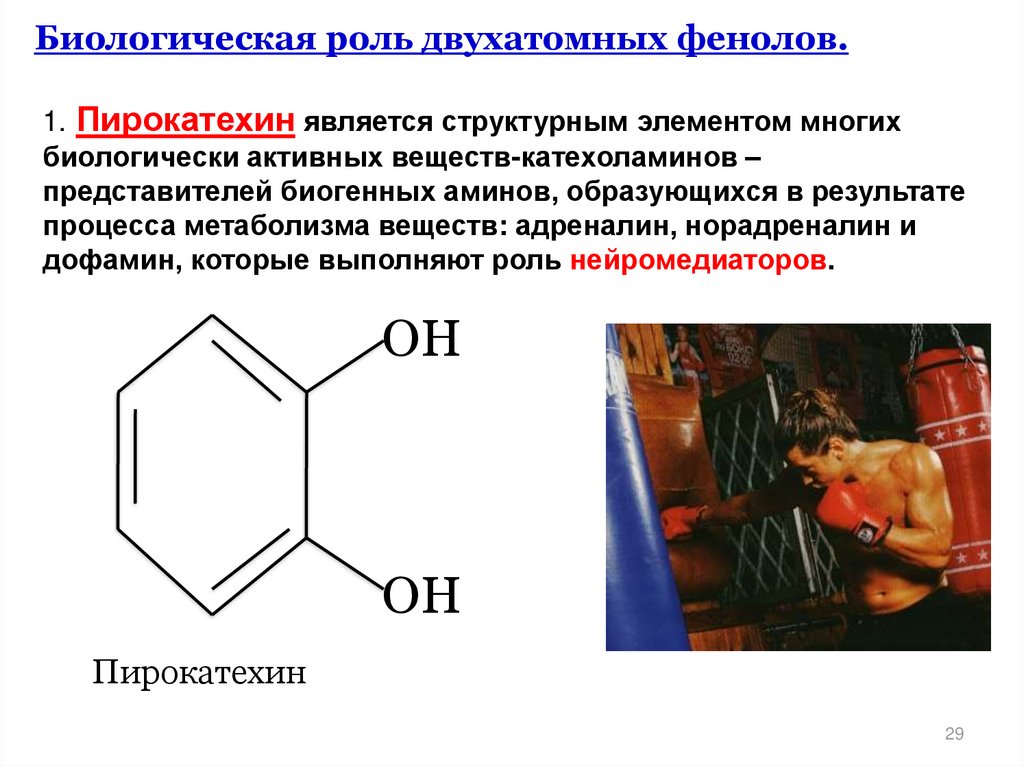
29.
Биологическая роль двухатомных фенолов.1. Пирокатехин является структурным элементом многих
биологически активных веществ-катехоламинов –
представителей биогенных аминов, образующихся в результате
процесса метаболизма веществ: адреналин, норадреналин и
дофамин, которые выполняют роль нейромедиаторов.
ОН
ОН
Пирокатехин
29
30.
Адреналин – гормон мозгового веществанадпочечников, гормон страха.
Интересно, что лишь левовращающий (природный) адреналин
обладает биологической активностью, тогда как
правовращающий биологически неактивен
30
31.
2.Резорцин – используется в составе мазей или примочек прикожных заболеваниях.
31
32.
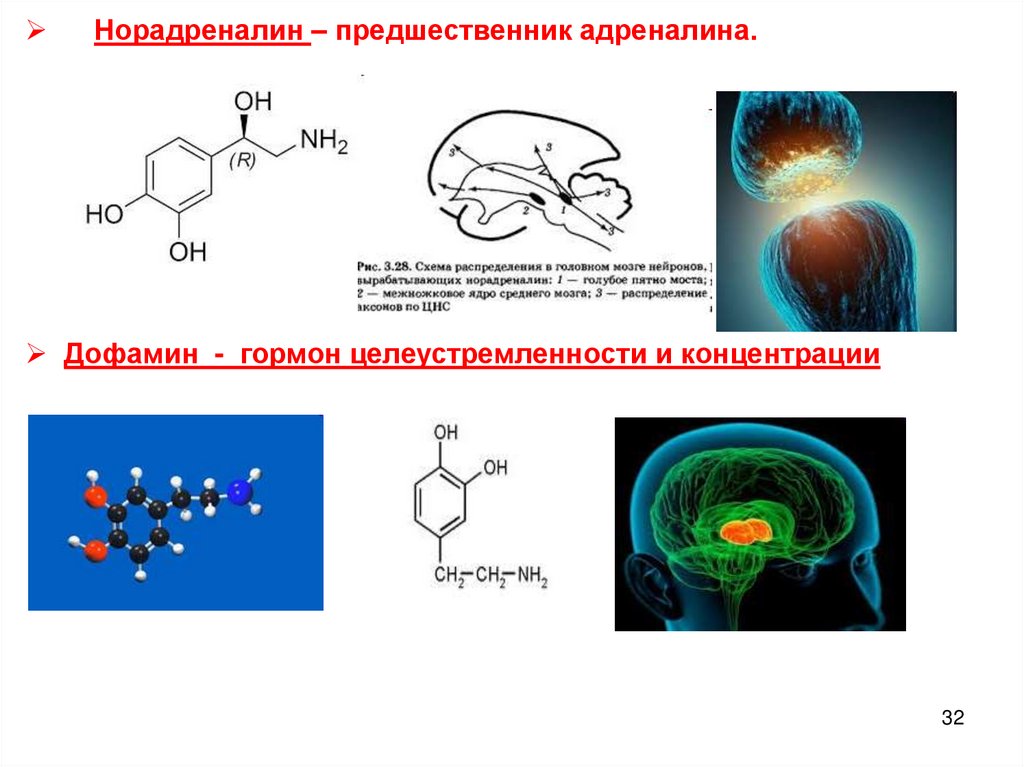
Норадреналин – предшественник адреналина.Дофамин - гормон целеустремленности и концентрации
32
33.
3.Гидрохинон – биологическая роль связана с окислительновосстановительными свойствами,окисленная форма (хинон)
и восстановленная (гидрохинон) входят в состав убихинонов.
Убихиноны присутствуют в липидной фазе всех
клеточных мембран и принимают участие в
окислительно-восстановительных процессах,
сопровождающихся переносом электронов
O
O
OH
+
-2e
-2 H
+
+2 H
OH
гидрохинон
+2e
O
O
хинон
33
34.
3435.
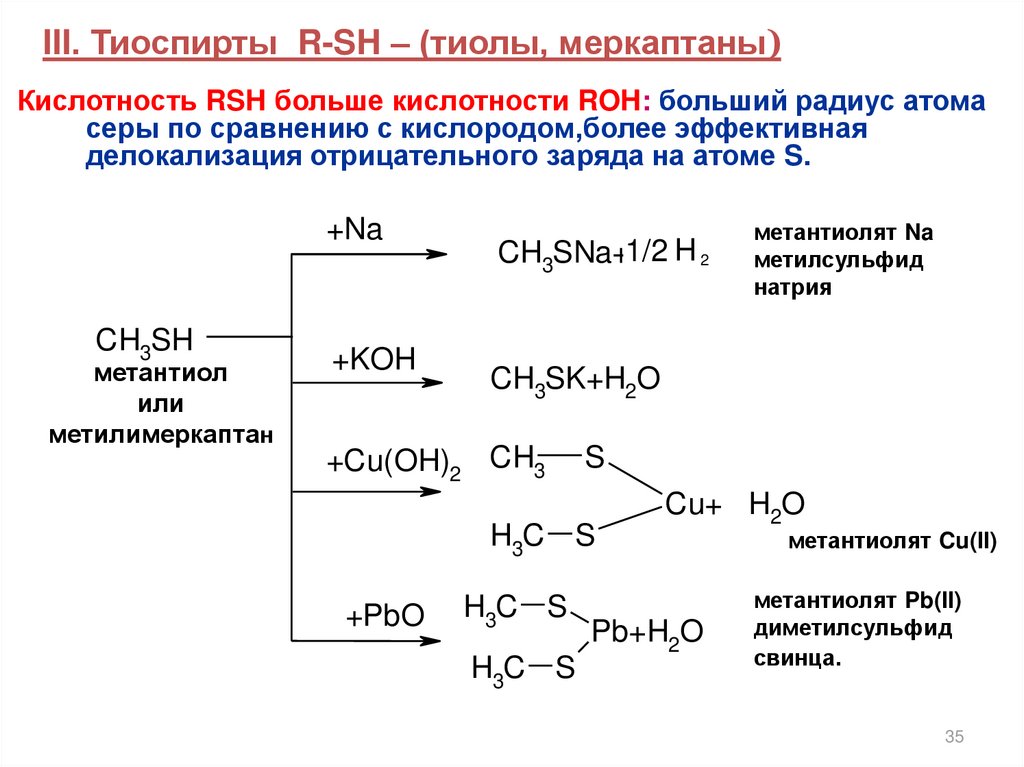
III. Тиоспирты R-SH – (тиолы, меркаптаны)Кислотность RSH больше кислотности ROH: больший радиус атома
серы по сравнению с кислородом,более эффективная
делокализация отрицательного заряда на атоме S.
+Na
CH3SH
метантиол
или
метилимеркаптан
+KOH
CH3SNa+1/2 H 2
CH3SK+H2O
+Cu(OH)2 CH3
S
H3C S
+PbO
метантиолят Na
метилсульфид
натрия
H3C S
H3C S
Cu+ H2O
Pb+H2O
метантиолят Cu(II)
метантиолят Pb(II)
диметилсульфид
свинца.
35
36.
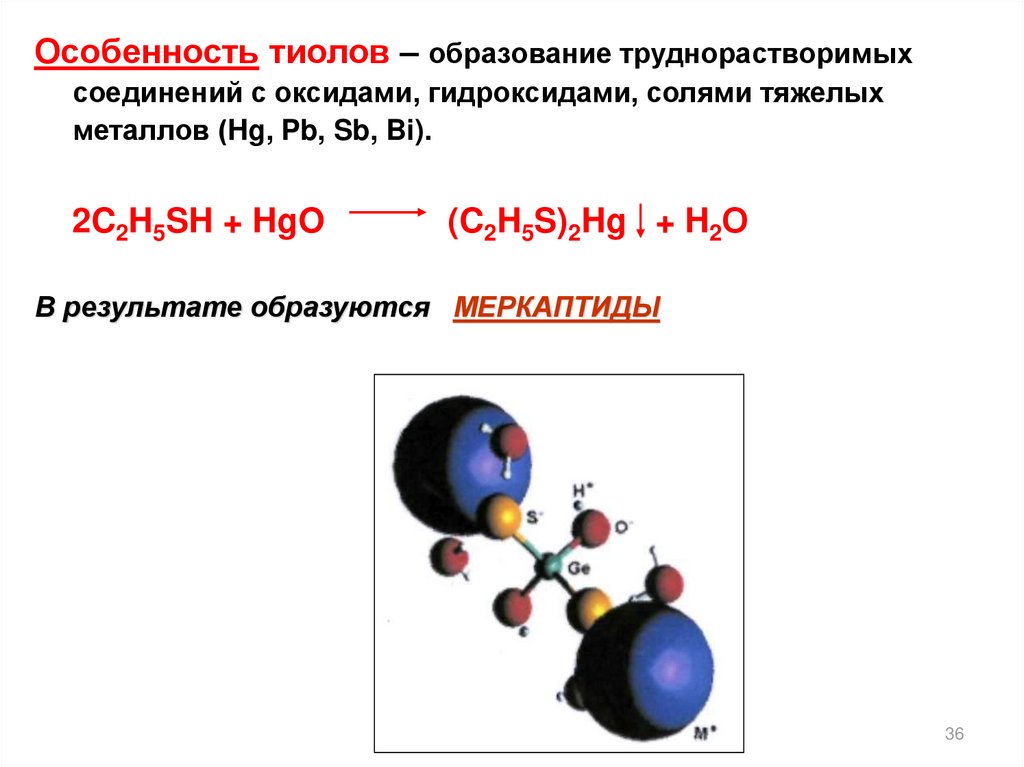
Особенность тиолов – образование труднорастворимыхсоединений с оксидами, гидроксидами, солями тяжелых
металлов (Hg, Pb, Sb, Bi).
2C2H5SH + HgO
(C2H5S)2Hg + H2О
В результате образуются МЕРКАПТИДЫ
36
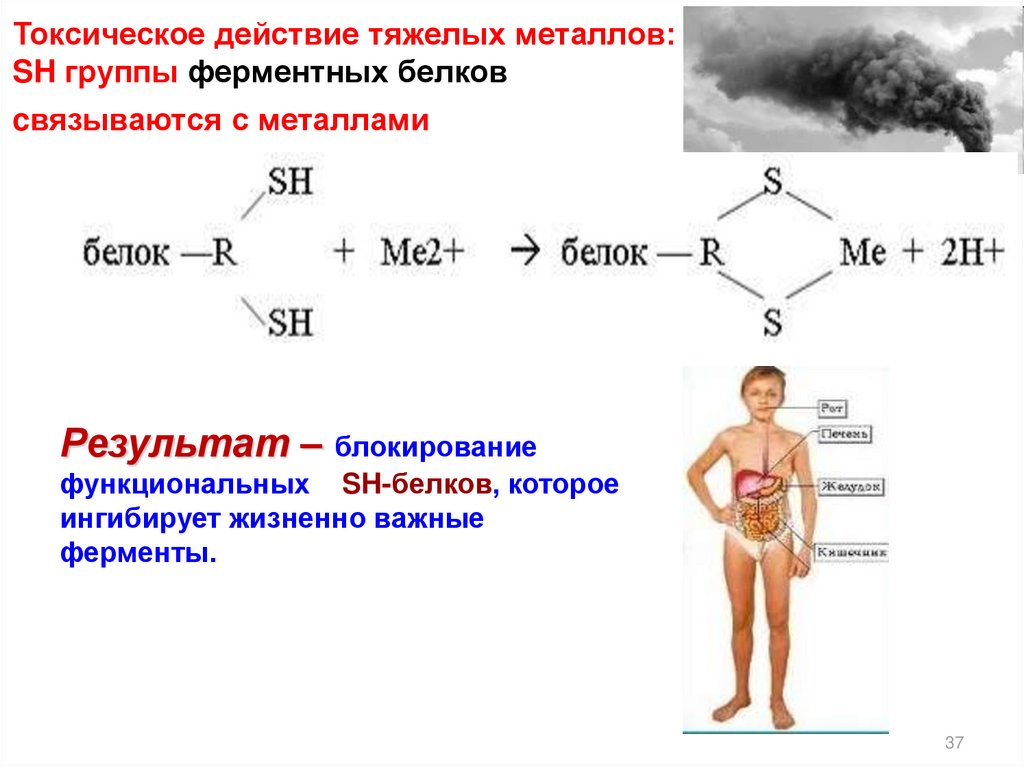
37. Токсическое действие тяжелых металлов: SH группы ферментных белков cвязываются с металлами
Результат – блокированиефункциональных SH-белков, которое
ингибирует жизненно важные
ферменты.
37
38.
Антидоты – противоядия – содержат несколько SH групп, которыеобразуют более прочные растворимые комплексы с тяжелыми
металлами, связывают свободный яд и освобождают
инактивированный фермент.
38
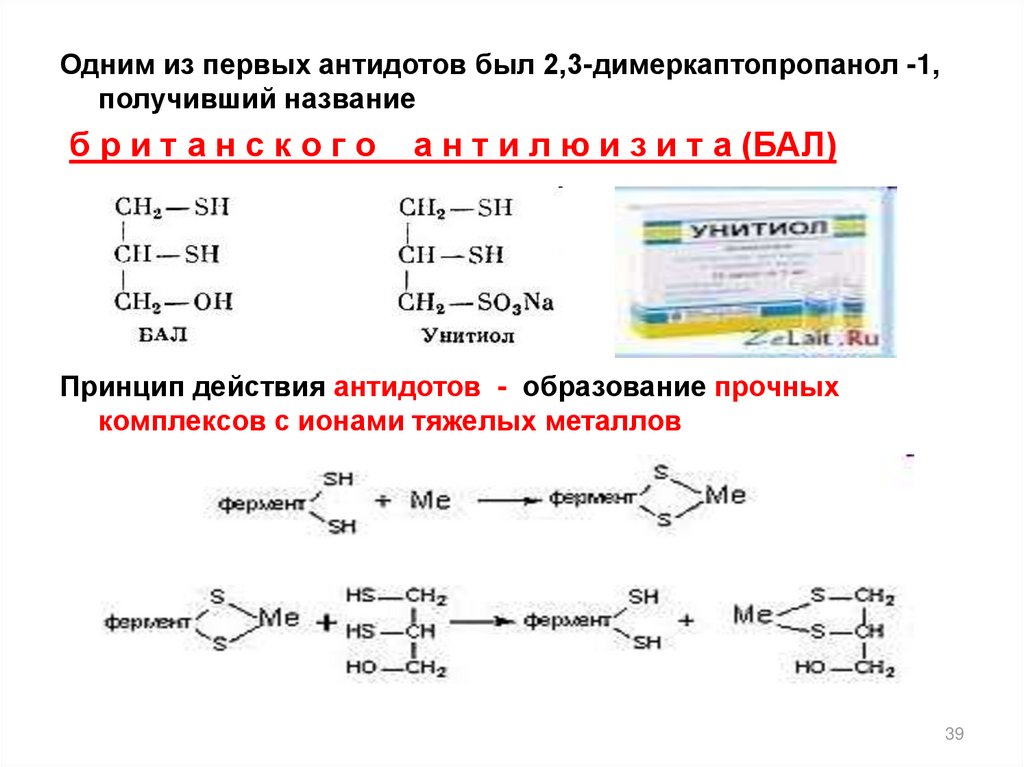
39.
Одним из первых антидотов был 2,3-димеркаптопропанол -1,получивший название
британского
а н т и л ю и з и т а (БАЛ)
Принцип действия антидотов - образование прочных
комплексов с ионами тяжелых металлов
39
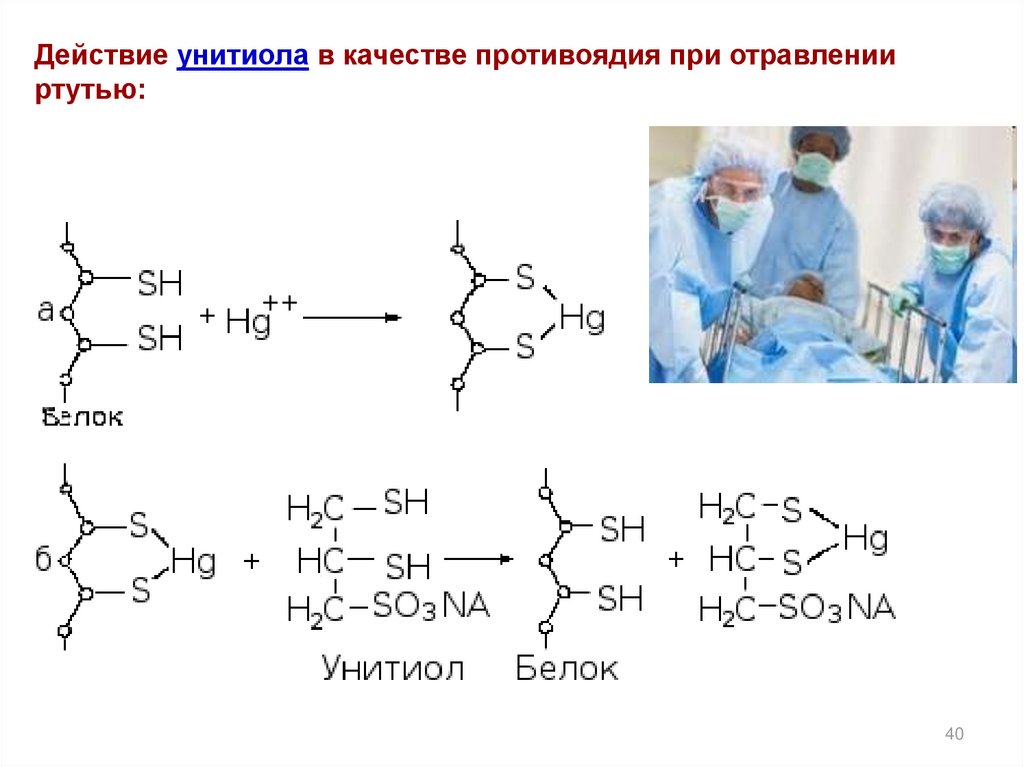
40. Действие унитиола в качестве противоядия при отравлении ртутью:
4041.
Классификация антидотовАнтидоты химического действия
обезвреживают отравляющие вещества в крови и
тканях пострадавшего вследствие нейтрализации ОВ
или образования малотоксических, либо безвредных
веществ.
• Антидоты физико-химического действия включают в себя
обволакивающие и адсорбирующие вещества.
• Антидоты конкурентного действия
непосредственно на отравляющие вещества не
действуют, но вступают с ними в конкурентные
отношения за влияния на реактивные системы
организма.
• Антидоты физиологического действия
вызывают физиологический эффект,
противоположный действию отравляющих
веществ.
41
42.
Наиболее распространенный тиол ворганизме – кофермент А (кофермент
ацилирования, обычно обозначаемый KoASH ).
CH2 CH2
NH2 SH
+ пантотеновая + аденозиндифосфат
кислота
2-аминоэтантиол
KoASH играет важную роль в процессах обмена веществ, в
частности активирует карбоновые кислоты, превращая их в
реакционно-способные сложные эфиры тиолов.
42
43. РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ SN И ЭЛИМИНИРОВАНИЯ E
4344.
Для спиртов характерны:1) кислотные свойства; R – O – H
2) реакции нуклеофильного замещения SN;
R–O–H
3) Реакции элиминирования Е
(дегидратация)
4) Реакции окисления (ОВР).
44
45.
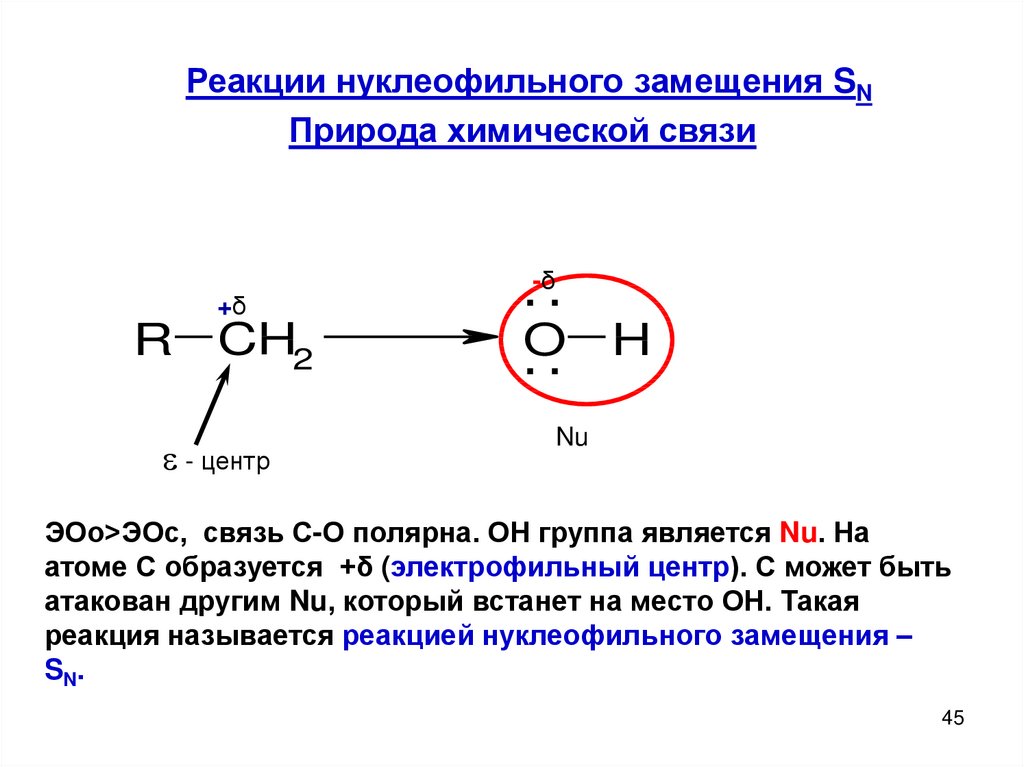
Реакции нуклеофильного замещения SNПрирода химической связи
+δ
R CH2
- центр
.-δ.
.O.
H
Nu
ЭОо>ЭОс, связь С-О полярна. ОН группа является Nu. На
атоме С образуется +δ (электрофильный центр). С может быть
атакован другим Nu, который встанет на место ОН. Такая
реакция называется реакцией нуклеофильного замещения –
SN.
45
46. Реакции SN
• Реакции нуклеофильного замещения SN характерны длясоединений , содержащих нуклеофил Nu,связанный с
атомом углерода С в sp3 гибридизации
ROH - спирты
R-Г – галогенпроизводные
R-SH –тиоспирты
R-NН2 – амины
46
47.
Общая схема SNR – Г + NaOH
H 2O
R – OH + NaГ
• SN1
47
48.
Уходящий анион должен быть более устойчивым, чематакующий!
Самые стабильные анионы – Г-: Cl-, Br-, I-, поэтому в классе RГ
реакции SN – протекают легко:
R – Cl + NaOH
H2O
R – OH + NaCl
Для остальных классов ROH, RSH, RNH2 реакции протекают
трудно, т.к. соединения содержат плохо уходящие группы:
ОН,SH,NH2
48
49. Для протекания реакции SN необходимо из плохо уходящей группы создать хорошо уходящую. Это делается с помощью катализатора
(часто Н+).49
50.
Механизм SN (на примере ROH)CH3
CH3
+δ
CH3
C
H+
-δ
OH
CH3
+ HBr
C
Br
+ H2O
CH3
CH3
- центр
CH3
C
CH3
CH3
CH3
OH + H+
CH3
C
+
O
CH3
H
Kt
CH3
CH3
C
CH3
-H2O
CH3
C+
CH3
устойчивый
карбокатион
CH3
Br
H
Br
50
51.
Субстраты с третичными радикалами (третичные спирты,
третичные галогеналканы) реагируют по SN1, а с первичными по SN2- механизму.
• SN2
Соединения со вторичными радикалами могут реагировать по
любому механизму в зависимости от
природы нуклеофила, уходящей группы и растворителя.
51
52.
Легкость вступления в реакцию SN в классе спиртов:третичные > вторичные > первичные
52
53.
В целом способность вступать в реакцию нуклеофильногозамещения для соединений различных классов меняется в
следующей последовательности:
R – Г > R – OH > R – SH
>
RNH2
Группы SH ,NH2, NHR, NR2 чрезвычайно плохо уходящие
группы.Их нуклеофильное замещение осуществляется
специальными (специфическими )реакциями:
53
54.
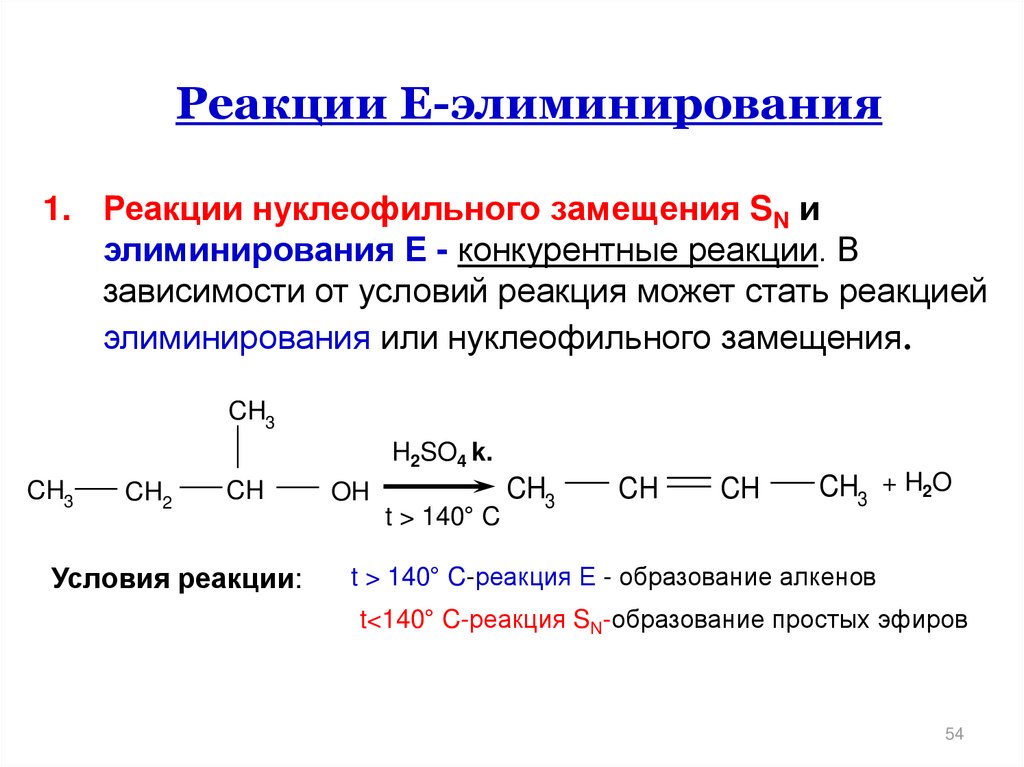
Реакции Е-элиминирования1. Реакции нуклеофильного замещения SN и
элиминирования Е - конкурентные реакции. В
зависимости от условий реакция может стать реакцией
элиминирования или нуклеофильного замещения.
CH3
H2SO4 k.
CH3
CH2
CH
Условия реакции:
OH
t > 140° C
CH3
CH
CH
CH3 + H2O
t > 140° C-реакция Е - образование алкенов
t<140° C-реакция SN-образование простых эфиров
54
55.
Механизм ЕCH3
CH3
CH2
CH
OH
+ H+
(из H2SO4)
+
- H2O
HSO4+
- H2SO4
Отщепление происходит по правилу Зайцева.
Легкость протекания реакции:
третичные > вторичные > первичные спирты
Аналогично реакции Е протекают и в классе
галогенпроизводных. Элиминирование в тиоспиртах, аминах
протекает через образование сульфониевых или аммониевых
катионов.
56.
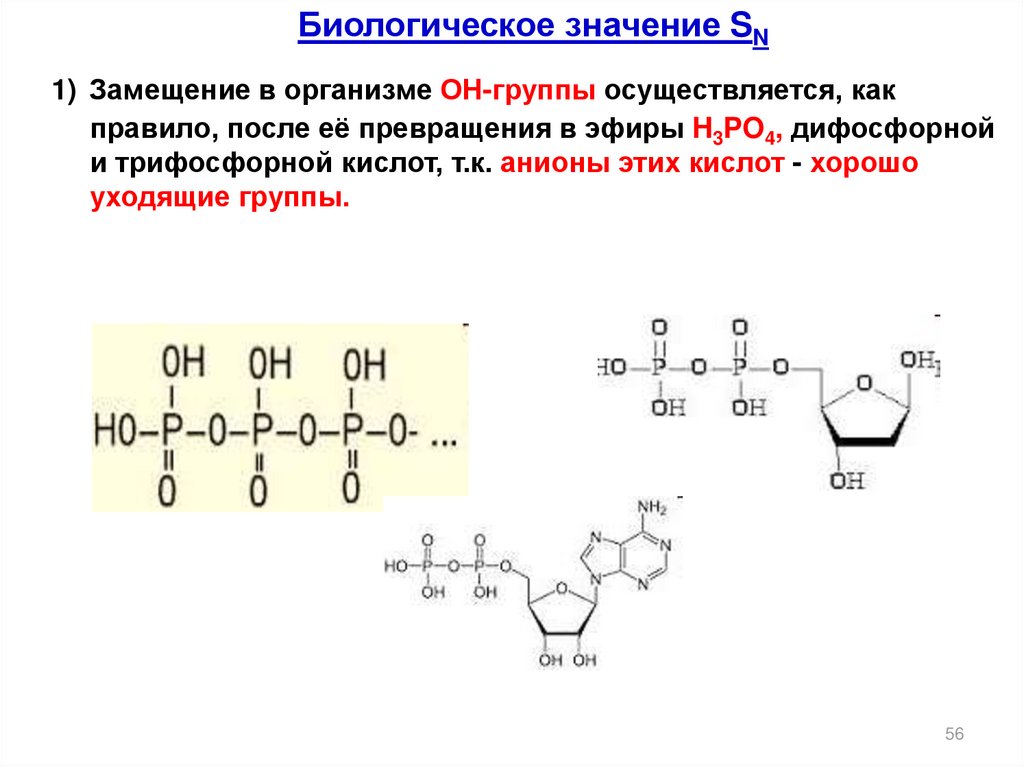
Биологическое значение SN1) Замещение в организме ОН-группы осуществляется, как
правило, после её превращения в эфиры H3PO4, дифосфорной
и трифосфорной кислот, т.к. анионы этих кислот - хорошо
уходящие группы.
56
57.
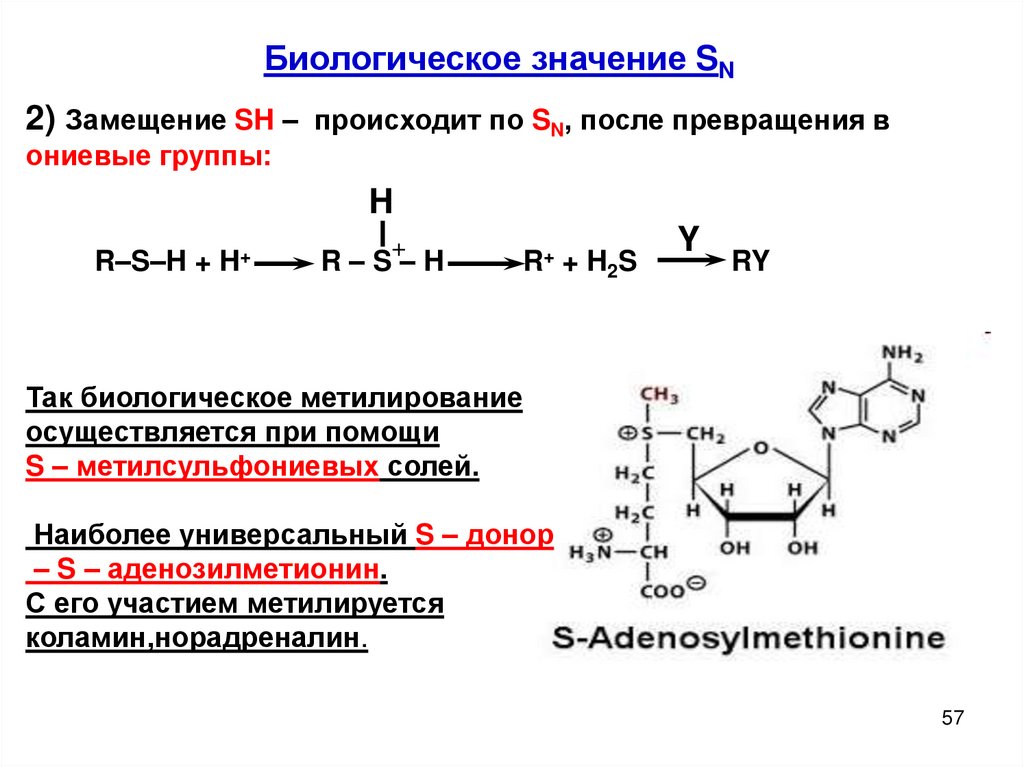
Биологическое значение SN2) Замещение SH – происходит по SN, после превращения в
ониевые группы:
H
R–S–H + H+
+
R–S–H
R+ + H2S
Y
RY
Так биологическое метилирование
осуществляется при помощи
S – метилсульфониевых солей.
Наиболее универсальный S – донор
– S – аденозилметионин.
С его участием метилируется
коламин,норадреналин.
57
58.
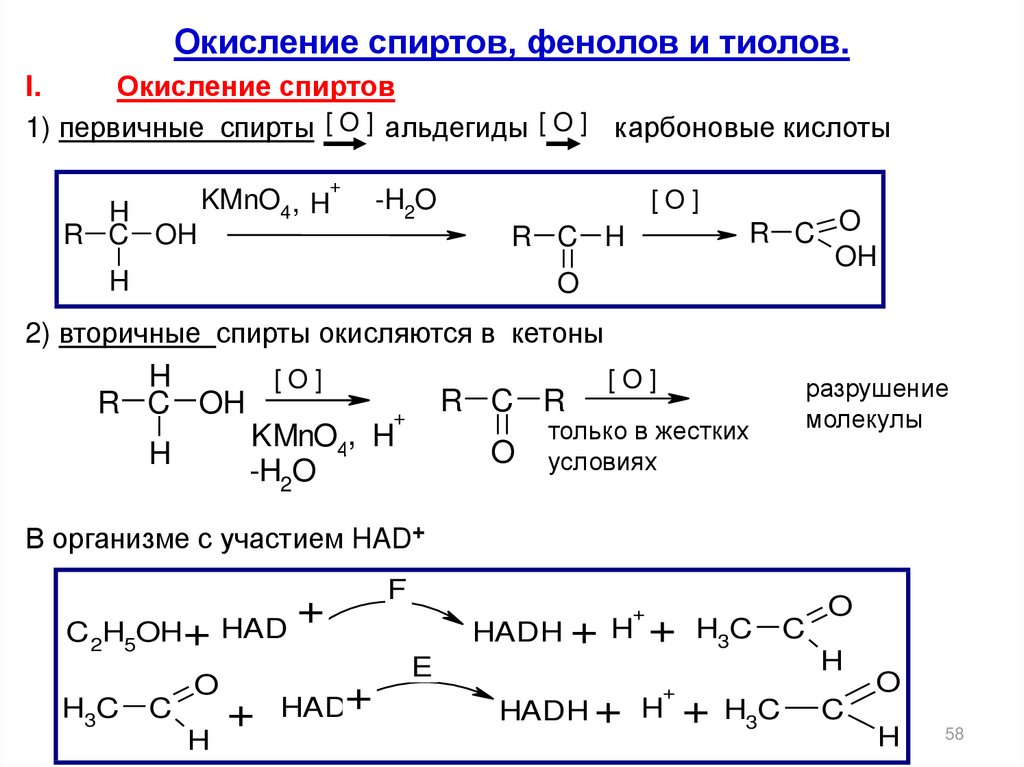
Окисление спиртов, фенолов и тиолов.I.
Окисление спиртов
1) первичные спирты [ O ] альдегиды [ O ] карбоновые кислоты
+
H
R C OH
KMnO4 , H
-H2O
[O]
R C H
H
R C O
OH
O
2) вторичные спирты окисляются в кетоны
H
[O]
R C OH
+
KMnO4, H
H
-H2O
R C R
O
[O]
только в жестких
условиях
разрушение
молекулы
В организме с участием HAD+
C 2H5OH+
H3C
C
O
H
+
HAD
+ HAD+
F
+
HADH + H
+
H3C
E
+
HADH + H
+
H3C
C
O
H
O
C
H
58
59.
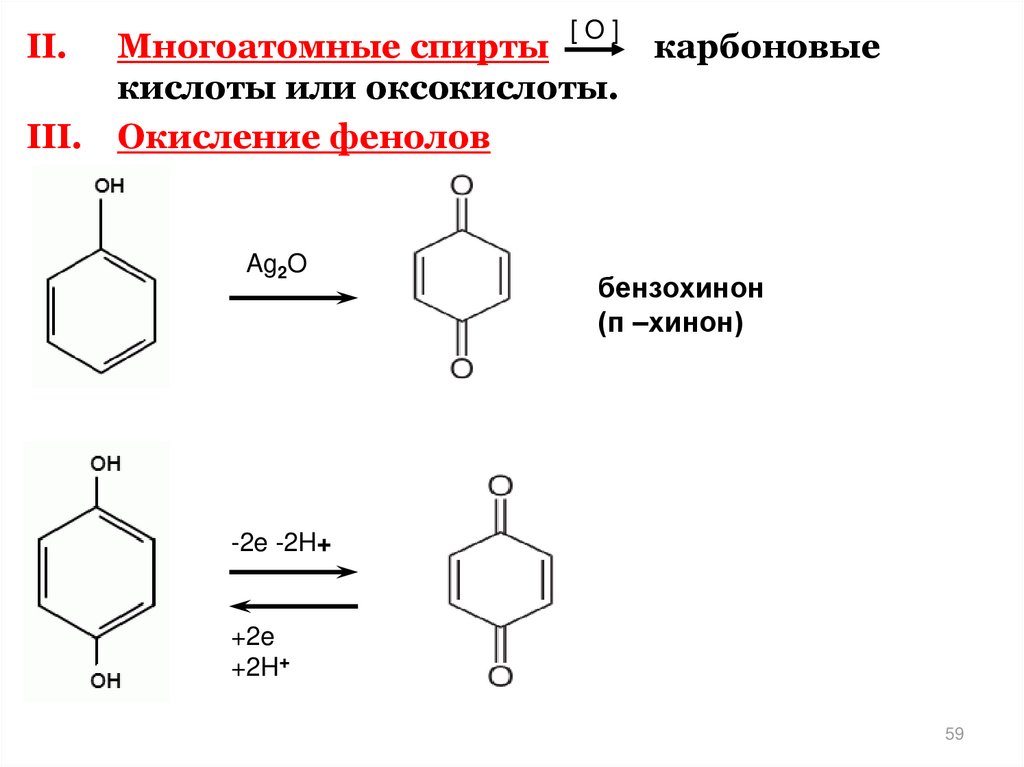
[O]II.
Многоатомные спирты
кислоты или оксокислоты.
III. Окисление фенолов
Ag2O
карбоновые
бензохинон
(п –хинон)
-2e -2H+
+2e
+2H+
59
60.
IV.Окисление S-H.
В организме под влиянием ферментов:
S–H
E
–S–S–
Eсв S-H = 330 кДж/моль, Eсв O-H = 462 кДж/моль
S-H расщепляются даже когда реагируют с мягкими окислителями
(H2O2)
R-S-H + H2O2
[O]
[H]
R-S-S-R
+
H2O
дисульфид
Спирты в аналогичных условиях не окисляются.
В спиртах подвергается окислению более слабая связь C-H, это
приводит к другим продуктам окисления.
[O]
R-S-H
R-SO3H
в жестких
условиях
сульфокислота
60
61. Основность органических соединений. Биологически важные реакции аминов.
6162. Основания Бренстеда
+62
63.
Факторы, влияющие на основностьа) Электроотрицательность элемента
Чем меньше ЭО, тем сильнее основность
б) Размер гетероатома
Чем радиус меньше, тем основность больше
в) Влияние заместителей
ЭД заместители увеличивают основность, ЭА –
уменьшают
г) Влияние сопряжения
Участие в сопряжении ослабляет основность
63
64.
Основные центры в адреналине:CH CH2
H-O
..
N
H
OH
2
H-O
CH3
1-p-основный центр
2,3-оксониевые центры
4-аммониевый центр
4
1
3
Основность этих центров ( с учетом влияния всех факторов)
уменьшается:
4>3>2>1
Основность в ряду соединений различных классов, имеющих
одинаковые
радикалы,
уменьшается
в
следующей
последовательности:
R-NH2 > R-OH > R-SH
! Наиболее сильными органическими основаниями являются
амины.
64
65.
Амины – органические основания.Амины – соединения, которые можно представить как
производные аммиака, полученные заменой атомов Н на
радикал.
65
66.
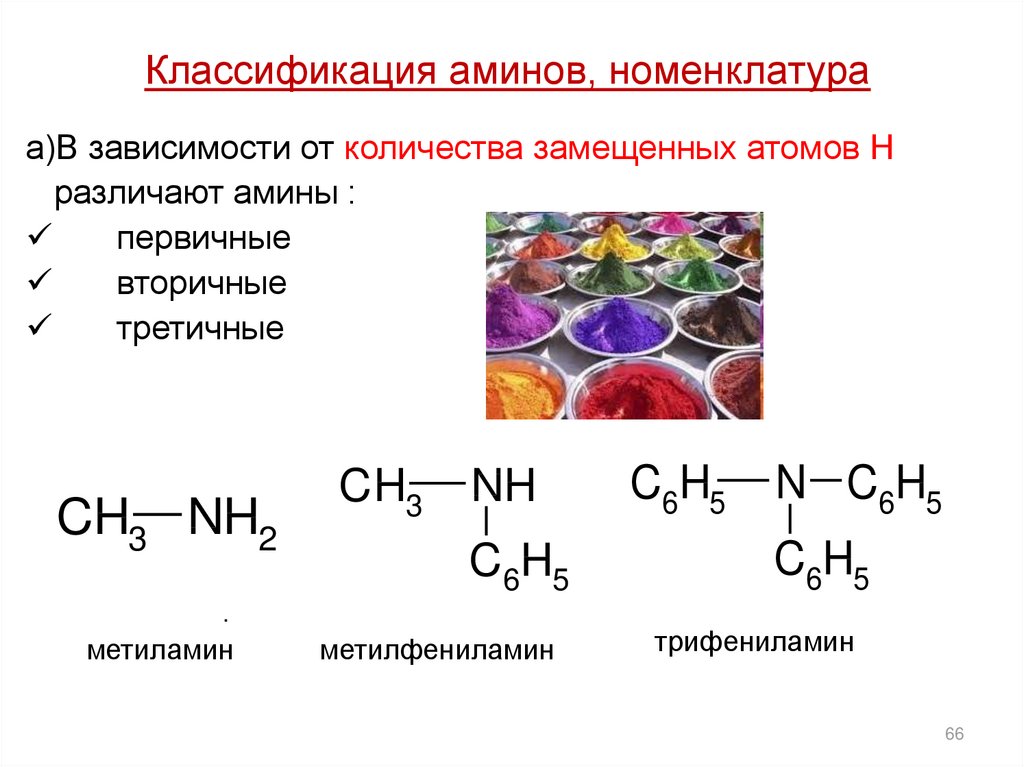
Классификация аминов, номенклатураа)В зависимости от количества замещенных атомов Н
различают амины :
первичные
вторичные
третичные
CH3 NH2
CH3
NH
C6H5
.
метиламин
метилфениламин
C6H5
N C6H5
C6H5
трифениламин
66
67.
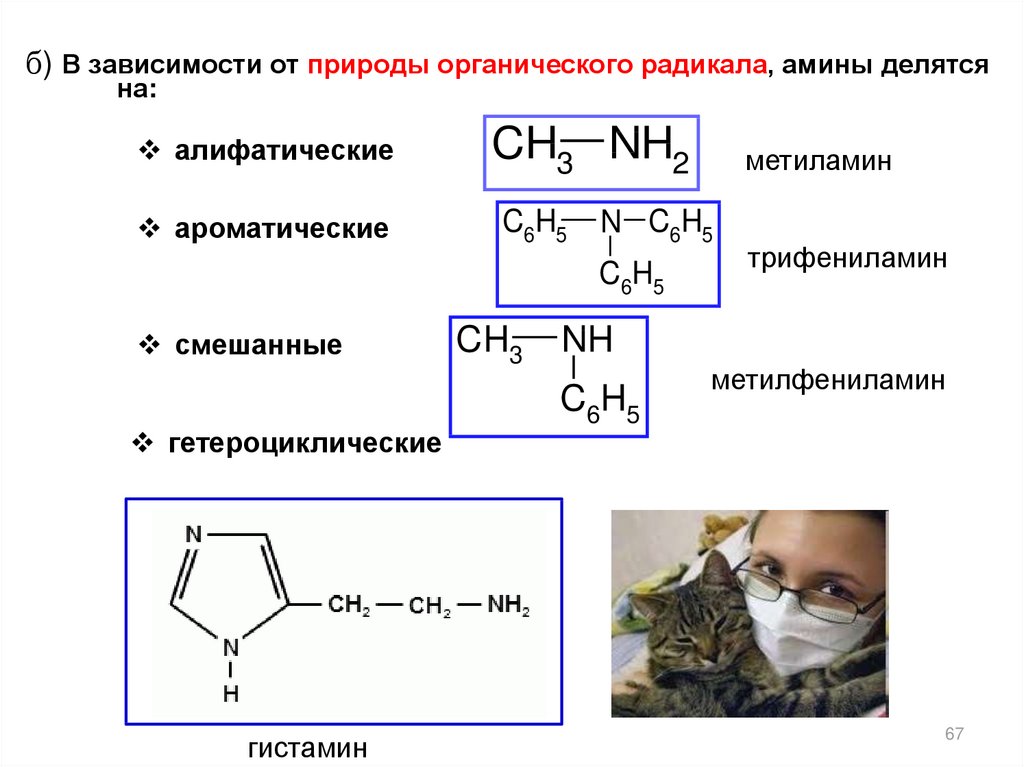
б) В зависимости от природы органического радикала, амины делятсяна:
алифатические
ароматические
CH3 NH2
C6H5
N C6H5
C6H5
смешанные
гетероциклические
гистамин
CH3
метиламин
трифениламин
NH
C6H5
метилфениламин
67
68. Анилин – простейший представитель первичных ароматических аминов:
бесцветная маслянистая жидкость с характерным запахом,малорастворим в воде, ядовит.
68
69.
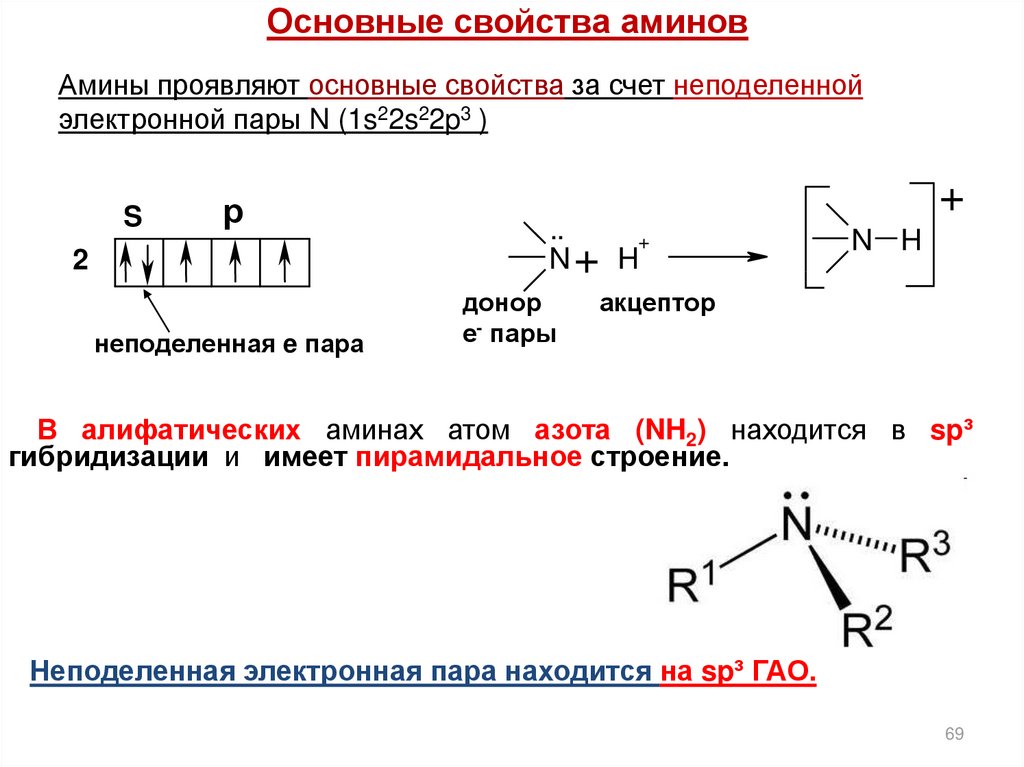
Основные свойства аминовАмины проявляют основные свойства за счет неподеленной
электронной пары N (1s22s22p3 )
S
р
2
неподеленная e пара
..
+
N+ H
донор
е- пары
+
N H
акцептор
В алифатических аминах атом азота (NH2) находится в sp³
гибридизации и имеет пирамидальное строение.
Неподеленная электронная пара находится на sp³ ГАО.
69
70.
! На основность аминов влияют природа радикалов и ихколичество.
70
71.
а) Алифатические амины R-NH2Алкильный радикал R (CH3-, C2H5- и т.д.) обладает
+I
эффектом, повышает электронную плотность на атоме N,
увеличивая основные свойства.
NH3
CH3 NH2
CH3
NH
CH3
pK0=4.75
pK0=3.37
pK0=3.22
Усиление основных свойств алифатических аминов в
водных растворах.
Третичный амин в водном растворе имеет меньшую основность из-за
пространственных факторов и специфической гидратации.
71
72.
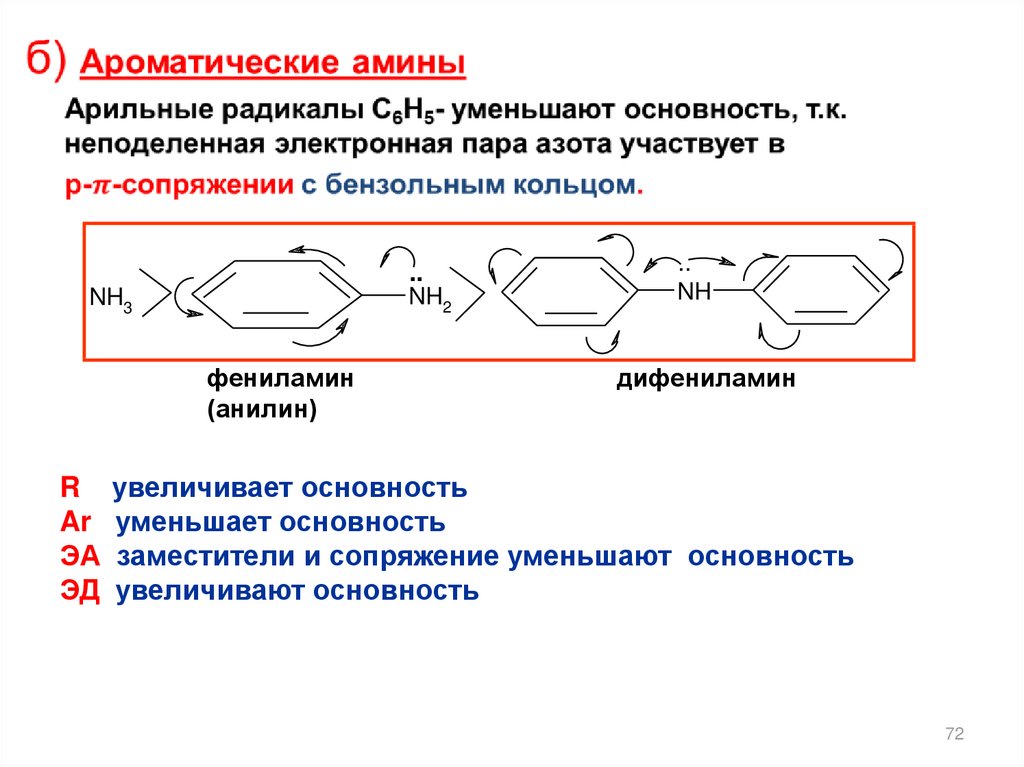
..NH2
NH3
фениламин
(анилин)
R
Ar
ЭА
ЭД
..
NH
дифениламин
увеличивает основность
уменьшает основность
заместители и сопряжение уменьшают основность
увеличивают основность
72
73.
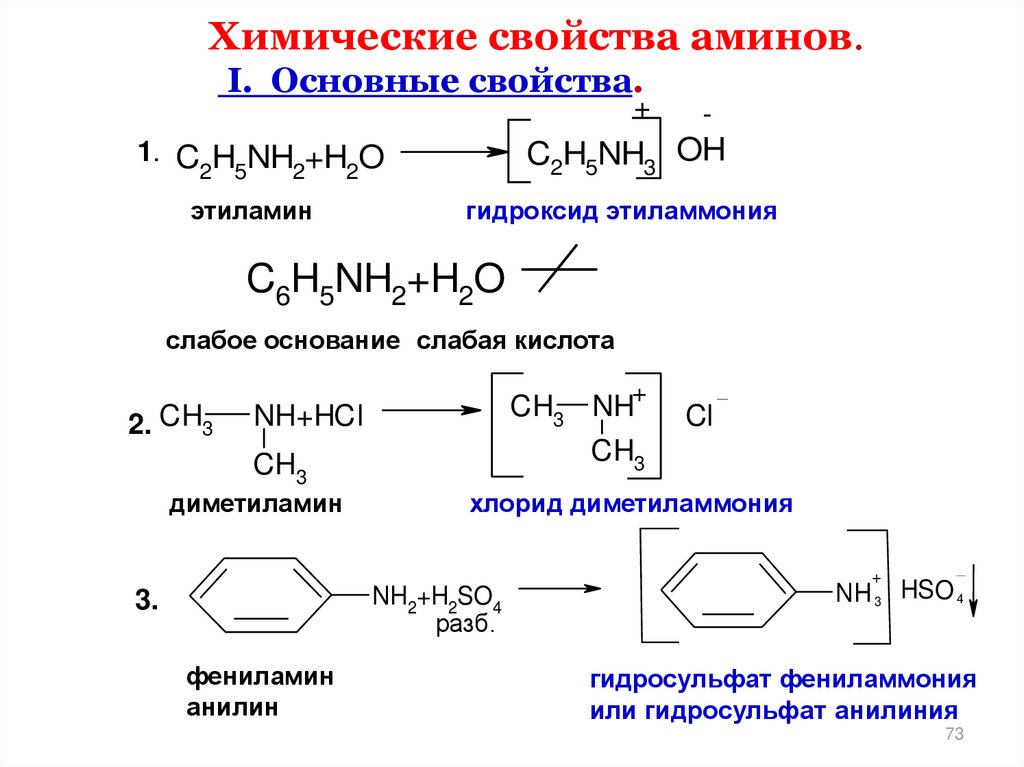
Химические свойства аминов.I. Основные свойства.
+
C2H5NH3 OH
1. C H NH +H O
2 5
2
2
этиламин
-
гидроксид этиламмония
C6H5NH2+H2O
слабое основание слабая кислота
2. CH3
+
CH3 NH
NH+HCl
CH3
CH3
диметиламин
Cl
хлорид диметиламмония
+
NH2+H2SO4
разб.
3.
фениламин
анилин
N H 3 HSO 4
гидросульфат фениламмония
или гидросульфат анилиния
73
74.
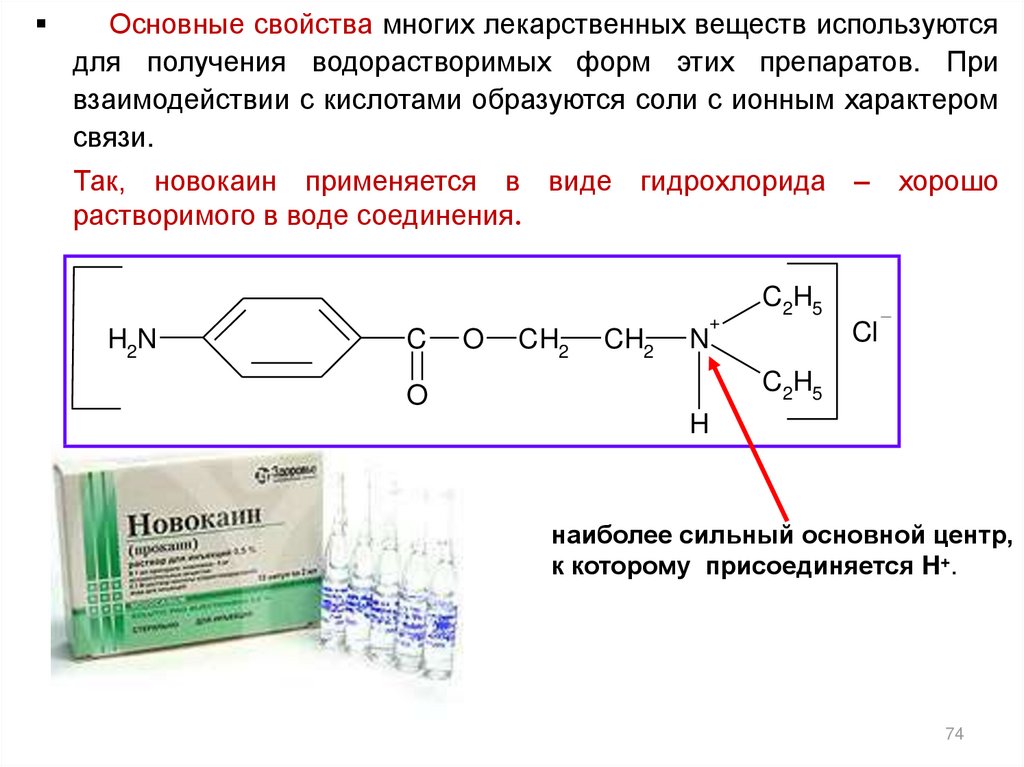
Основные свойства многих лекарственных веществ используютсядля получения водорастворимых форм этих препаратов. При
взаимодействии с кислотами образуются соли с ионным характером
связи.
Так, новокаин применяется в виде гидрохлорида – хорошо
растворимого в воде соединения.
H2N
C
O
CH2
CH2
+
C2H5
Cl
N
C2H5
O
H
наиболее сильный основной центр,
к которому присоединяется H+.
74
75.
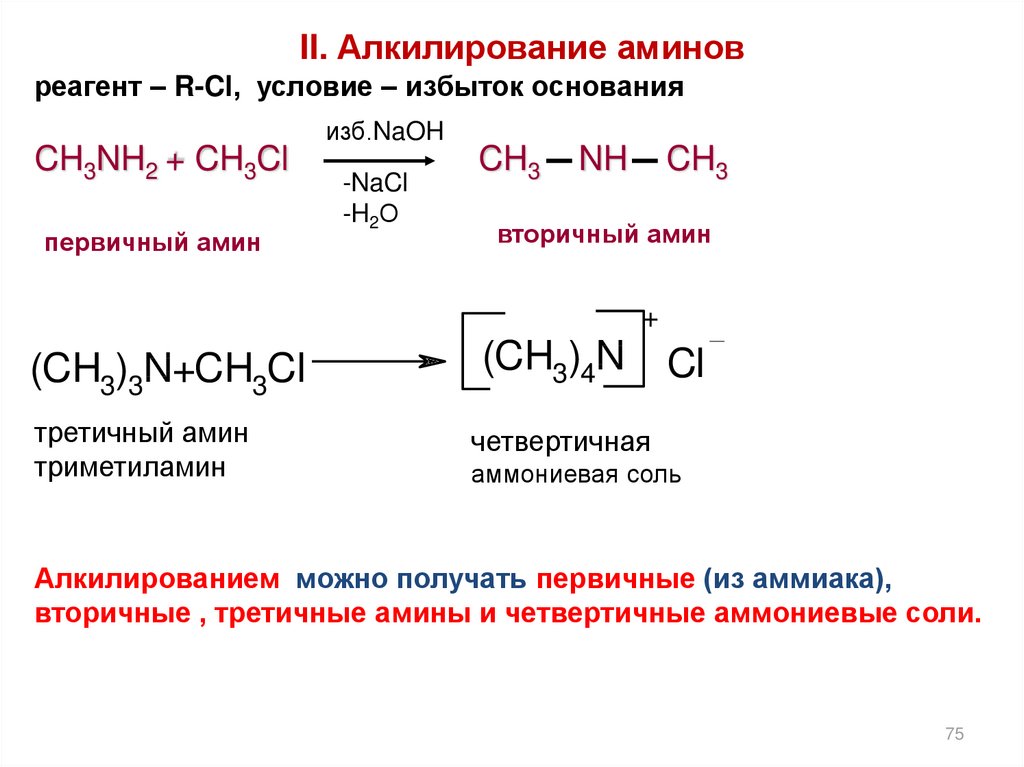
II. Алкилирование аминовреагент – R-Cl, условие – избыток основания
изб.NaOH
CH3NH2 + CH3Cl
первичный амин
-NaCl
-H2О
CH3
NH
CH3
вторичный амин
+
(CH3)3N+CH3Cl
третичный амин
триметиламин
(CH3)4N
Cl
четвертичная
аммониевая соль
Алкилированием можно получать первичные (из аммиака),
вторичные , третичные амины и четвертичные аммониевые соли.
75
76.
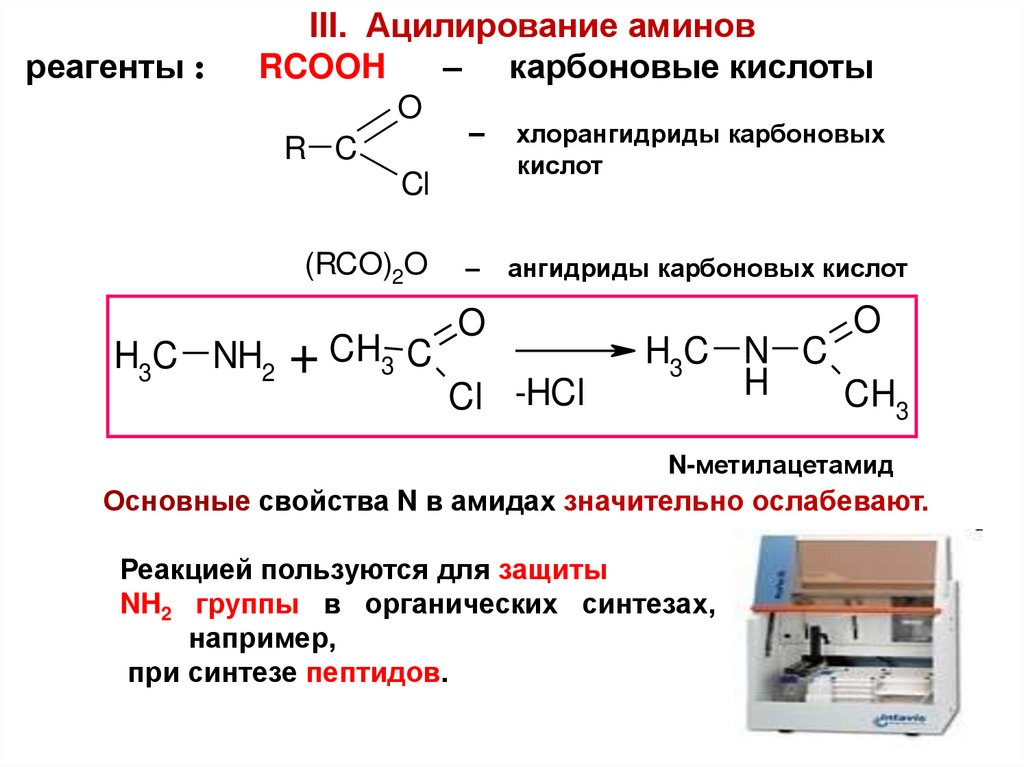
реагенты :III. Ацилирование аминов
RCOOH
– карбоновые кислоты
O
R C
–
хлорангидриды карбоновых
кислот
–
ангидриды карбоновых кислот
Cl
(RCO)2O
H3C NH2
+ CH3 C
O
Cl -HCl
O
H3C N C
H
CH3
N-метилацетамид
Основные свойства N в амидах значительно ослабевают.
Реакцией пользуются для защиты
NH2 группы в органических синтезах,
например,
при синтезе пептидов.
76
77.
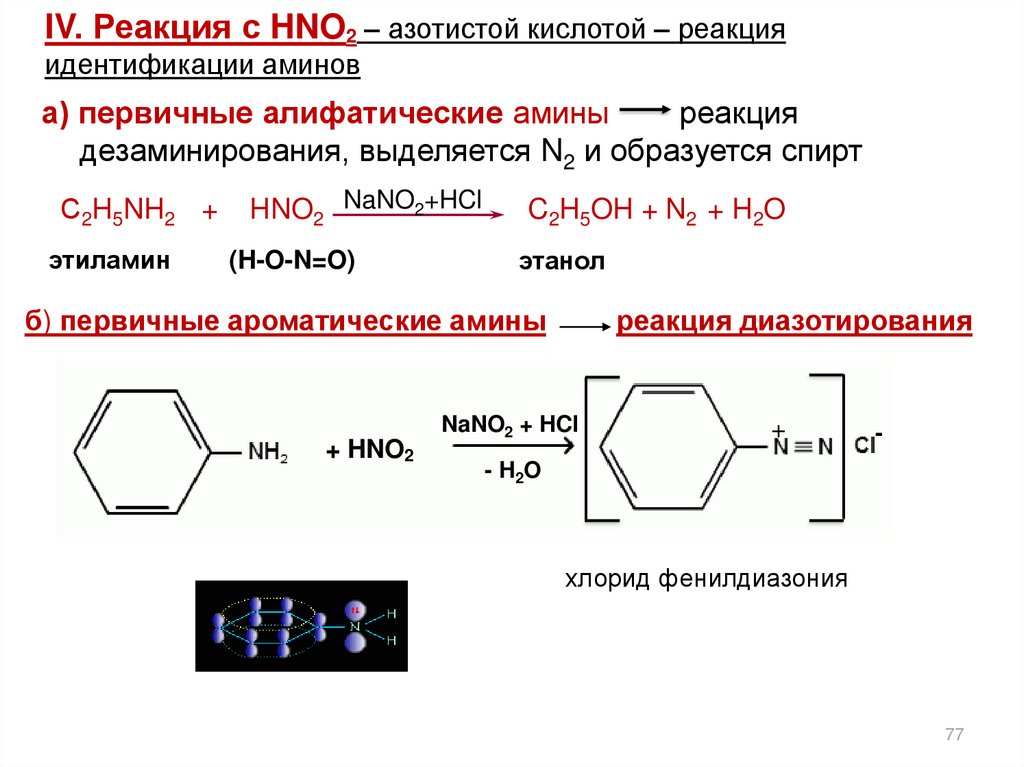
IV. Реакция с HNO2 – азотистой кислотой – реакцияидентификации аминов
а) первичные алифатические амины
реакция
дезаминирования, выделяется N2 и образуется спирт
С2H5NH2 +
этиламин
HNO2 NaNO2+HCl
(H-O-N=O)
C2H5OH + N2 + H2O
этанол
б) первичные ароматические амины
+ HNO2
реакция диазотирования
NaNO2 + HCl
+
-
- H2O
хлорид фенилдиазония
77
78.
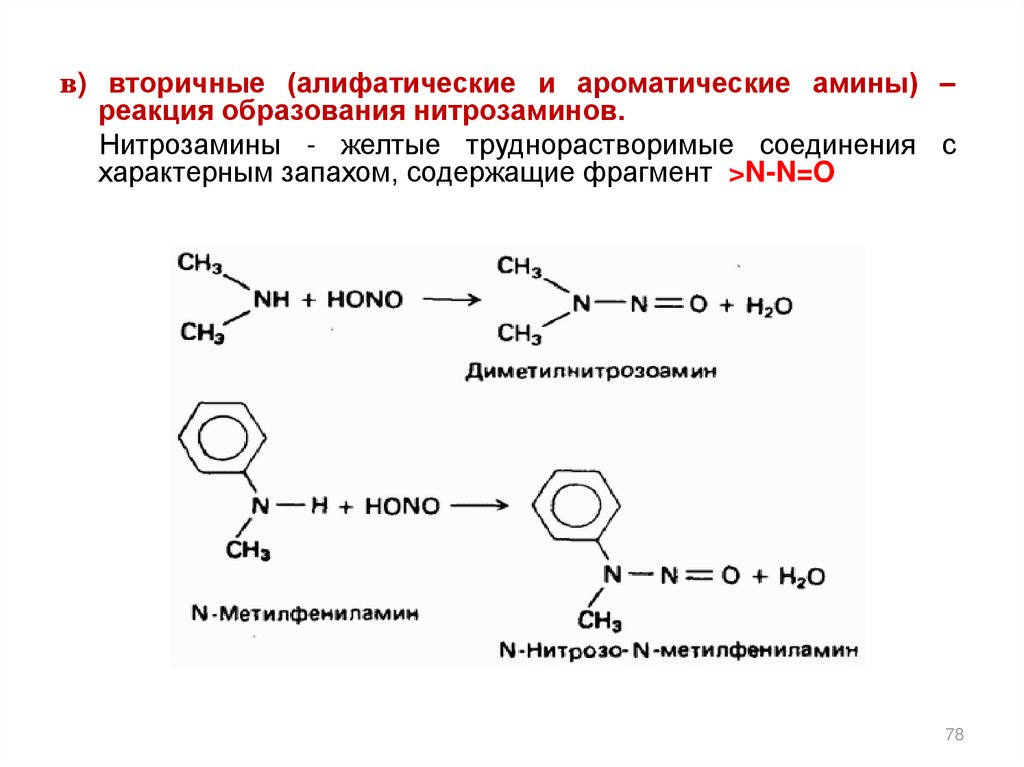
в) вторичные (алифатические и ароматические амины) –реакция образования нитрозаминов.
Нитрозамины - желтые труднорастворимые соединения с
характерным запахом, содержащие фрагмент >N-N=O
78
79.
г) третичные ароматические (или смешанные) амины+
NaNO2 + HCl
-H2О
п-нитрозодиметиланилин
д) третичные алифатические амины
с HNO2 не
взаимодействуют!
осадок зеленого
цвета
+ HNO2
79
80. Получение аминов
1) Из галогенпроизводныхобразуется соль амина, из которой действием щелочи можно выделить
первичный амин (этиламин):
При взаимодействии первичного амина и галогенпроизводного и
последующей обработкой щелочью получают вторичные амины:
Повторение приводит к образованию третичного амина:
81.
2) Получение алифатических и ароматическихвторичных аминов восстановлением
нитросоединений.
Восстановителем является водород «в момент
выделения», который образуется при
взаимодействии, например, цинка со щелочью или
железа с соляной кислотой:
Зинин Николай
Николаевич (1812
– 1880)
Русский химик –
органик, академик. В
1842 году открыл
реакцию
восстановления
ароматических
нитросоединений и
получил анилин,
доказал, что амины –
основания способные
образовывать соли с
различными
кислотами
81
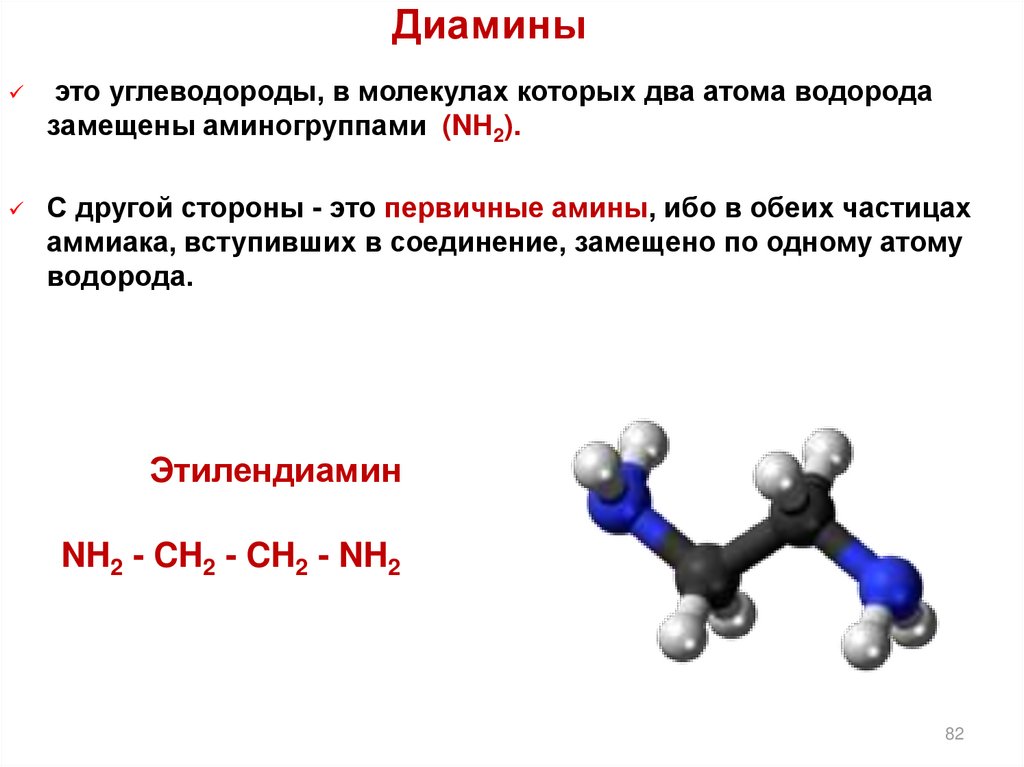
82. Диамины
это углеводороды, в молекулах которых два атома водородазамещены аминогруппами (NН2).
С другой стороны - это первичные амины, ибо в обеих частицах
аммиака, вступивших в соединение, замещено по одному атому
водорода.
Этилендиамин
NH2 - CH2 - CH2 - NH2
82
83. Путресцин H2N(CH2)4NH2
(1,4-диаминобутан или 1,4-тетраметилендиамин)Путресцин образуется при гниении белков из
орнитина (диаминокарбоновая кислота):
NH2-(CH2)3-CH(COOH)-NH2 → NH2-(CH2)4-NH2 + CO2↑
орнитин
путресцин
Путресцин находится в моче при цистинурии и образуется при
гниении мяса (в трупах, вместе с кадаверином) и рыбы (сельди).
Искусственно получается всеми общими способами образования
диаминов.
84. Путресцин H2N(CH2)4NH2
Образуется в толстой кишке при ферментативномдекарбоксилировании.
• Путресцин принимает активное участие в нормальном
росте клеток, их дальнейшей дифференциации.
84
85. Кадаверин
(1,5-диаминопентан или α-,ε- пентаметилендиамин)от лат. cadaver — «труп». Содержится в продуктах гнилостного
распада белков; образуется из лизина при его ферментативном
декарбоксилировании:
NH2-(CH2)4-CH(COOH)-NH2 → NH2-(CH2)5-NH2 +CO2↑
лизин
кадаверин
Кадаверин обладает неприятным запахом и принадлежит к группе
птомаминов (трупных ядов), однако ядовитость кадаверина
относительно невелика.
Птоамины – от греч. ptoma — «труп», группа азотсодержащих
химических соединений, образующихся
при гнилостном разложении, с участием
микроорганизмов, белков мяса, рыбы,
дрожжей и пр.
85
86. Алкалоиды
Гетероциклические, азотсодержащие основаниярастительного происхождения. Как правило представляют
собой третичные амины
! Содержатся в растениях в виде солей органических кислот
– лимонной, яблочной, щавелевой
Эфедрин
Кониин
86
87. Эфедрин Алкалоид, содержащийся в различных видах растений рода эфедра, C6H5CH(OH)CH(NHCH3)CH3. Впервые выделен в 1887. По
действию близок к адреналину.Возбуждает центральную нервную систему.
87
88. Никотин
Алкалоид, содержится, главнымобразом, в листьях и семенах
различных видов табака и
является жидкостью с неприятным
запахом и жгучим вкусом.
88
89. Никотин
Использование в медицинеИсторически никотин часто использовался в медицинских целях.
В настоящее время также разрабатывается использование
никотина для лечения различных заболеваний:
лечение никотиновой зависимости,
в качестве болеутоляющего средства,
от синдрома дефицита внимания,
болезни Альцгеймера,
болезни Паркинсона,
колита, герпеса и туберкулёза
89
90.
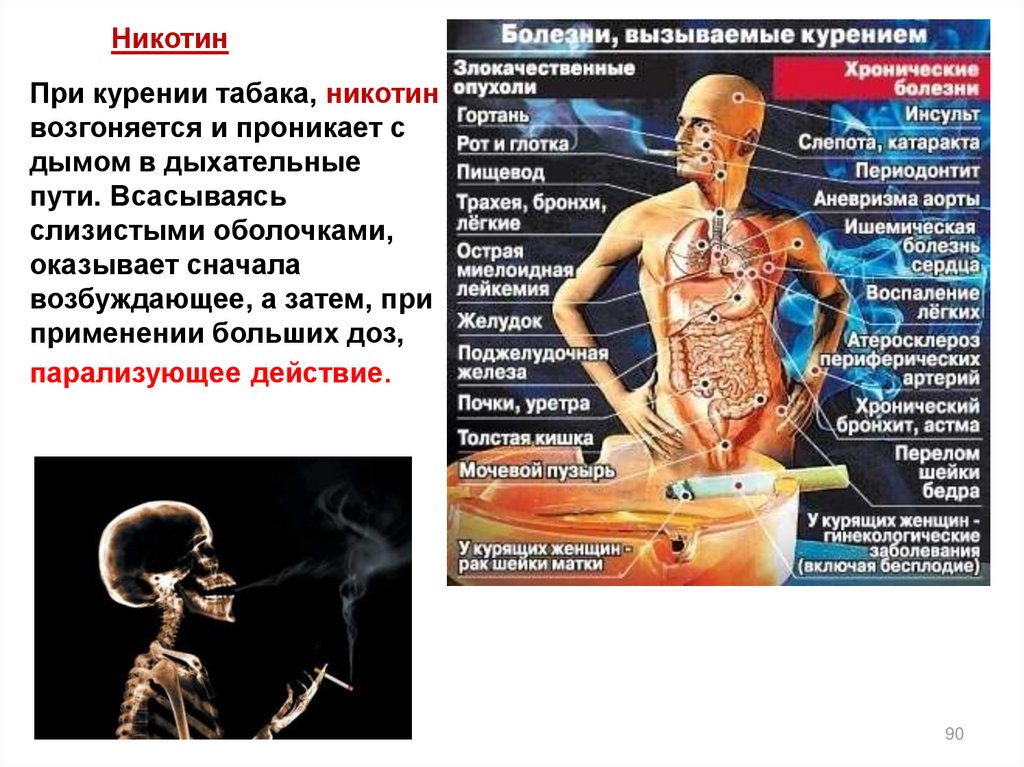
НикотинПри курении табака, никотин
возгоняется и проникает с
дымом в дыхательные
пути. Всасываясь
слизистыми оболочками,
оказывает сначала
возбуждающее, а затем, при
применении больших доз,
парализующее действие.
90
91.
!При длительном
употреблении,
никотин
вызывает
физическую
зависимость- одну из
самых сильных среди
известных наркотиков.
91
92.
Медико – биологическое значение аминов:1. Анилин и его производные используются для синтеза
лекарственных препаратов – сульфаниламидов
Впервые сульфаниламид был синтезирован в 1908 году.
Все сульфаниламиды содержат сульфонамидную группу
SO2NH2. Замена ее на другие группы приводит к потере
антибактериальной активности.
92
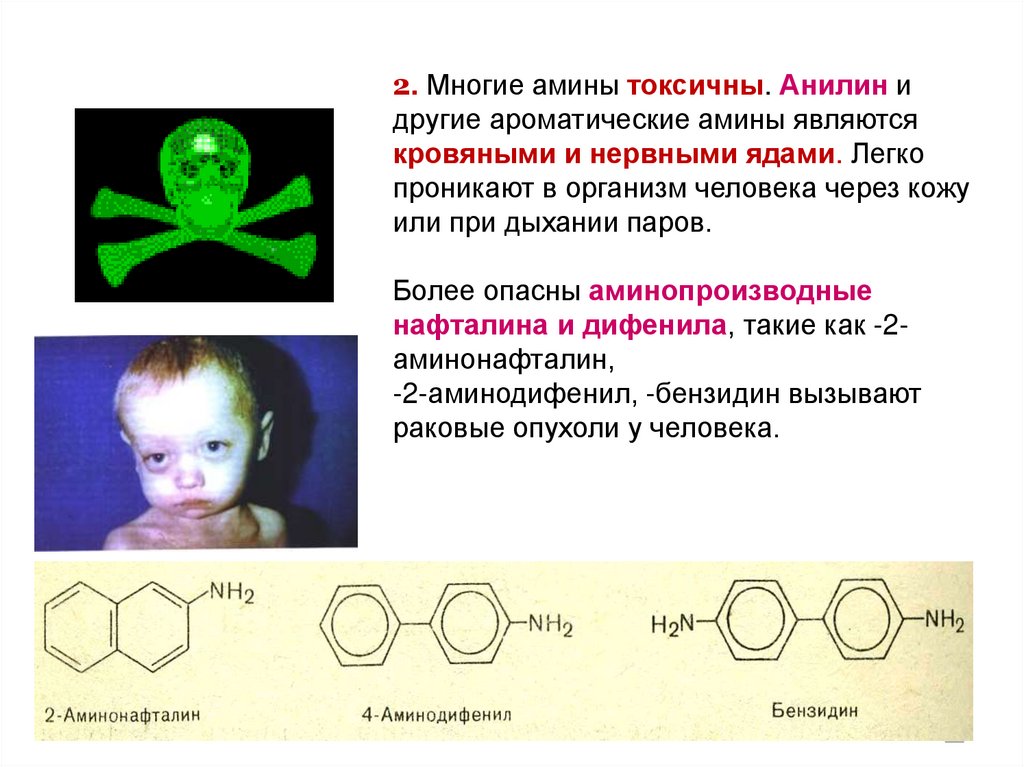
93. 2. Многие амины токсичны. Анилин и другие ароматические амины являются кровяными и нервными ядами. Легко проникают в организм
человека через кожуили при дыхании паров.
Более опасны аминопроизводные
нафталина и дифенила, такие как -2аминонафталин,
-2-аминодифенил, -бензидин вызывают
раковые опухоли у человека.
93
94.
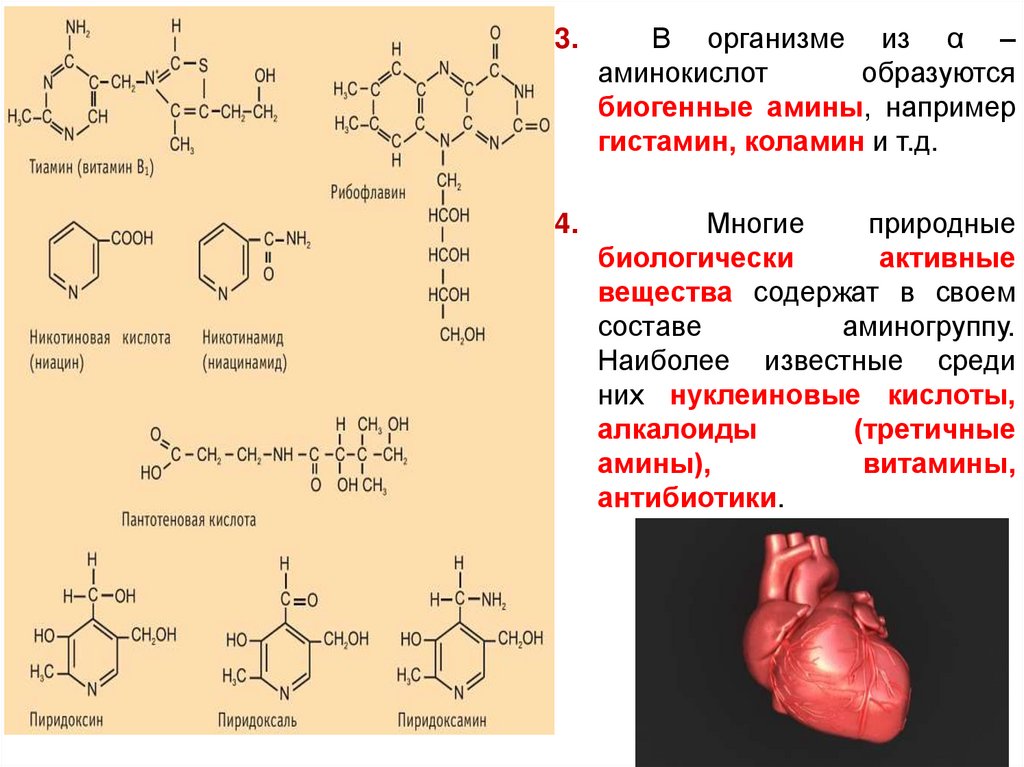
3.В организме из α –
аминокислот
образуются
биогенные амины, например
гистамин, коламин и т.д.
4.
Многие
природные
биологически
активные
вещества содержат в своем
составе
аминогруппу.
Наиболее известные среди
них нуклеиновые кислоты,
алкалоиды
(третичные
амины),
витамины,
антибиотики.
94
95. Аминоспирты и аминофенолы
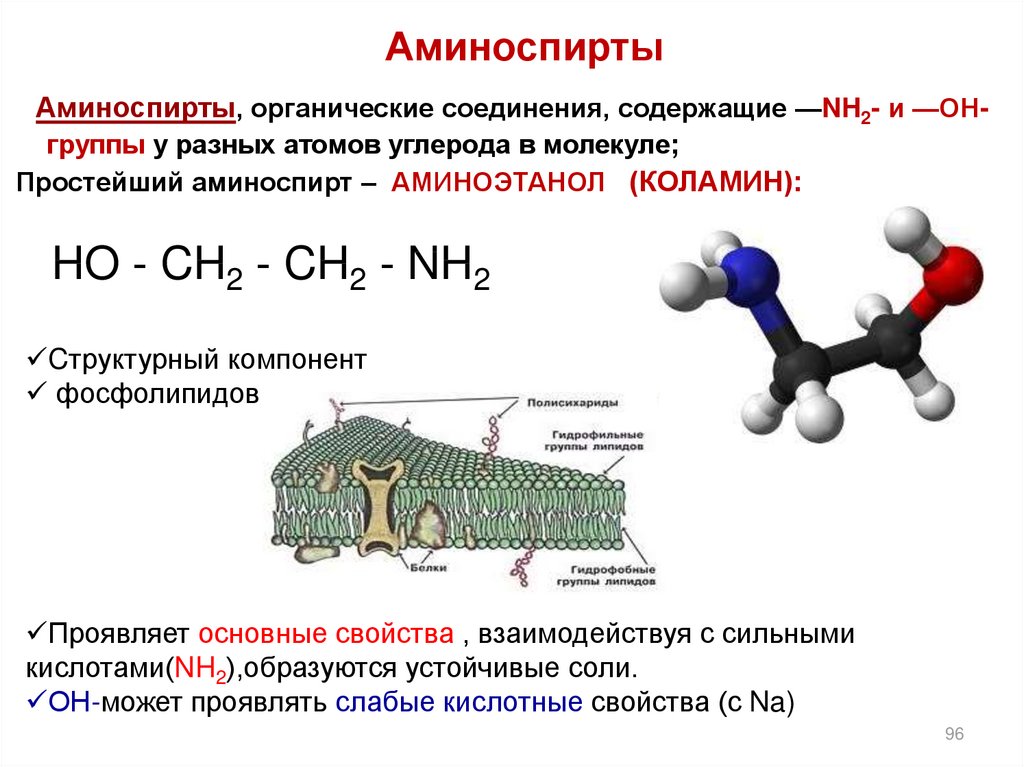
9596. Аминоспирты
Аминоспирты, органические соединения, содержащие —NH2- и —ОНгруппы у разных атомов углерода в молекуле;Простейший аминоспирт – АМИНОЭТАНОЛ (КОЛАМИН):
HO - CH2 - CH2 - NH2
Cтруктурный компонент
фосфолипидов
Проявляет основные свойства , взаимодействуя с сильными
кислотами(NH2),образуются устойчивые соли.
ОН-может проявлять слабые кислотные свойства (с Na)
96
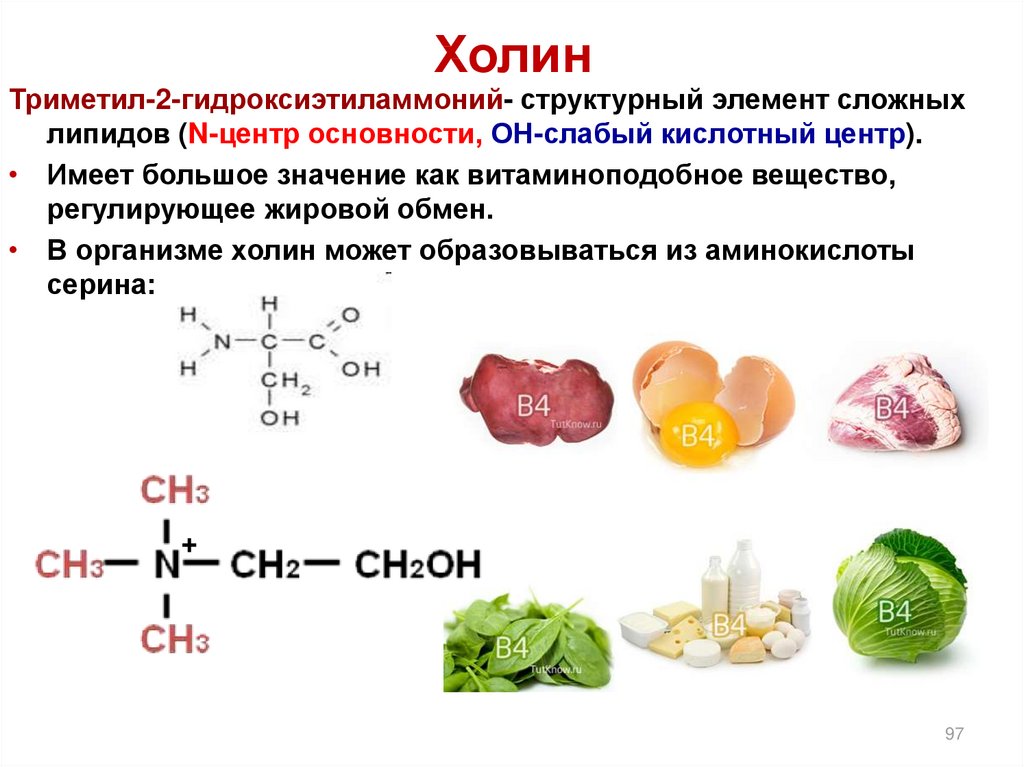
97. Холин
Триметил-2-гидроксиэтиламмоний- структурный элемент сложныхлипидов (N-центр основности, ОН-слабый кислотный центр).
• Имеет большое значение как витаминоподобное вещество,
регулирующее жировой обмен.
• В организме холин может образовываться из аминокислоты
серина:
+
97
98. Ацетилхолин
Ацетилхолин- уксуснокислый эфир холинабиологически активное вещество, широко распространённое в
природе.
Посредник при передаче нервного возбуждения в нервных тканях
(нейромедиатор)
Он образуется в организме при ацетилировании холина с
помощью ацетилкофермента А
98
99.
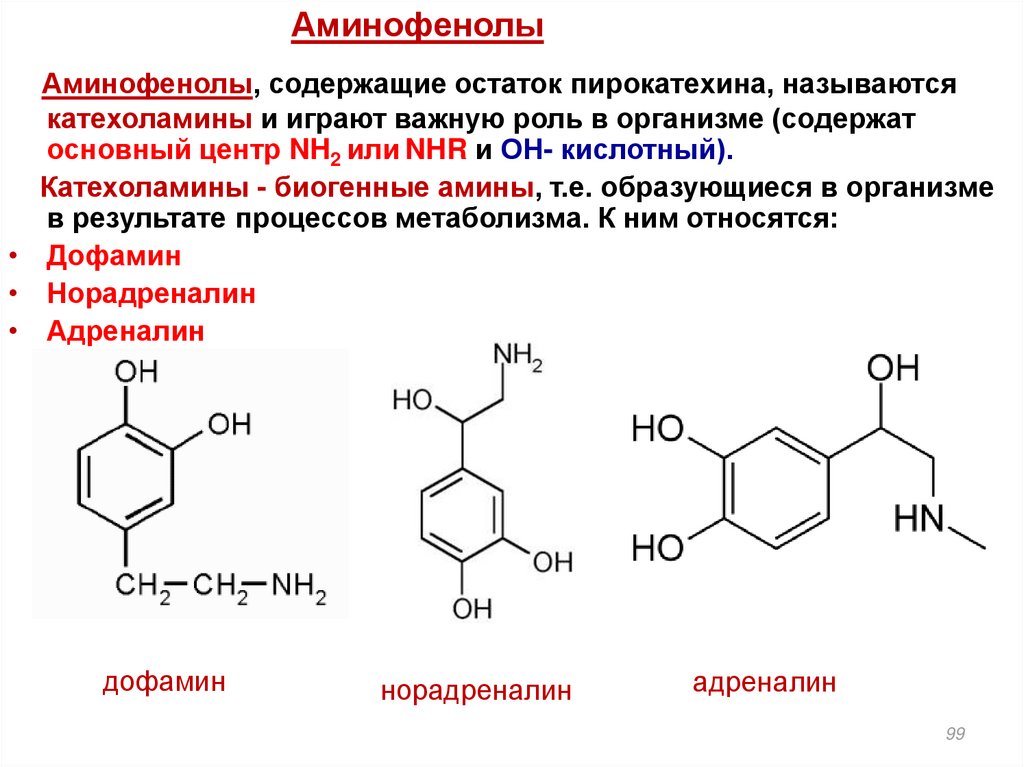
АминофенолыАминофенолы, содержащие остаток пирокатехина, называются
катехоламины и играют важную роль в организме (содержат
основный центр NH2 или NHR и ОН- кислотный).
Катехоламины - биогенные амины, т.е. образующиеся в организме
в результате процессов метаболизма. К ним относятся:
• Дофамин
• Норадреналин
• Адреналин
дофамин
норадреналин
адреналин
99
100. Катехоламины
• Производные пирокатехина• активно участвуют в физиологических и
биохимических процессах.
• гормоны мозгового слоя надпочечников
и медиаторы нервной системы.
• они отражают и определяют состояние
симпатического отдела вегетативной
нервной системы.
• играют важную роль в
нейрогуморальной регуляции и нервной
трофике.
100
101. НОРАДРЕНАЛИН
• Главным образом важна его роль именно как нейромедиатора.Синоним: норэпинефрин.
• По действию на сердце, кровеносные сосуды, гладкие мышцы, а также
на углеводный обмен Н. обладает свойствами гормона и близок к
своему N-метильному производному — адреналину. Уровень Н. в
крови, органах и выделениях организма позволяет судить о состоянии
(тонусе и реактивности) симпатической нервной системы .
Н получают
синтетическим путём;
применение в
медицинской практике:
при падении кровяного
давления, при коллапсе,
шоке, кровопотерях и т. д.
101
102. Дофамин
• Дофамин,3,4-диоксифенилэтиламин,
окситирамин,
C6H3(OH)2CH2CH2(NH2), промежуточный продукт биосинтеза
катехоламинов, образующийся в результате декарбоксилирования
диоксифенилаланина (ДОФА).
• Дофамин (ДОФА) – важнейший нейромедиатор, участвующий в так
называемой «системе награды». Когда мы делаем что-то хорошее в
мозге выделяется дофамин, что и создаёт ощущение удовольствия
• Ряд органов и тканей (печень, лёгкие, кишечник и др.) содержат
преимущественно Д. Наряду с адреналином и норадреналином Д. в
небольших количествах секретируется надпочечниками.
102
103. Инфракрасная спектроскопия
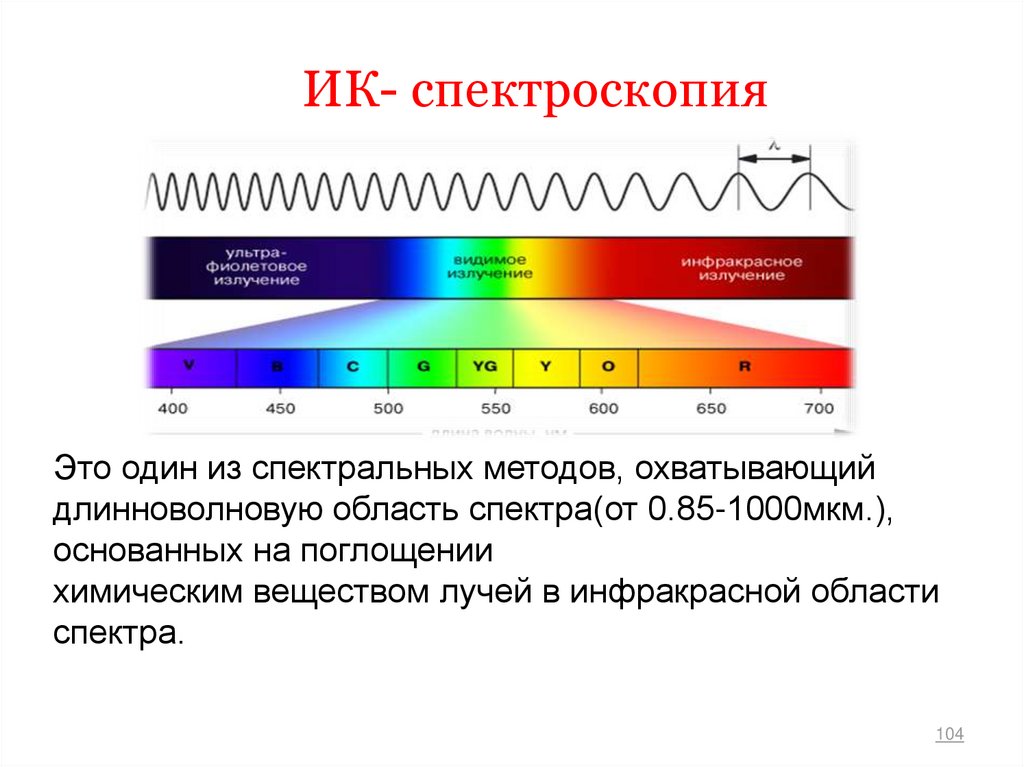
103104. ИК- спектроскопия
Это один из спектральных методов, охватывающийдлинноволновую область спектра(от 0.85-1000мкм.),
основанных на поглощении
химическим веществом лучей в инфракрасной области
спектра.
104
105. ИК- спектроскопия
• Чтобы понять принципы, на которых основана ИК –спектроскопия, надо познакомиться с внутренним
движением атомов в молекулах.
• Ковалентно связанные атомы совершают колебания
различного типа, важнейшие из которых - валентные
и деформационные.
105
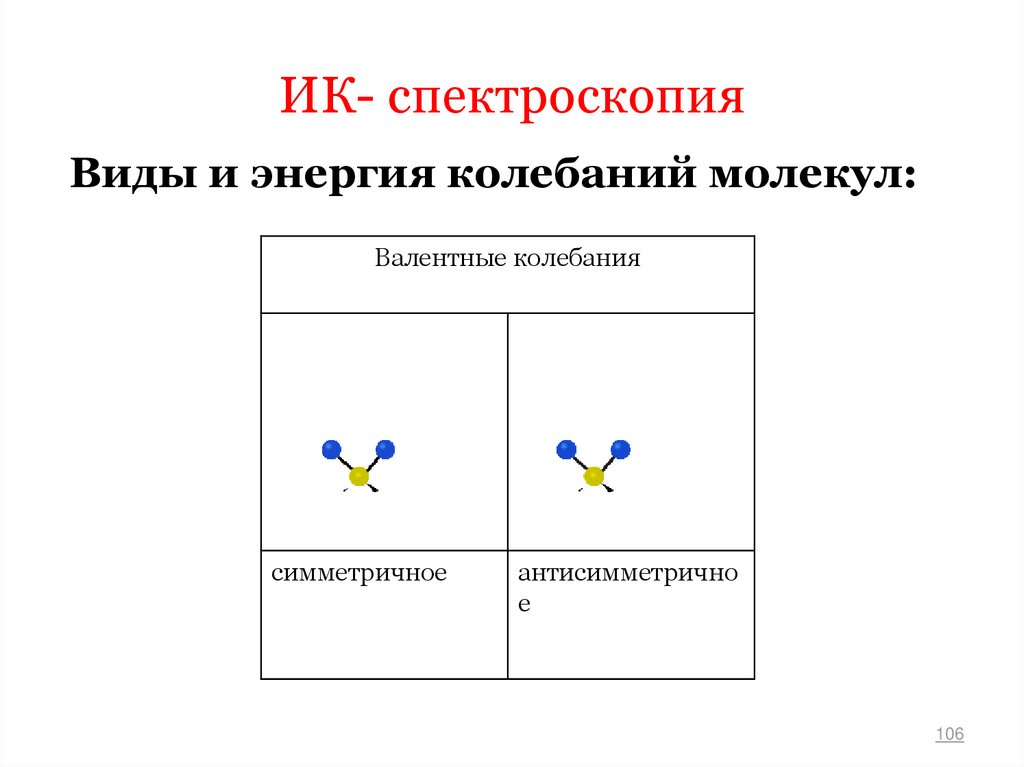
106. ИК- спектроскопия
Виды и энергия колебаний молекул:Валентные колебания
симметричное
антисимметрично
е
106
107. ИК- спектроскопия
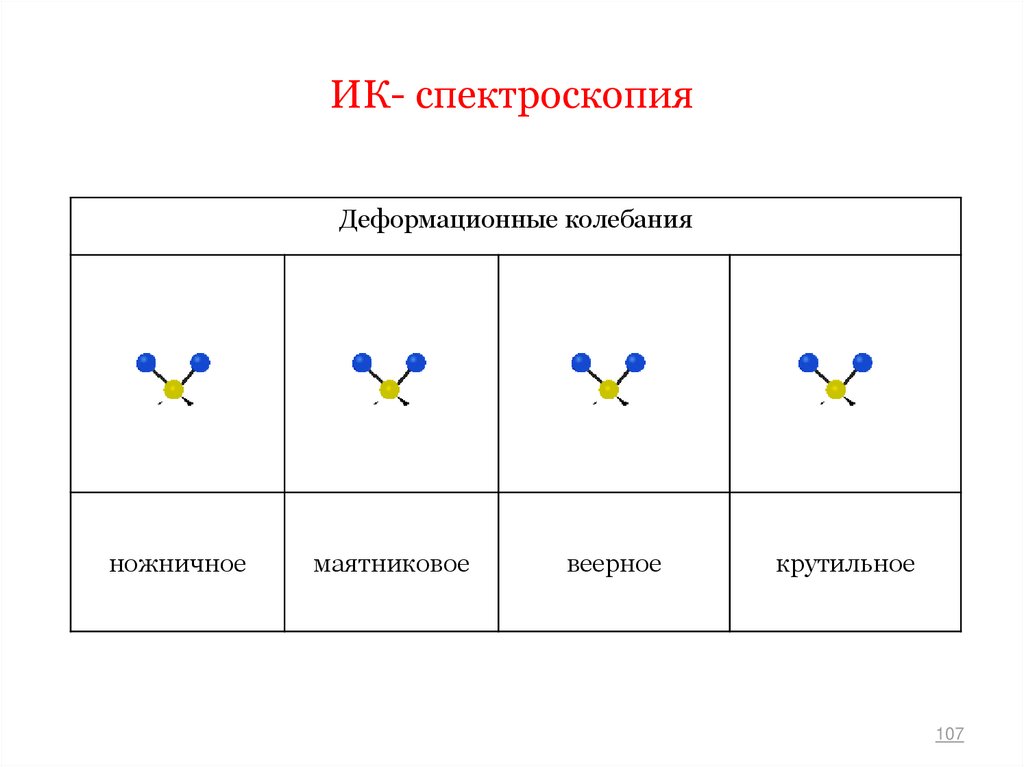
Деформационные колебанияножничное
маятниковое
веерное
крутильное
107
108. ИК- спектроскопия
• При валентных колебаниях связь попеременно торастягивается, то укорачивается.
• Деформационные колебания представляют собой
изменение валентного угла между двумя связями
одного атома .
• Каждому типу колебаний соответствует собственная
частота, которая определяется массой связанных
между собой атомов и прочностью связи.
• Чем больше масса атомов, тем ниже частота их
колебаний и прочнее связь.
108
109. ИК- спектроскопия
• Для молекул и ковалентно связанных атомов действуютпохожие закономерности. Частота колебаний связи О-Н
выше, чем частота колебаний связи С-О, поскольку в
первом случае масса атомов меньше. Частота колебаний
С=О также больше, чем С-О, так как двойная связь
более прочная.
• Органические молекулы поглощают ИК-излучение,
частота которого совпадает с собственной
частотой колебаний атомов. При этом происходит
усиление колебательного движения, энергия молекулы
возрастает.
• ИК- излучение поглощает только молекулы, в которых
содержатся полярные ковалентные связи.
109
110. ИК- спектроскопия
• Каждый тип связей имеет индивидуальнуюкомбинацию атомных масс и прочности связи и,
следовательно, собственную частоту колебаний и
поглощает ИК - излучение характерной для него
частоты (длины волны)
• С помощью прибора, который позволяет облучать
вещество ИК-светом разной длины волны, можно
определить длины волн, на которых происходит
поглощение.
110
111.
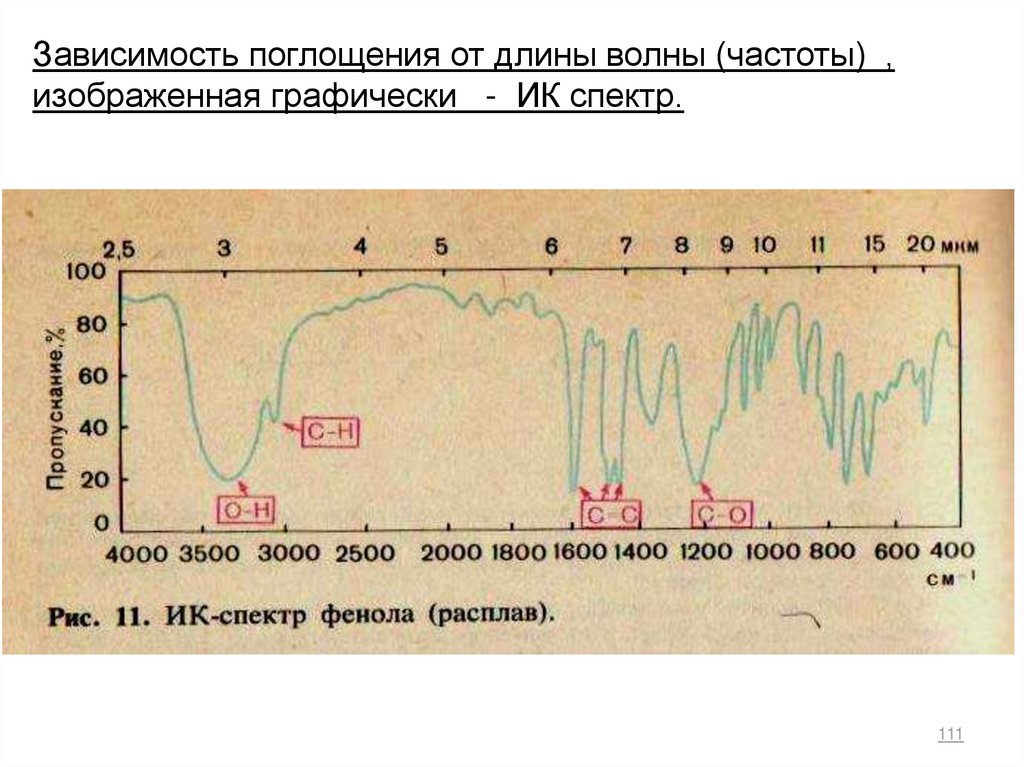
Зависимость поглощения от длины волны (частоты) ,изображенная графически - ИК спектр.
111
112.
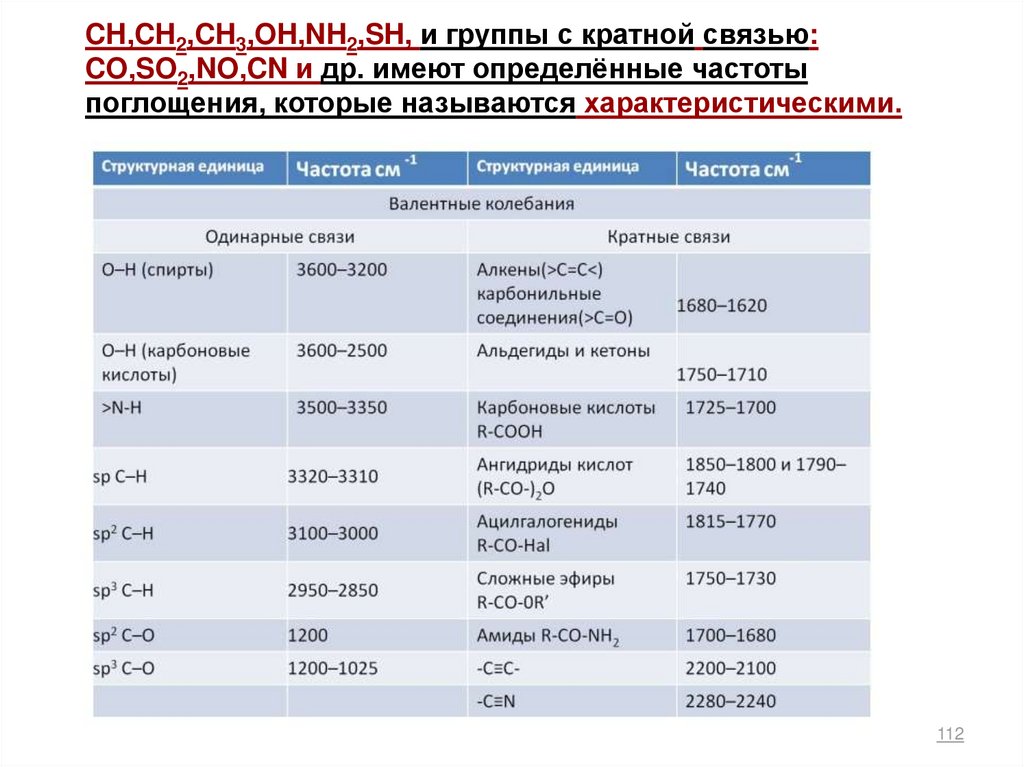
CH,CH2,CH3,OH,NH2,SH, и группы с кратной связью:CO,SO2,NO,CN и др. имеют определённые частоты
поглощения, которые называются характеристическими.
112
113. ИК- спектроскопия
Характеристические частоты и функциональные группы113
114. Основные области ИК спектра
• 4000-2500 см-1 Область валентных колебанийпростых связей X-H: O-H,C-H,S-H, N-H.
-1
• 2500-1500 см Область валентных колебаний
кратных связей X=Y, X≡Y: C=C, C=O, C=N, C≡C, C≡N.
• 1500-500 см-1 Область валентных колебаний простых
связей X-Y: C-C, C-N, C-O и деформационных
простых связей X-H:C-H,C-O, C-N.
114
115. ИК- спектроскопия
• Большая часть спектральной информации,позволяющей обнаружить структурные группы,
расположена в длинноволновой части ИКспектра. Которую часто называют областью
функциональных групп.
• Интерпретировать коротковолновую часть
спектра труднее. Здесь не удаётся соотнести
каждую полосу с определённым фрагментом
молекулы. Однако контур в этой области
спектра индивидуален для каждого
вещества.
115
116.
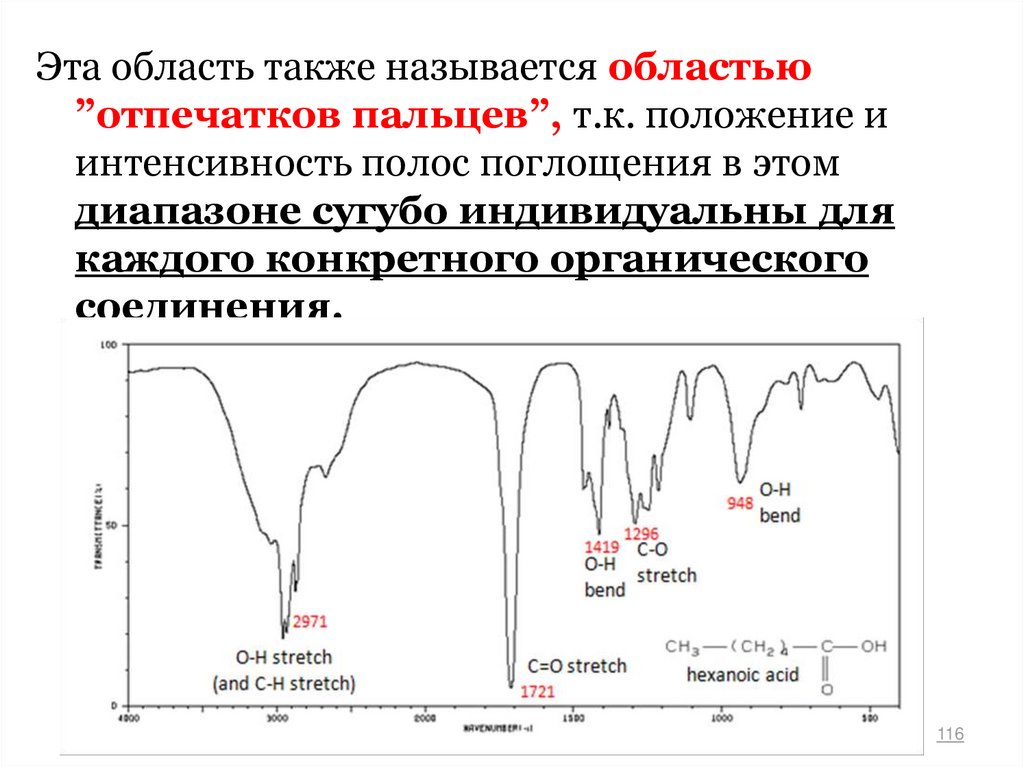
Эта область также называется областью”отпечатков пальцев”, т.к. положение и
интенсивность полос поглощения в этом
диапазоне сугубо индивидуальны для
каждого конкретного органического
соединения.
116
117. ИК- спектроскопия
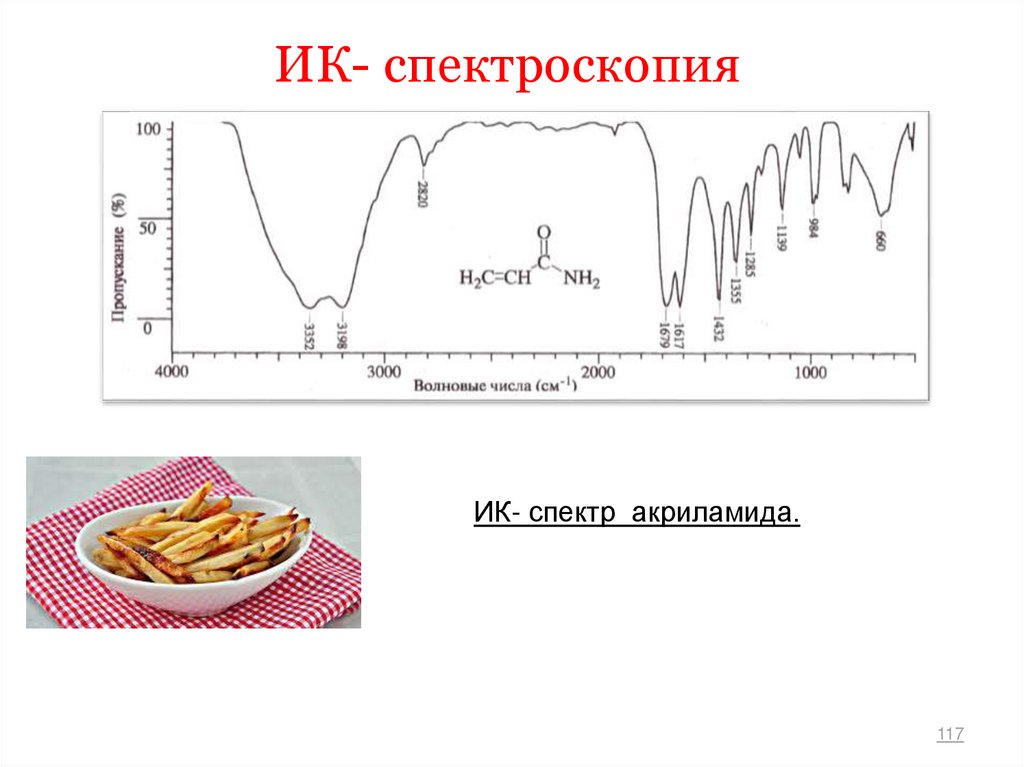
ИК- спектр акриламида.117
118.
ИК- спектроскопияИК- спектры
структурных изомеров
крезола
118
119.
ИК- спектроскопияМногие функциональные группы дают несколько полос
поглощения благодаря наличию нескольких типов связей. Так,
функциональная группа спиртов содержит связи О-Н и С-О,
которым соответствуют полосы поглощения около 3400см1 и в области 1150-1050 см-1. По положению полосы
колебаний связи С-О можно различить первичные, вторичные и
третичные спирты.
ИК- спектроскопия
120. ИК- спектроскопия
• Итак, инфракрасный спектр соединения- этографик зависимости интенсивности
поглощения от волнового числа (величина
обратная длине волны и пропорциональная
частоте).
• Положение полос поглощения в спектрк
позволяет обнаруживать в молекуле вещества
те или иные функциональные группы.
• ИК –спектры позволяют отождествлять
соединение с уже известным веществом
120
121. Применение в медицине
Метод инфракрасной спектроскопиипозволяет исследовать твердую,
жидкую фазы биологической
массы. Биологический образец
можно изучать в целом и без
предварительных химических
обработок, а также использовать
малые (до 10 мг) навески.
122. ИК используется для :
• диагностики онкологическихзаболеваний
• определения некоторых
веществ в биологических
жидкостях: крови, моче,
слюне, слезной жидкости,
желчи, молоке
• идентификации некоторых
витаминов, гормонов и
других биологически
активных веществ.
123.
• диагностики и определения степенитяжести остеопороза и
эффективности его лечения
• изучения процессов регенерации
• прогнозировании эпилепсии
• в диагностике алкоголизма и
опийной наркомании
124.
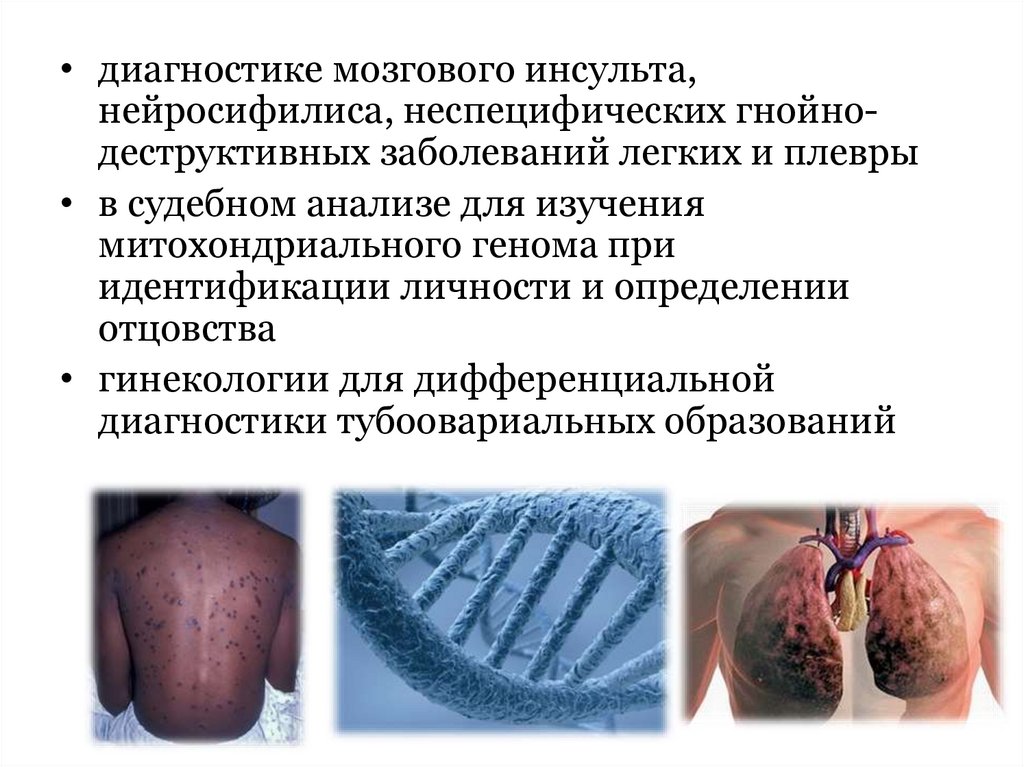
• диагностике мозгового инсульта,нейросифилиса, неспецифических гнойнодеструктивных заболеваний легких и плевры
• в судебном анализе для изучения
митохондриального генома при
идентификации личности и определении
отцовства
• гинекологии для дифференциальной
диагностики тубоовариальных образований




























































 chemistry
chemistry








