Similar presentations:
Альдегиды и кетоны
1.
АЛЬДЕГИДЫКЕТОНЫ
2.
Альдегиды и кетоны относятся к классу органическихкислородсодержащих, а именно - карбонильных соединений, то
есть содержат карбонильную группу -C(O)-. Альдегиды и кетоны
также называют оксосоединениями, карбонильную группу - оксогруппой.
3.
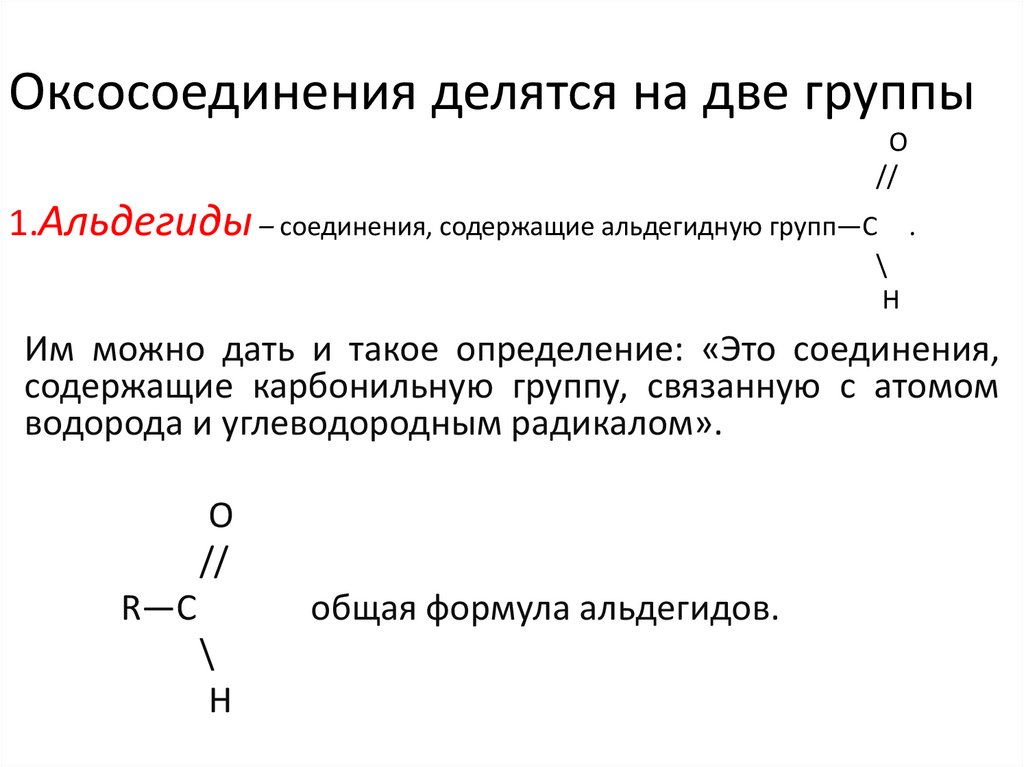
Оксосоединения делятся на две группыO
//
1.Альдегиды – соединения, содержащие альдегидную групп—С
.
\
H
Им можно дать и такое определение: «Это соединения,
содержащие карбонильную группу, связанную с атомом
водорода и углеводородным радикалом».
O
//
R—C
общая формула альдегидов.
\
H
4.
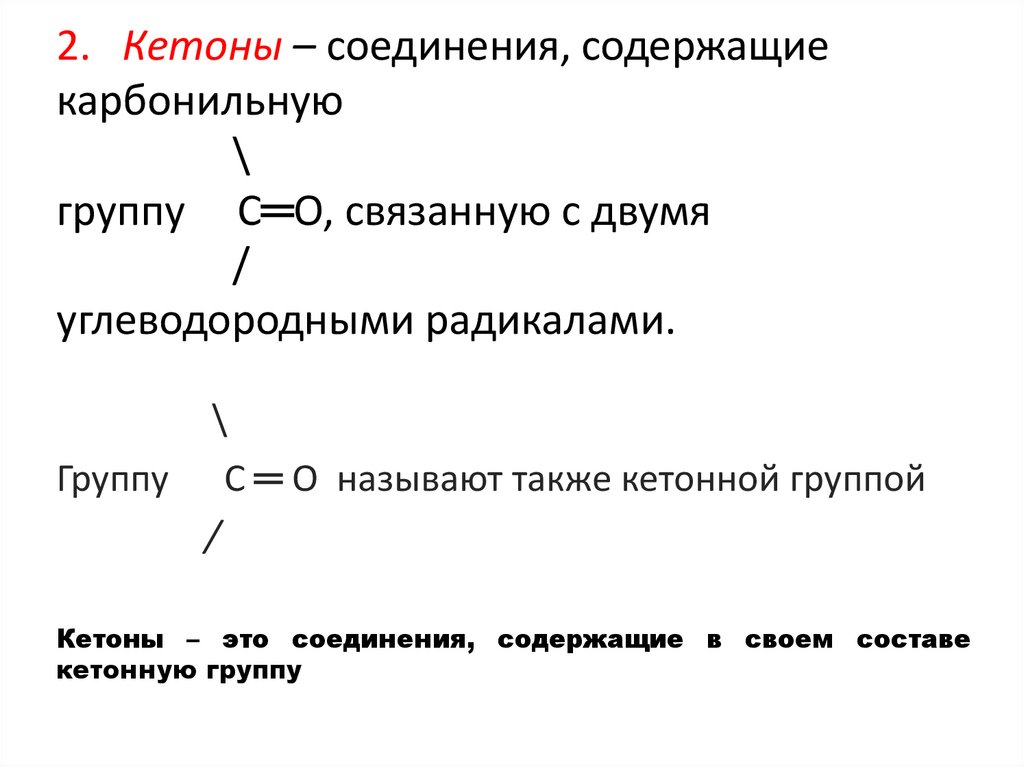
2. Кетоны – соединения, содержащиекарбонильную
\
группу С═О, связанную с двумя
/
углеводородными радикалами.
\
Группу С ═ О называют также кетонной группой
/
Кетоны – это соединения, содержащие в своем составе
кетонную группу
5.
6.
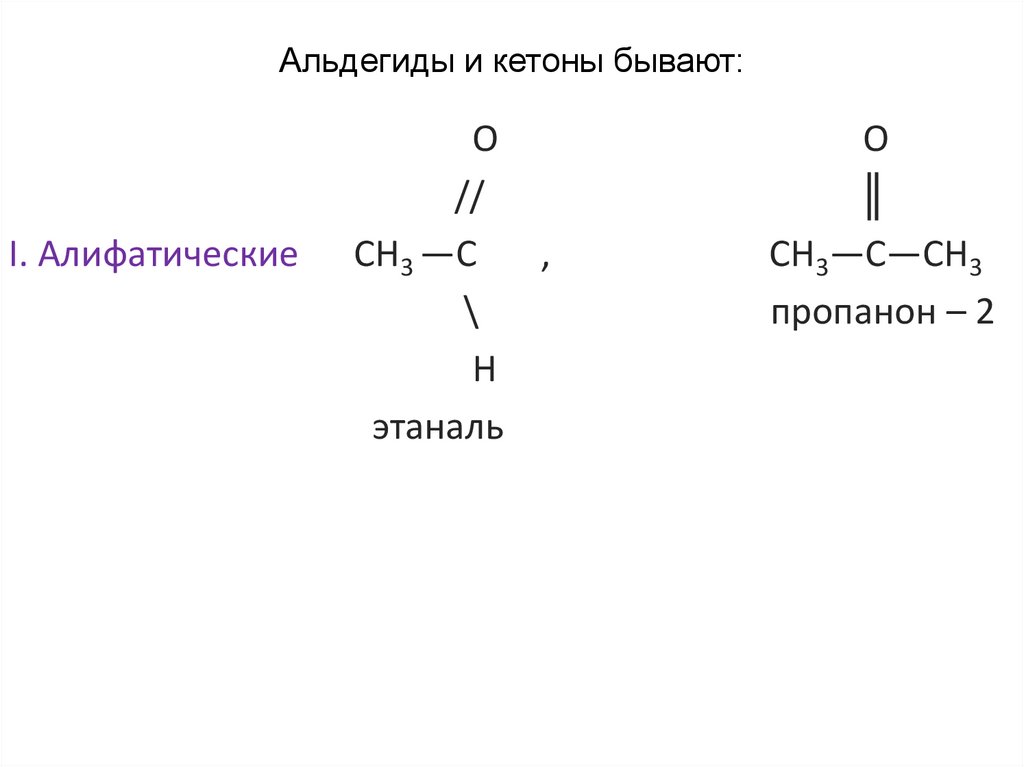
Альдегиды и кетоны бывают:I. Алифатические
О
//
СН3 —С
,
\
Н
этаналь
О
║
СН3—С—СН3
пропанон – 2
7.
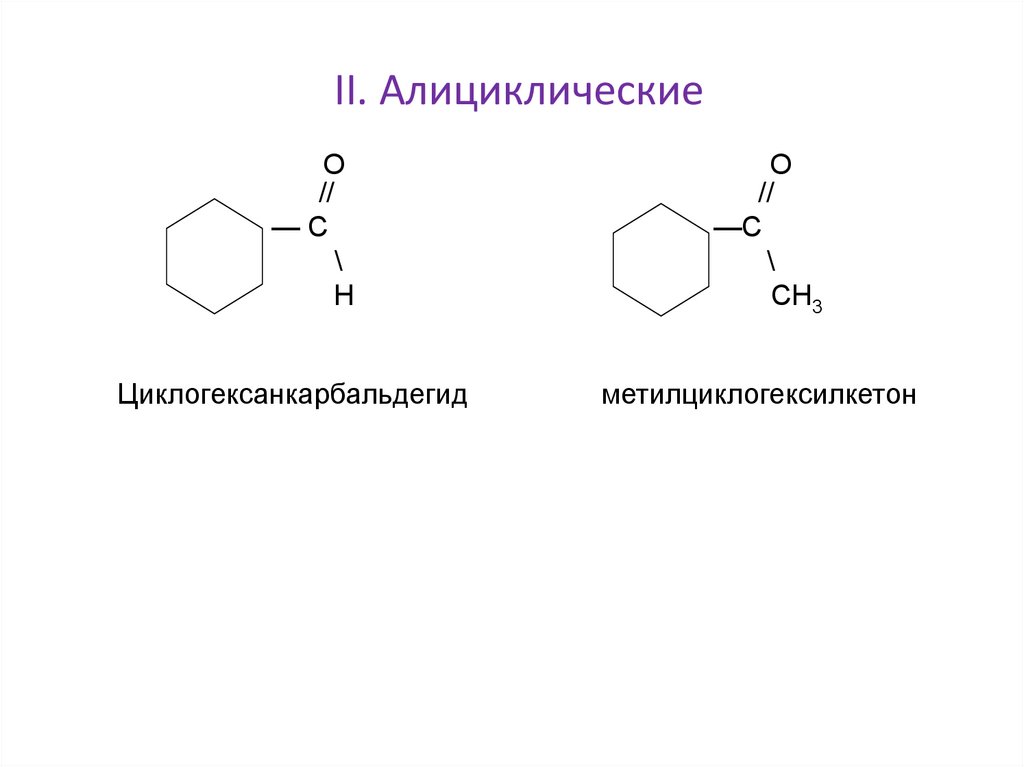
II. АлициклическиеО
//
—С
\
Н
Циклогексанкарбальдегид
О
//
—С
\
СН3
метилциклогексилкетон
8.
III. АроматическиеО
//
С6Н5—С
\
Н
бензальдегид
— С —
║
О
бензофенон
9.
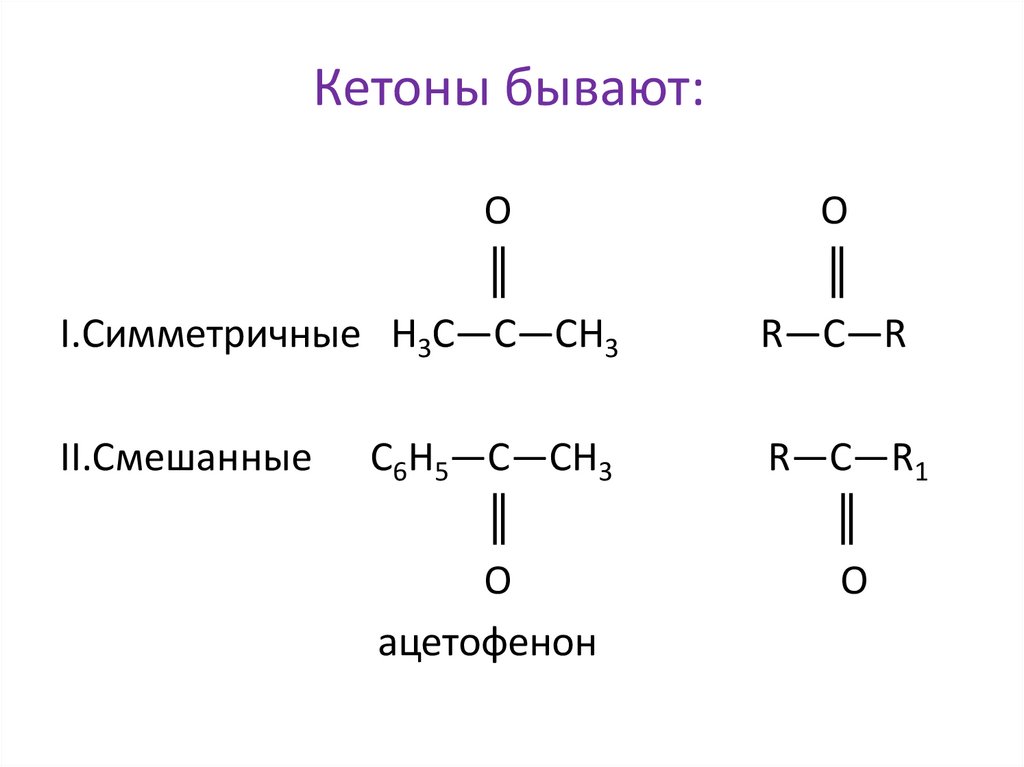
Кетоны бывают:O
║
I.Симметричные Н3С—С—СН3
О
║
R—C—R
II.Смешанные
R—C—R1
║
O
С6Н5—С—СН3
║
О
ацетофенон
10.
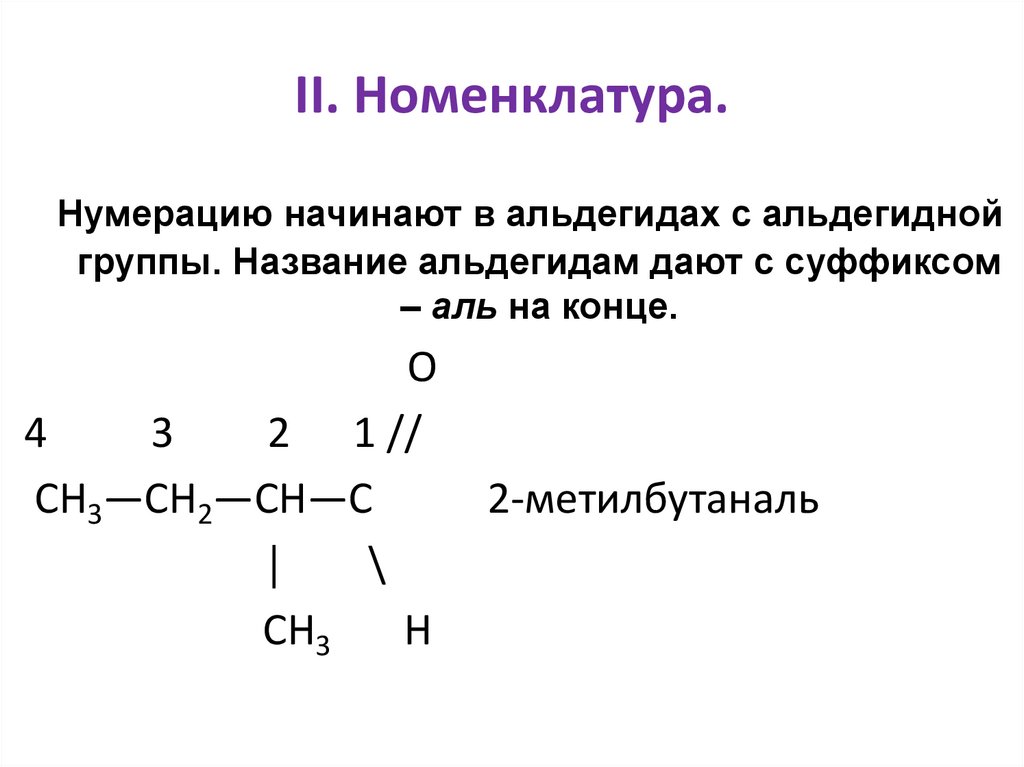
II. Номенклатура.Нумерацию начинают в альдегидах с альдегидной
группы. Название альдегидам дают с суффиксом
– аль на конце.
О
4
3
2 1 //
СН3—СН2—СН—С
│
\
СН3
Н
2-метилбутаналь
11.
Кетоны начинают нумеровать с того конца, к которому ближе кетоннаягруппа, называют с суффиксом – он на конце.
СН3—С—СН2—СН3
║
О
бутанон – 2
метилэтилкетон
12.
Гомологический ряд альдегидов:О
//
1.Н—С
\
Н
метаналь ( формальдегид, муравьиный альдегид,
40% р-р называют – формалин ).
О
//
2.СН3—С
этаналь ( уксусный альдегид ).
\
Н
13.
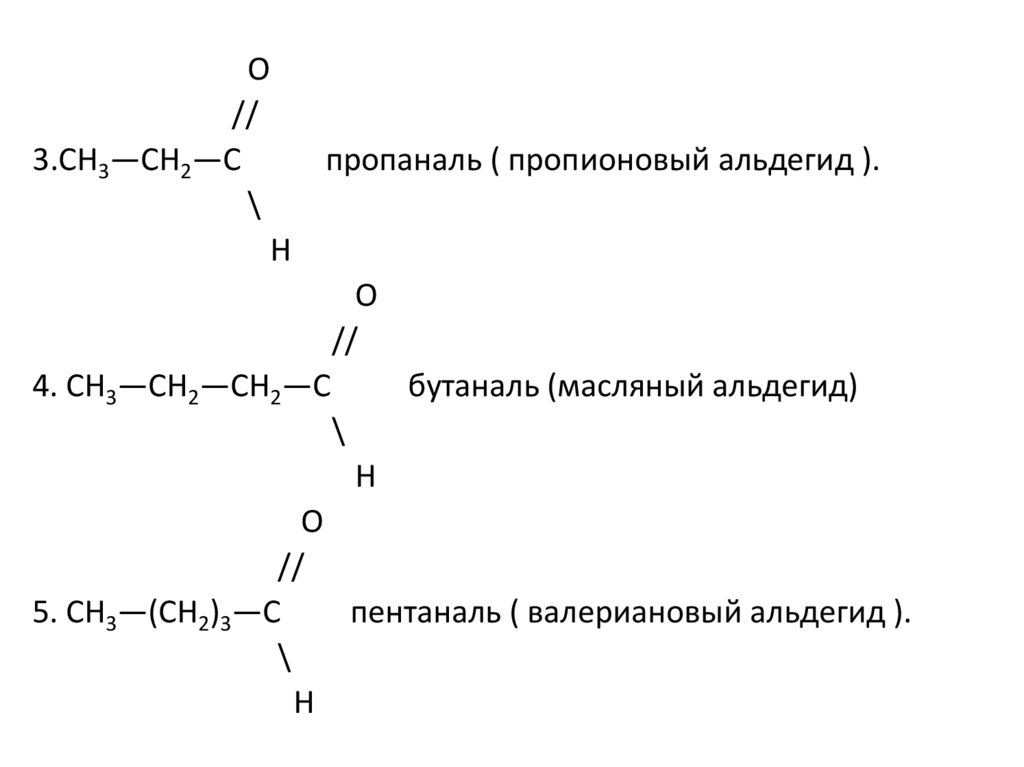
О//
3.СН3—СН2—С
\
пропаналь ( пропионовый альдегид ).
Н
О
//
4. СН3—СН2—СН2—С
бутаналь (масляный альдегид)
\
Н
О
//
5. СН3—(СН2)3—С
пентаналь ( валериановый альдегид ).
\
Н
14.
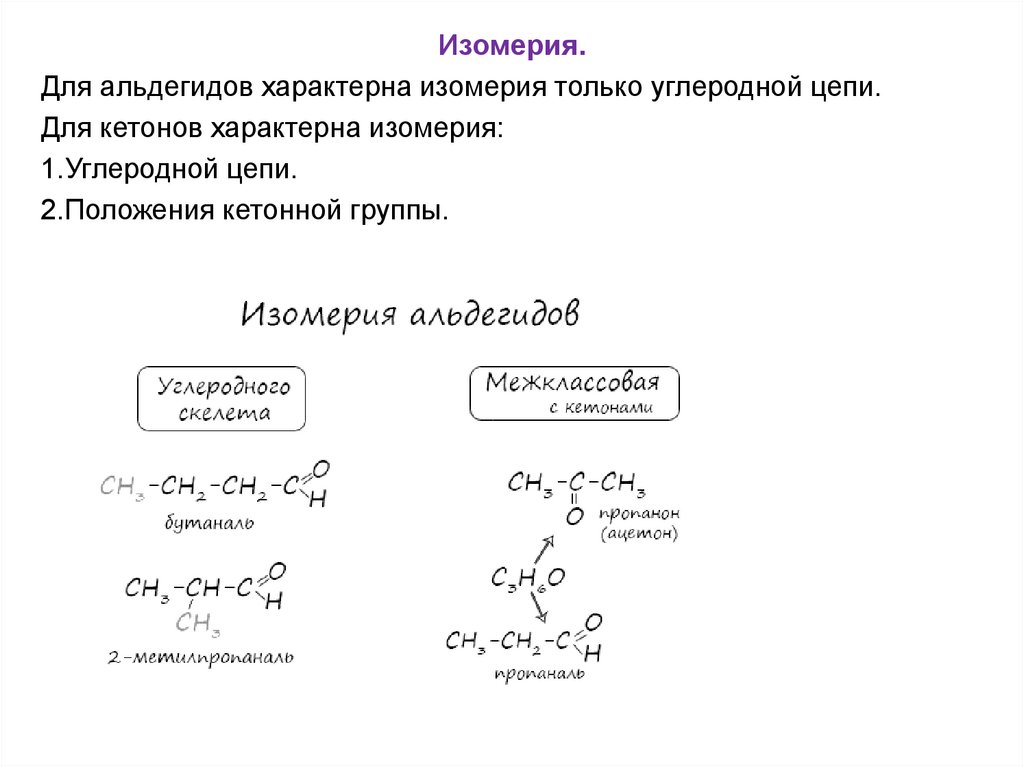
Изомерия.Для альдегидов характерна изомерия только углеродной цепи.
Для кетонов характерна изомерия:
1.Углеродной цепи.
2.Положения кетонной группы.
15.
16.
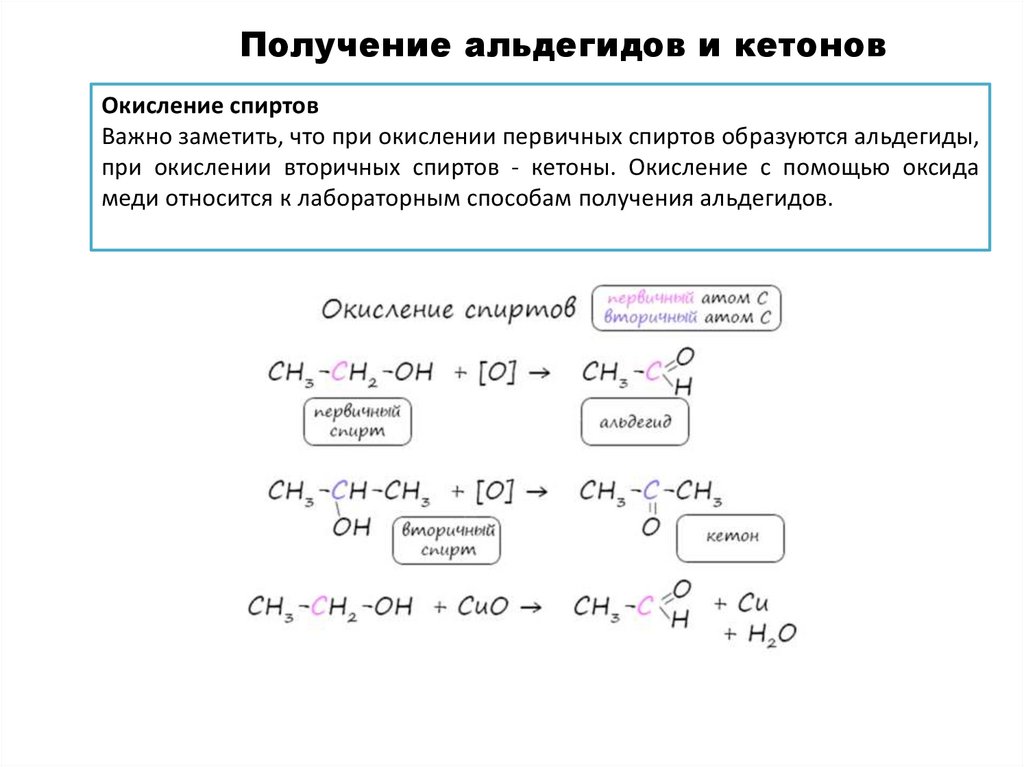
Получение альдегидов и кетоновОкисление спиртов
Важно заметить, что при окислении первичных спиртов образуются альдегиды,
при окислении вторичных спиртов - кетоны. Окисление с помощью оксида
меди относится к лабораторным способам получения альдегидов.
17.
Пиролиз солей карбоновых кислотЭтот способ также просто осуществить в лабораторных условиях. При
пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей
карбоновых кислот возможно получение кетонов.
18.
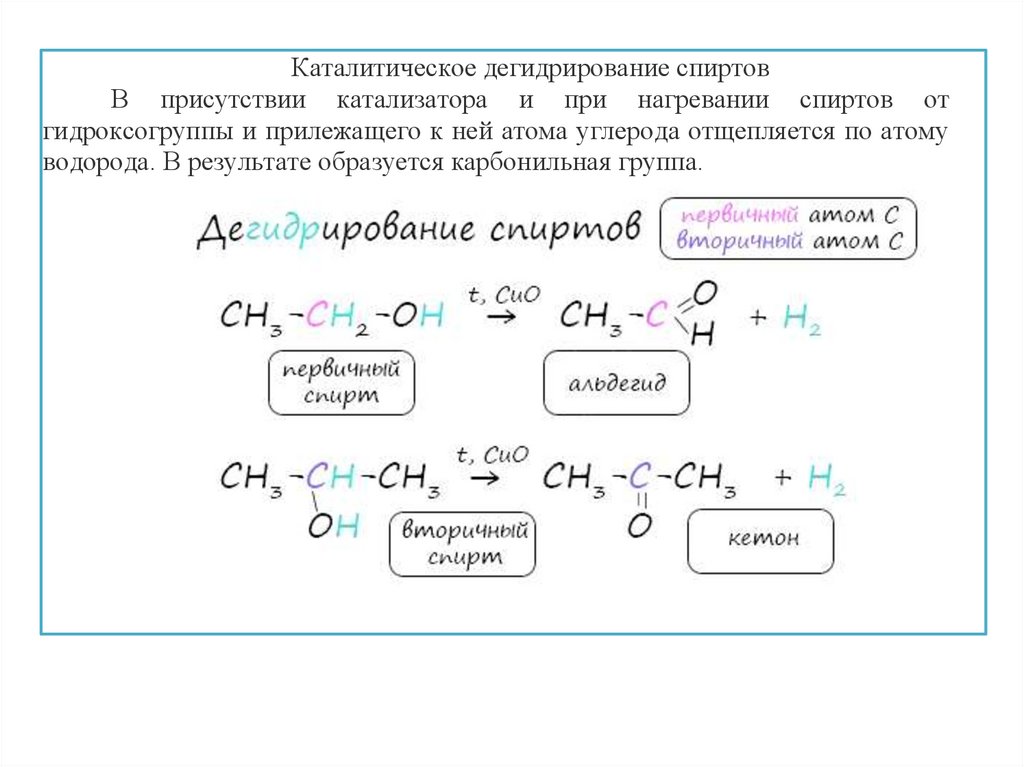
Каталитическое дегидрирование спиртовВ присутствии катализатора и при нагревании спиртов от
гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому
водорода. В результате образуется карбонильная группа.
19.
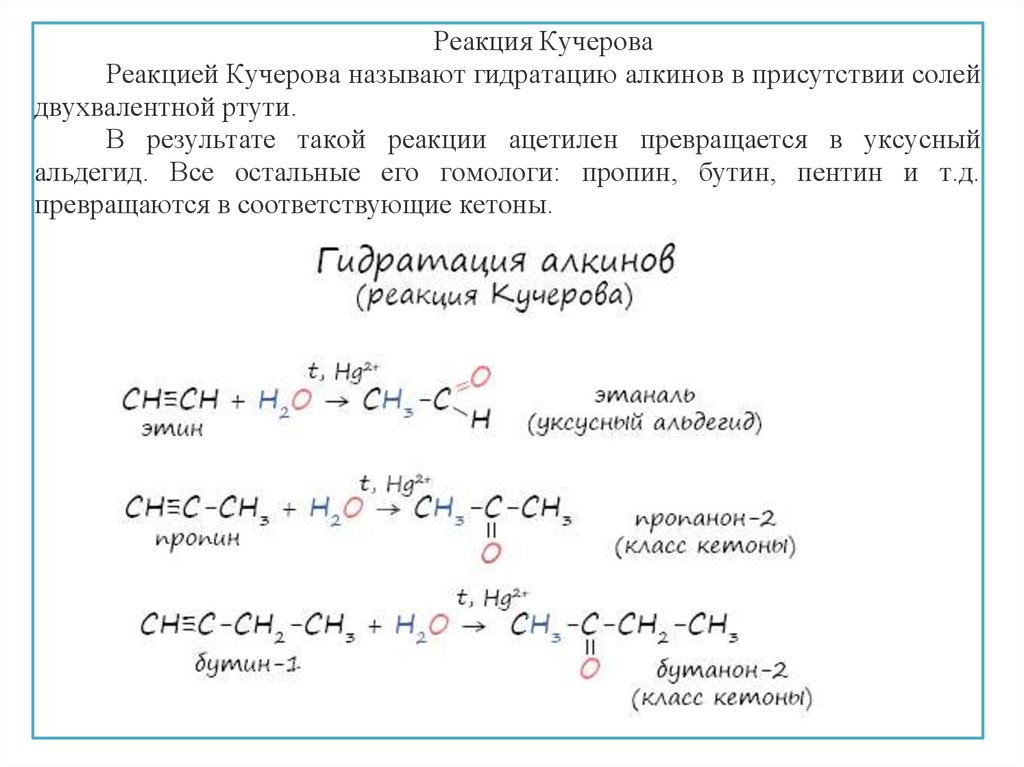
Реакция КучероваРеакцией Кучерова называют гидратацию алкинов в присутствии солей
двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный
альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д.
превращаются в соответствующие кетоны.
20.
Гидролиз дигалогеналкановДля получения альдегида два атома галогена должны находиться у
первичного атома углерода, для получения кетонов - у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в
которых две OH-группы прилежат к одному атому углерода. Такие
соединения неустойчивы и распадаются на карбонильное соединение
(альдегид или кетон) и воду.
21.
Окисление метанаВ промышленности окислением метана при температуре 500 °C и в
присутствии катализатора получают формальдегид.
22.
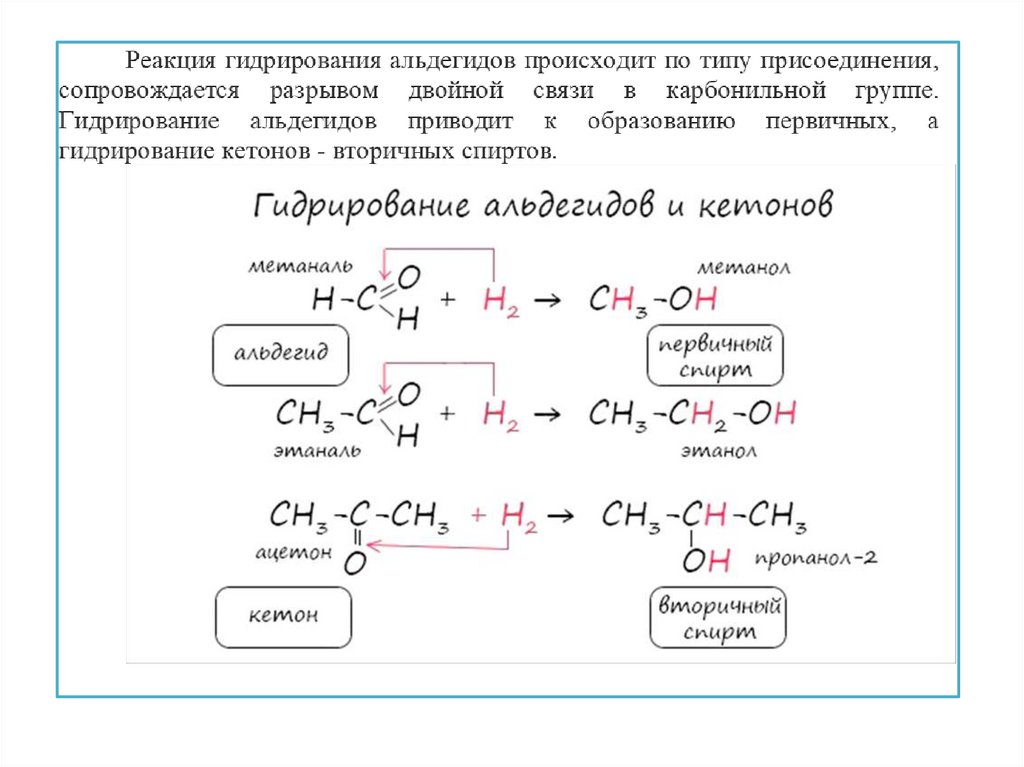
Химические свойства альдегидов и кетоновЗапомните, что для альдегидов и кетонов характерны реакции
присоединения по карбонильной группе. Это является важным
отличием альдегидов от карбоновых кислот, для которых
реакции присоединения не характерны.
23.
24.
Окисление альдегидовВ результате полного окисления, горения, образуется углекислый газ и
вода.
2CH3CHO + 5O2 → 4CO2 + 4H2O
Альдегиды легко окисляются до карбоновых кислот в лабораторных
условиях. Это осуществляется с помощью известной реакции серебряного
зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
25.
Окисление также возможно другим реагентом - гидроксидом меди II.Эта реакция также относится к качественным для альдегидов, в результате
образуется кирпично-красный осадок оксида меди I.
26.
Йодоформная проба:O
+ NaOH
//
СН3—С—СН3 + 3J2 —————→ CHJ3↓ + CH3—C
+ 3HJ
║
йодоформ
\
O
ONa
ацетат натрия
Эта реакция используется для обнаружения ацетоновых тел в моче у
больных сахарным диабетом.














 chemistry
chemistry








