Similar presentations:
Азотсодержащие органические соединения. Лекция 8
1.
Азотсодержащиеорганические
соединения
2.
Амины3.
• Амины – органические соединения,являющиеся производными аммиака, в
молекуле которого один, два или три атома
водорода замещены на углеводородные
радикалы.
По числу замещённых атомов водорода различают:
• первичные (замещён один атом водорода)
• вторичные (замещены два атома из трёх)
• третичные амины (замещены все три атома)
• четвертичные аммониевые соединения
4.
По характеру органической группы, связанной сазотом:
• алифатические,
• ароматические (анилины)
• жирно-ароматические (содержат ароматический
и алифатический радикалы)
По числу NH2-групп в молекуле амины делят на
моноамины, диамины, триамины либо полиамины
Изомерия:
• изомерия углеродного скелета,
• положения аминогруппы,
• изомерия первичных, вторичных и третичных
аминов
5.
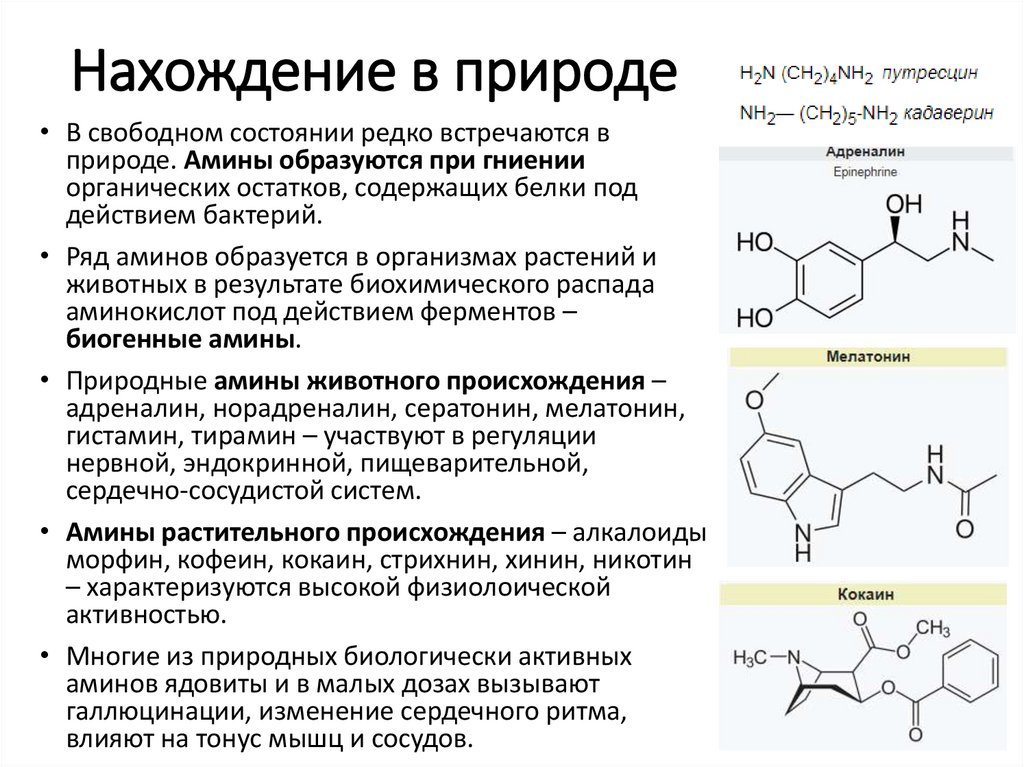
Нахождение в природе• В свободном состоянии редко встречаются в
природе. Амины образуются при гниении
органических остатков, содержащих белки под
действием бактерий.
• Ряд аминов образуется в организмах растений и
животных в результате биохимического распада
аминокислот под действием ферментов –
биогенные амины.
• Природные амины животного происхождения –
адреналин, норадреналин, сератонин, мелатонин,
гистамин, тирамин – участвуют в регуляции
нервной, эндокринной, пищеварительной,
сердечно-сосудистой систем.
• Амины растительного происхождения – алкалоиды
морфин, кофеин, кокаин, стрихнин, хинин, никотин
– характеризуются высокой физиолоической
активностью.
• Многие из природных биологически активных
аминов ядовиты и в малых дозах вызывают
галлюцинации, изменение сердечного ритма,
влияют на тонус мышц и сосудов.
6.
Физические свойства аминов• Низшие амины – метиламин,
диметиламин, триметиламин и
этиламин – при комнатной
температуре являются газами.
• Высшие амины до 12 атомов
углерода являются жидкостями.
• Амины с более длинными
заместителями являются
твёрдыми веществами.
• Низшие амины хорошо
смешиваются с водой. С ростом
углеводородного радикала и
разветвленности растворимость
снижается.
• Амины имеют характерный
неприятный рыбный запах
7.
Способы получения аминов1) Из природных объектов
- Перегонка обезжиренных костей
- Из селедочного рассола
- Разложением аминокислот и белков
8.
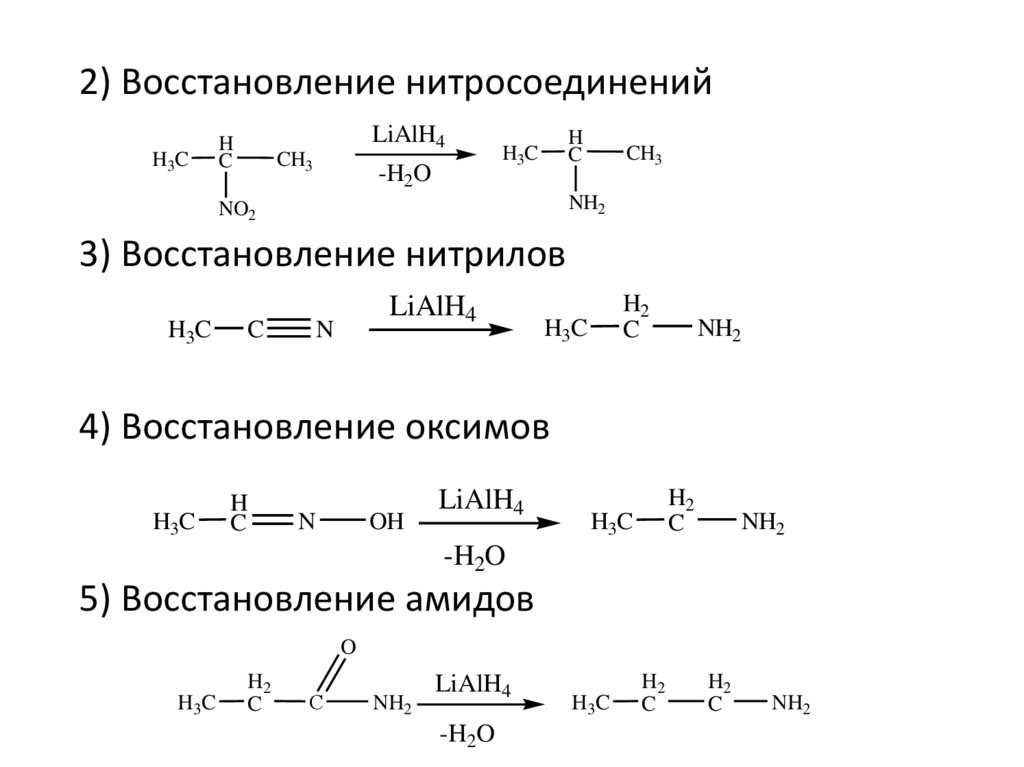
2) Восстановление нитросоединенийH3C
H
C
LiAlH4
CH3
-H2O
H
C
H3C
CH3
NH2
NO2
3) Восстановление нитрилов
H3C
C
LiAlH4
N
H2
C
H3C
NH2
4) Восстановление оксимов
H3C
H
C
N
OH
LiAlH4
H2
C
H3C
NH2
-H2O
5) Восстановление амидов
O
H3C
H2
C
С
NH2
LiAlH4
-H2O
H3C
H2
C
H2
C
NH2
9.
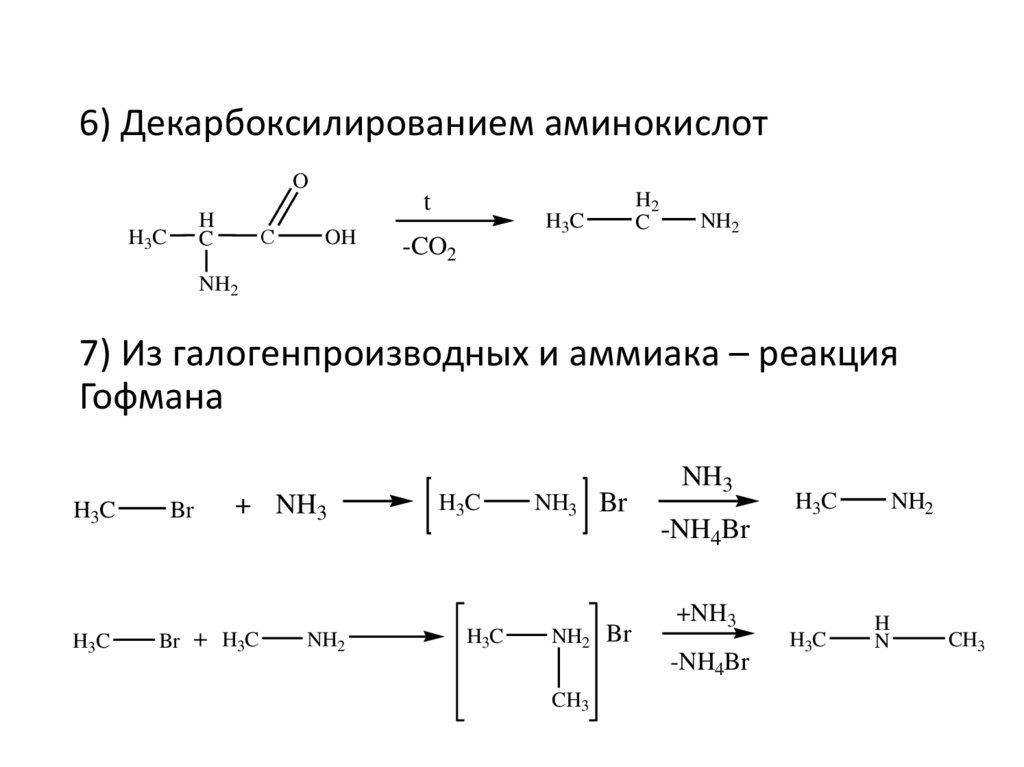
6) Декарбоксилированием аминокислотO
H
C
H3C
С
t
OH
H3C
H2
C
NH2
-CO2
NH2
7) Из галогенпроизводных и аммиака – реакция
Гофмана
H3C
H3C
Br
+ NH3
Br + H3C
NH2
H3C
H3C
NH3 Br
NH2 Br
NH3
NH2
-NH4Br
+NH3
-NH4Br
CH3
H3C
H3C
H
N
CH3
10.
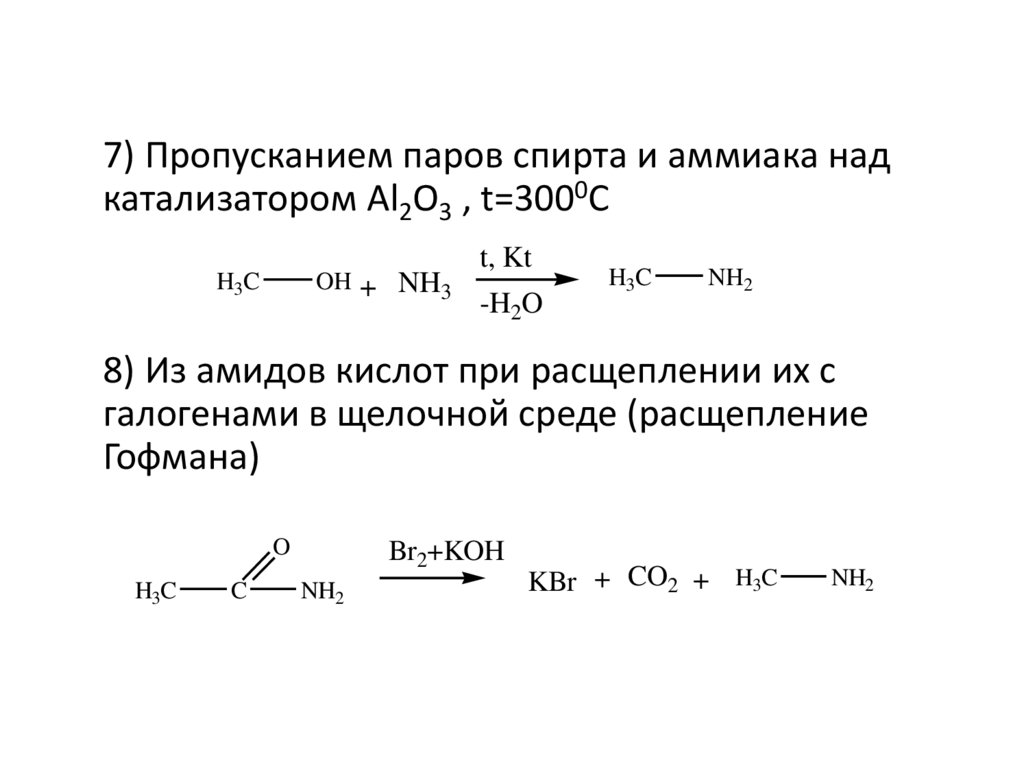
7) Пропусканием паров спирта и аммиака надкатализатором Al2O3 , t=3000C
OH + NH3
H3C
t, Kt
-H2O
H3C
NH2
8) Из амидов кислот при расщеплении их с
галогенами в щелочной среде (расщепление
Гофмана)
O
H3C
C
Br2+KOH
NH2
KBr + CO2 + H3C
NH2
11.
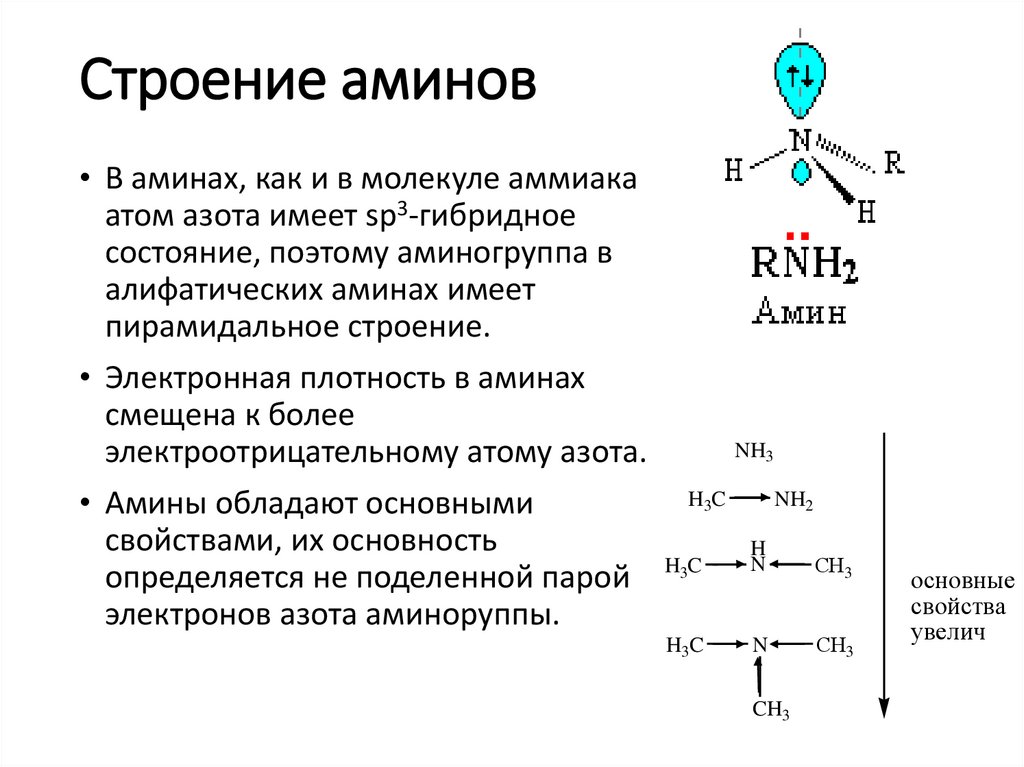
Строение аминов• В аминах, как и в молекуле аммиака,
атом азота имеет sp3-гибридное
состояние, поэтому аминогруппа в
алифатических аминах имеет
пирамидальное строение.
• Электронная плотность в аминах
смещена к более
электроотрицательному атому азота.
• Амины обладают основными
свойствами, их основность
определяется не поделенной парой
электронов азота аминоруппы.
NH3
H3C
NH2
H3C
H
N
СН3
H3C
N
СН3
CH3
основные
свойства
увелич
12.
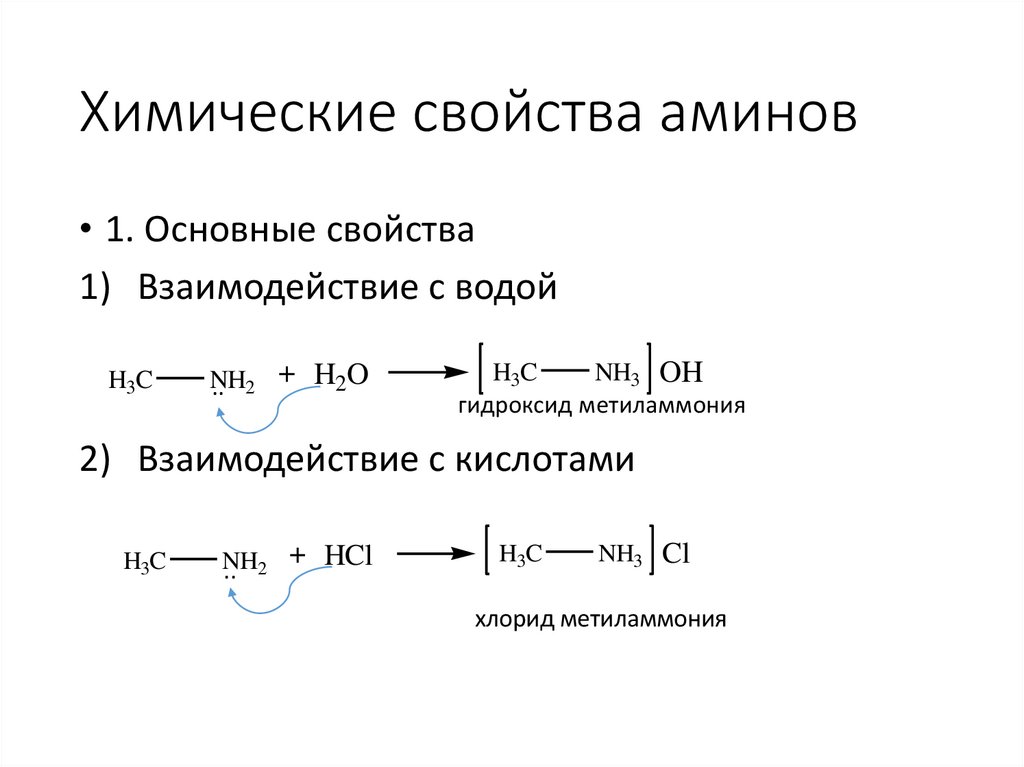
Химические свойства аминов• 1. Основные свойства
1) Взаимодействие с водой
H3C
NH
.. 2 + H2O
H3C
NH3 OH
гидроксид метиламмония
2) Взаимодействие с кислотами
H3C
+ HCl
NH
.. 2
H3C
NH3 Cl
хлорид метиламмония
13.
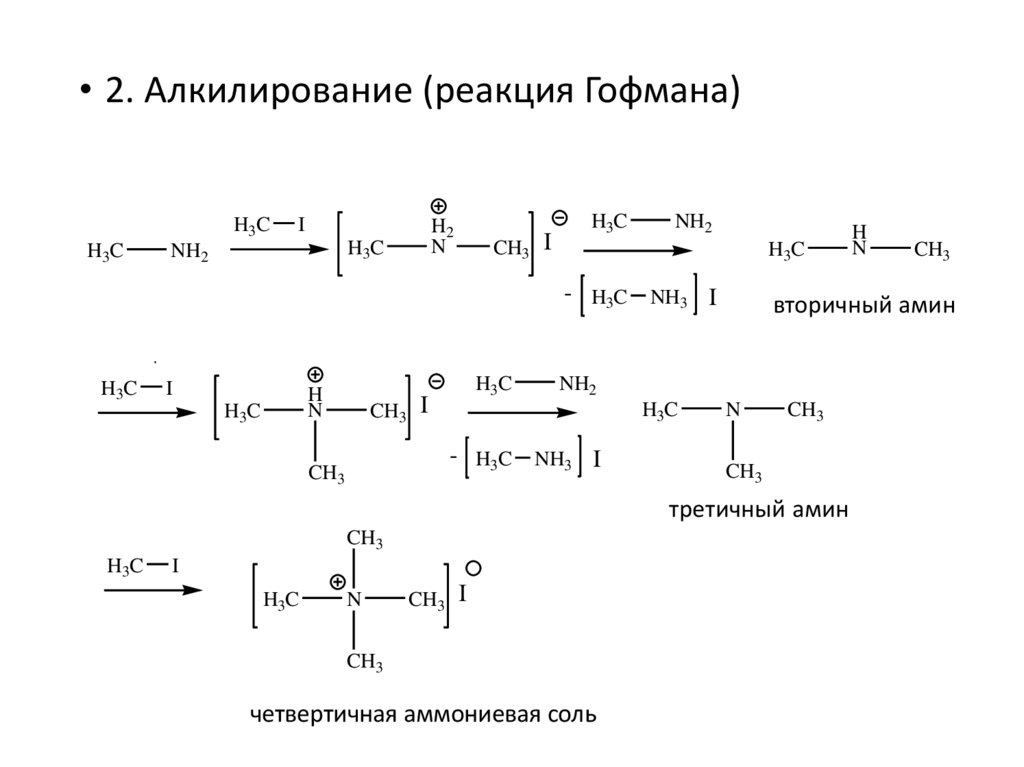
• 2. Алкилирование (реакция Гофмана)H3C
H3C
I
H2
N
H3C
NH2
CH3 I
H3C
NH2
H3C
- H3C NH3 I
H3C
I
H
N
H3C
H3C
CH3 I
- H3C NH3 I
CH3
N
CH3
CH3
третичный амин
CH3
H3C
I
H3C
N
CH3 I
CH3
четвертичная аммониевая соль
CH3
вторичный амин
NH2
H3C
H
N
14.
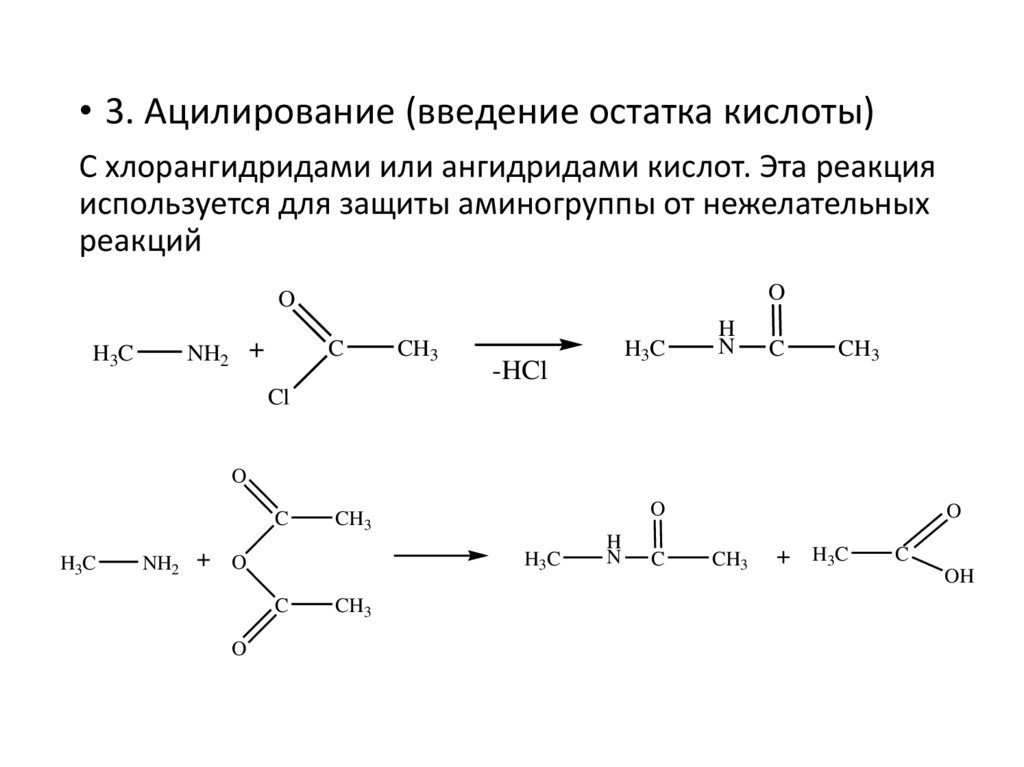
• 3. Ацилирование (введение остатка кислоты)С хлорангидридами или ангидридами кислот. Эта реакция
используется для защиты аминогруппы от нежелательных
реакций
O
O
H3C
+
NH2
C
CH3
H3C
-HCl
H
N
C
CH3
Cl
O
C
H3C
NH2
+ O
H3C
C
O
O
CH3
CH3
H
N
C
O
CH3
+ H3C
C
OH
15.
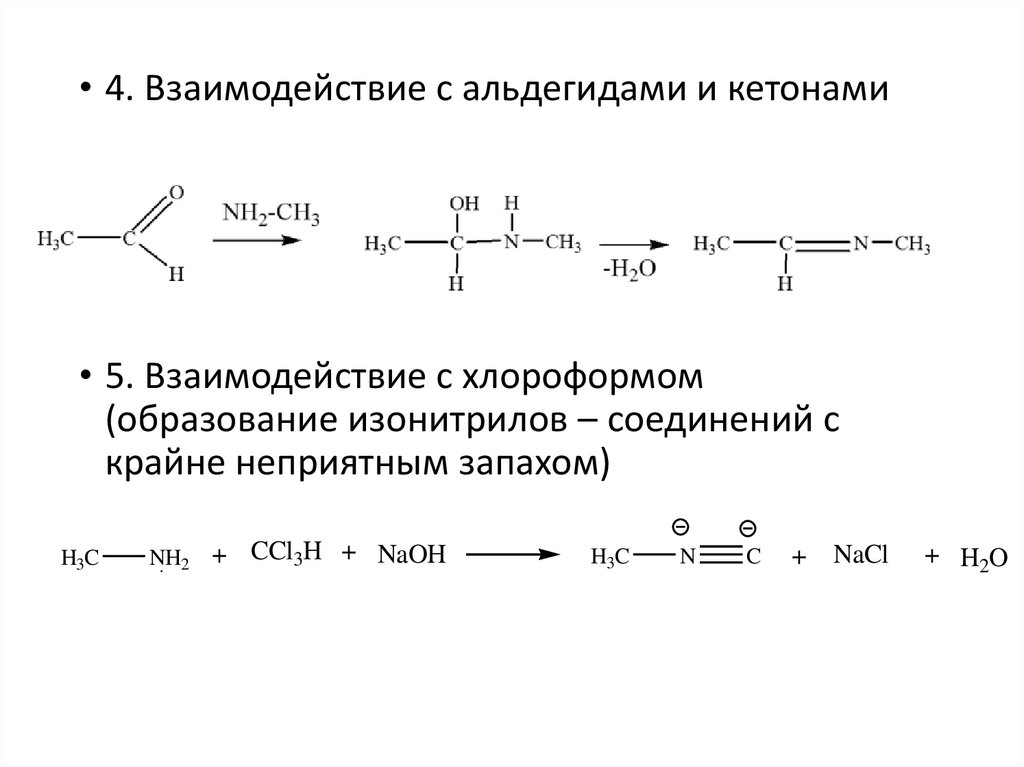
• 4. Взаимодействие с альдегидами и кетонами• 5. Взаимодействие с хлороформом
(образование изонитрилов – соединений с
крайне неприятным запахом)
H3C
NH2 +
CCl3H + NaOH
H3C
N
C
+
NaCl
+ H2O
16.
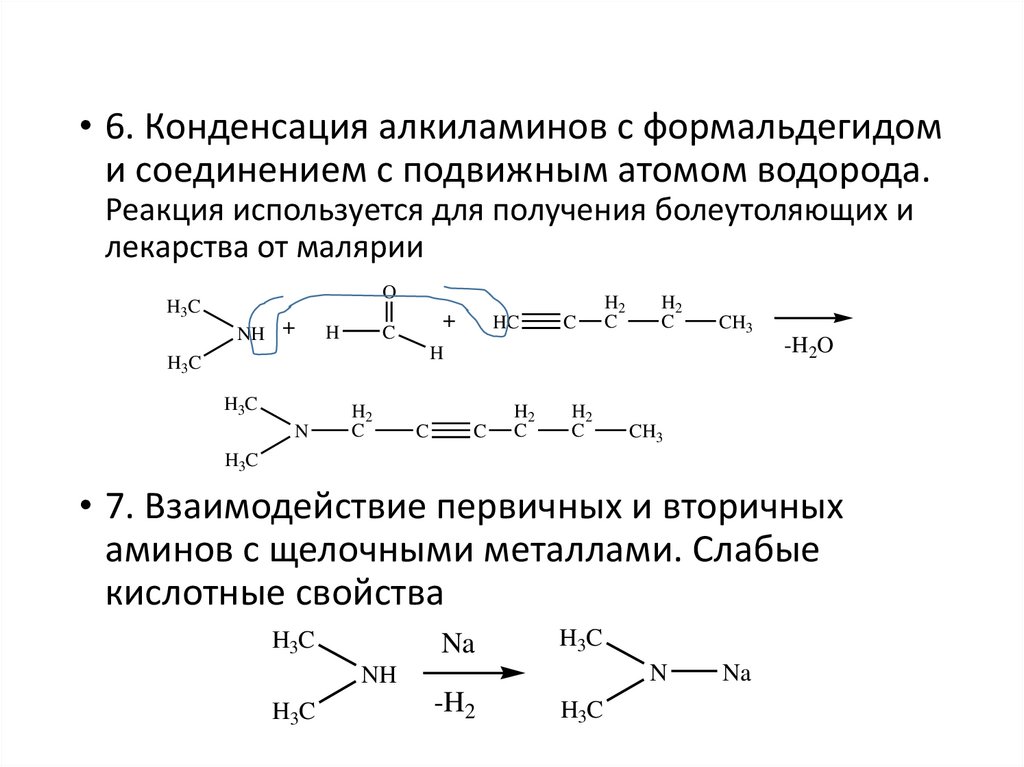
• 6. Конденсация алкиламинов с формальдегидоми соединением с подвижным атомом водорода.
Реакция используется для получения болеутоляющих и
лекарства от малярии
H3C
O
NH +
H
+
C
HC
C
H2
C
H2
C
CH3
-H2O
H
H3C
H3C
N
H2
C
C
C
H2
C
H2
C
CH3
H3C
• 7. Взаимодействие первичных и вторичных
аминов с щелочными металлами. Слабые
кислотные свойства
H3C
Na
H3C
N
NH
H3C
-H2
H3C
Na
17.
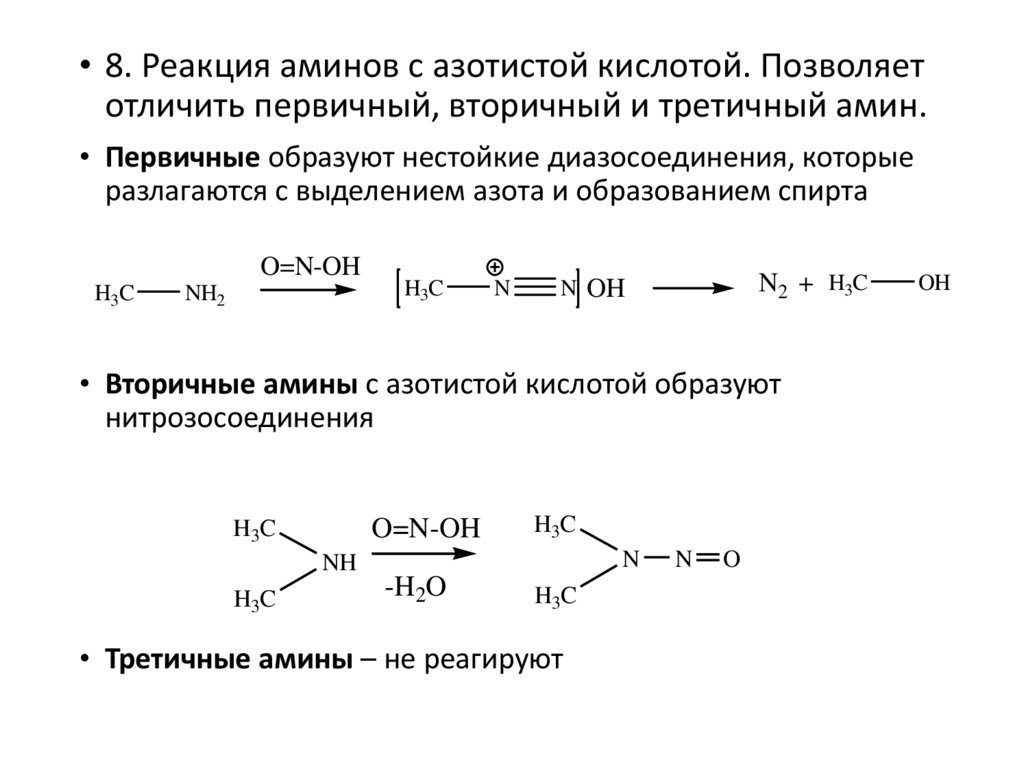
• 8. Реакция аминов с азотистой кислотой. Позволяетотличить первичный, вторичный и третичный амин.
• Первичные образуют нестойкие диазосоединения, которые
разлагаются с выделением азота и образованием спирта
O=N-OH
H3C
NH2
H3C
N
N2 + H3C
N OH
• Вторичные амины с азотистой кислотой образуют
нитрозосоединения
O=N-OH
H3C
NH
H3C
H3C
N
-H2O
H3C
• Третичные амины – не реагируют
N
O
OH
18.
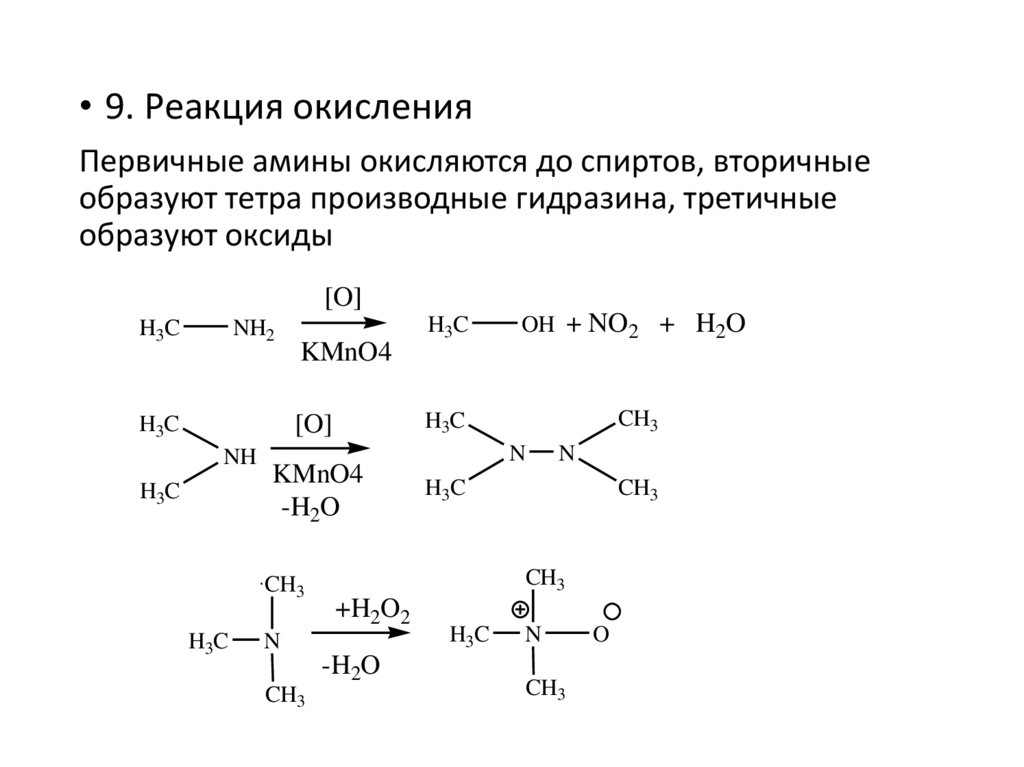
• 9. Реакция окисленияПервичные амины окисляются до спиртов, вторичные
образуют тетра производные гидразина, третичные
образуют оксиды
[O]
H3C
NH2
NH
H3C
KMnO4
-H2O
CH3
H3C
OH + NO2 + H2O
H3C
CH3
KMnO4
[O]
H3C
H3C
N
H3C
CH3
CH3
+H2O2
N
-H2O
CH3
N
H3C
N
CH3
O
19.
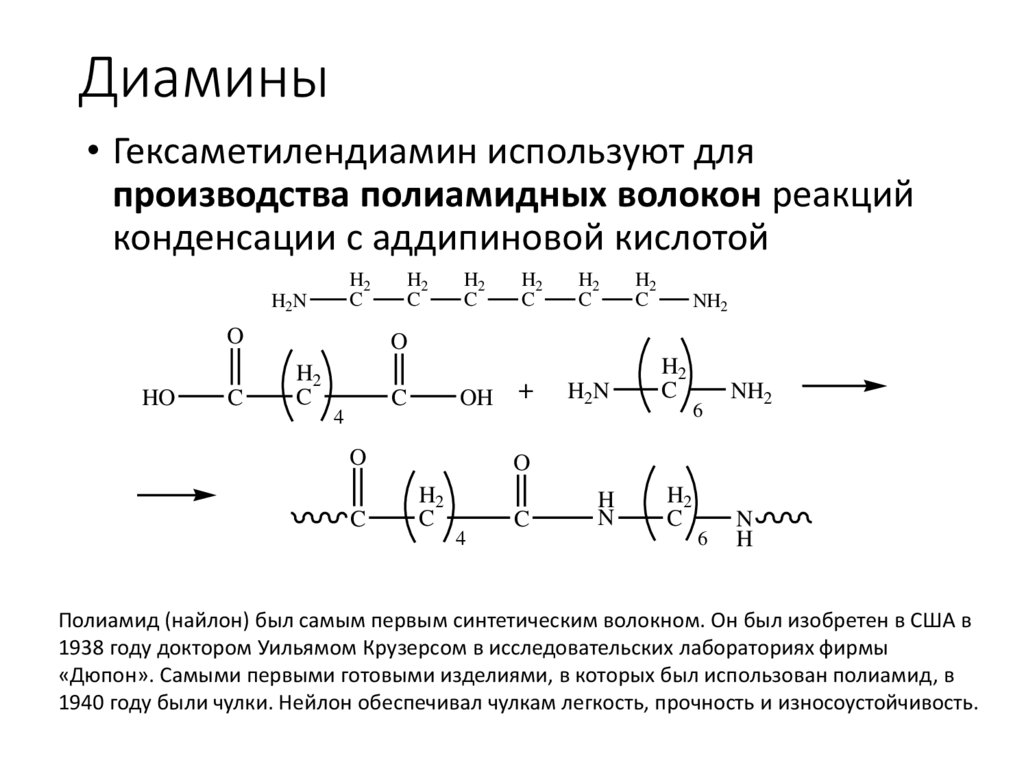
Диамины• Гексаметилендиамин используют для
производства полиамидных волокон реакций
конденсации с аддипиновой кислотой
H2
C
H2N
O
HO
C
H2
C
H2
C
H2
C
H2
C
H2
C
NH2
O
H2
C
C
4
OH
O
C
+
H2N
H2
C
H
N
H2
C
6
NH2
O
H2
C
4
C
6
N
H
Полиамид (найлон) был самым первым синтетическим волокном. Он был изобретен в США в
1938 году доктором Уильямом Крузерсом в исследовательских лабораториях фирмы
«Дюпон». Самыми первыми готовыми изделиями, в которых был использован полиамид, в
1940 году были чулки. Нейлон обеспечивал чулкам легкость, прочность и износоустойчивость.
20.
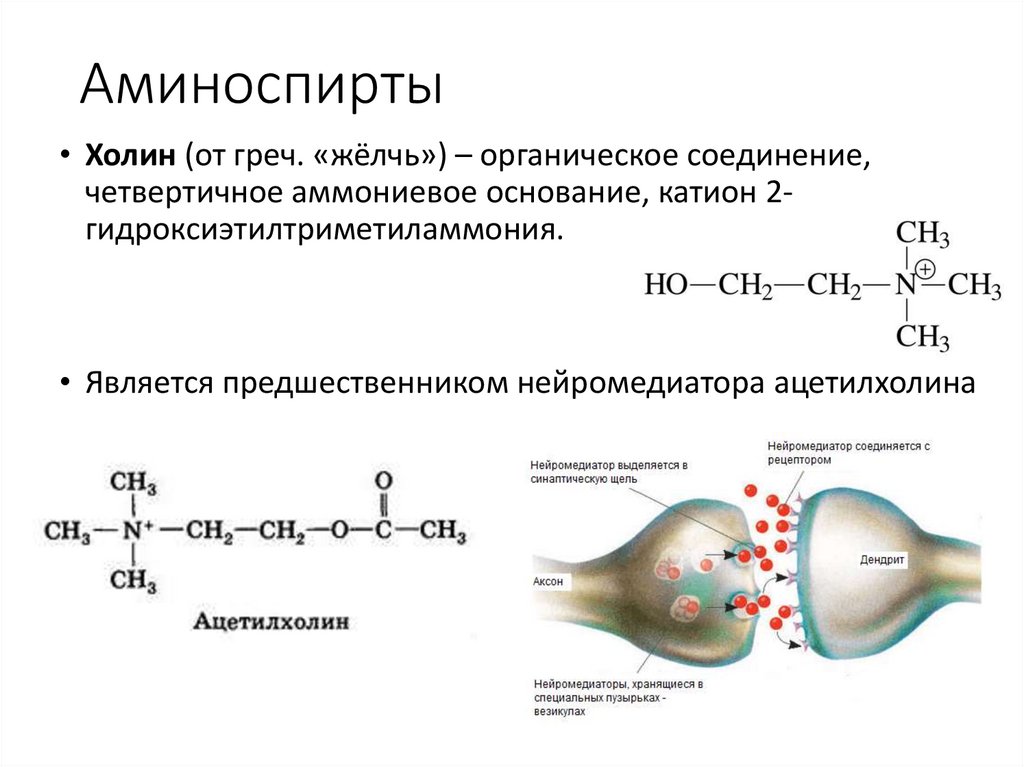
Аминоспирты• Холин (от греч. «жёлчь») – органическое соединение,
четвертичное аммониевое основание, катион 2гидроксиэтилтриметиламмония.
• Является предшественником нейромедиатора ацетилхолина
21.
Нитросоединения22.
• Нитросоединения – органические соединения,содержащие одну или несколько нитрогрупп –
NO2. Под нитросоединениями обычно
подразумевают C-нитросоединения, в которых
нитрогруппа связана с атомом углерода
(нитроалканы, нитроалкены, нитроарены)
• В зависимости от строения радикала R, различают
алифатические (предельные и непредельные),
ациклические, ароматические и гетероциклические
нитросоединения.
• По характеру углеродного атома, с которым связана
нитрогруппа, нитросоединения подразделяются на
первичные, вторичные и третичные.
23.
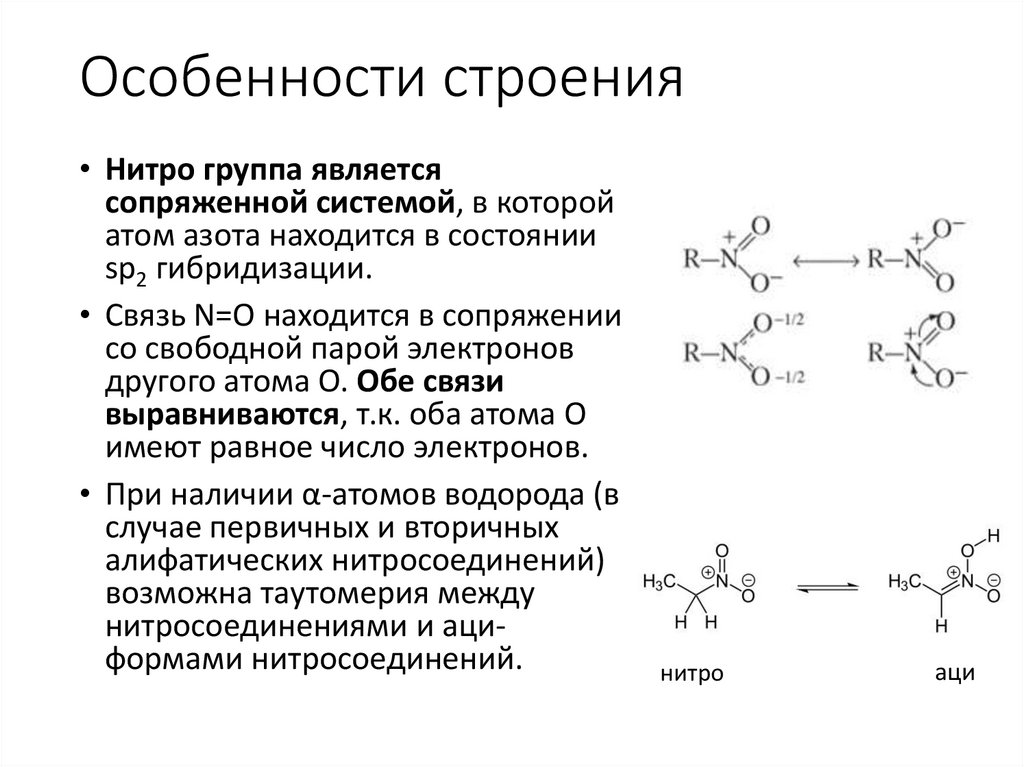
Особенности строения• Нитро группа является
сопряженной системой, в которой
атом азота находится в состоянии
sp2 гибридизации.
• Связь N=О находится в сопряжении
со свободной парой электронов
другого атома О. Обе связи
выравниваются, т.к. оба атома О
имеют равное число электронов.
• При наличии α-атомов водорода (в
случае первичных и вторичных
алифатических нитросоединений)
возможна таутомерия между
нитросоединениями и ациформами нитросоединений.
нитро
аци
24.
Получение1. Нитрование (по Коновалову) 140-150°С
разбавленной азотной кислотой или оксидами
азота
2. Из галогенпроизводных (реакция Мейера):
25.
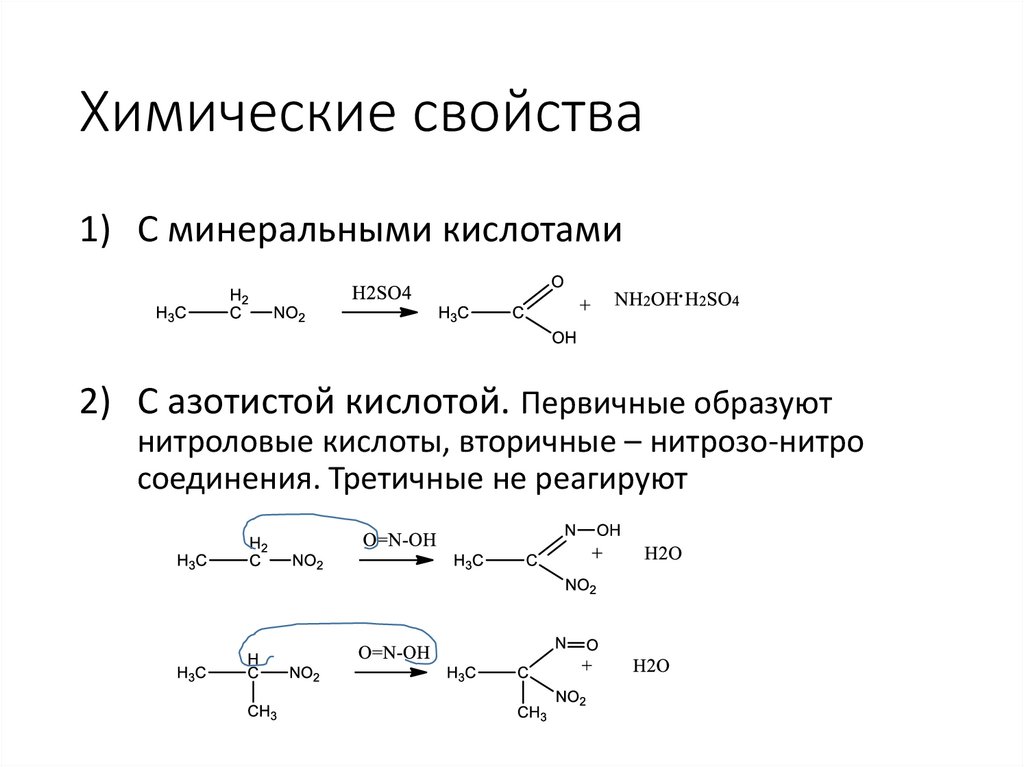
Химические свойства1) С минеральными кислотами
2) С азотистой кислотой. Первичные образуют
нитроловые кислоты, вторичные – нитрозо-нитро
соединения. Третичные не реагируют
26.
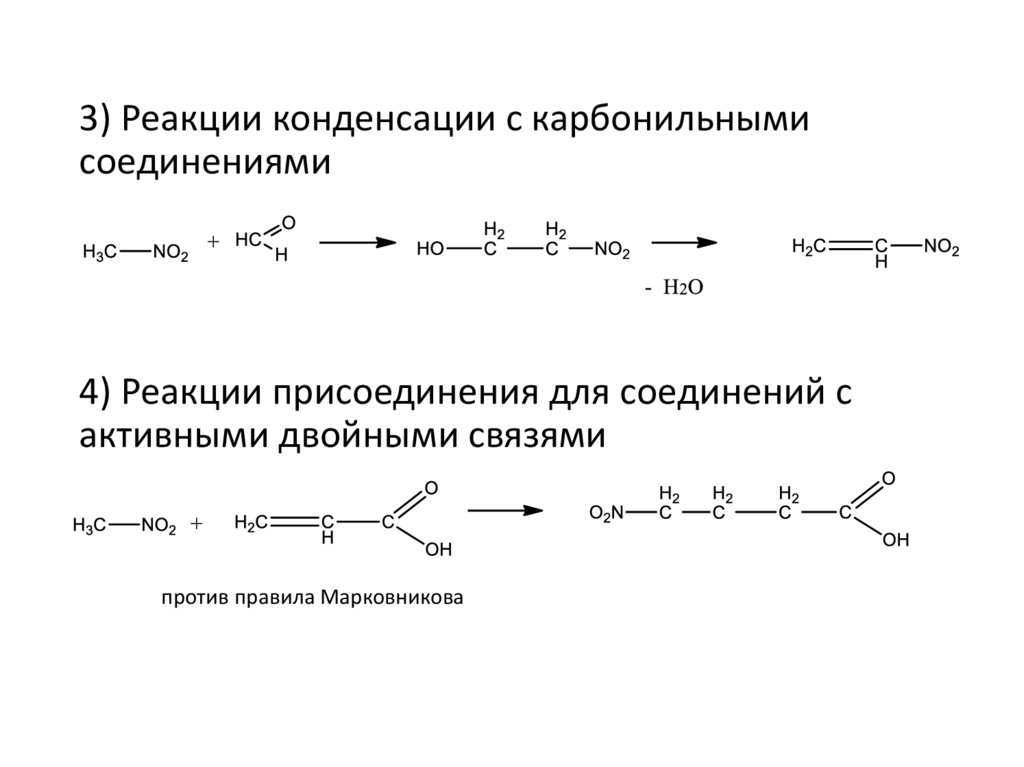
3) Реакции конденсации с карбонильнымисоединениями
4) Реакции присоединения для соединений с
активными двойными связями
против правила Марковникова
27.
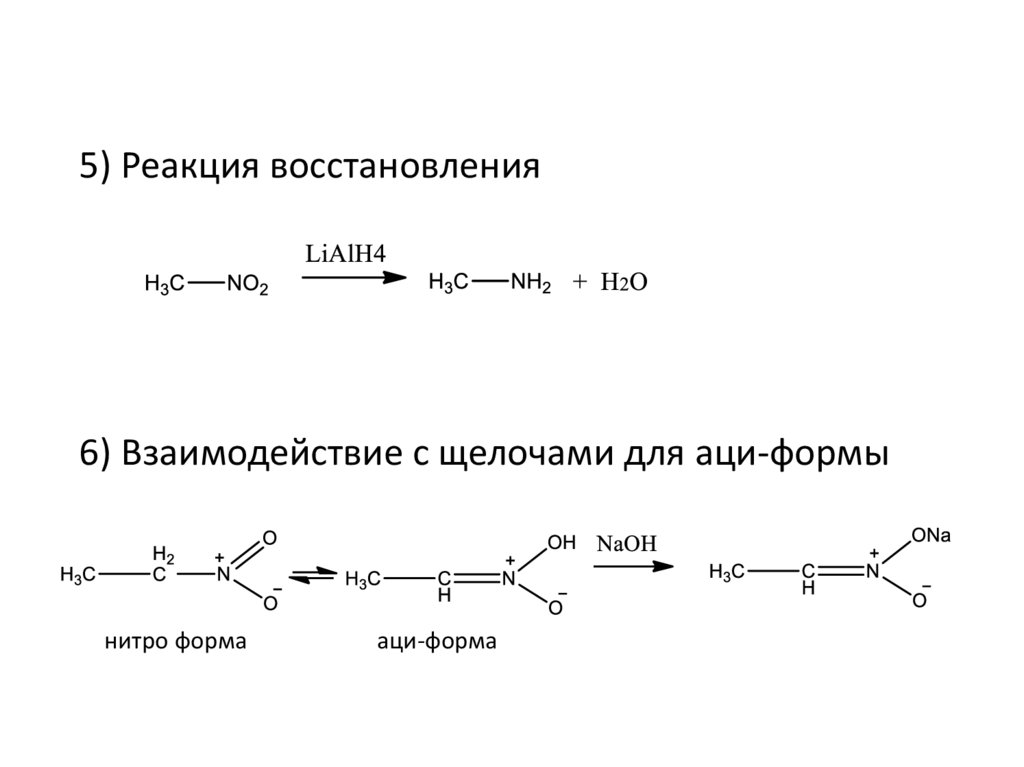
5) Реакция восстановления6) Взаимодействие с щелочами для аци-формы
нитро форма
аци-форма
28.
Применение аминов и нитросоединенийНитросоединения - полупродукты в производстве красителей, полимеров,
моющих препаратов и ингибиторов коррозии; смачивающих,
эмульгирующих, диспергирующих агентов; пластификаторов и
модификаторов полимеров, пигментов и пр. Они находят широкое
применение в органическом синтезе
Нитропарафины обладают сильным местным раздражающим действием и
являются относительно токсичными веществами. Относятся к клеточным
ядам общего действия, особенно опасны для печени.










 chemistry
chemistry








