Similar presentations:
Химические равновесия в растворах. Лекция 2 часть 2
1.
АНАЛИТИЧЕСКАЯ ХИМИЯЛЕКЦИЯ 2, часть 2
Химические равновесия в растворах
Лектор Семенова Ирина Николаевна
2.
Факторы, влияющие на растворимость осадков1. Концентрация ионов водорода
Растворимость осадков, образованных анионами слабых
кислот, увеличивается с увеличением концентрации ионов
водорода.
CaF2 = Ca2+ + 2F-
↓+2H+
2HF
Равновесие сдвигается в сторону растворения осадка.
3.
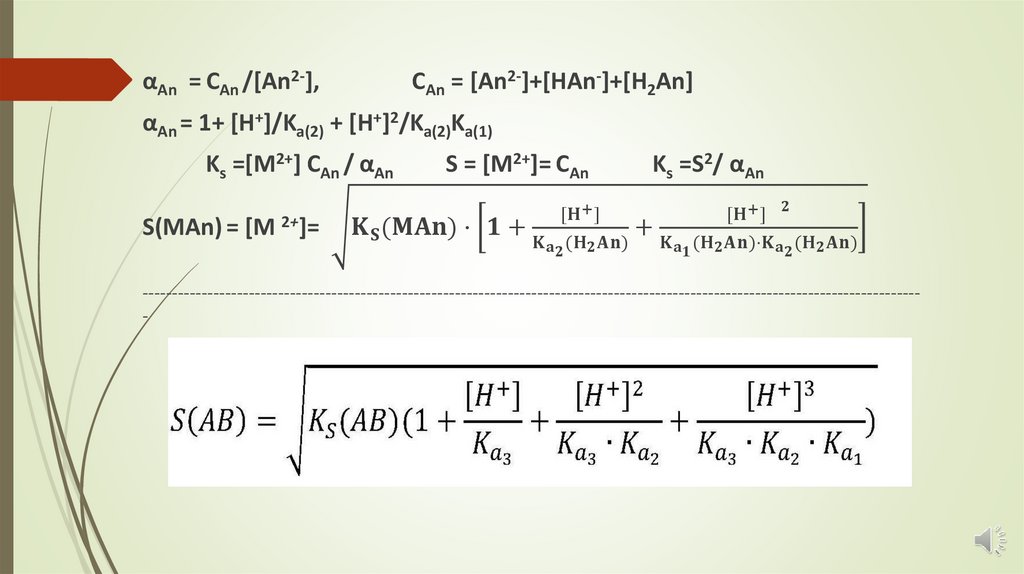
MAn (ос) ⇄ M2+ + An2Ks(MAn) = [M2+][An2- ]
При добавлении сильной кислоты в раствор над осадком An2 связываются с
ионами H+ , образуя слабую двухосновную кислоту H2An:
An2 + H+ ⇄ HAn
Ka(2) = [An2-][H+] /[HAn-]
HAn + H+ ⇄ H2An
Ka(1) = [HAn-][H+] /[H2An];
[HAn-]= [An2-][H+]/Ka(2)
[H2An]=[HAn-][H+]/Ka(1) = [An2-][H+]2/Ka(1)Ka(2)
Степень взаимодействия An2 с H+ характеризуется коэффициентом
побочной реакции αA
4.
αAn = CAn /[An2-],CAn = [An2-]+[HAn-]+[H2An]
αAn = 1+ [H+]/Ka(2) + [H+]2/Ka(2)Ka(1)
Ks =[M2+] CAn / αAn
S(MAn) = [M 2+]=
S = [M2+]= CAn
















 chemistry
chemistry








