Similar presentations:
Экзаменационные вопросы. Химическое равновесие
1.
Экзаменационные вопросы6. Химическое равновесие
1. Термодинамическое условие химического равновесия. Стандартная (термодинамическая) константа
равновесия. Сдвиг равновесия. Изобара и изотерма реакции. Принцип Ле-Шателье.
2. Кинетическое условие химического равновесия. Константа равновесия.
3. Расчет равновесного состава газовой смеси.
4. Равновесие в растворах. Электролитическая диссоциация. Константа диссоциации.
5. Ионное произведение воды. Водородный показатель.
6. Расчет pH растворов кислот и оснований. Многоосновные кислоты и многокислотные основания.
7. Гидролиз водных растворов солей. pH растворов солей.
8. Произведение растворимости. Расчет растворимости малорастворимых веществ.
9. Фазовые равновесия. Понятие компонента, термодинамической степени свободы. Правило фаз Гиббса.
Диаграмма состояния однокомпонентной системы (воды как универсального растворителя).
10. Молекулярные водные растворы. Закон Рауля. Диаграмма состояния двухкомпонентной системы. Изменение
температуры кристаллизации и кипения растворов.
11. Ионные водные растворы. Изотонический коэффициент. Изменение коллигативных свойств растворов.
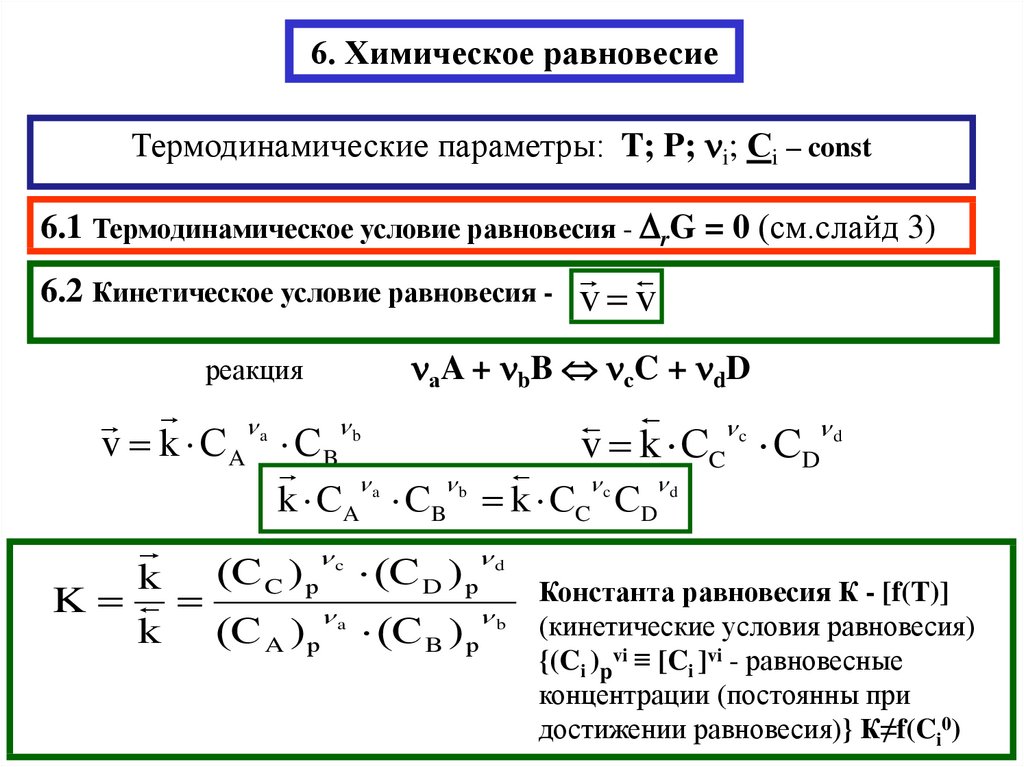
2. 6. Химическое равновесие
Термодинамические параметры: T; P; i; Сi – const6.1 Термодинамическое условие равновесия - rG = 0 (см.слайд 3)
6.2 Кинетическое условие равновесия -
v v
аA + bB сC + dD
реакция
a
b
c
d
v k СA СB
v k СC СD
k СA СB k СC СD
a
b
c
d
(С
)
(С
)
k
C р
D р
K
k (С A ) р a (С B ) р b
c
d
Константа равновесия К - [f(T)]
(кинетические условия равновесия)
{(Ci )pvi ≡ [Ci ]vi - равновесные
концентрации (постоянны при
достижении равновесия)} К≠f(Ci0)
3.
Энергия Гиббса реакции в нестандартных условияхреакция
аA + bB = сC + dD
rG0 = ( c fG0C + d fG0D ) – ( a fG0A + b fG0B ) С0 =1 моль/л
Сi С0
rGi = rG0i + R T lnCi
p
с
i
i
С
X
– Ci безразмерная концентрация, где Сi –
i
i
0
0
p с текущая концентрация [моль/л ], С0 =1 моль/л
i
Xi
i – мольная доля;
pi
– относительное парциальное давление [атм], p0 =1,013.105 Па
0
p
rG = ( c fG0C+ d fG0D ) – ( a fG0A+ b fG0B) + R T ( c lnСC+ d lnCD– a lnCA–
b lnCB)
c
d
С
С
0
C D
G
G
R
T
ln
r
r
v
v
a
b
С
С
A B
v
v
4.
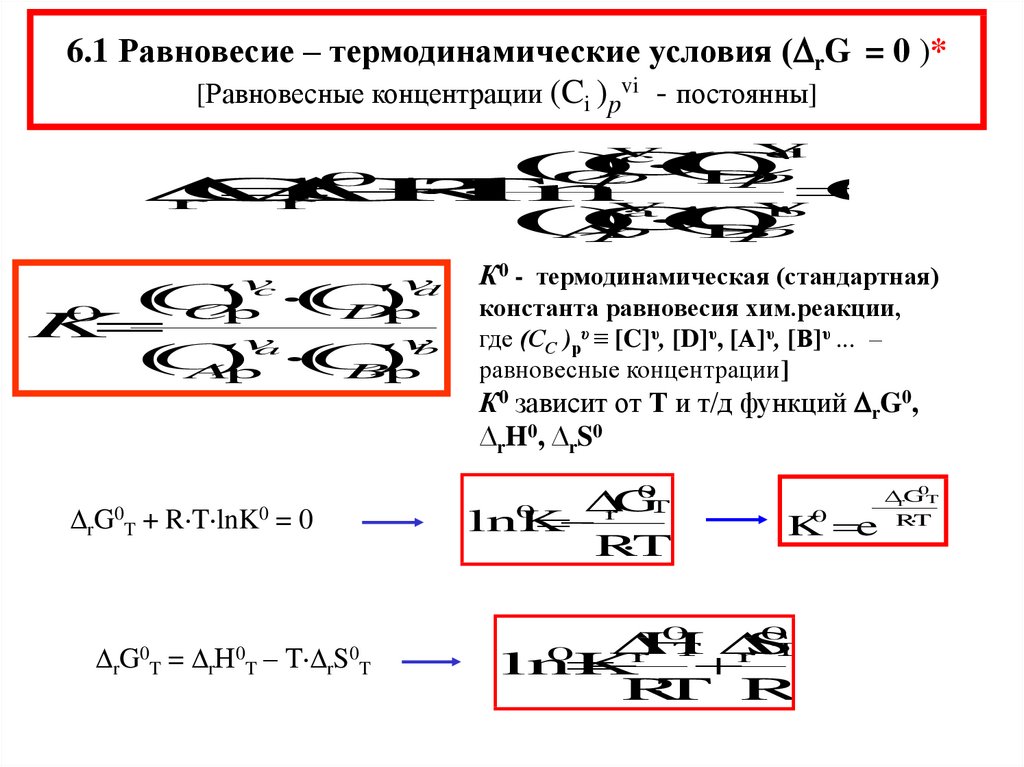
6.1 Равновесие – термодинамические условия ( rG = 0 )*[Равновесные концентрации (Ci )pvi - постоянны]
v
d
c
(С
)
(
С
)
C
р
D
р
0
G
G
R
T
ln
0
r
r
v
v
a
b
(С
)
(
С
)
A
р
B
р
v
(
С
) (
С
)
K
(
С
) (
С
)
v
c
Cр
v
a
Aр
0
v
d
Dр
v
b
Bр
К0 - термодинамическая (стандартная)
константа равновесия хим.реакции,
где (СС )рυ ≡ [C]υ, [D]υ, [А]υ, [В]υ ... –
равновесные концентрации]
К0 зависит от Т и т/д функций rG0,
∆rH0, ∆rS0
0
G
Т
0
lnK
r
R
T
rG0T + R T lnK0 = 0
r
G0
T
= r
Н0
T
– Т r
S0
T
K0 e
0
0
H
S
Т
Т
lnK
r r
R
T R
0
rG0T
R T
5.
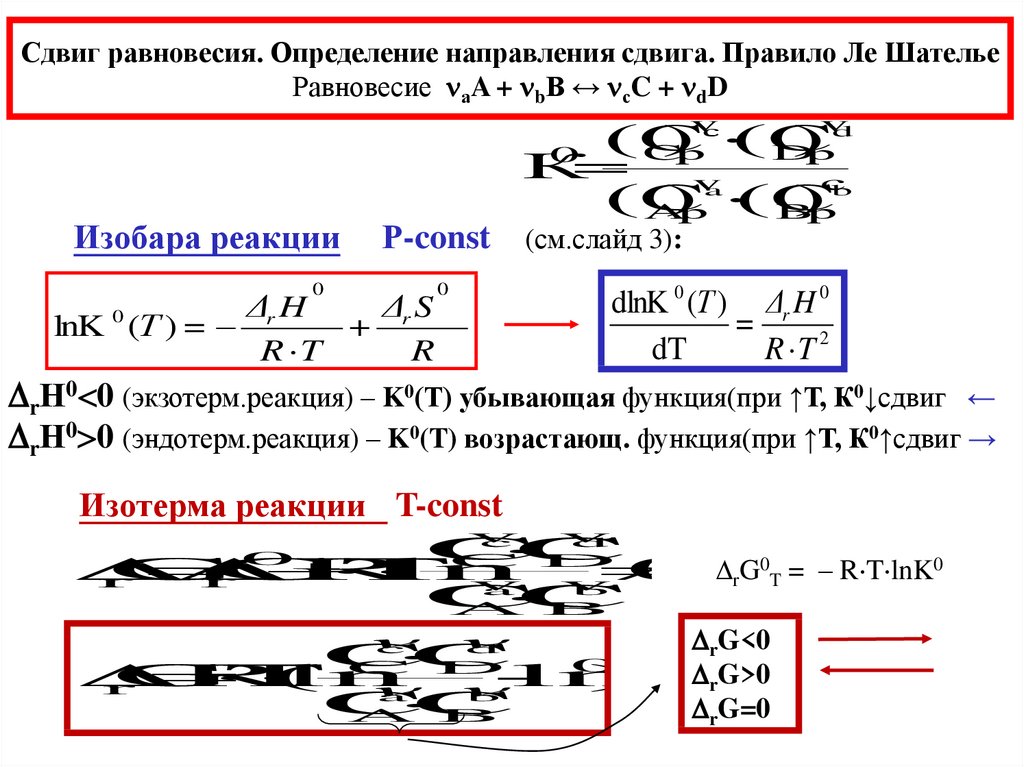
Сдвиг равновесия. Определение направления сдвига. Правило Ле ШательеРавновесие аA + bB ↔ сC + dD
с
d
(С
)
(С
)
Cр
Dр
0
К
v
c
a
b
(С
)
(С
)
Aр
Bр
v
Изобара реакции
v
Р-const (см.слайд 3):
0
Δr H
Δr S
0
lnK (Т ) =
+
R T
R
0
dlnK 0 (Т ) Δr H 0
=
dT
R T 2
rН0 0 (экзотерм.реакция) – K0(T) убывающая функция(при ↑Т, К0↓сдвиг ←
rН0 0 (эндотерм.реакция) – K0(T) возрастающ. функция(при ↑Т, К0↑сдвиг →
Изотерма реакции T-const
c
d
С
С
0
C
D
rG0T = – R T lnK0
G
G
R
T
ln
0
r
r
v
v
a
b
С
С
A B
v
v
G<0
c
d
r
С
С
0
C D
rG>0
G
R
T
(
ln
lnK
)
r
a
b
С
С
rG=0
A
B
6. Константа равновесия К, её размерность. Связь между К [кинетич.К-f(T), K≠f(Cнач)] и стандартной К0 [термодинам.К0–f(T, т/д
Константа равновесия К, её размерность. Связь между К[кинетич.К-f(T), K≠f(Cнач)] и стандартной К0 [термодинам.К0–
f(T, т/д функций)] Для равновесной реакции: аA + bB = сC + dD
K
d
(СC ) р c (С D ) р
a
A р
(С )
b
B р
(С )
К≡KX - концентрации задаются мольными долями [безразмерная величина]
К≡Kp - концентрации задаются парциальными давлениями - [(Па) ]
= ( c+ d) - ( a+ b)
К≡KC – концентрации задаются молярной концентрацией - [(моль/л) ]
p
K X K ( 0 )
p
0
0
K p K (p )
0
R T
KC K ( 0 )
p
0
p/p 0 ~p физ.атм., относит.давл. р0 = 1,013 105 Па - стандартное
давление
7. Равновесие – динамическое (непрерывное протекание прямой и обратной реакции в состоянии равновесия, где [A], [B], [C], [D] –
постоянные равновесные концентрации)Реакция
При t= 0
аA + bB eE + dD
CA= (CA)0 CB= (CB)0
CE= 0
CD=0
С
(CA)0
(CB)0
(CD)р ≡ [D] – пост. равновесные конц.
(CE)p ≡ [E]
(CA)p ≡ [A]
(CB)p ≡ [E]
(CD)0
(CE)0
v
t
• v
v v
0
v
tрав
t
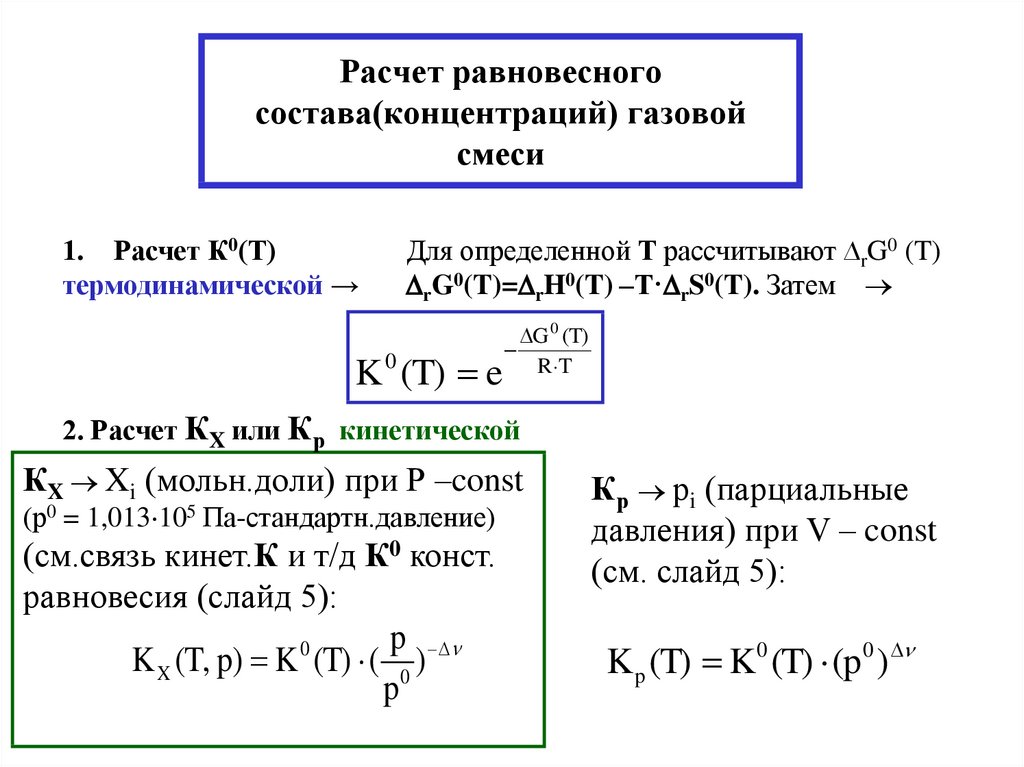
8. Расчет равновесного состава(концентраций) газовой смеси
1. Расчет К0(Т)термодинамической →
Для определенной Т рассчитывают ∆rG0 (T)
rG0(T)= rH0(T) –Т· rS0(T). Затем
K 0 (T) e
G 0 (T)
R T
2. Расчет КX или Кр кинетической
КX Xi (мольн.доли) при Р –const
(р0 = 1,013 105 Па-стандартн.давление)
(см.связь кинет.К и т/д К0 конст.
равновесия (слайд 5):
p
0
K X (T, p) K (T) ( 0 )
p
Кр рi (парциальные
давления) при V – const
(см. слайд 5):
K p (T) K0 (T) (p0 )
9. 3. Пример расчета равновесного состава (через мольные доли Хi →К Х ). Диссоциация АВ при Р -const и температуре Т
АВt=0
равновесие
=
САВ
+
0
ni (число молей) САВ - z
С АВ z
Xi
С АВ z
(мольн.доли)
ni
Xi
ni
А
z
z
С АВ z
В
0
z
z
С АВ z
n i (САВ z) ( z) ( z) САВ z
z z (САВ z )
z2
KX
2
(САВ z ) (САВ z ) (САВ z ) САВ z 2
KX С
2
АВ
KX z z
2
2
z
K X С 2АВ
K X 1
10. Равновесие в растворах (дисперсных системах)
Раствор - гомогенная однофазная многокомпонентная система,образованная двумя или более веществами. По агрегатному состоянию - газовые,
жидкие и твёрдые растворы. Основн. способ получения жидк.р-ров - растворение
А - растворенное вещество-твёрдое, жидкое, газ
(дисперсная фаза)
А+В
В – растворитель (дисперсионная среда)
А+В – раствор (дисперсная система)
Концентрация раствора – важная характеристика раствора
(относительное соотношение количеств растворенного вещества и растворителя)
m
A
•массовая доля - %
100%
m A B
(процент.конц.)
• мольная доля X %
моль
•молярная концентрация - С М А [
]
VA B
л
•нормальная концентр.– СН
моль
•моляльная концентрация - С m А [
]
mB
кг
•массовая конц. (г/л)
A
100%
A B
11. Электролитическая диссоциация
АВA+
+
B-
A+ + B- AB
АВ A+ + B- *)
С0 - общая концентрация
СД - конц.молекул в виде
ионов
СД = [A+]=[B-]=αС0
[AB]= С0 - αС0
Сд
Где α степень диссоциации -
С0
α>50%, <5%, 5<α<50%
Сильные, слабые, средней силы электролиты
[ A ][ B ]
*) Константа диссоциации(равновесия) – K д
[ AB]
Иногда вместо [Сi] = ai , где ai = γi Ci ,
ai – активность, γi – коэфф. активности
Сильн.: 1 КД
[ A ][ B ] С0 С0 2 С0
Kд
[ AB]
С0 С0
1
Слаб.: α 0
К д = α 2С0
КД
С0
12. Ионное произведение воды Kw = [H+] [OH–]
Ионное произведение водыKw = [H+] [OH–]
H2O H+ + OH- слабый электролит
[H ] [OH ]
Kд
[H 2O]
Kw = [H+] [OH–] = 1,0 10-14 [(моль/л)2]
0
[H2O]-const
[H2O]=1000/18 [моль/л] K = К [H O] = [H+] [OH–] = 1,0 10-14
w
Д
2
КД = 1.8 10 -16
– наз. ионное произведение воды
(постоянная величина в водных р-рах)
Нейтральная среда [H+] = [OH–] = 10-7 [моль/л]
Кислая среда [H+] > 10-7 т.е. (10-6,-5,-4 …); [OH–] < 10-7(10-8,-9,-10
…) [моль/л]
Щелочн.среда [H+] < 10-7(10-8,-9,-10 …); [OH–] > 10-7(10-6,-5,-4 …)
[моль/л]
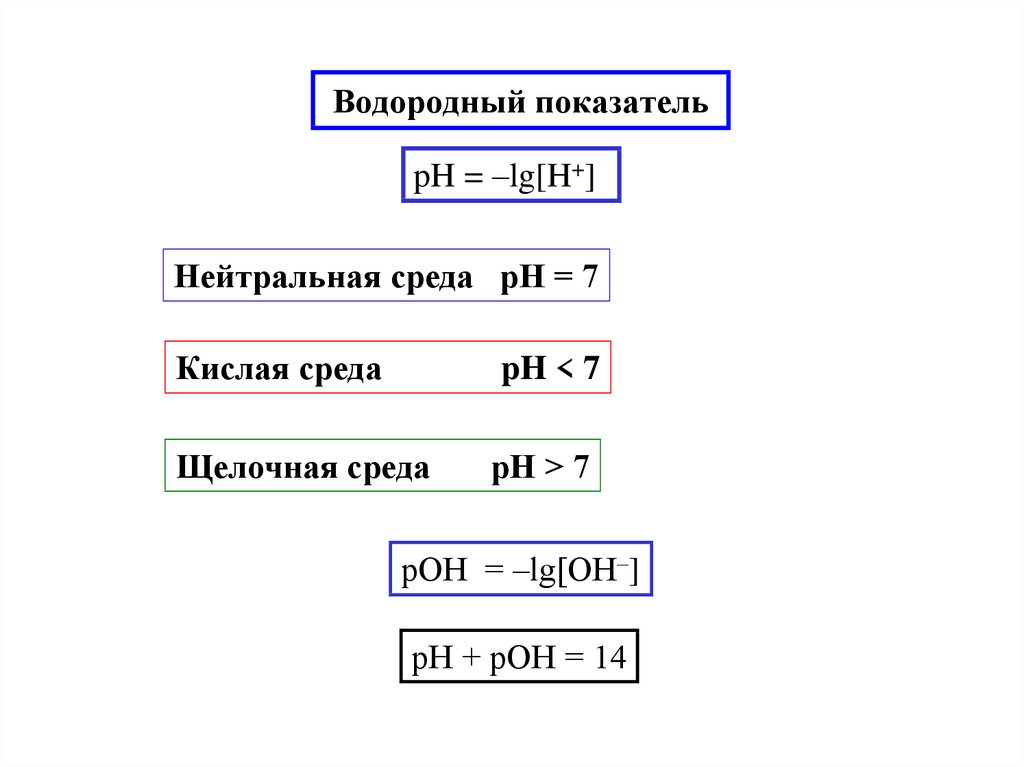
13. Водородный показатель
pH = –lg[H+]Нейтральная среда pH = 7
Кислая среда
pH < 7
Щелочная среда
pH > 7
pОH = –lg[ОH–]
pH + pОH = 14
14. Растворы кислот и оснований
HAn H+ + An-МеOH Ме+ + OH-
[Ме ][OH ]
[H ][An ]
Kb
Kа
[МеOH]
[HAn]
Слабые электролиты 0
[H ]2
Kа
[HAn]
[H ] K a Скисл
pH lg[ K a Cкисл ]
[OH ]2
Kb
[МеOH]
[OH ] Kb Сосн
pH 14 lg[ K b Cосн ]
Сильные электролиты 1
[H+] = C кисл ;
[OH -] = Сосн, pH = 14 - рОН
рН = –lg[ Скисл]
pH = 14 + lg[ Cосн]
15. Многоосновные кислоты и основания
H2An H+ + НAn-Ме(OH)2 МеOH+ + OH-
[H ][НAn ]
K а1
[H 2 An]
[МеОН ][OH ]
K b1
[Ме(OH) 2 ]
HAn- H+ + An2
Kа2
2
[H ][An ]
[HAn ]
Ка1 >> Ка2
МеOH+ Ме2+ + OH-
[Ме 2 ][OH ]
Kb 2
[МеOH ]
Кb1 >> Кb2
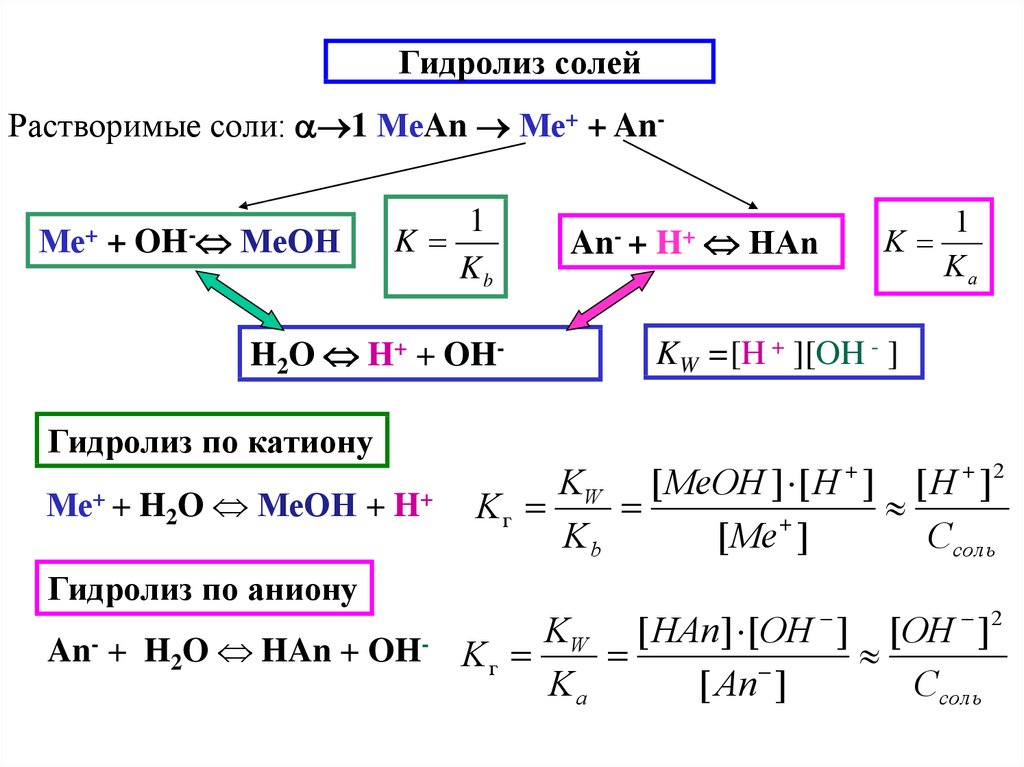
16. Гидролиз солей
Растворимые соли: 1 МеAn Ме+ + AnМе++
OH-
МеOH
1
K
Kb
H2O H+ + OHГидролиз по катиону
Ме+ + H2O МеOH + H+
Гидролиз по аниону
An- + H2O HAn + OH-
An- +
H+
HАn
1
K
Ka
KW =[H + ][OH - ]
KW [ MeOH ] [ H ] [ H ]2
Kг
Kb
[ Me ]
Cсоль
KW [ HAn] [OH ] [OH ]2
Kг
Ka
[ An ]
Cсоль
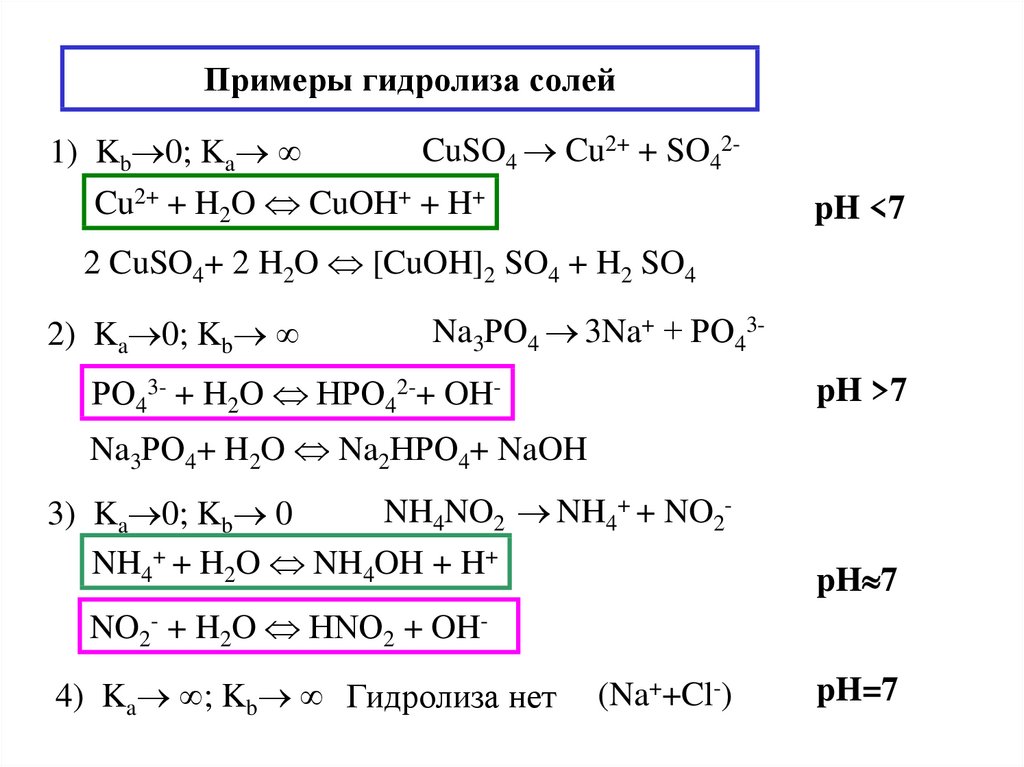
17. Примеры гидролиза солей
1) Kb 0; KaCuSO4 Cu2+ + SO42-
Cu2+ + H2O CuOH+ + H+
pH <7
2 CuSO4+ 2 H2O [CuOH]2 SO4 + H2 SO4
2) Ka 0; Kb
Na3РO4 3Na+ + РO43-
РO43- + H2O HРO42-+ OH-
pH >7
Na3РO4+ H2O Na2HРO4+ NaOH
NH4NO2 NH4+ + NO23) Ka 0; Kb 0
NH4+ + H2O NH4OH + H+
pH 7
NO2- + H2O НNO2 + OH4) Ka ; Kb Гидролиза нет
(Na++Cl-)
pH=7
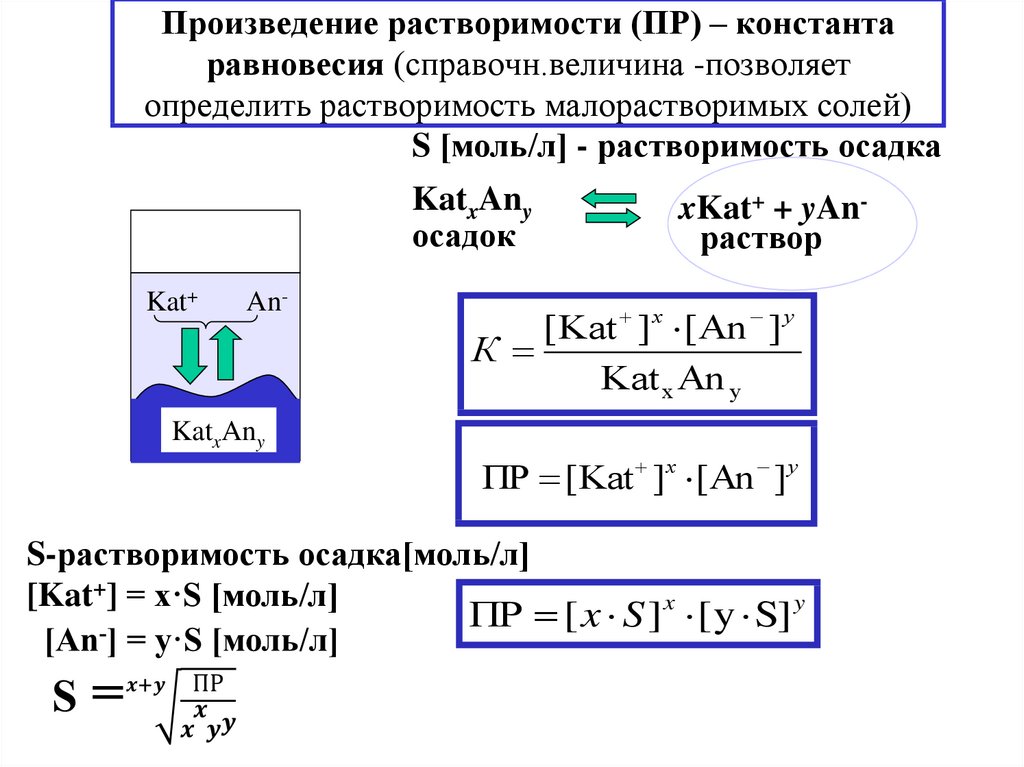
18. Произведение растворимости (ПР) – константа равновесия (справочн.величина -позволяет определить растворимость малорастворимых
солей)S [моль/л] - растворимость осадка
KatxAny
осадок
Kat+
An-
xKat+ + yAnраствор
[Kat ] x [An ] y
К
Kat x An y
KatxAny
ПР [Kat ]x [An ] y
S-растворимость осадка[моль/л]
[Kat+] = x·S [моль/л]
ПР [ x S ]x [ y S] y
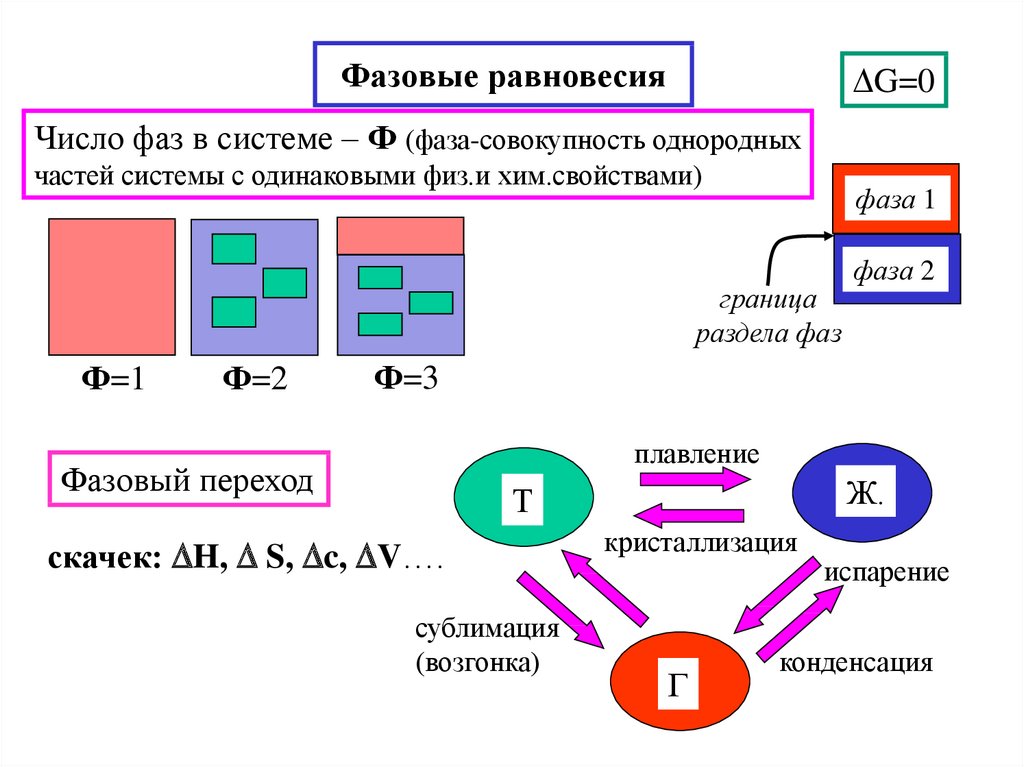
19. Фазовые равновесия
G=0Число фаз в системе – Ф (фаза-совокупность однородных
частей системы с одинаковыми физ.и хим.свойствами)
фаза 1
граница
раздела фаз
Ф=1
Ф=2
фаза 2
Ф=3
плавление
Фазовый переход
Ж.
Т
скачек: H, S, c, V….
сублимация
(возгонка)
кристаллизация
Г
испарение
конденсация
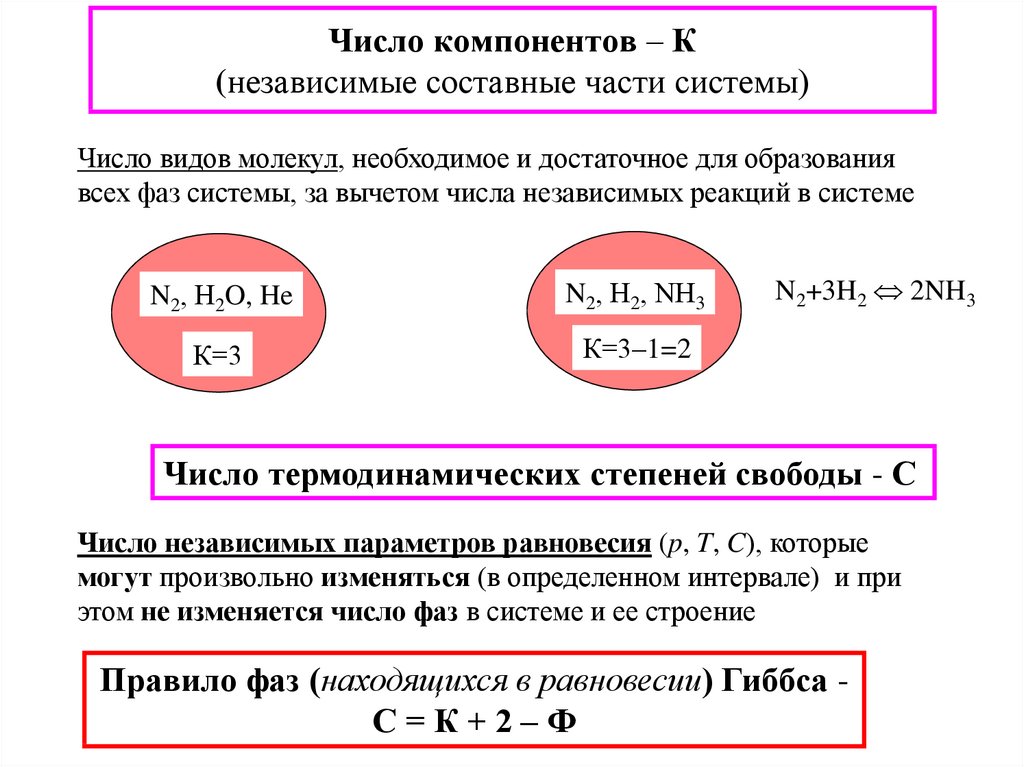
20. Число компонентов – К (независимые составные части системы)
Число видов молекул, необходимое и достаточное для образованиявсех фаз системы, за вычетом числа независимых реакций в системе
N2, Н2O, He
N2, Н2, NН3
К=3
К=3–1=2
N2+3H2 2NH3
Число термодинамических степеней свободы - С
Число независимых параметров равновесия (p, T, C), которые
могут произвольно изменяться (в определенном интервале) и при
этом не изменяется число фаз в системе и ее строение
Правило фаз (находящихся в равновесии) Гиббса С=К+2–Ф
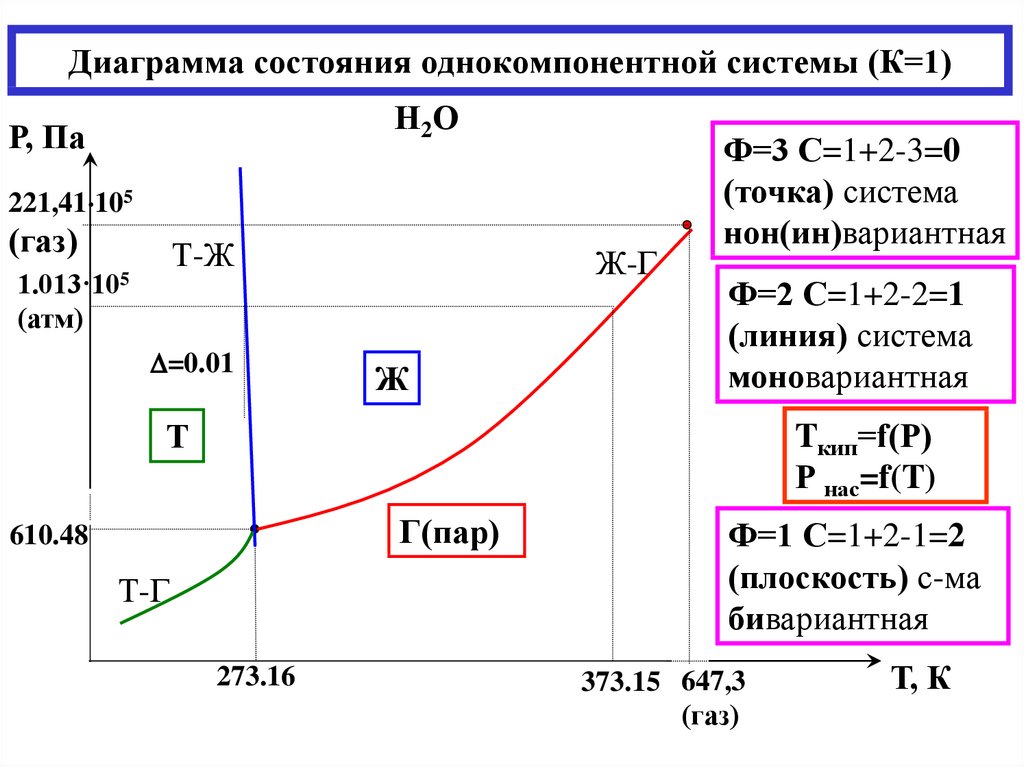
21. Диаграмма состояния однокомпонентной системы (К=1)
Н2ОР, Па
221,41 105
(газ)
Т-Ж
1.013·105
(атм)
=0.01
Ж-Г
Ж
Ф=3 С=1+2-3=0
(точка) система
нон(ин)вариантная
Ф=2 С=1+2-2=1
(линия) система
моновариантная
Tкип=f(Р)
Р нас=f(T)
Т
Г(пар)
610.48
Т-Г
273.16
Ф=1 С=1+2-1=2
(плоскость) с-ма
бивариантная
373.15 647,3
(газ)
Т, К
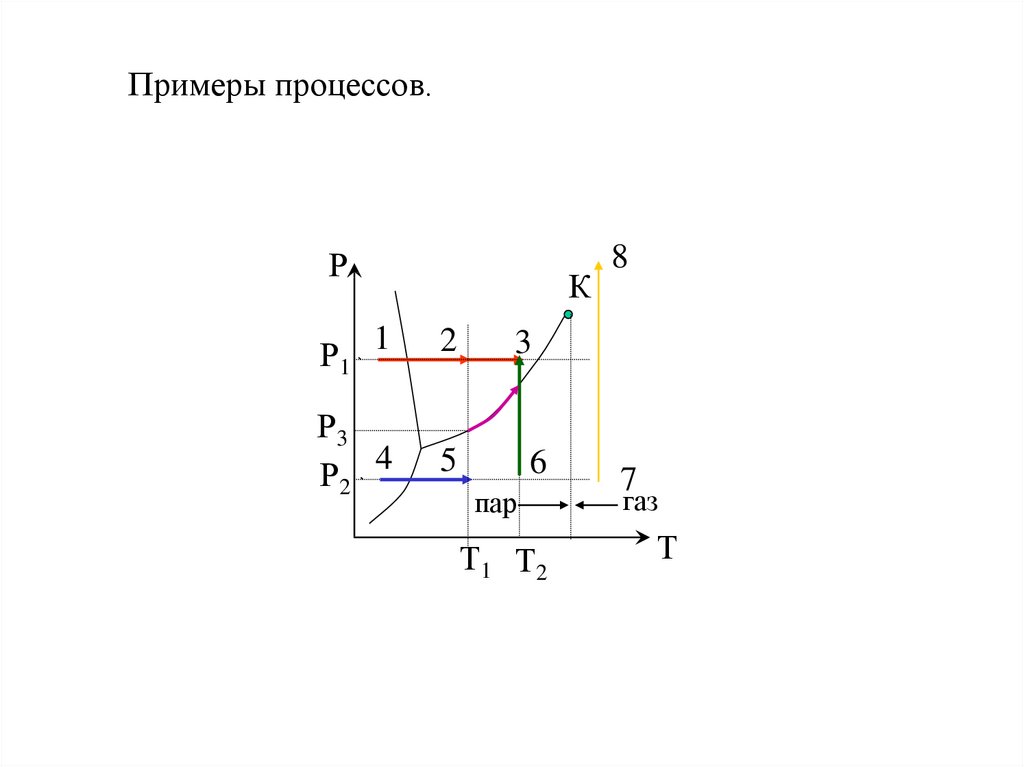
22. Примеры процессов.
РК
Р1 1
2
Р3
Р2 4
5
8
3
6
пар
Т1 Т2
7
газ
Т
23. Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор.
0 р-р неэлектролитаp0 –давление насыщенного
Н2Опар
пара (Н2Опар ) над чистым
растворителем (Н2О)
рА –давление (Н2Опар )
над раствором (Н2О+А)
Н2О + А
p
XA
p0
Закон Рауля
p0 p А
A
p0
A p
Двухфазное равновесие
1) Т Ж; Ж Г
С=2+2–2=2
Tпл=f(р,СА)
Tкип=f(р,СА)
2) Т Г
Ф=3
С=2+2–3=1
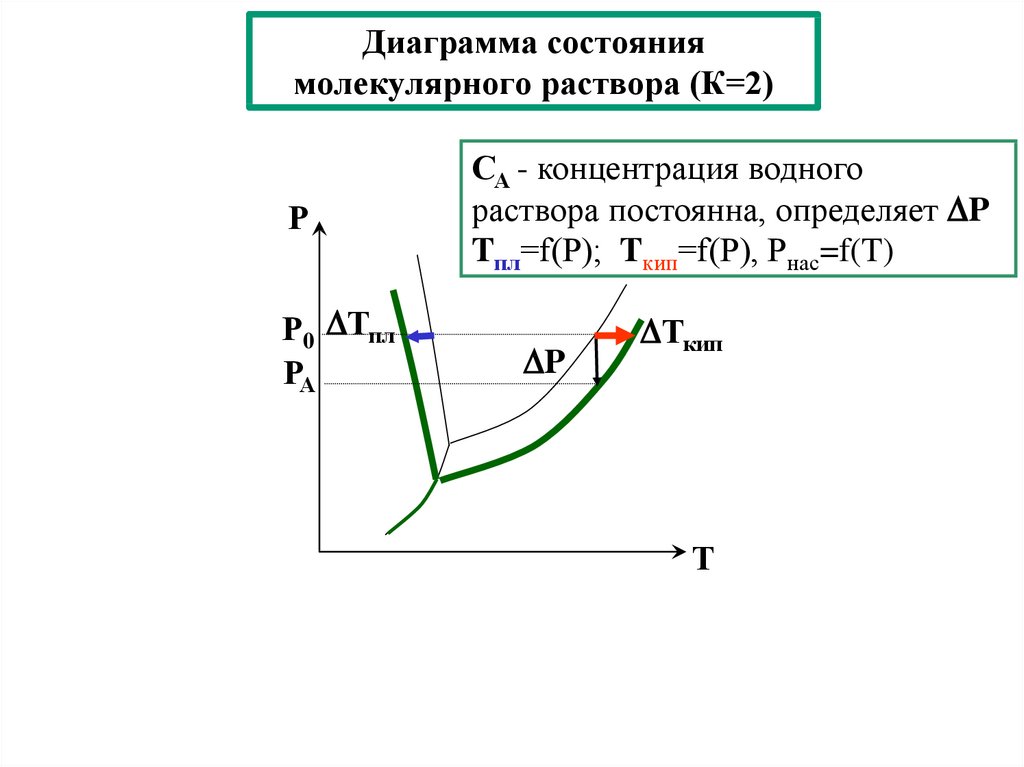
24. Диаграмма состояния молекулярного раствора (К=2)
РР0 Тпл
РА
СА - концентрация водного
раствора постоянна, определяет P
Tпл=f(Р); Tкип=f(Р), Рнас=f(T)
P
Ткип
Т
25. Кипение и кристаллизация растворов
• Повышение температуры кипения раствора по сравнению с чистымрастворителем ( Ткип) прямо пропорционально концентрации
растворенного вещества
Ткип = Kэб См
См [моль/кг] – моляльная концентрация
Kэб [К кг/моль]– эбуллиоскопическая постоянная растворителя
• Понижение температуры кристаллизации раствора по сравнению с
чистым растворителем прямо пропорционально концентрации
растворенного вещества
Ткр = Kкр См
Kкр [К кг/моль]– криоскопическая постоянная растворителя
R (Tкип ) 2 M
K эб
1000 v H
vH - [Дж /кг]
mH
K кр
R (Tкр ) 2 M
1000 m H
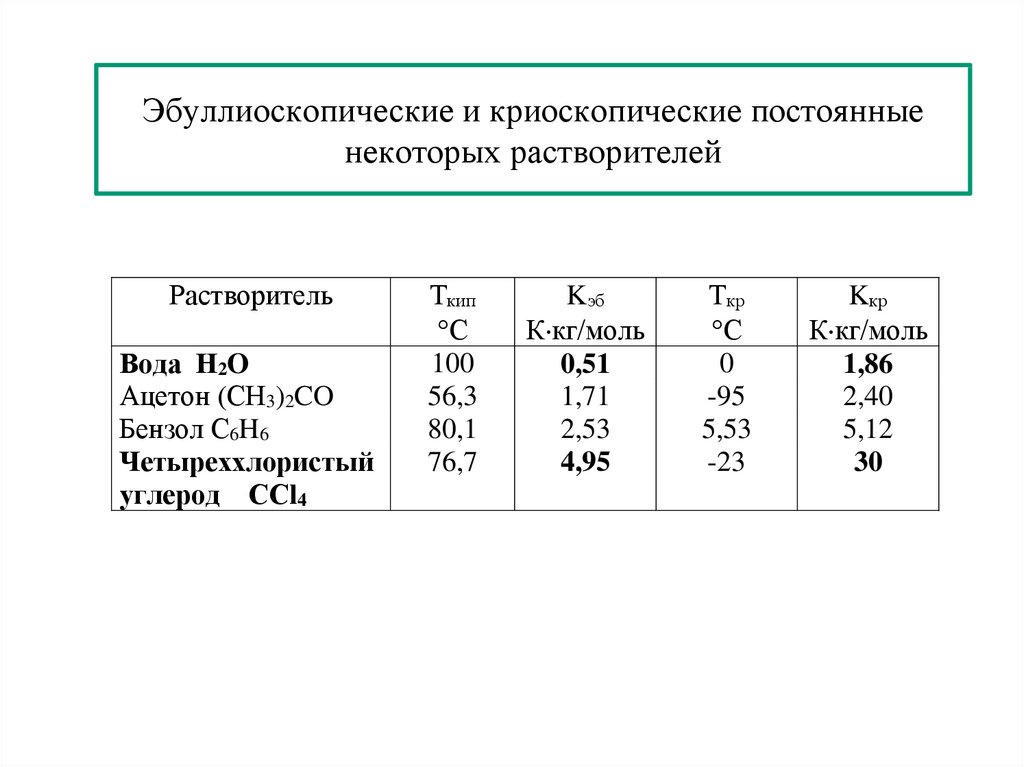
26. Эбуллиоскопические и криоскопические постоянные некоторых растворителей
РастворительВода H2O
Ацетон (CH3)2CO
Бензол C6H6
Четыреххлористый
углерод CCl4
Ткип
С
100
56,3
80,1
76,7
Kэб
К кг/моль
0,51
1,71
2,53
4,95
Ткр
С
0
-95
5,53
-23
Kкр
К кг/моль
1,86
2,40
5,12
30
27. Изотонический коэффициент – i (для растворов электролитов)
- показывает увеличение числа частиц в растворе электролита по сравнениюс раствором не электролита (молекулярного раствора) той же концентрации
(приводит к изменению коллигативных свойств растворов электролитов)
АxВy x А+ + y ВN0 - число молекул растворенного вещества; N0 (x + y )+(N0 - N0 ) суммарное число частиц (ионов и недиссоциированных молекул)
- степень диссоциации, m = x + y
i
N 0 (x y) (N 0 N 0 )
N0
1 сильн.
электролиты
Ткип = i Kэб См
m 1 (m - 1) 1
i=m
Ткр = i Kкр См
P
i XA
P0


![Константа равновесия К, её размерность. Связь между К [кинетич.К-f(T), K≠f(Cнач)] и стандартной К0 [термодинам.К0–f(T, т/д Константа равновесия К, её размерность. Связь между К [кинетич.К-f(T), K≠f(Cнач)] и стандартной К0 [термодинам.К0–f(T, т/д](https://cf2.ppt-online.org/files2/slide/k/KAuUf3qhzQwJCjkSpvmYTdP5O6aX9s0trN1HFl/slide-5.jpg)
![Равновесие – динамическое (непрерывное протекание прямой и обратной реакции в состоянии равновесия, где [A], [B], [C], [D] – Равновесие – динамическое (непрерывное протекание прямой и обратной реакции в состоянии равновесия, где [A], [B], [C], [D] –](https://cf2.ppt-online.org/files2/slide/k/KAuUf3qhzQwJCjkSpvmYTdP5O6aX9s0trN1HFl/slide-6.jpg)



![Ионное произведение воды Kw = [H+] [OH–] Ионное произведение воды Kw = [H+] [OH–]](https://cf2.ppt-online.org/files2/slide/k/KAuUf3qhzQwJCjkSpvmYTdP5O6aX9s0trN1HFl/slide-11.jpg)


![Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор. Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор.](https://cf2.ppt-online.org/files2/slide/k/KAuUf3qhzQwJCjkSpvmYTdP5O6aX9s0trN1HFl/slide-22.jpg)


 chemistry
chemistry








