Similar presentations:
Ионные равновесия в растворах
1.
Ионные равновесия в растворахЛекция 15 по курсу «Общая и неорганическая
химия»
2.
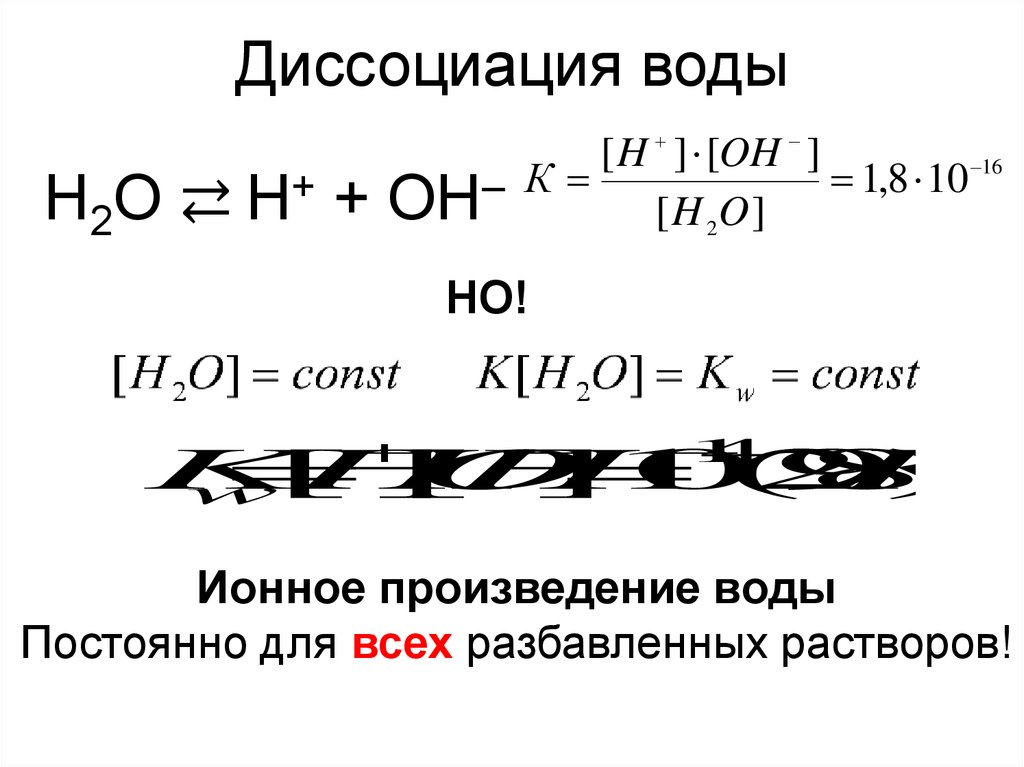
Диссоциация водыH2 O ⇄ H+ +
[ H ] [OH ]
16
К
1,8 10
–
OH
[ H 2O ]
НО!
1
4
KH
[]
[
O
H
]1
0
(
2
9
8
K
)
w
Ионное произведение воды
Постоянно для всех разбавленных растворов!
3.
При 22°С степень электролитической диссоциации водыравна 1,8·10-9, то есть из 555000000 молекул воды диссоциирует одна. Следовательно, вода – очень слабый электролит и для
описания процесса ее диссоциации применим закон действующих масс.
[ H ] [OH ]
К
[ H 2O ] ,
где К - константа диссоциации воды равный 1,8 10-16.
[Н+]·[ОН-] = К·[Н2О]
Так как [Н2О] = const = 55,56 моль/дм3, то получим:
[Н+][ОН-] = Кw.
Постоянная Кw называется ионным произведением воды.
1
4
KH
[]
[
O
H
]1
0
(
2
9
8
K
)
w
4.
Водородный показатель (pH)pH = –lg[H+]
H 2O
⇄ H+
+
OH–
[H+] > [OH–]
Кислая
среда
Kw = [H+][OH–] = 10–14
[H+] =
[OH–]
Нейтральная
среда
[H+] < [OH–]
Щелочная
среда
-1 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
Лакмус
Лакмус
Метилоранж
Метилоранж
Фенолфталеин
Фенолфталеин
5.
Значения рН некоторых растворовpH
0
1
2
3
4
5
6
7
8
9
10
11
12
13
Окраска индикатора
Пример раствора
Точный
pH
HCl (1:10)
HCl (0.1 M)
Лимон
Яблочный сок, столовый уксус
Томатный сок
Черный кофе
Молоко
Чистая вода
Слезы, кровь
1% раствор NaHCO3
0.0
0.1 М раствор NH3
0.1 M раствор Na2CO3
0.1 M раствор NaOH
11.3
11.7
12.9
1.0
2.1
2.3 – 2.7
4.1
5.0
6.3
7.0
7.4
8.5
6.
Степень гидратации различных ионов и молекулнеодинакова и зависит от размеров частиц и
величины их заряда. Чем больше заряд и
меньше размеры иона, то есть выше удельная
плотность заряда, тем больше степень
гидратации.
Недиссоциированные молекулы также в той или
иной степени гидратированы, их гидратная
оболочка возникает только вокруг полярных
групп и потому может быть не сплошной.
Гидратация ионов в растворе влияет на их
подвижность, причем зависимость обратно
пропорциональная.
7.
Равновесие растворенияИсходное
состояние
Растворение
началось
Равновесное
состояние
8.
Константа (произведение)растворимости
KtxAny(к) ⇄ xKty+(р) + yAnx–(р)
y
x
x
y
K
[
K
t
][
A
n
]
s
В старых книгах обозначают как ПР
Применима только к малорастворимым и
нерастворимым электролитам!
9.
Расчет растворимости по Ksa) В чистой воде
AgCl(к) ⇄ Ag+(р) + Cl–(р)
1
0
KA
[gC
]
[l]1
.
5
6
1
0
s
(размерность моль2/дм2 подразумевается, но не пишется)
По уравнению реакции:
[A
g]
[C
l ] x
(т.к. никаких других источников ионов в растворе нет)
5
3
моль/дм
K
x
x
K
1
.
2
5
1
0
s
s
2
Нашли концентрацию. А растворимость?
10.
Расчет растворимости по Ks(продолжение)
Растворимость (S) – масса вещества в 100 г
растворителя
= 1 г/см3 (для разб. растворов верно!)
Допущения:
mAgCl << mраствора
В 1000 г воды
В 100 г воды
1.25 10-5 моль AgCl
1.25 10-6 моль AgCl
SAgCl = 1.25 10-6 143,5 = 1.79 10–3 г
Количество AgCl (моль)
в 100 г воды
МAgCl,
г/моль
11.
Расчет растворимости солей смногозарядными ионами
Ca3(PO4)2 ⇄ 3Ca2+ + 2PO43–
2
3
3
2
4
3
3
K
[
C
a
]
[
P
O
]
2
.
0
7
1
0
s
33
(
3
x
)
(
2
x
)
108
x
2
.
07
10
3
2
5
33
2
.
07
10
7
x
1
.
92
10
1
.
13
10
108
5
SCa ( PO )
3
1
35
5
= 1.13∙10-7∙310 = 3.53∙10–5 г/дм3
или 3.53∙10–6 г на 100 г растворителя
4
2
12.
Способы смещенияравновесия растворимости
1. Повышение температуры – S↑
2. Добавление одноименного иона – S↓
3. Добавление реагента, участвующего в
конкурирующем равновесии с катионом
или анионом – S↑
4. Добавление электролита, не имеющего
общих ионов – обычно S немного ↑
(солевой эффект).
Причина: количество ионов ↑ взаимодействие
между ними ↑ активность ионов↓
13.
Влияние одноименных ионовKtxAny(к) ⇄ xKty+(р) + yAnx–(р)
Повышение концентрации Kty+
y
x
x
y
K
[K
t ][A
n]
s
= const
Автоматически снижается концентрация Anx–!
(произведение должно остаться постоянным)
14.
Расчет растворимости по Ksб) В растворе с одноименным ионом:
Рассчитаем SAgCl в 0,01М растворе NaCl
AgCl(к) ⇄ Ag+(р) + Cl–(р)
[
Ag
]
x
,
[
Cl
]
0
,
01
x
10
K
[
Ag
][
Cl
]
x
(
0
,
01
x
)
1
.
56
10
s
Поскольку x << 0.01, то:
8
3
K
0
.
0
1
x
x
1
.
5
6
1
0
моль/дм
s
5
моль/дм3
1
.
25
10
А в чистой воде?
Растворимость уменьшилась в 800 раз!
15.
Что такое «конкурирующее равновесие»?CuS(к) ⇄ S2–(р) + Cu2+(р)
Cu2+(р) + 2OH–(р) ⇄ Cu(OH)2↓(к)
2H+(р) + S2–(р) ⇄ H2S↑(г)
Газ
Слабый
электролит
4NH3(р) + Cu2+(р) ⇄ [Cu(NH3)4]2+(р)
Pb2+
(р) +
S2–
PbS↓(к)
Осадок
(р) ⇄
Координационное
соединение
16.
Ионообменные реакции.Реакции в растворах электролитов, при которых не происходит изменения зарядов ионов,
входящих в соединения, называются ионообменными реакциями.
Правило Бертолле: равновесие в ионообменных
реакциях смещается в сторону образования
наименее диссоциированных соединений.
В соответствии с этим направление реакций
ионного обмена определяется следующим эмпирическим правилом: ионные реакции протекают в
сторону образования осадков, газов, слабых
электролитов, комплексных ионов.
17.
При написании уравнений ионных реакций сильные электролиты пишут в диссоциированном виде,слабые – в недиссоциированном.
Образование осадков:
AgNO3 + NaCl AgCl + NaNO3
В растворе:
+
+
+
Ag + NO3 + Na + Cl AgCl + Na + NO3 .
Исключим ионы, которые не взаимодействуют, тогда уравнение имеет вид:
Ag+ + Cl- AgCl
Уравнения такого вида называются ионными.
Ионное уравнение получение гидроксида железа
запишется следующим образом:
Fe3+ + 3OH- Fe(OH)3 .
18.
Образование газов:Na2S + H2SO4 H2S + NaSO4;
+
2+
2+
22Na + S + 2H + SO4 H2S + 2Na + SO4 ;
2H+ + S2- H2S .
19.
Образование слабых электролитов:Образование воды. Реакция, протекающая с образованием воды при взаимодействии ионов водорода (точнее, ионов гидроксония) и гидроксид – ионов,
называется реакцией нейтрализации.
NaOH + HCl H2O + NaCl
+
OH + H H2O
(H3O+ + OH- 2H2O).
Образование слабого основания.
NH4+ + Cl- + K+ + OH- NH4OH + K+ + ClNH4+ + OH- NH4OH.
Образование слабой кислоты.
2СH3COO- + 2Na+ + 2H+ + SO42- 2CH3COOH +
3Na+ + SO42CH3COO- + H+ CH3COOH.


















 chemistry
chemistry








