Similar presentations:
Алкины. Химические и физические свойства алкинов. Строение алкинов
1.
Алкины — алифатические непредельныеуглеводороды, в молекулах которых между
углеродными атомами имеется одна
тройная связь.
Общая формула гомологического ряда алкинов
СnН2n-2
2. Строение алкинов
HC
C
H
ацетилен (этин)
3. ВИДЫ ИЗОМЕРИИ АЛКИНОВ
Структурная:•1. Изомерия положения тройной связи (начиная с С4Н6):
•2. Изомерия углеродного скелета (начиная с С5Н8):
4.
•3. Межклассовая изомерия с алкадиенами ициклоалкенами, начиная с С4Н6:
Пространственная изомерия
Цис-транс изомерия в молекулах алкинов невозможна, т.к.
заместители при тройной связи могут располагаться только
одним способом – вдоль линии связи
5. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКИНОВ
• С2Н2-С4Н6 газы,• С5Н8-С16Н30 – жидкости,
• начиная с С17Н32 – твердые вещества
• Температуры кипения и плавления ацетиленовых углеводородов
увеличиваются с ростом их молекулярной массы. Температуры
кипения и плавления алкинов выше, чем у соответствующих
алкенов.
• Алкины являются гидрофобными соединениями и поэтому
хорошо растворяются в органических растворителях и плохо
растворимы в воде.
• Низшие алкины обладают наркотическим эффектом; ацетилен
использовался для ингаляционного наркоза под названием
нарцилен. Ацетилен также вызывает ускорение созревания
плодов.
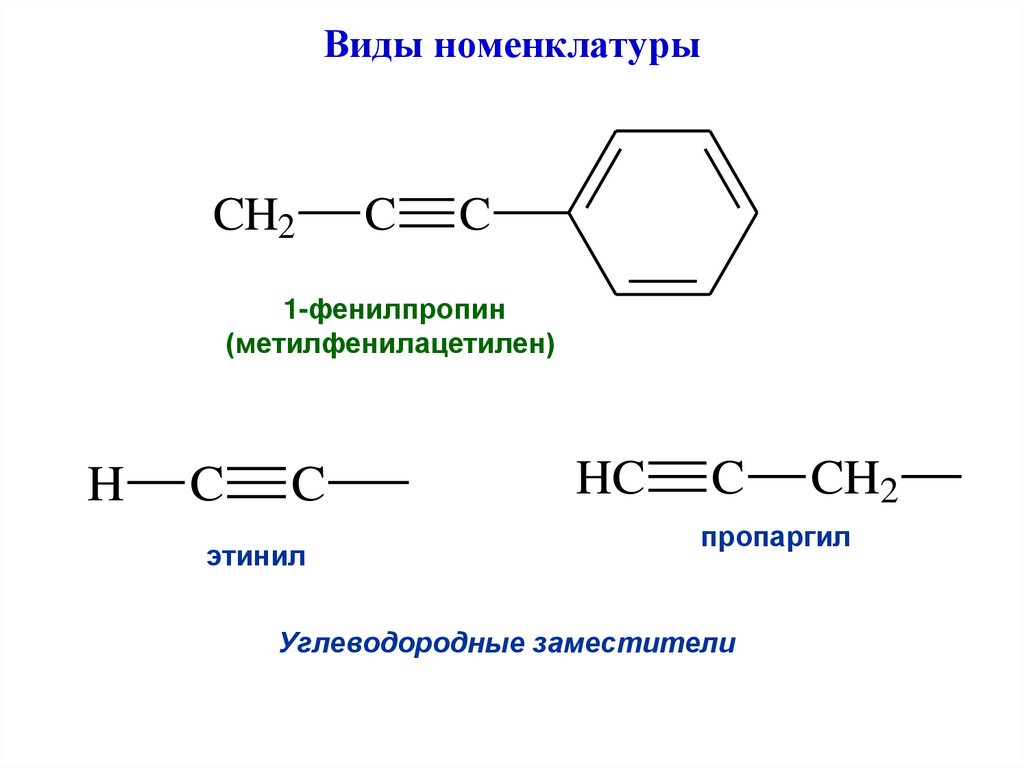
6. Виды номенклатуры
CH2C
C
1-фенилпропин
(метилфенилацетилен)
H
C
C
этинил
HC
C
CH2
пропаргил
Углеводородные заместители
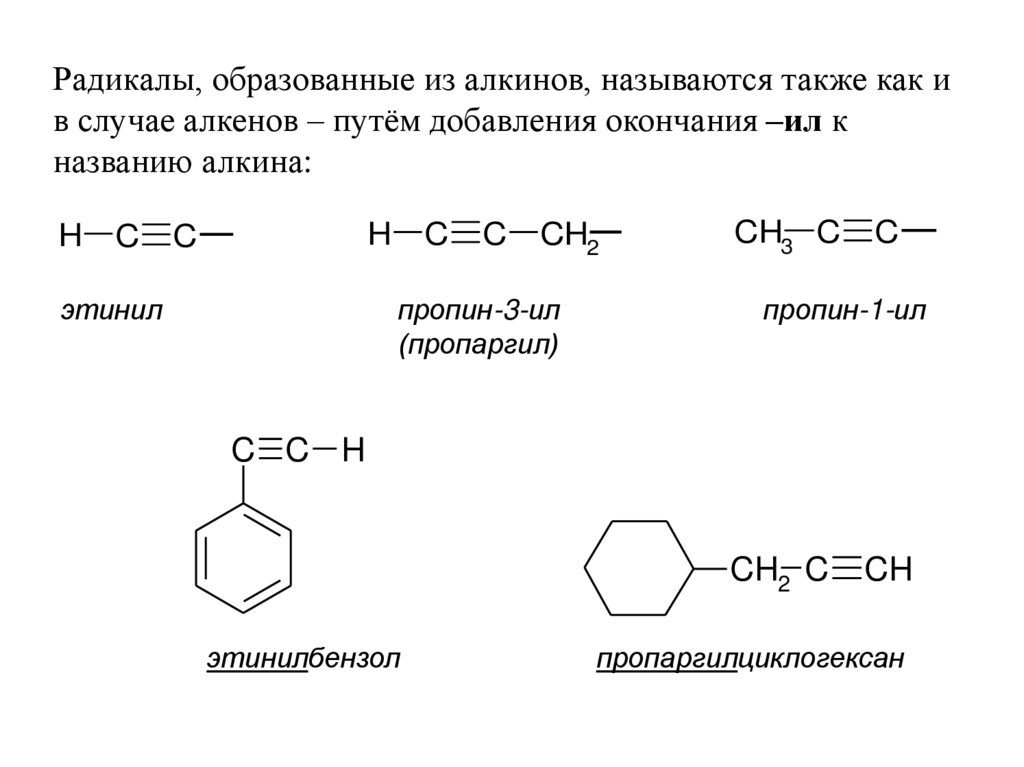
7.
Радикалы, образованные из алкинов, называются также как ив случае алкенов – путём добавления окончания –ил к
названию алкина:
H
C
H
C
этинил
C
C
CH2
пропин-3-ил
(пропаргил)
CH3 C
C
пропин-1-ил
C C H
CH2 C
этинилбензол
CH
пропаргилциклогексан
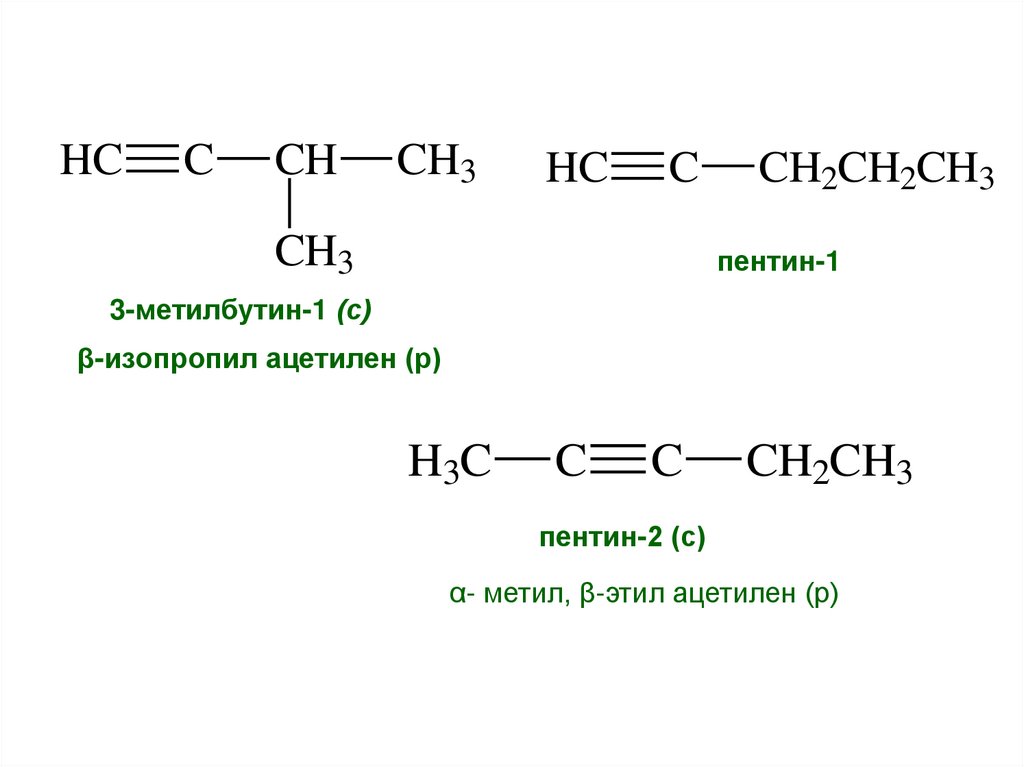
8.
HCC
CH
CH3
HC
C
CH3
CH2CH2CH3
пентин-1
3-метилбутин-1 (с)
β-изопропил ацетилен (р)
H3C
C
C
CH2CH3
пентин-2 (с)
α- метил, β-этил ацетилен (р)
9.
Способы получения алкиновПромышленные способы
1. Пиролиз метана
2CH4
1500°C
HC
CH + 3H2
Реакцию проводят электродуговым способом, пропуская метан
между электродами с временем контакта 0,1-0,01 секунды. Такой
малый интервал нагревания обусловлено тем, что ацетилен при
такой температуре может разлагаться на углерод и водород.
10.
Лабораторные способы2. Гидролиз карбидов (магния и кальция)
Mg2C3 + 4H2O
CaC2 + 2H2O
CH3 C
HC
CH + Mg(OH)2
CH + Ca(OH)2
Карбид кальция образуется при нагревании смеси оксида кальция
СаО (жженой извести) и кокса до 2500 °С:
CaO + 3C
2500°C
CaC2 + CO
11.
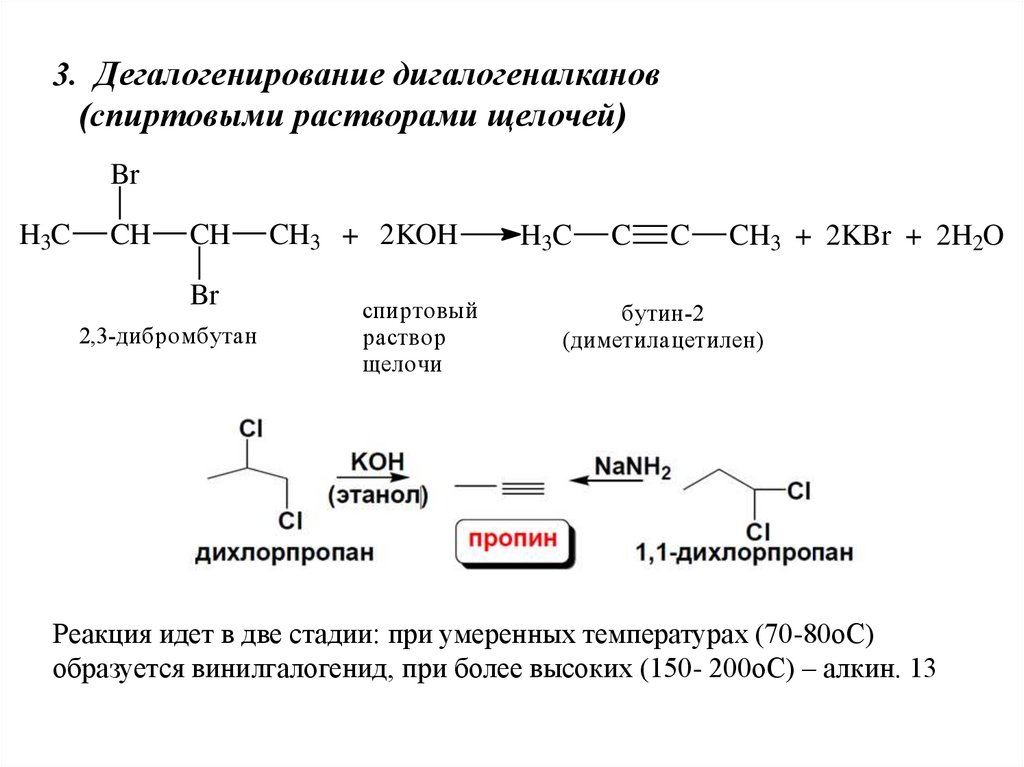
3. Дегалогенирование дигалогеналканов(спиртовыми растворами щелочей)
Br
H3C
CH
CH
Br
2,3-дибромбутан
CH3 + 2KOH
спиртовый
раствор
щелочи
H3C
C
C
CH3 + 2KBr + 2H2O
бутин-2
(диметилацетилен)
Реакция идет в две стадии: при умеренных температурах (70-80оС)
образуется винилгалогенид, при более высоких (150- 200оС) – алкин. 13
12.
4. Взаимодействие алкилгалогенидов с ацетиленидамиметаллов
CH3 C
C Na
+
пропинид натрия
+
CH3 Br
бромметан
CH3 C
C CH3 + NaBr
бутин-2
Реакция идет только с первичными галоидными алкилами.
13.
Химические свойства алкинов• Химические свойства алкинов сходны с алкенами, что обусловлено
их ненасыщенностью – наиболее типичными реакциями являются
реакции присоединения, протекающие с разрывом кратных связей.
• Степень ненасышенность алкинов выше, однако, их реакционная
способность в реакциях электрофильного присоединения по
сравнению с алкенами значительно ниже.
Реакции характерные для алкинов:
1.
2.
3.
4.
5.
6.
7.
8.
Электрофильное присоединение(АЕ).
Нуклеофильное присоединение(АN).
Карбонилирование.
Кислотные свойства (замещение атомов Н при концевой тройной
связи на металл).
Присоединение терминальных алкинов к карбонильным
соединениям (реакция Фаворского).
Изомеризация.
Окисление.
Димеризация, циклоолигомеризация, полимеризация.
14.
Отличия в свойствах алкинов и алкенов определяютсяследующими факторами.
1. Тройная связь короче двойной: длина связи С≡С 0,12 нм, а С=С 0,133 нм.
sp-гибридизованный атом С значительно более электроотрицателен
(sp3–2,5; sp2–2,6; sp–2,8).
2. π-электронная плотность тройной связи расположена более компактно,
чем в алкенах, и электроны π-связей удерживаются ядрами углерода
более прочно чем в = связи, поэтому атакующему электрофилу в
данном случае труднее оторвать пару электронов от тройной связи.
Поэтому реакции электрофильного присоединения к алкинам
протекают медленнее, чем к алкенам.
15.
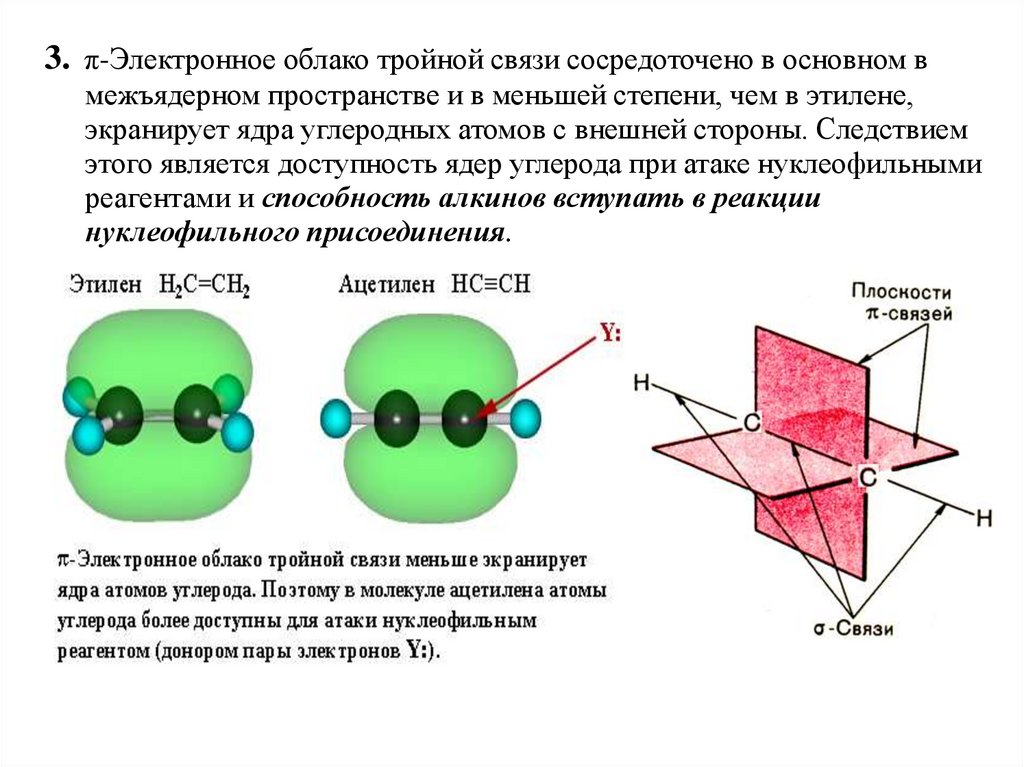
3. π-Электронное облако тройной связи сосредоточено в основном вмежъядерном пространстве и в меньшей степени, чем в этилене,
экранирует ядра углеродных атомов с внешней стороны. Следствием
этого является доступность ядер углерода при атаке нуклеофильными
реагентами и способность алкинов вступать в реакции
нуклеофильного присоединения.
16.
4. Связь атома водорода с углеродом в sp-гибридизованном состояниизначительно более полярна по сравнению с С–Н-связями в алканах и
алкенах. Это объясняется различным вкладом в гибридизованное
состояние s-орбитали, которая более прочно, чем р-орбиталь,
удерживает электроны.
Доля s-орбиталей в sp3-состоянии составляет 25%, в sp2 – 33%, а в sp –
50%. Чем больше вклад s-орбиталей, тем выше способность атома
удерживать внешние электроны, то есть его электроотрицательность:
2,5 (Сsp3); 2,8 (Сsp2); 3,2 (Сsp).
Повышенная полярность связи Сsp–Н приводит к возможности её
гетеролитического разрыва с отщеплением протона (Н+).
Таким образом, алкины с концевой тройной связью R–С≡С–H
(алкины-1) проявляют кислотные свойства и способны, вступая в
реакции с металлами, образовывать соли.
17.
I.Реакции присоединения
(по электрофильному механизму АЕ)
1. Галогенирование
Электрофильное присоединение галогенов к алкинам протекает медленнее,
чем для алкенов (первая π-связь разрывается труднее, чем вторая):
Br
HC
CH
Br2
HC
CH
Br2
Br
CH CH
ацетилен
Br
Br
1,2-дибромэтен
Br
Br
1,1,2,2-тетрабромэтан
Алкины обесцвечивают бромную воду, проявляя сходство с алкенами
18.
2. ГидрированиеHC
CH
ацетилен
H2 (Pt)
H2C
CH2
этилен
H2 (Pt)
CH3 CH3
этан
В присутствии металлических катализаторов (Pt, Ni) алкины
присоединяют водород с образованием алкенов (разрывается первая πсвязь), а затем алканов (разрывается вторая π-связь).
При использовании менее активного катализатора
Pd/CaCO3/Pb(CH3COO)2 гидрирование останавливается на стадии
образования алкенов (преимущественно, цис-изомеров).
Гидрирование алкинов относят к реакциям восстановления,
поскольку присоединение водорода к атомам углерода приводит к
понижению степени их окисления
19.
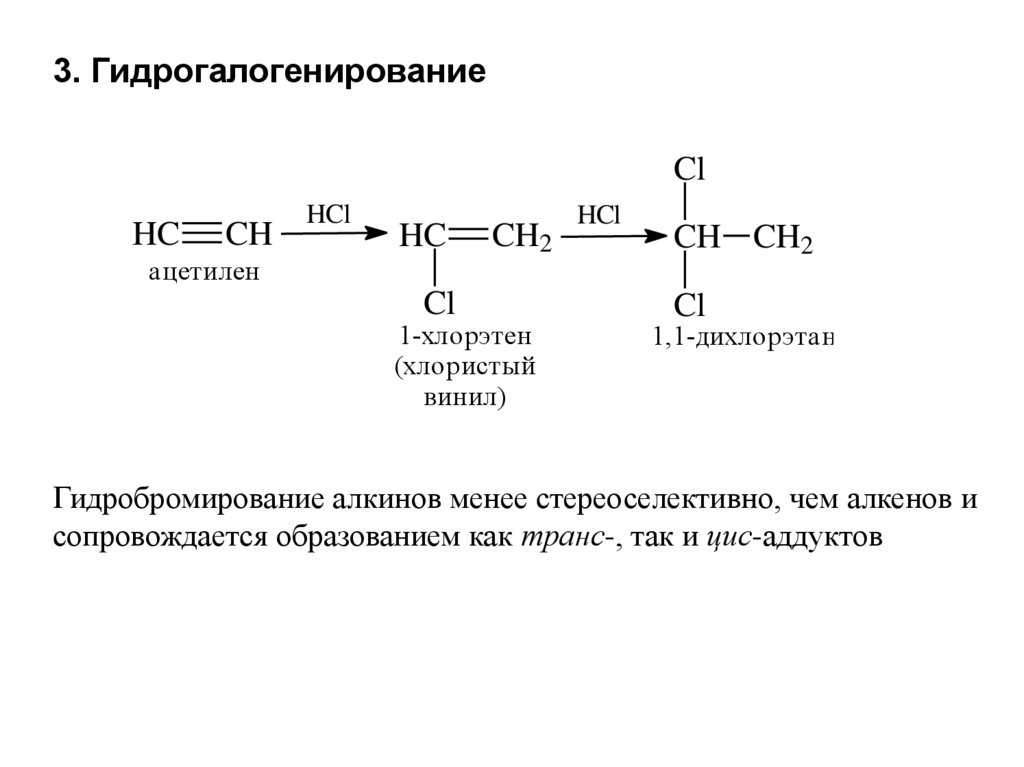
3. ГидрогалогенированиеCl
HC
CH
HCl
HC
ацетилен
Cl
CH2
1-хлорэтен
(хлористый
винил)
HCl
CH CH2
Cl
1,1-дихлорэтан
Гидробромирование алкинов менее стереоселективно, чем алкенов и
сопровождается образованием как транс-, так и цис-аддуктов
20.
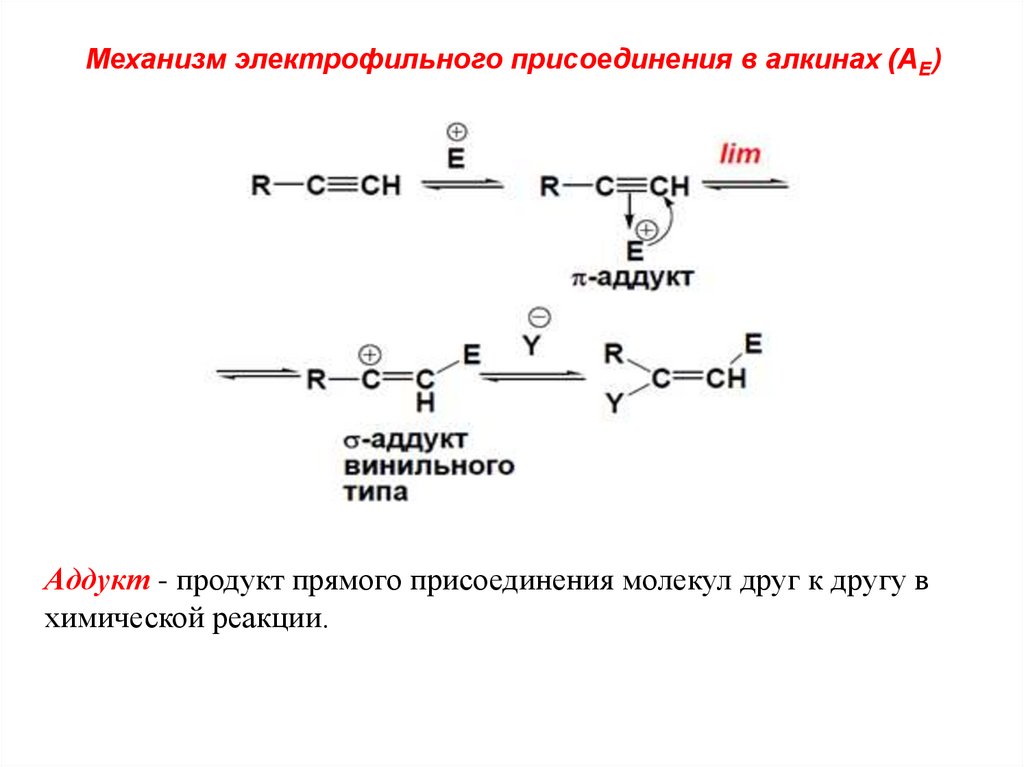
Механизм электрофильного присоединения в алкинах (АЕ)Аддукт - продукт прямого присоединения молекул друг к другу в
химической реакции.
21.
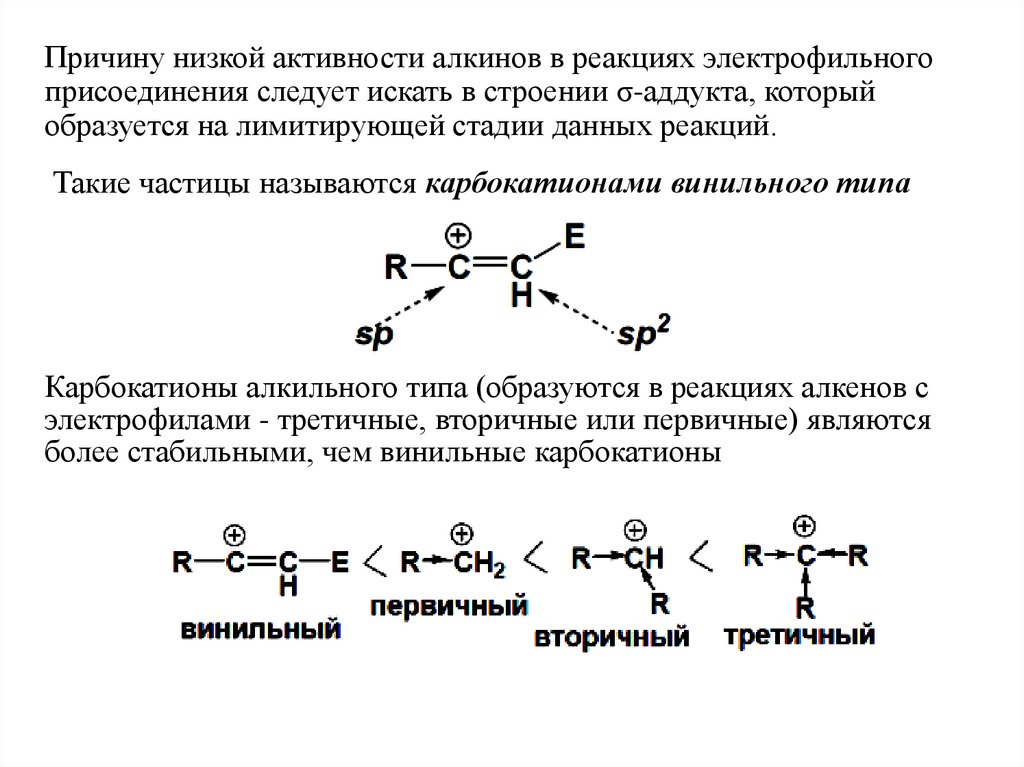
Причину низкой активности алкинов в реакциях электрофильногоприсоединения следует искать в строении σ-аддукта, который
образуется на лимитирующей стадии данных реакций.
Такие частицы называются карбокатионами винильного типа
Карбокатионы алкильного типа (образуются в реакциях алкенов с
электрофилами - третичные, вторичные или первичные) являются
более стабильными, чем винильные карбокатионы
22.
II. Реакции присоединения(по нуклеофильному механизму АN)
1. Гидратация (реакция Кучерова)
Присоединение воды происходит в присутствии катализатора соли
ртути (II) и идет через образование неустойчивого непредельного
спирта, который изомеризуется в уксусный альдегид (в случае
ацетилена):
H
HC
CH + H2O
ацетилен
Hg , H2SO4
O
O
2+
H2C
C
H3C
H
виниловый спирт
(неустойчив)
C
H
уксусный альдегид
23.
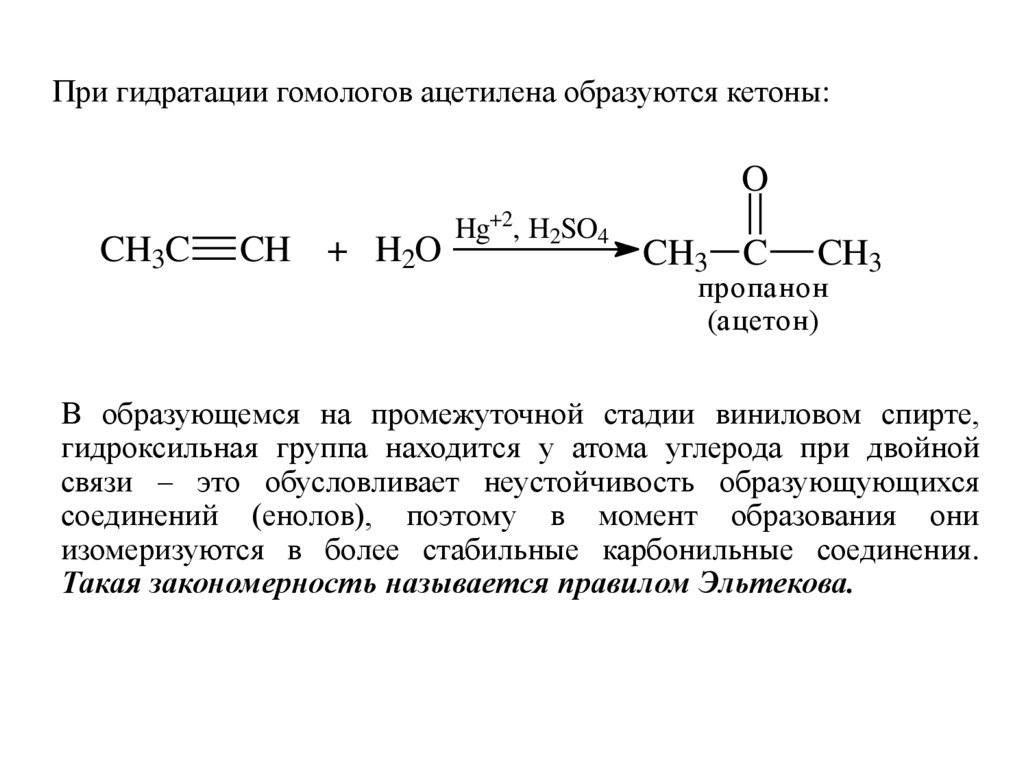
При гидратации гомологов ацетилена образуются кетоны:O
CH3C
CH + H2O
Hg+2, H2SO4
CH3 C
CH3
пропанон
(ацетон)
В образующемся на промежуточной стадии виниловом спирте,
гидроксильная группа находится у атома углерода при двойной
связи – это обусловливает неустойчивость образующующихся
соединений (енолов), поэтому в момент образования они
изомеризуются в более стабильные карбонильные соединения.
Такая закономерность называется правилом Эльтекова.
24.
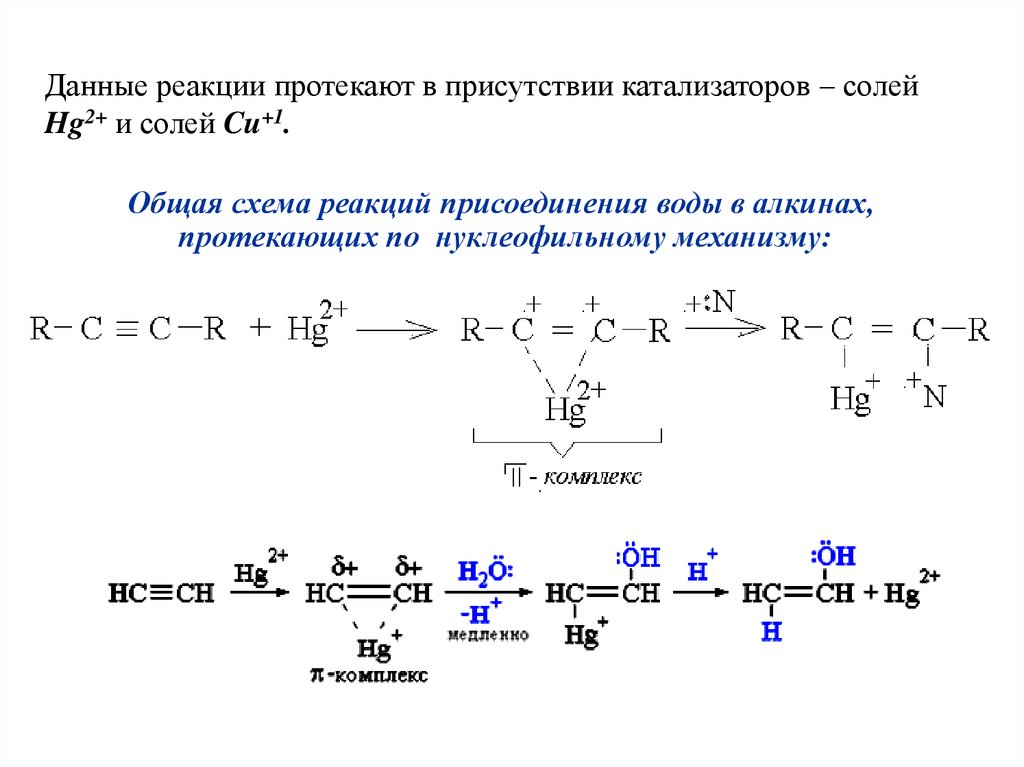
Данные реакции протекают в присутствии катализаторов – солейHg2+ и солей Cu+1.
Общая схема реакций присоединения воды в алкинах,
протекающих по нуклеофильному механизму:
25.
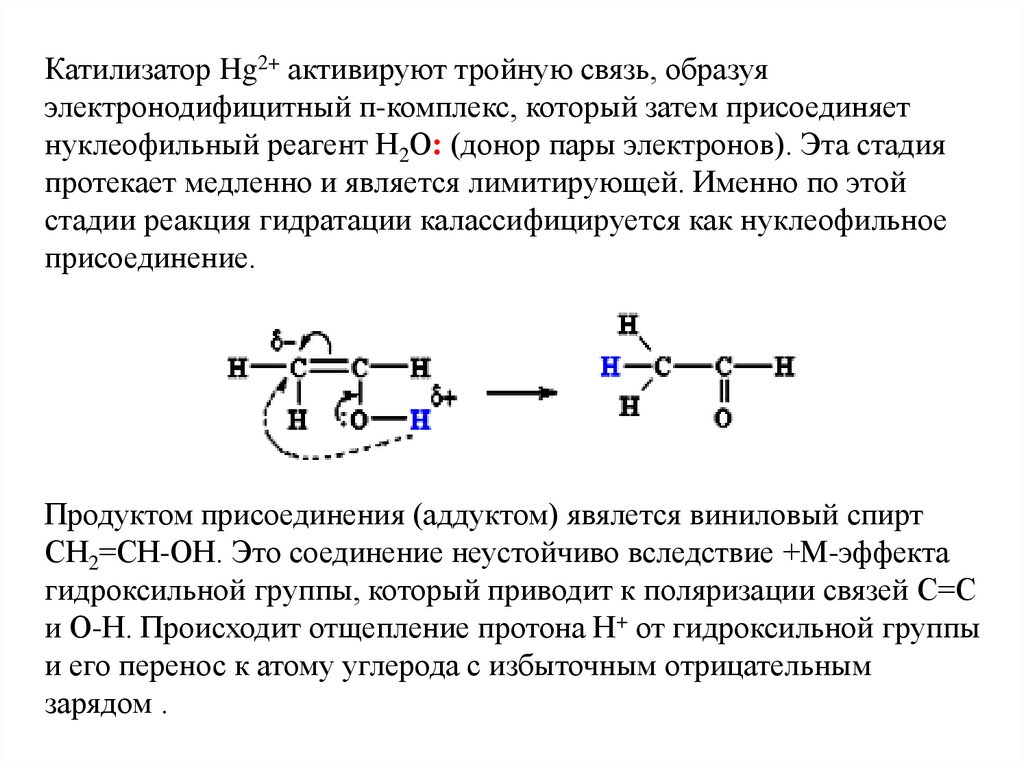
Катилизатор Hg2+ активируют тройную связь, образуяэлектронодифицитный п-комплекс, который затем присоединяет
нуклеофильный реагент Н2О: (донор пары электронов). Эта стадия
протекает медленно и является лимитирующей. Именно по этой
стадии реакция гидратации калассифицируется как нуклеофильное
присоединение.
Продуктом присоединения (аддуктом) явялется виниловый спирт
СН2=СН-ОН. Это соединение неустойчиво вследствие +М-эффекта
гидроксильной группы, который приводит к поляризации связей С=С
и О-Н. Происходит отщепление протона Н+ от гидроксильной группы
и его перенос к атому углерода с избыточным отрицательным
зарядом .
26.
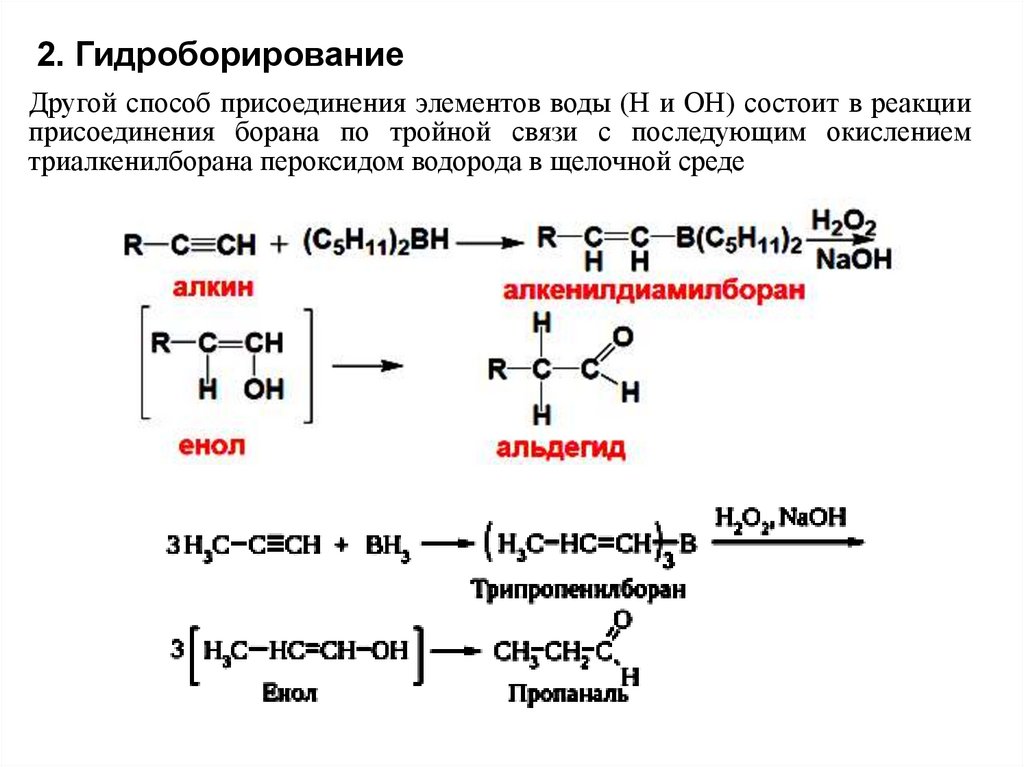
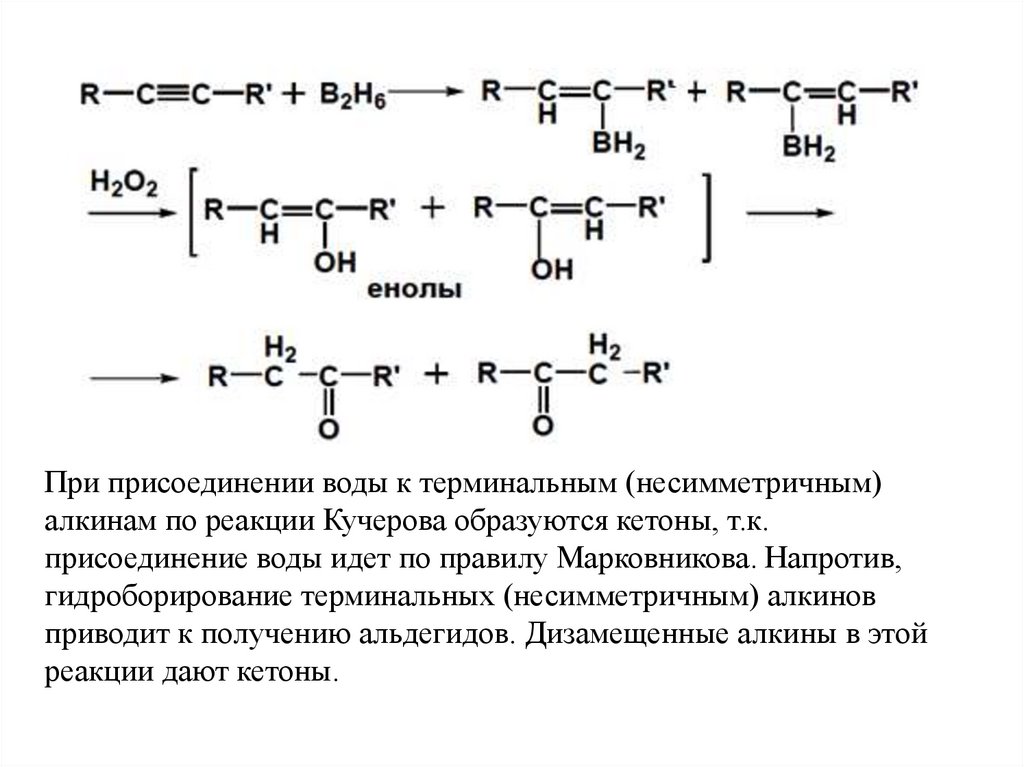
2. ГидроборированиеДругой способ присоединения элементов воды (Н и ОН) состоит в реакции
присоединения борана по тройной связи с последующим окислением
триалкенилборана пероксидом водорода в щелочной среде
27.
При присоединении воды к терминальным (несимметричным)алкинам по реакции Кучерова образуются кетоны, т.к.
присоединение воды идет по правилу Марковникова. Напротив,
гидроборирование терминальных (несимметричным) алкинов
приводит к получению альдегидов. Дизамещенные алкины в этой
реакции дают кетоны.
28.
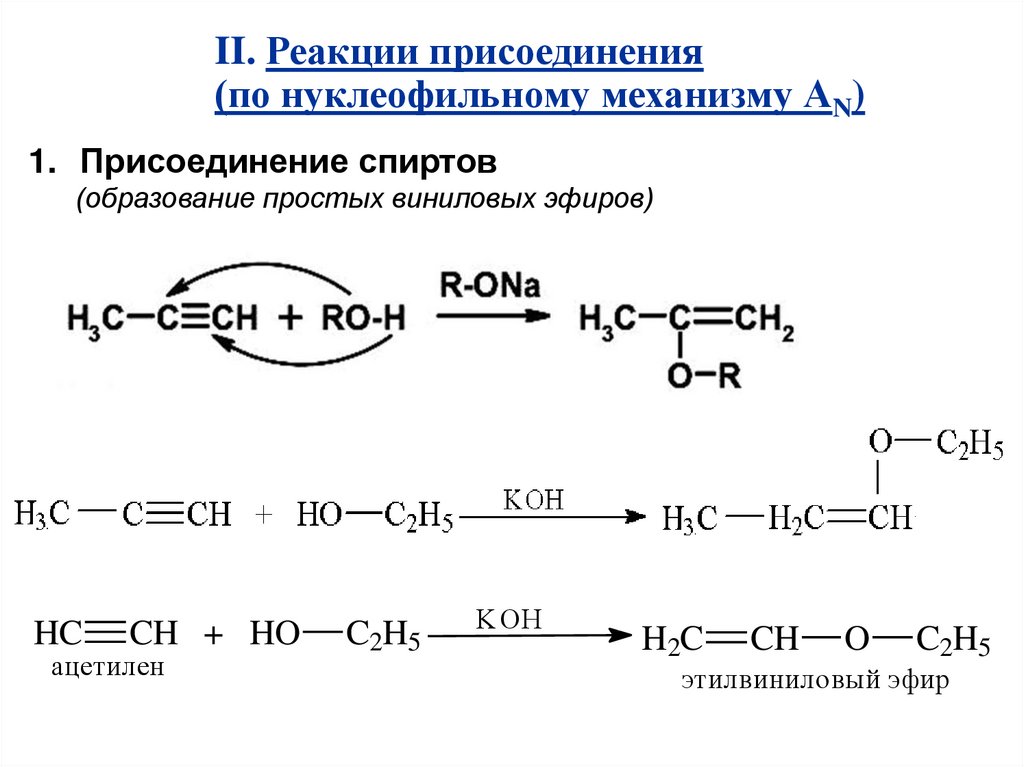
II. Реакции присоединения(по нуклеофильному механизму АN)
1. Присоединение спиртов
(образование простых виниловых эфиров)
HC
CH + HO
ацетилен
C2H5
KOH
H2C
CH
O
C2H5
этилвиниловый эфир
29.
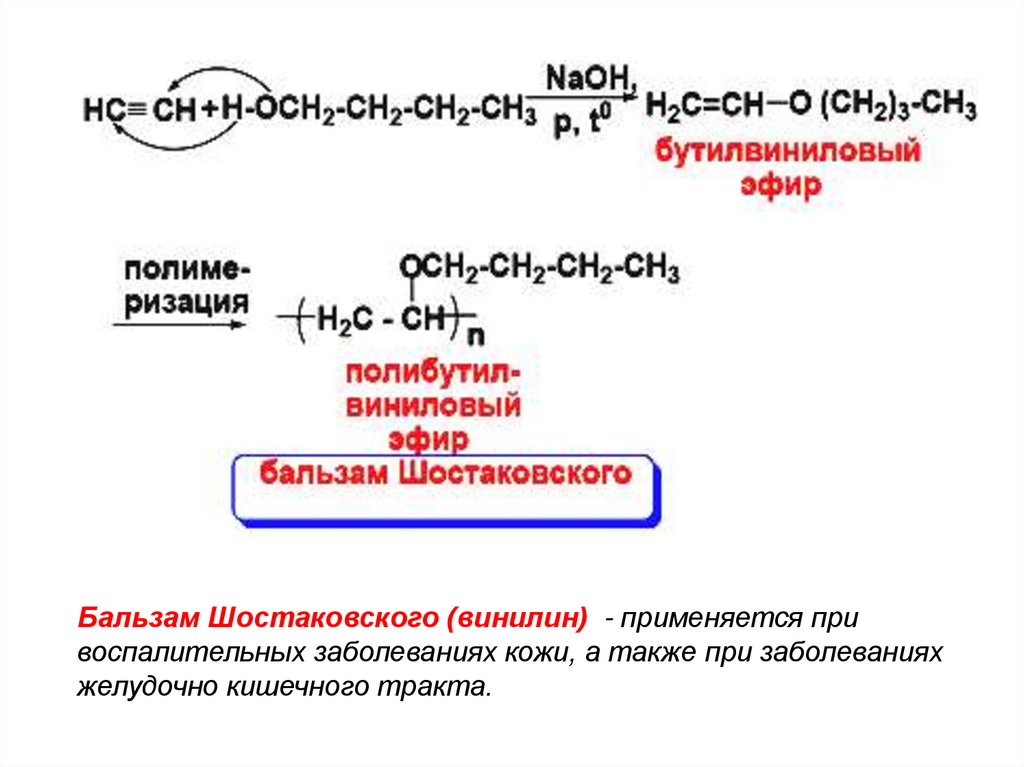
Бальзам Шостаковского (винилин) - применяется привоспалительных заболеваниях кожи, а также при заболеваниях
желудочно кишечного тракта.
30.
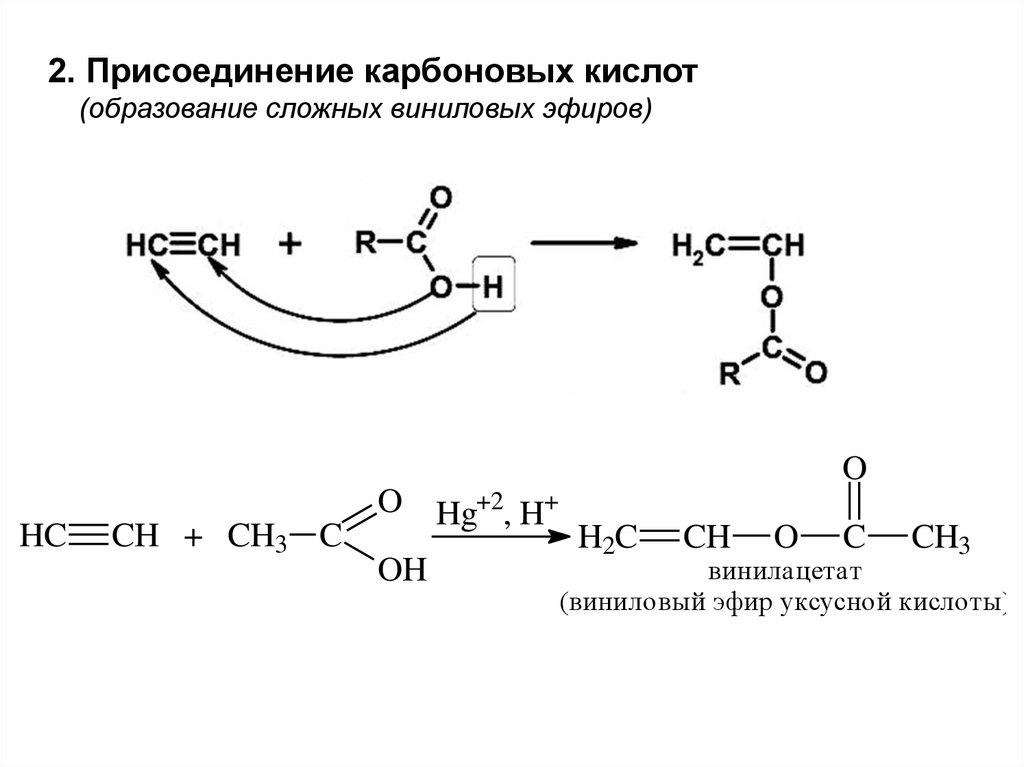
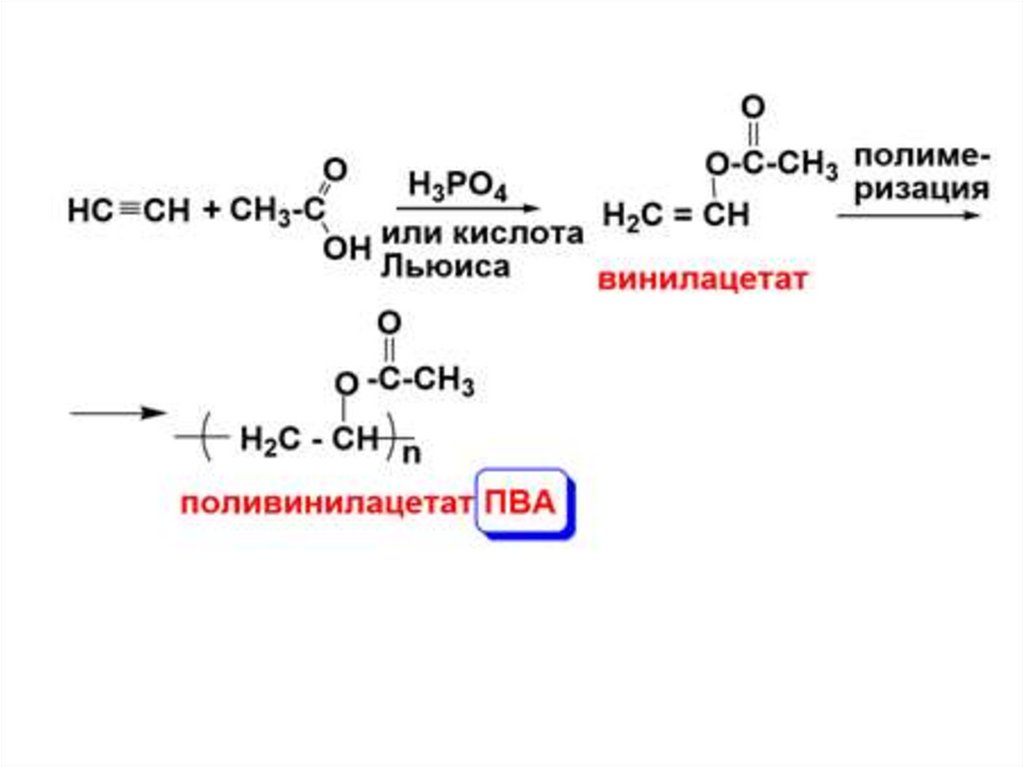
2. Присоединение карбоновых кислот(образование сложных виниловых эфиров)
O
HC
CH + CH3 C
O Hg+2, H+
OH
H2C
CH
O
C
CH3
винилацетат
(виниловый эфир уксусной кислоты)
31.
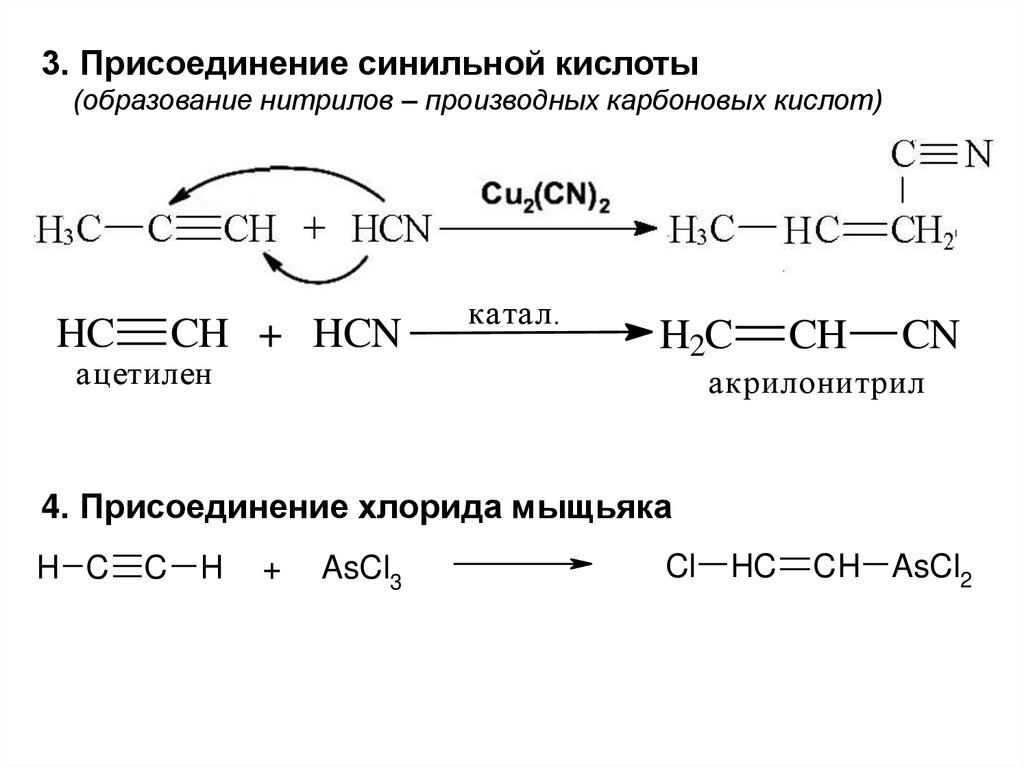
32.
3. Присоединение синильной кислоты(образование нитрилов – производных карбоновых кислот)
HC
CH + HCN
ацетилен
катал.
H2C
CH
CN
акрилонитрил
4. Присоединение хлорида мыщьяка
H C
C
H
+
AsCl3
Cl
HC
CH AsCl2
33.
III. Реакции карбонилирования алкинов(оксосинтез, формилирование) - присоединение СО в присутствии
нуклеофилов (Н2О, R-ОН, NH3) и катализатора Ni(CO)4. Продуктами
реакции является акриловая кислота и еѐ функциональные
производные.
Общая схема реакций:
Пример:
34.
IV. Кислотные свойства алкиновАцетилен и его гомологи с концевой тройной связью R–C≡C–H
(алкины-1) вследствие полярности связи С(sp)–Н проявляют слабые
кислотные свойства, при этом образуются соли – ацетилениды
+
H
-
C
-
C
+
H
35.
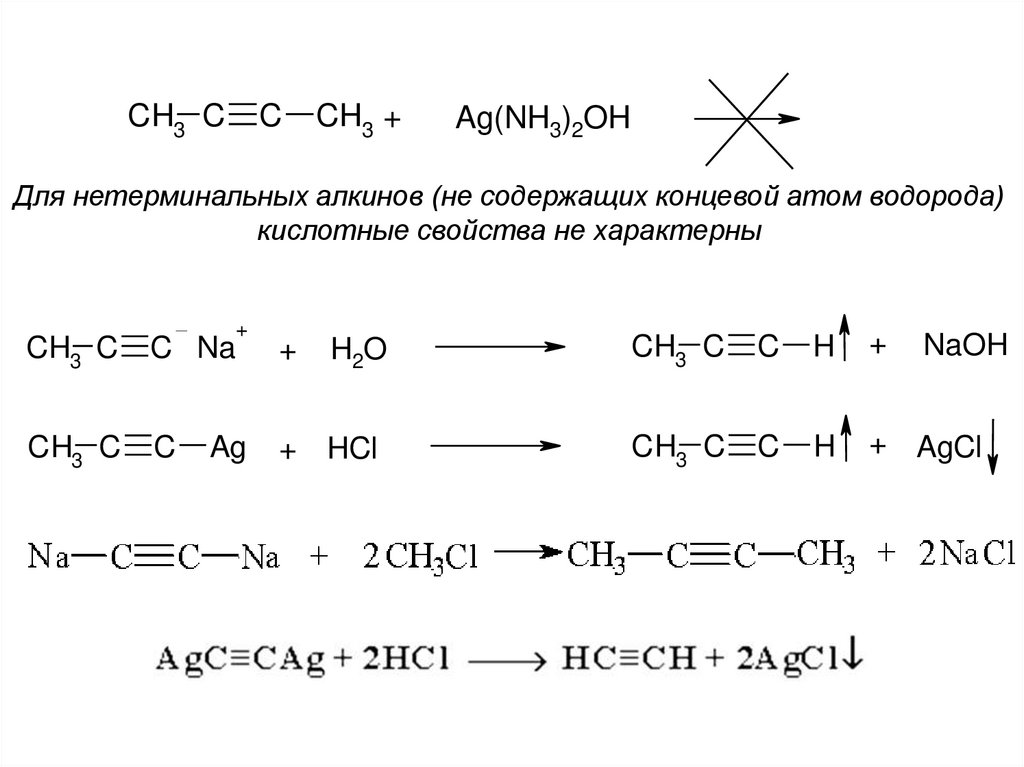
CH3 CC
CH3 +
Ag(NH3)2OH
Для нетерминальных алкинов (не содержащих концевой атом водорода)
кислотные свойства не характерны
CH3 C
C Na
CH3 C
C
+
Ag
+
H2O
+ HCl
CH3 C
C
H
+
CH3 C
C
H
+ AgCl
NaOH
36.
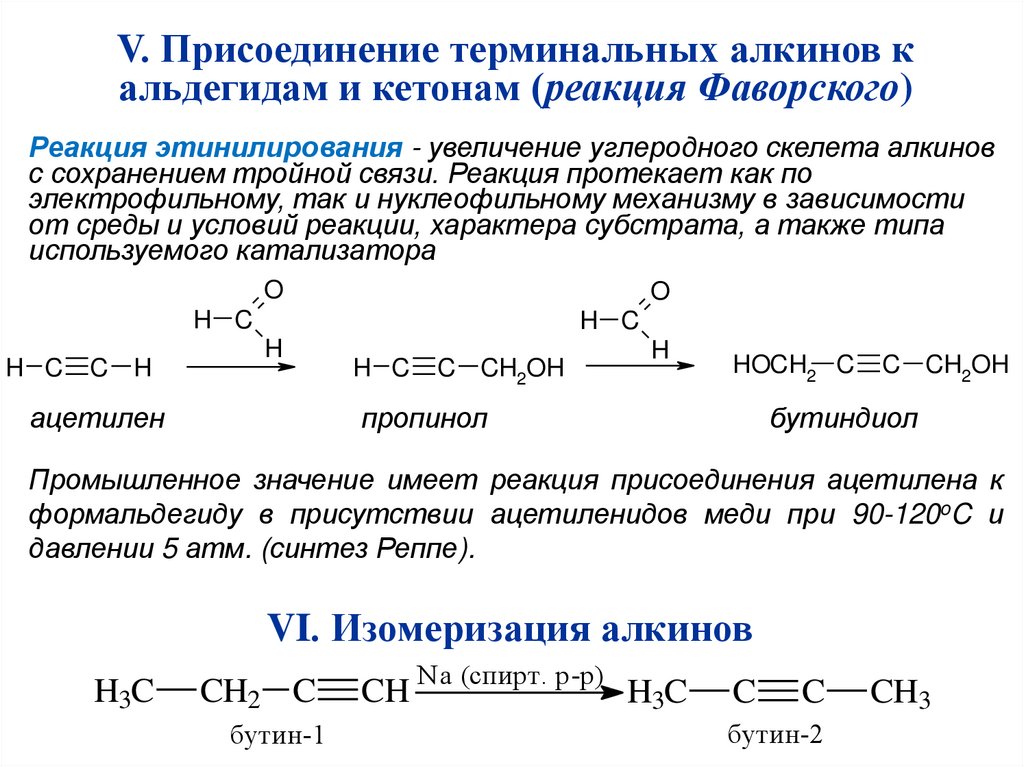
V. Присоединение терминальных алкинов кальдегидам и кетонам (реакция Фаворского)
Реакция этинилирования - увеличение углеродного скелета алкинов
с сохранением тройной связи. Реакция протекает как по
электрофильному, так и нуклеофильному механизму в зависимости
от среды и условий реакции, характера субстрата, а также типа
используемого катализатора
O
O
H C
H C
C
H
H C
H
ацетилен
H C
C CH2OH
H
HOCH2 C
пропинол
C CH2OH
бутиндиол
Промышленное значение имеет реакция присоединения ацетилена к
формальдегиду в присутствии ацетиленидов меди при 90-120oC и
давлении 5 атм. (синтез Реппе).
VI. Изомеризация алкинов
H3C
CH2 C
бутин-1
CH
Na (спирт. р-р)
H3C
C
C
бутин-2
CH3
37.
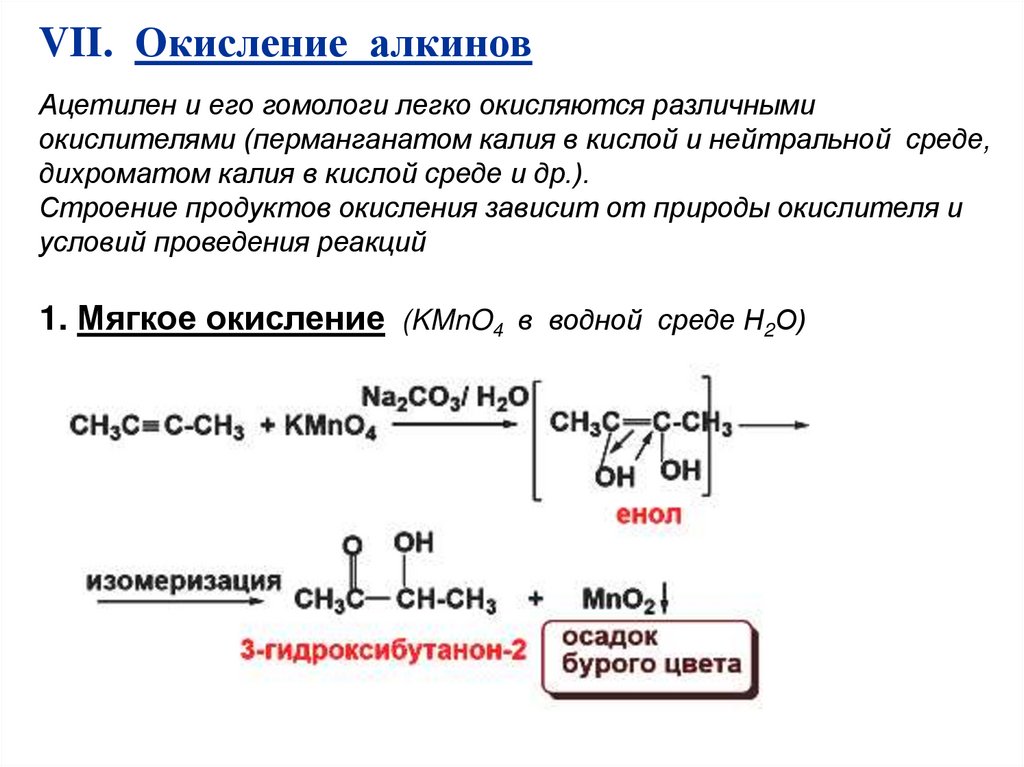
VII. Окисление алкиновАцетилен и его гомологи легко окисляются различными
окислителями (перманганатом калия в кислой и нейтральной среде,
дихроматом калия в кислой среде и др.).
Строение продуктов окисления зависит от природы окислителя и
условий проведения реакций
1. Мягкое окисление (KMnO4 в водной среде Н2О)
38.
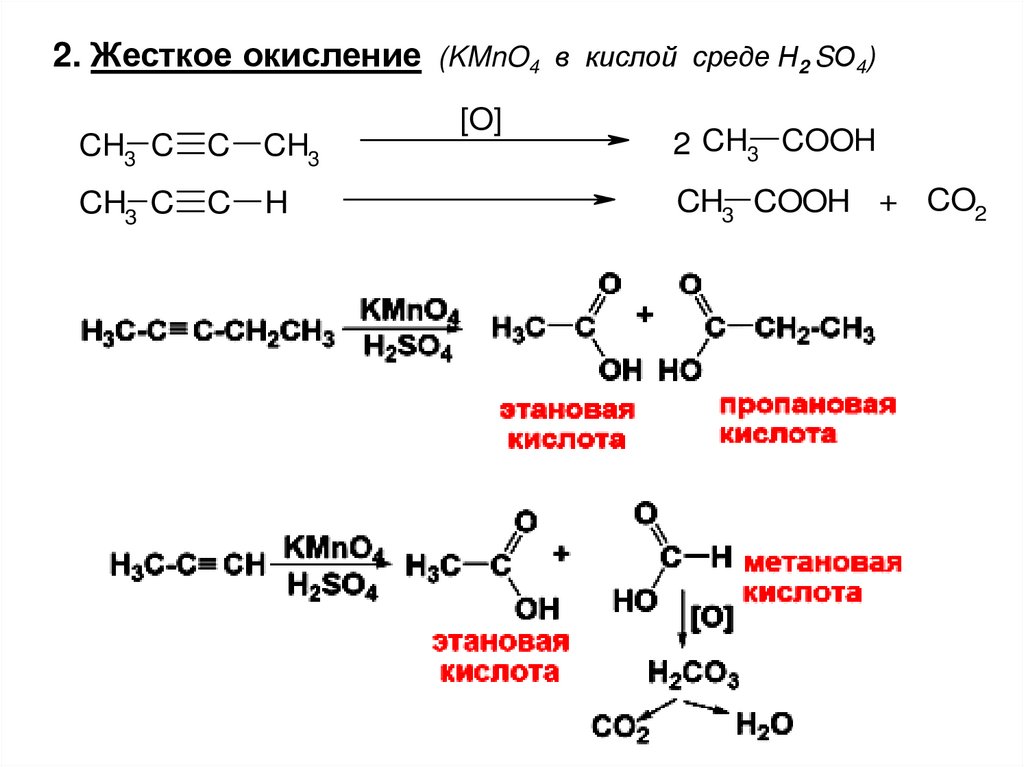
2. Жесткое окисление (KMnO4 в кислой среде Н2 SО4)CH3 C
C
CH3
CH3 C
C
H
[O]
2 CH3 COOH
CH3 COOH + CO2
39.
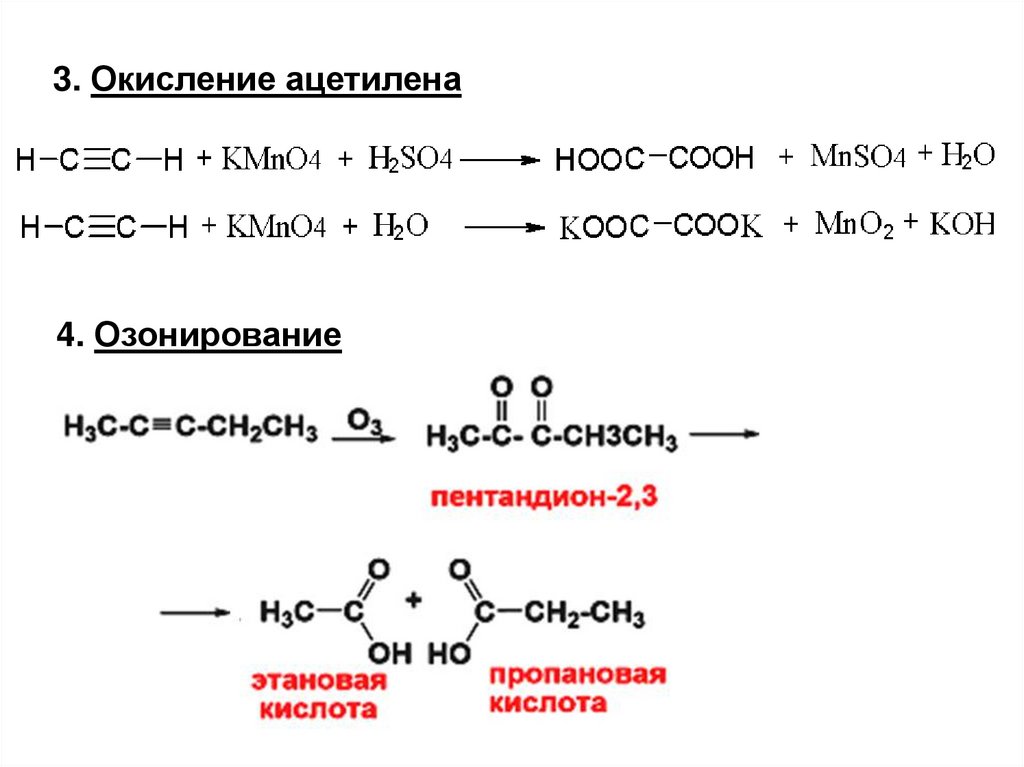
3. Окисление ацетилена4. Озонирование
40.
VIII. Полимеризация алкиновДля алкинов характерны реакции димеризации, циклоолигомеризации и полимеризации, идущие за счет раскрытия тройной связи
1. Димеризация
(под действием водно-аммиачного раствора CuCl)
HC
C
HC
CH2 + HCl
H2C
C
HC
Cl
хлоропрен
CH2
41.
3. Циклоолигомеризация - Реакция Зелинского(получение циклических три- и тетрамеров).
Термическая и каталитическая (Ni, Co, Cr, H2SO4)
CH
CH
CH
HC
CH
C (актив.)
400°С
CH
бензол
3CH3 C
CH
CH3
H2SO4 (к)
t°C
CH3
CH3
1,3,5 триметилбензол
42.
3. Полимеризация алкинов (ацетилена)Полимеризация ацетилена происходит в присутствии катализатора
AlCl3/TiCl4. При этом образуется линейный полиацетилен,
содержащий звенья цис- и транс-конфигурации
Полимер, состоящий из цис-звеньв (–СН=СН–)n, –
цис-полиацетилен – при нагревании изомеризуется в более
устойчивый транс-полиацетилен. Такие полимеры (полиены)
представляют собой систему сопряженных (делокализованных)
π-cвязей и обладают полупроводниковыми свойствами.
43.
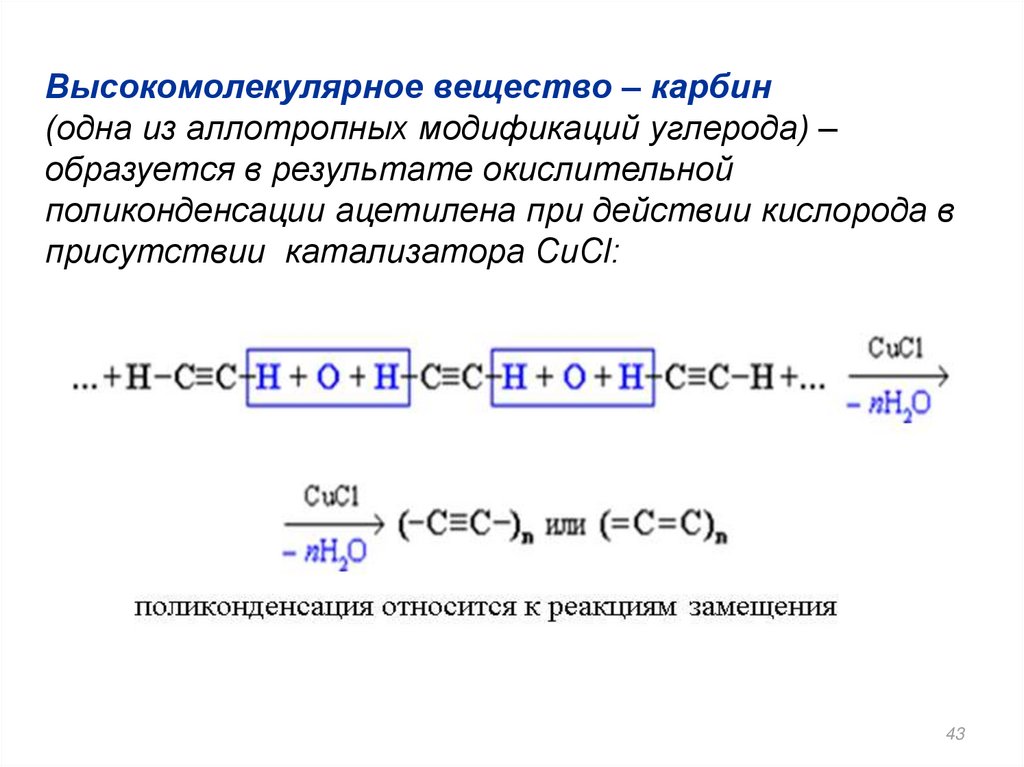
Высокомолекулярное вещество – карбин(одна из аллотропных модификаций углерода) –
образуется в результате окислительной
поликонденсации ацетилена при действии кислорода в
присутствии катализатора CuCl:
43



















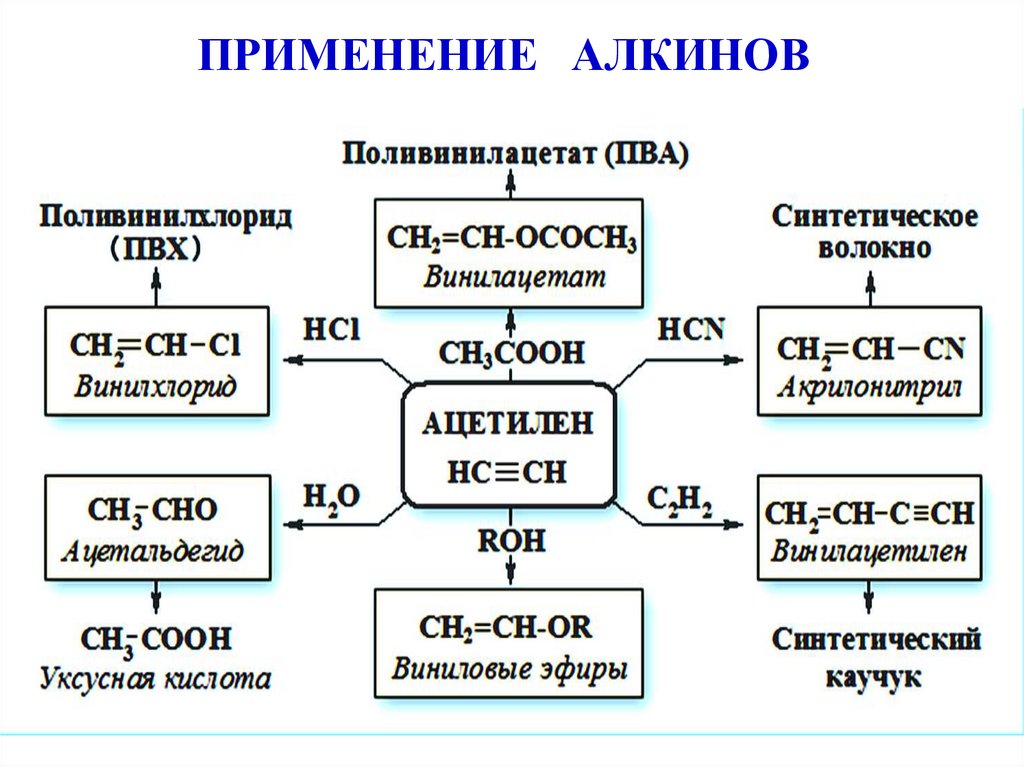
 chemistry
chemistry








