Similar presentations:
Химические свойства алканов
1.
Химические свойстваалканов
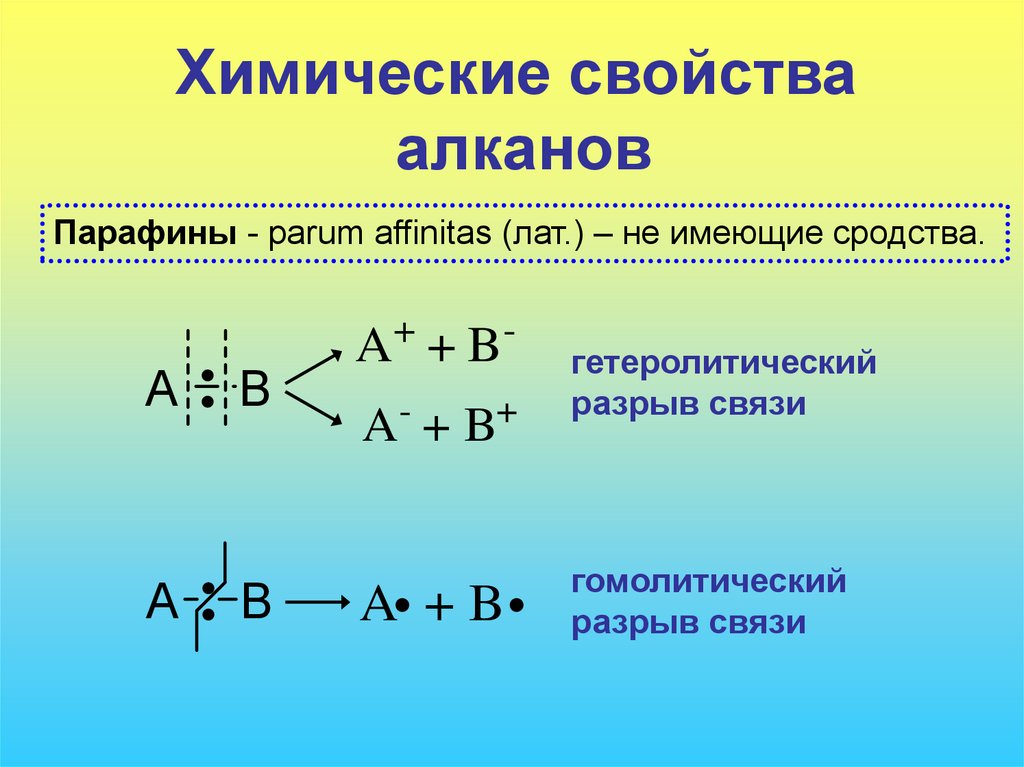
Парафины - parum affinitas (лат.) – не имеющие сродства.
A
A
B
B
A+ + B A- + B+
A +B
гетеролитический
разрыв связи
гомолитический
разрыв связи
2.
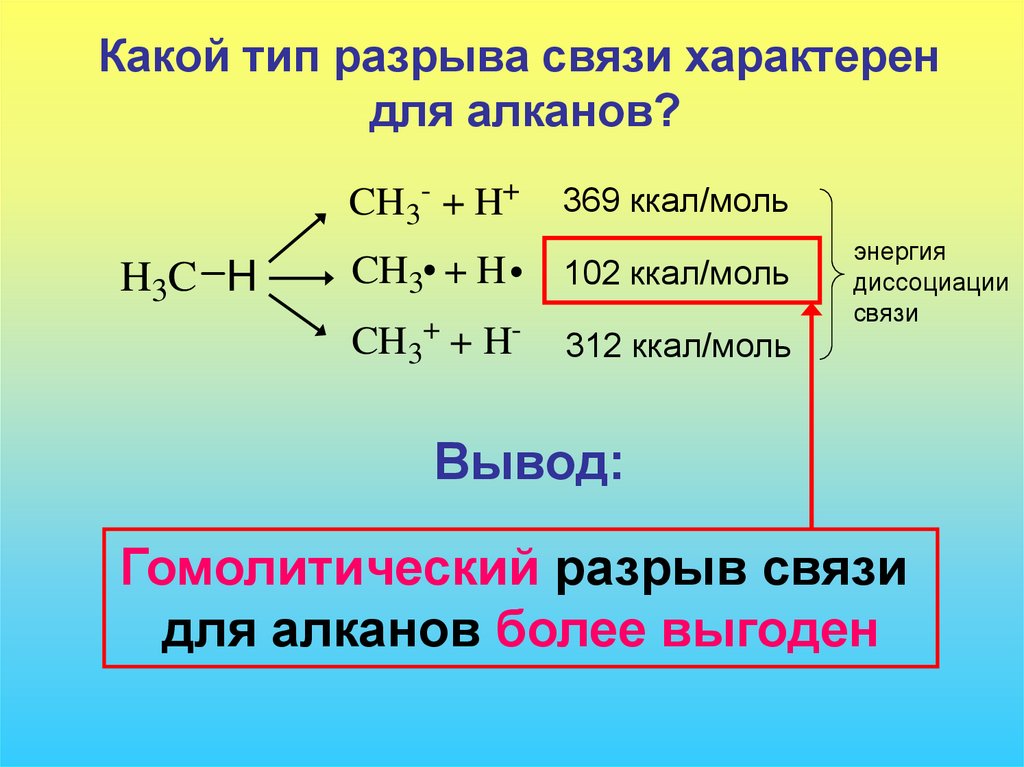
Какой тип разрыва связи характерендля алканов?
CH3- + H+
H3C H
369 ккал/моль
CH3 + H
102 ккал/моль
CH3+ + H-
312 ккал/моль
энергия
диссоциации
связи
Вывод:
Гомолитический разрыв связи
для алканов более выгоден
3.
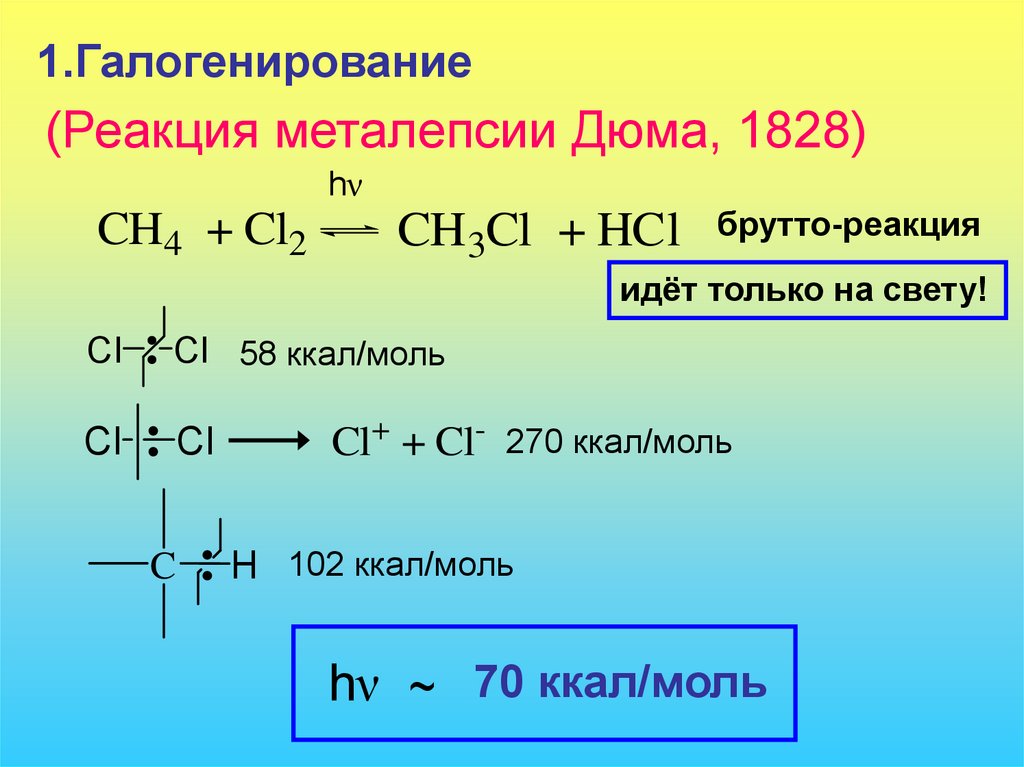
1.Галогенирование(Реакция металепсии Дюма, 1828)
hν
CH4 + Cl2
CH3Cl + HCl
брутто-реакция
идёт только на свету!
Cl
Cl 58 ккал/моль
Cl
Cl
C
Cl+ + Cl- 270 ккал/моль
H 102 ккал/моль
hν ~ 70 ккал/моль
4.
1 квант света, близкого к hν, вызывает гомолиз молекулы Сl2Реакция хлорирования протекает как цепная
радикальная неразветвленная реакция.
На 1 hν ~ 10000 циклов
3 этапа
1. Инициирование цепи
Cl Cl hν 2Cl
2. Развитие цепи
CH3 + HCl
CH4 + Cl
CH3 + Cl2
CH3Cl + Cl
CH2Cl + Cl2
CH3Cl + Cl
CH2Cl + HCl
CH2Cl2 + Cl ….. CHCl3, CCl4
Цепь продолжается пока есть активные радикалы
5.
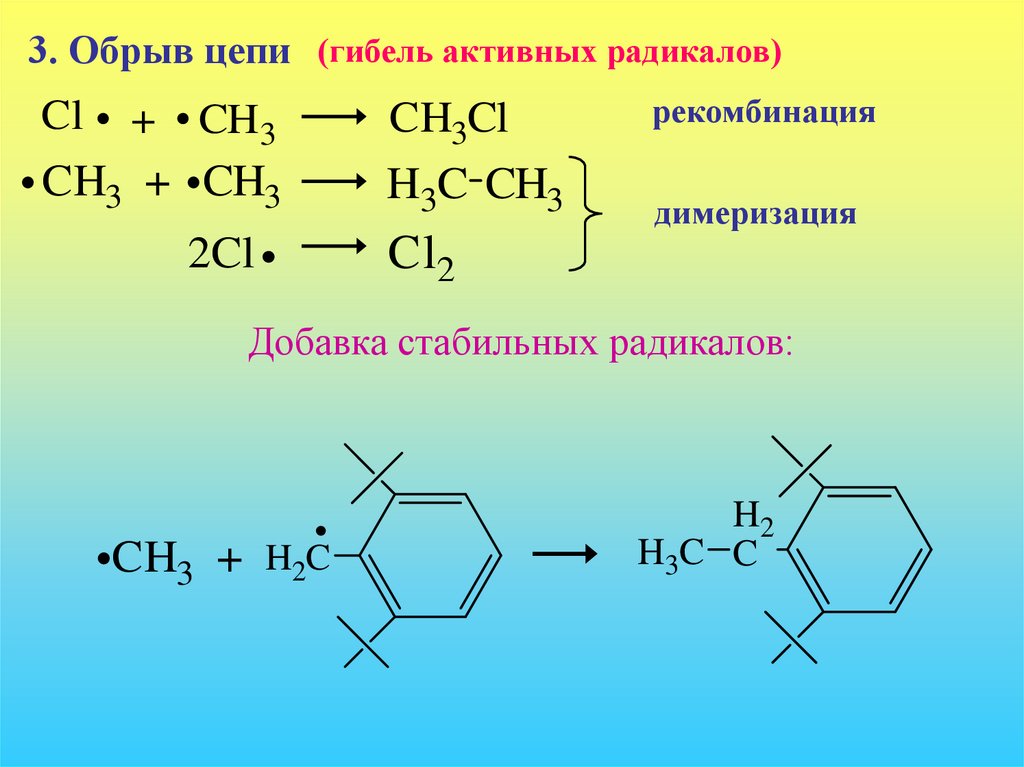
3. Обрыв цепи (гибель активных радикалов)Cl
+ CH3
CH3 + CH3
2Cl
CH3Cl
H3C CH3
рекомбинация
димеризация
Cl2
Добавка стабильных радикалов:
CH3 + H2C
H2
H3C C
6.
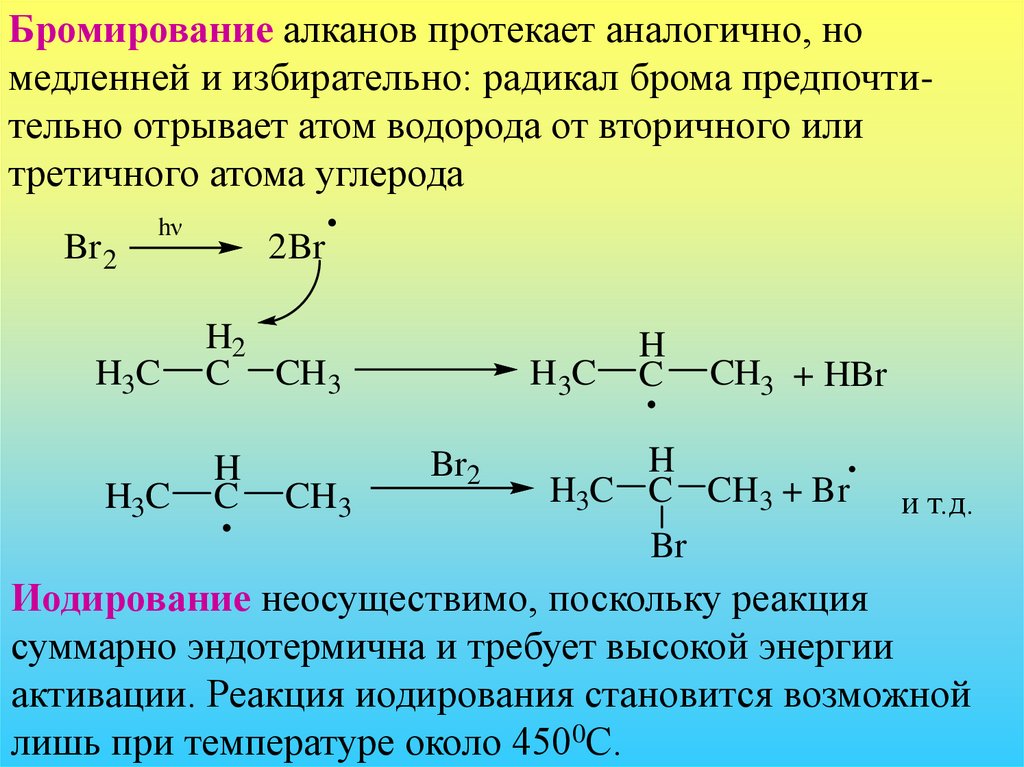
Бромирование алканов протекает аналогично, номедленней и избирательно: радикал брома предпочтительно отрывает атом водорода от вторичного или
третичного атома углерода
Br 2
hν
2Br
H3C
H2
C CH 3
H3C
H
C
CH3
H3C
Br2
H
C
CH3 + HBr
H
H3C C CH 3 + Br
и т.д.
Br
Иодирование неосуществимо, поскольку реакция
суммарно эндотермична и требует высокой энергии
активации. Реакция иодирования становится возможной
лишь при температуре около 4500С.
7.
Фторирование – крайне экзотермичный процесс,происходит значительное обугливание. Если берется алкан
отличный от метана, то в процессе рвутся связи С-С.
Как препаративный метод получения фторидов
фторирование элементарым фтором не применяется.
Реакция нитрования
Реакция нитрования впервые осуществлена русским
химиком М.И. Коноваловым в 1893 году. Дымящая
азотная кислота вызывает воспламенение
органических веществ, т.е. интенсивный процесс их
окисления. Коновалов взял разбавленную кислоту:
CH
HNO3 (11 - 14%)
0
150 C , запаянная трубка
C NO 2
8.
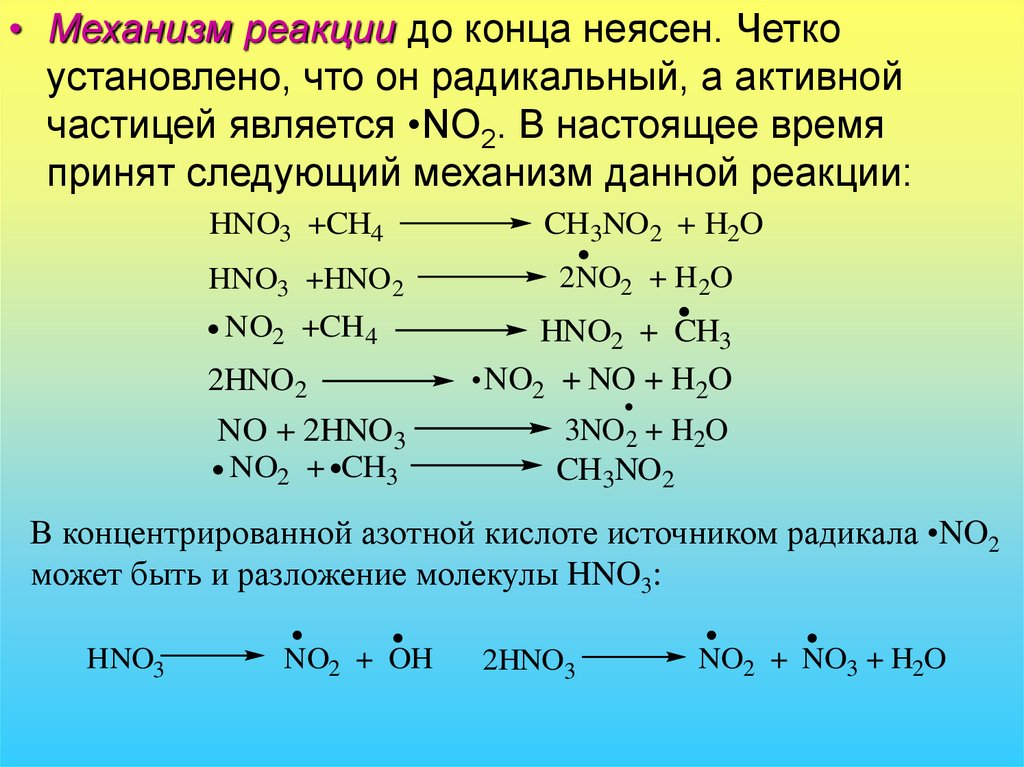
• Механизм реакции до конца неясен. Четкоустановлено, что он радикальный, а активной
частицей является •NO2. В настоящее время
принят следующий механизм данной реакции:
HNO3 +CH4
HNO3 +HNO 2
NO2 +CH4
2HNO2
NO + 2HNO3
NO2 + CH3
CH3NO2 + H2O
2NO2 + H 2O
HNO2 + CH3
NO2 + NO + H2O
3NO2 + H2O
CH3NO2
В концентрированной азотной кислоте источником радикала •NO2
может быть и разложение молекулы HNO3:
HNO3
NO2 + OH
2HNO3
NO2 + NO3 + H2O
9.
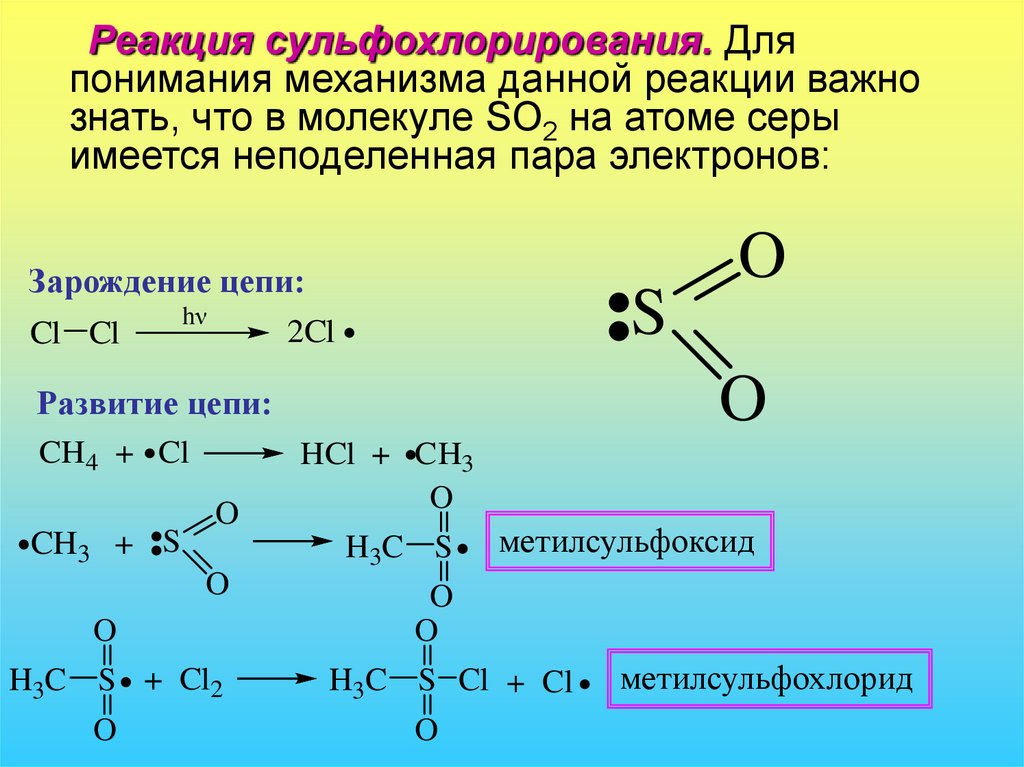
Реакция сульфохлорирования. Дляпонимания механизма данной реакции важно
знать, что в молекуле SO2 на атоме серы
имеется неподеленная пара электронов:
Зарождение цепи:
hν
2Cl
Cl Cl
S
O
Развитие цепи:
CH 4 + Cl
CH3 + S
O
O
H3C S + Cl2
O
HCl + CH3
O
H3C S
O
O
метилсульфоксид
O
O
H3C S Cl + Cl
O
метилсульфохлорид
10.
OO
H3C S Cl + NaOH
O
H3C S ONa
O
Мерзоляты – синтетические моющие вещеста
Преимущественное взаимодействие алкильного радикала с
диоксидом серы, приводящее к сульфохлорированию, а не с
молекулой хлора (что должно было бы давать продукт
хлорирования) обеспечивается тем, что
SO2 намеренно берется в очень большом избытке
В эту реакцию вводят алканы с длинной неразветвленной цепью
(число атомов углерода – десять и более).
11.
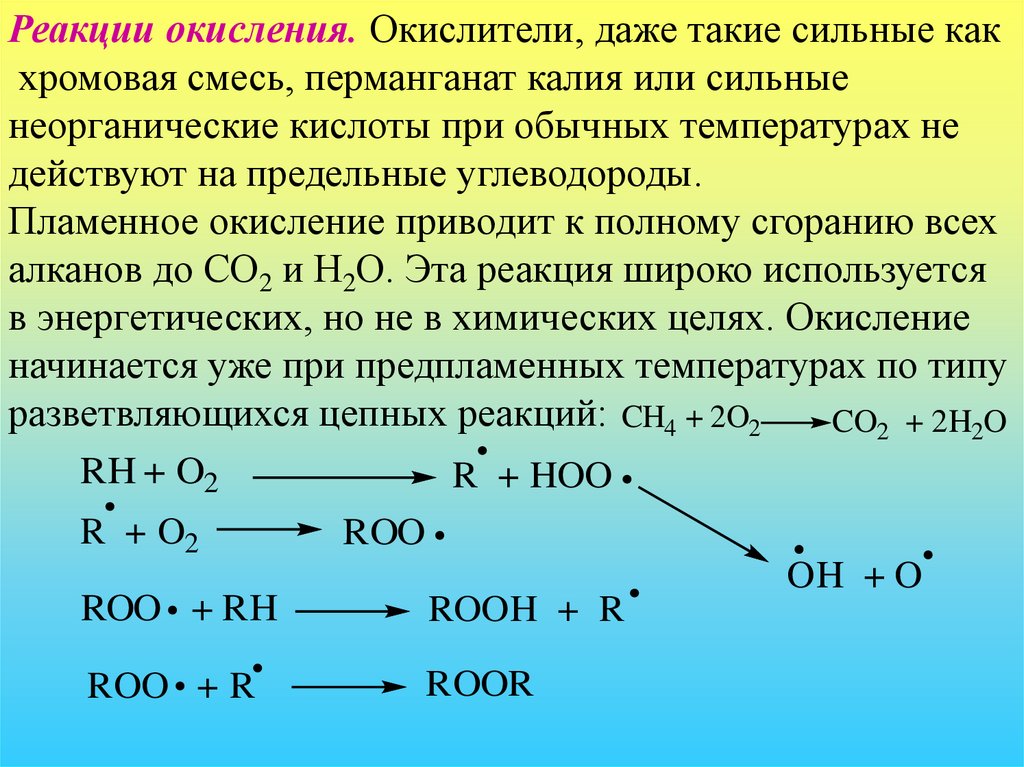
Реакции окисления. Окислители, даже такие сильные какхромовая смесь, перманганат калия или сильные
неорганические кислоты при обычных температурах не
действуют на предельные углеводороды.
Пламенное окисление приводит к полному сгоранию всех
алканов до СО2 и Н2О. Эта реакция широко используется
в энергетических, но не в химических целях. Окисление
начинается уже при предпламенных температурах по типу
разветвляющихся цепных реакций: CH4 + 2O2
CO2 + 2H2O
RH + O2
R + HOO
R + O2
ROO
OH + O
ROO + RH
ROOH + R
ROO + R
ROOR
12.
В первой фазе окисления углеводорода RH в качествемалоустойчивых
промежуточных
продуктов
образуются
гидроперекиси ROOH, распадающиеся с образованием альдегидов,
кетонов, спиртов, кислот, а также короткоживущих радикалов R .
Так выглядит горение бензина в автомобильном двигателе.
В двигателе внутреннего сгорания при сжатии смеси паров с
воздухом, нормальные углеводороды образуют перекиси,
вызывающие преждевременное воспламенение без участия
запальной свечи, которая дает искру только в момент наибольшего
сжатия поршнем смеси газов. Явление это называется –
детонацией и причиняет вред, т.к. способствует изнашиванию
двигателя и не позволяет полностью использовать его мощность.
Разветвленные парафины лишены этого недостатка. (Реакция
цепная, свободно-радикальная – более стабильные радикалы будут
способствовать «гладкому» протеканию реакции).
13.
• В 1927 году после того, как было обнаружено, что разныебензины
обладают
различными
детонационными
свойствами, были введены стандарты. Для наилучшего
бензина в то время известный – изооктан (2,2,4триметилпентан), детонирующий при высоких степенях
сжатия, было принято октановое число 100, а для нгептана, особенно склонного к детонации – за 0.
CH3
CH3
H3C C CH2 CH CH3
CH3 CH2 CH2 CH2 CH2 CH2 CH3
CH3 100
0
Качество бензина, т. е. его октановое число, резко повышается при добавлении
небольших количеств антидетонаторов.
4PbNa
сплав
+
4C2H5Cl
Pb(C2H5)4 + 4NaCl + 3Pb
тетраэтилсвинец
ТЭС – ядовит, вызывает цирроз печени, рак.
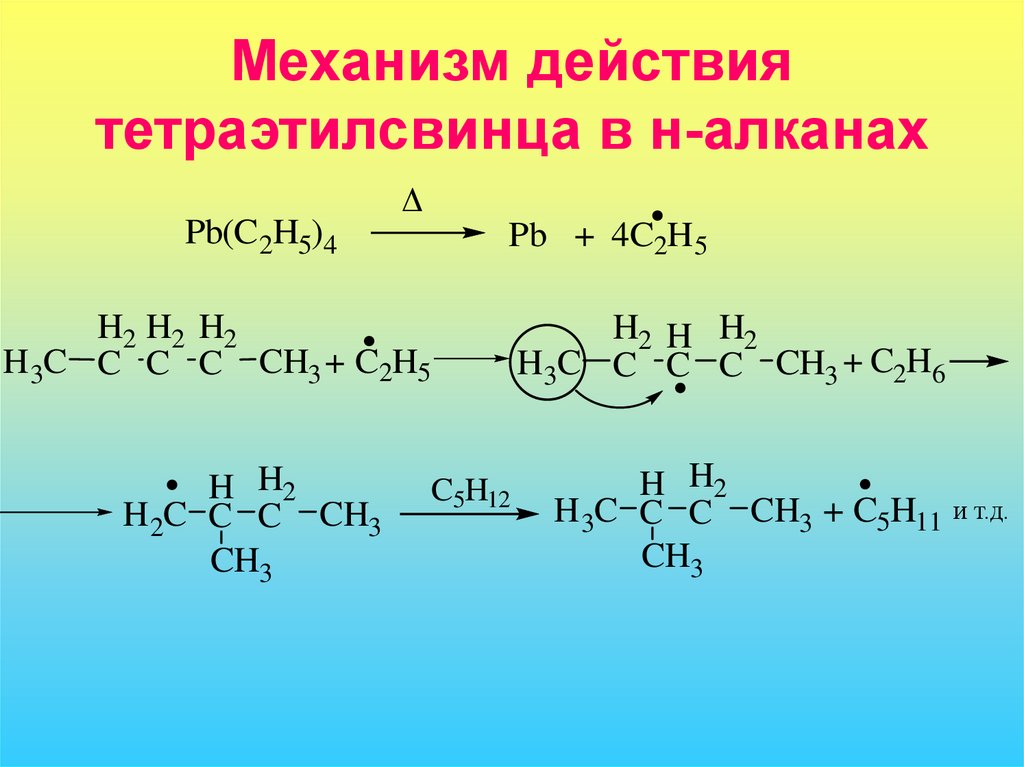
14. Механизм действия тетраэтилсвинца в н-алканах
ΔPb(C2H5)4
Pb + 4C2H5
H2 H2 H2
H 3C C C C CH3 + C2H5
H H2
H2C C C CH3
CH3
C5H12
H2 H H2
H3C C C C CH3 + C2H6
H H2
H 3C C C CH3 + C5H11
CH3
и т.д.
15.
Несмеянов предложил ЦПМ – более эффективен и бензиныс этой присадкой неядовиты:
циклопентадиенилпентакарбонилмарганца
(можно получить топливо с
OC Mn CO
октановым числом 135)
CO CO CO
В дизельных и ракетных топливах, где сжимается воздух, а
потом подается бензин, ценным является способность топлива
быстро загораться. Здесь наблюдается обратная зависимость: самые
ценные топлива состоят из нормальных углеводородов.
Способность топлива к воспламенению выражается в цетановых
числах. В оценочной условной шкале «цетановых чисел» точке 100
отвечает углеводород – цетан (гексадекан): С16Н34, а точке 0 - αСН3
метил-нафталин:
Для большинства автомобильных дизелей требуется топливо с
цетановым числом 45.
16.
Крекинг алканов.Метан – наиболее термически устойчивый из алканов. Он
подвергается термическому распаду при 1400 :
2СН4
С2H2
+
3H2
Это термический процесс. Один из промышленных
способов получения ацетилена. Углеводороды, содержащие
более длинные цепи разрываются в любом случайном месте
цепи. Как правило, получается эквимолярная смесь алканов и
олефинов.
CH3(CH2)4CH3
~
°
1500
CH3 +
CH2CH2CH2CH2CH3
CH3CH2 + CH2CH2CH2CH3
CH4 + CH2 CHCH2CH2CH3
CH3CH3 + CH2 CHCH2CH3
В 1934 году Гудри (США)
вел в практику каталитический крекинг на
алюмосиликатных катализаторах, позволяющий получать бензин с высоким октановым
числом (до 80). Алюмосиликаты действуют в этих условиях как кислотные катализаторы.
Полагают, что термический крекинг – это чисто гомолитический процесс.
Каталитический – гетеролитический процесс, идущий с образованием ионов, которые
перегруппировываются во вторичные и третичные как наиболее стабильные. Отсюда и
выше октановое число.
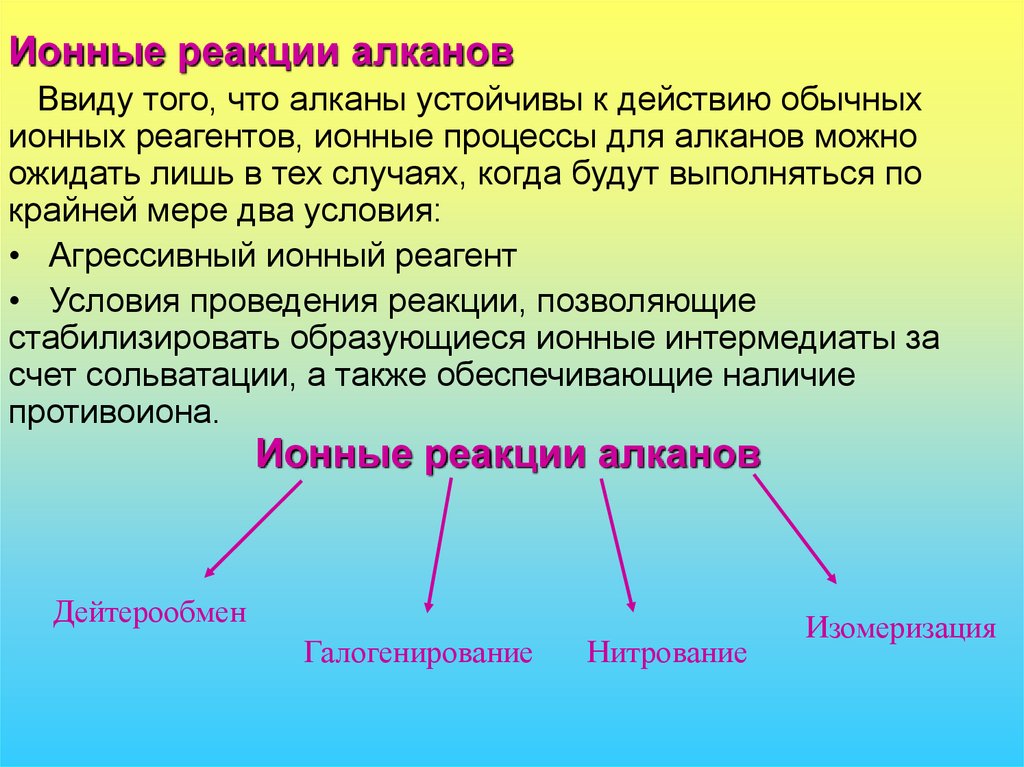
17. Ионные реакции алканов
Ввиду того, что алканы устойчивы к действию обычныхионных реагентов, ионные процессы для алканов можно
ожидать лишь в тех случаях, когда будут выполняться по
крайней мере два условия:
• Агрессивный ионный реагент
• Условия проведения реакции, позволяющие
стабилизировать образующиеся ионные интермедиаты за
счет сольватации, а также обеспечивающие наличие
противоиона.
Ионные реакции алканов
Дейтерообмен
Галогенирование
Нитрование
Изомеризация
18.
ДейтерообменВ 1968 г. Ола осуществил реакцию дейтерообмена:
CH 4
DF + SbF5
CH 3D
Процесс замещения водорода на дейтерий в этой реакции объяснили
промежуточным образованием иона метония СН 5 или СН4D+. Существование
иона СН 5 было доказано с помощью масс-спектральных исследований в газовой
фазе. Было найдено, что этот ион относительно прочный. Энергия диссоциации
его по схеме:
CH3 + H2
CH5
ΔН = 40 ккал/моль
Ион метония содержит углерод, связанный с пятью атомами водорода, а не с четырьмя,
как в метане. То есть в этом ионе связь атомов водорода с атомом углерода обеспечивается
всего четырьмя электронами. Атом углерода в таком ионе называется
гиперкоординированным, а связь – электрон-дефицитной. Чтобы понять, как образуется
связь в ионе метония, рассмотрим вначале хорошо известный пример соединения с
электрон-дефицитными связями – ион Н 3
Н
Н
+
о
0,87А
Н
Н
Н
о
0,75 А
19.
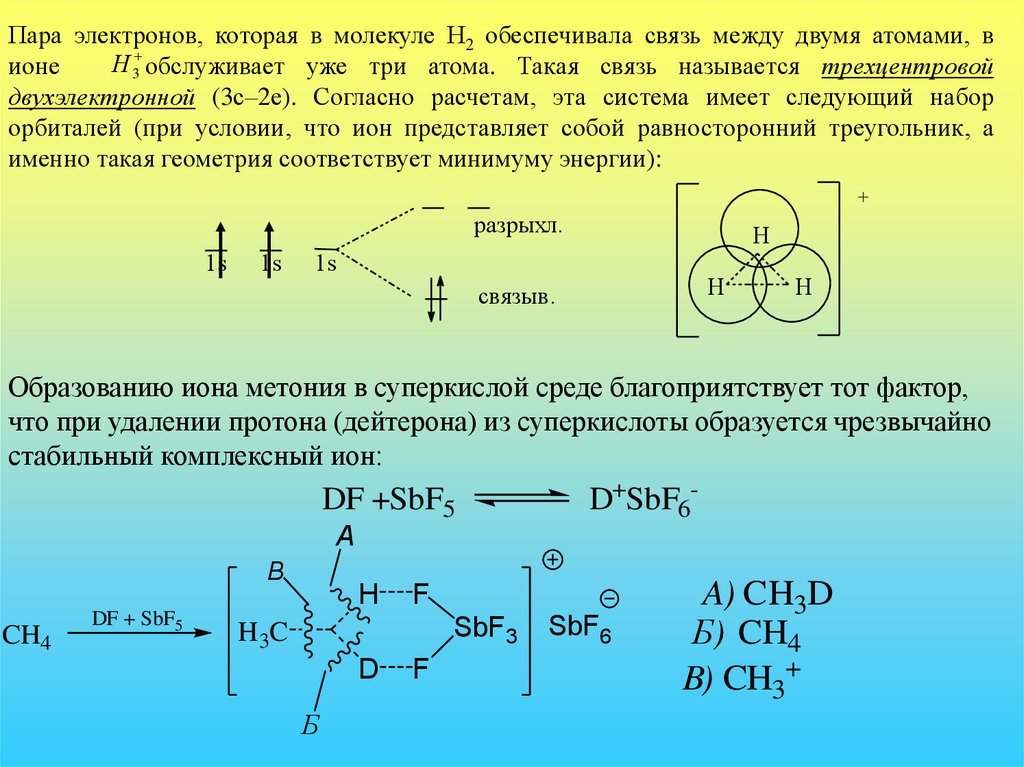
Пара электронов, которая в молекуле Н2 обеспечивала связь между двумя атомами, вН 3 обслуживает уже три атома. Такая связь называется трехцентровой
ионе
двухэлектронной (3с–2е). Согласно расчетам, эта система имеет следующий набор
орбиталей (при условии, что ион представляет собой равносторонний треугольник, а
именно такая геометрия соответствует минимуму энергии):
+
разрыхл.
1s
1s
Н
1s
Н
связыв.
Н
Образованию иона метония в суперкислой среде благоприятствует тот фактор,
что при удалении протона (дейтерона) из суперкислоты образуется чрезвычайно
стабильный комплексный ион:
DF +SbF5
D+SbF6-
A
B
CH4
DF + SbF5
H
F
SbF3
H 3C
D
Б
F
SbF6
A) CH3D
Б) CH4
B) CH3+
20.
HCH4 + [CH3]+
H3C
CH 3
SbF6
-H+
H3C CH3
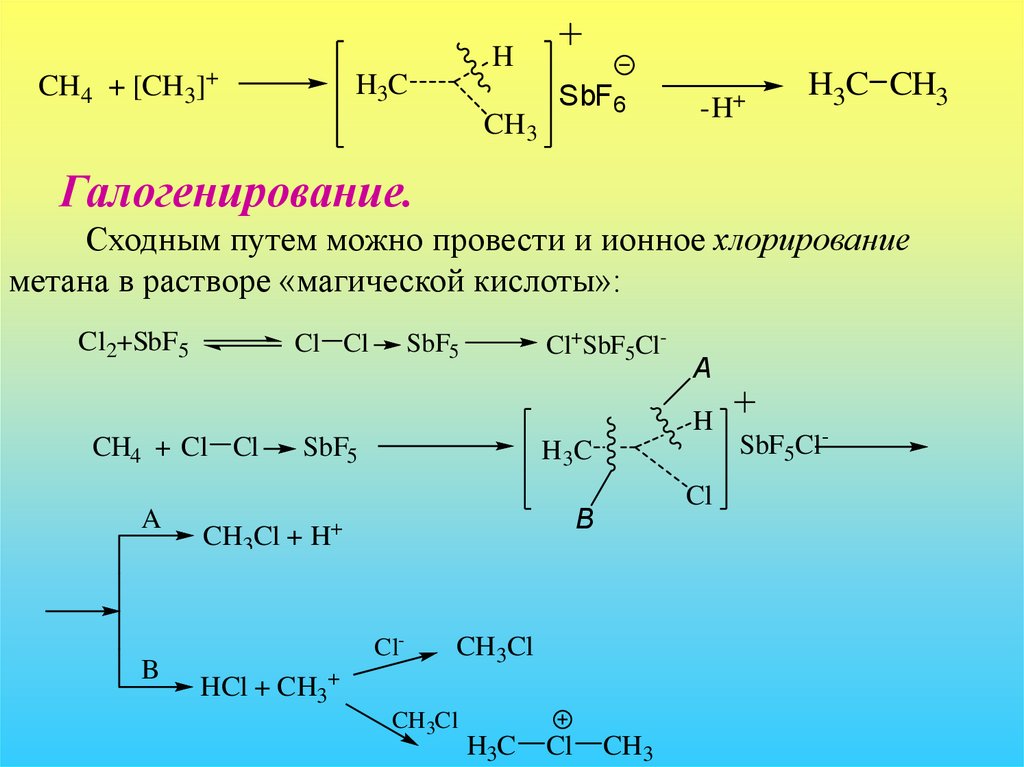
Галогенирование.
Сходным путем можно провести и ионное хлорирование
метана в растворе «магической кислоты»:
Cl2+SbF5
Cl Cl
Cl+SbF5Cl-
SbF5
A
H
CH4 + Cl Cl
A
B
SbF5
H 3C
Cl
B
CH3Cl + H+
Cl-
CH3Cl
HCl + CH3+
CH 3Cl
H3C
Cl
CH3
SbF5Cl-
21.
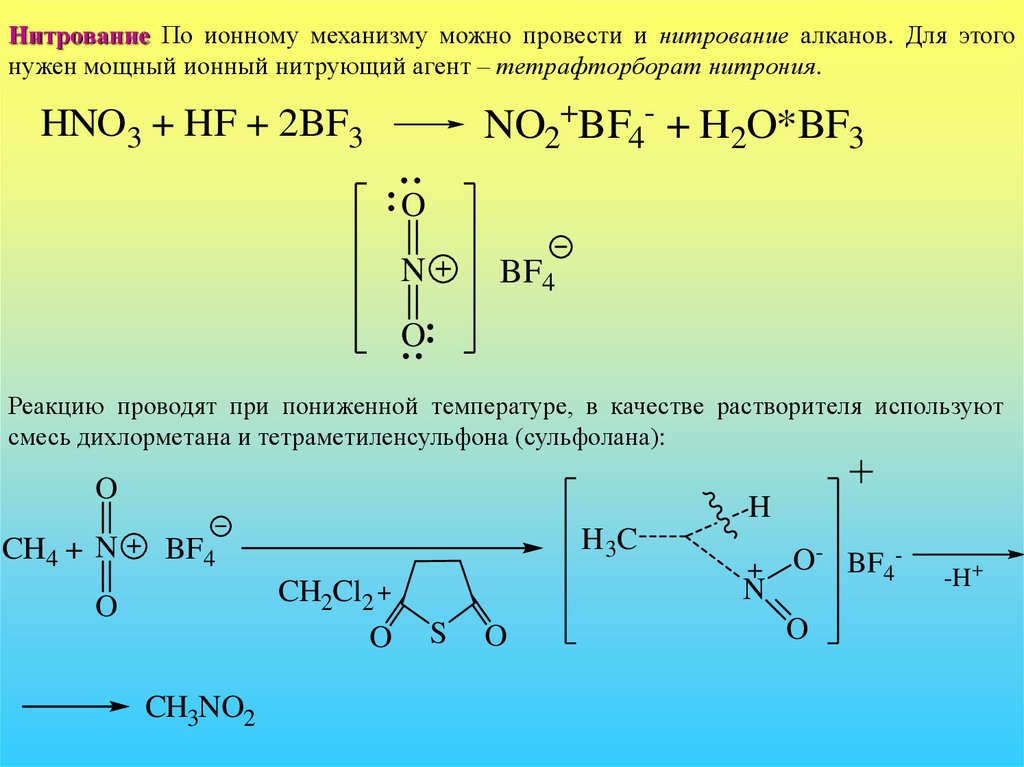
Нитрование По ионному механизму можно провести и нитрование алканов. Для этогонужен мощный ионный нитрующий агент – тетрафторборат нитрония.
NO2+BF4- + H2O*BF3
HNO3 + HF + 2BF3
O
N
BF4
O
Реакцию проводят при пониженной температуре, в качестве растворителя используют
смесь дихлорметана и тетраметиленсульфона (сульфолана):
O
CH4 + N
H
H 3C
BF4
CH2Cl2 +
O
O
CH3NO2
N
S
O
O- BF4O
-H+
22.
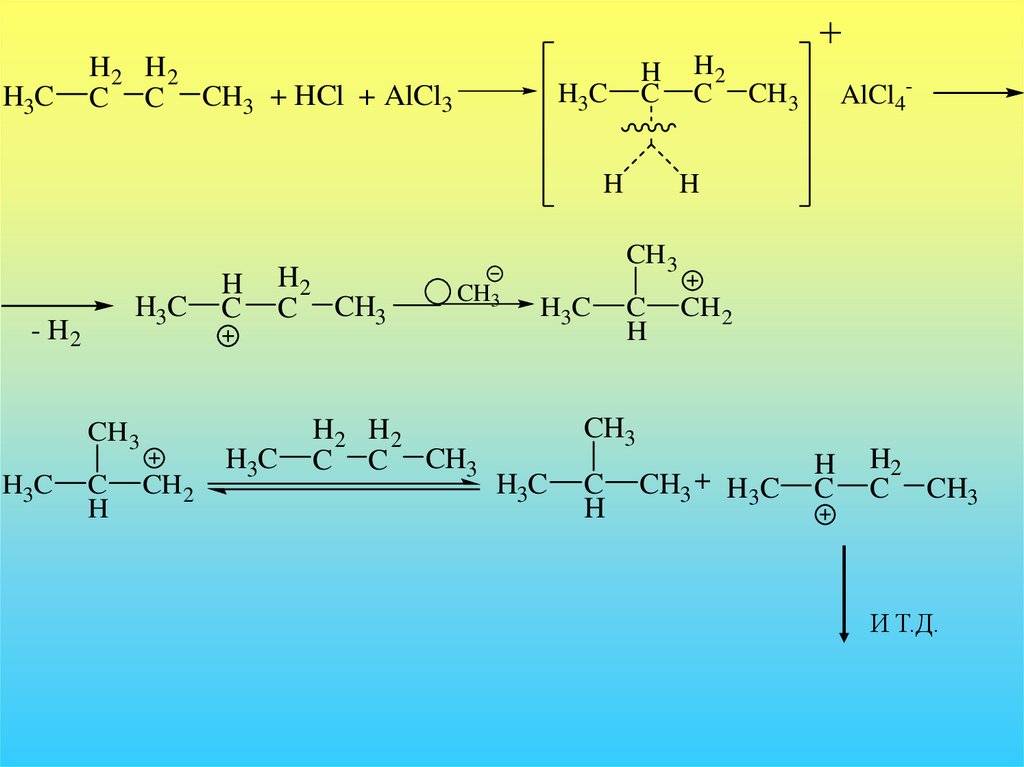
Изомеризация.В 1946 году было показано, что бутан изомеризуется в
термодинамически более стабильный изобутан в присутствии
кислоты Льюиса – хлорида алюминия. Было обнаружено, что
реакция эта идет только в присутствии примеси HCl. В отсутствие
HCl реакция не происходит. На начальных стадиях реакции
выделяется небольшое количество водорода:
CH3
CH3CH2CH2CH2
AlCl 3
примесь HCl
Н3С
CH
CH3 + немного H2
в начале реакции
Механизм этой реакции стал понятен после работ Ола и включает
образование катионов с гиперкоординированным углеродом.
23.
H3CH2 H2
C C CH3 + HCl + AlCl3
H
C
H3C
H
H3C
- H2
CH 3
H3C
C
H
CH 2
H
C
H2
C CH3
H3C
H2
C CH 3
AlCl4-
H
CH 3
CH3
H2 H2
C C CH3
H3C
C
H
CH 2
CH3
H3C
C
H
CH3 + H 3C
H
C
H2
C CH3
И Т.Д.
24. Алкилирование
• Электрофильное алкилирование осуществляется привзаимодействии алканов с заранее полученными
карбкатионами R3C+ (например t-Bu+SbF6-) или R3C+,
возникающими в результате переноса водорода:
R3CH + H+
R3C+ + H2
Среда – раствор сульфурилхлоридфторида, t= -780C
(CH3)3C+SbF6- +
(CH3)3CH
SO2ClF
0
-78 C
(CH3)3C
C(CH3)3+ HSbF6
~2%
Уменьшение пространственных препятствий повышает выход
(CH3)2CH+SbF6-
+ (CH3)3CH
SO2ClF
-780C
(CH3)2HC C(CH3)3 + HSbF6
~12%
25. Способы получения алканов
1. Из карбида алюминия можно получить метан:Al4C3
H2O
4Al(OH) 3 + 3CH4
Карбид алюминия
2. Синтез Фишера-Тропша
Из синтез-газа возможно получать насыщенные углеводороды с
длиной цепи 12-14 углеродных атомов:
nCO + (2n+1)H2
Синтез-газ
CnH2n+2 + nH2O
26.
3. Реакция Вюрца:2RHal + 2Na
2RHal + 2Na
R + 2NaHal
R
Na+ + [RHal]
Hal-
R
R
на поверхности натрия
в ра
ство
ре
R
R
Отрывает H от растворителя
RH
C4H9I + Na
Na+ + [C 4H9I]
C2H5I + Na
Na+ + [C2H 5I]
-NaI
-NaI
[C4H 9]
[C2H5]
Димеризация
произвольная:
На поверхности
натрия:
С4Н10, С6Н14, С8Н18
в растворе также
будут: С4Н10, С2Н6
27.
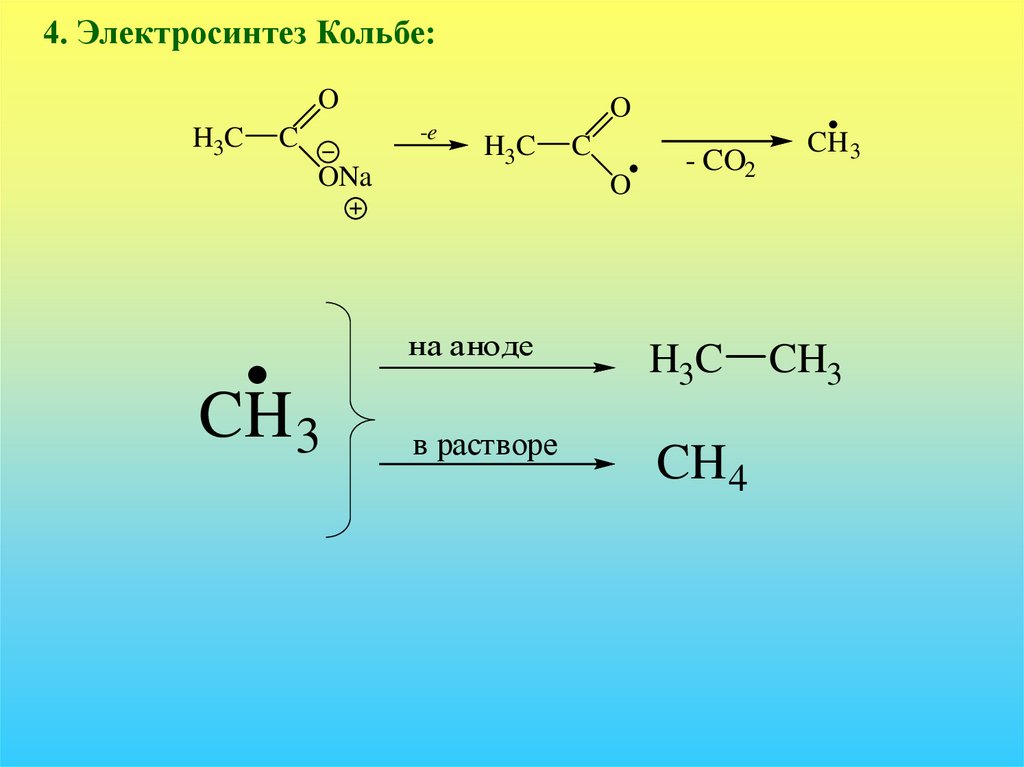
4. Электросинтез Кольбе:O
H3C
O
-e
C
ONa
H3C
O
на аноде
CH 3
C
в растворе
- CO2
H3C
CH 4
CH 3
CH3
28.
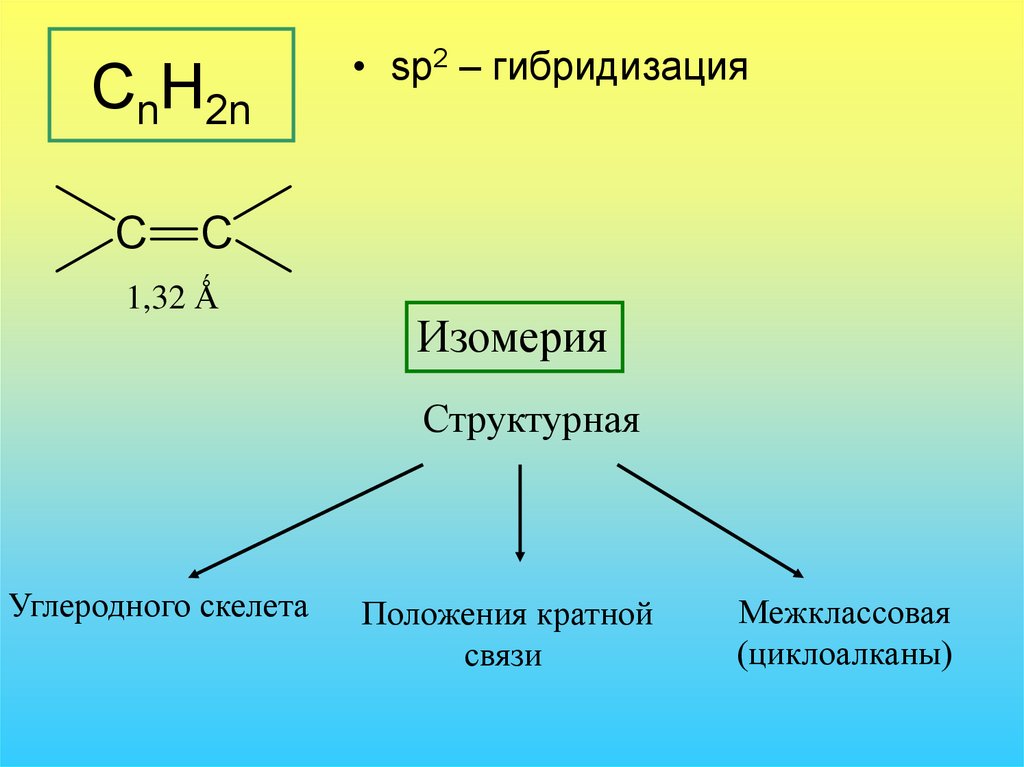
29. CnH2n
C• sp2 – гибридизация
C
1,32 Ǻ
Изомерия
Структурная
Углеродного скелета
Положения кратной
связи
Межклассовая
(циклоалканы)
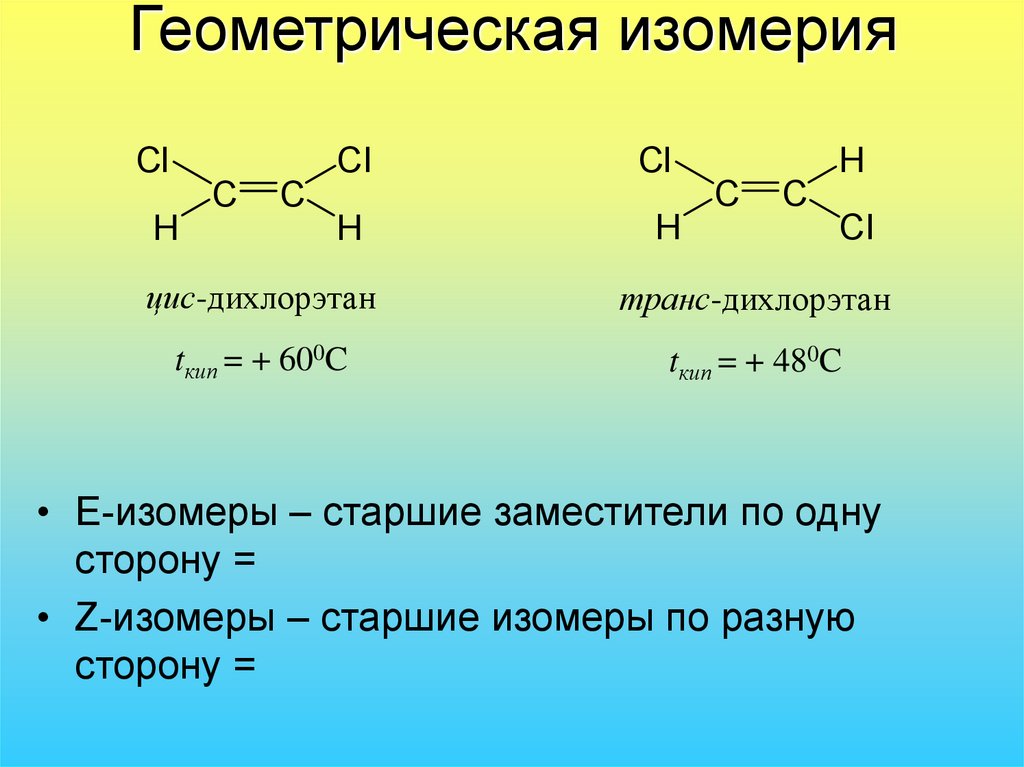
30. Геометрическая изомерия
ClCl
C
H
Cl
H
C
C
H
H
C
Cl
цис-дихлорэтан
транс-дихлорэтан
tкип = + 600C
tкип = + 480C
• Е-изомеры – старшие заместители по одну
сторону =
• Z-изомеры – старшие изомеры по разную
сторону =
31.
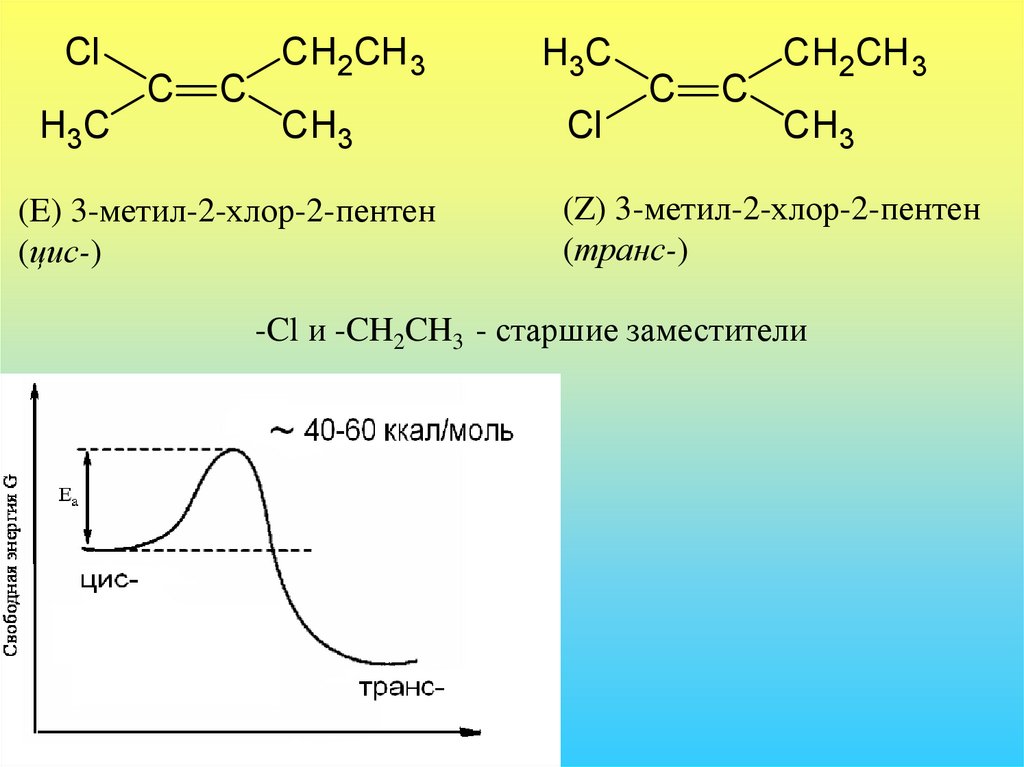
ClC
H3C
C
CH2CH3
CH3
(E) 3-метил-2-хлор-2-пентен
(цис-)
H3C
Cl
C
C
CH2CH 3
CH3
(Z) 3-метил-2-хлор-2-пентен
(транс-)
-Cl и -CH2CH3 - старшие заместители
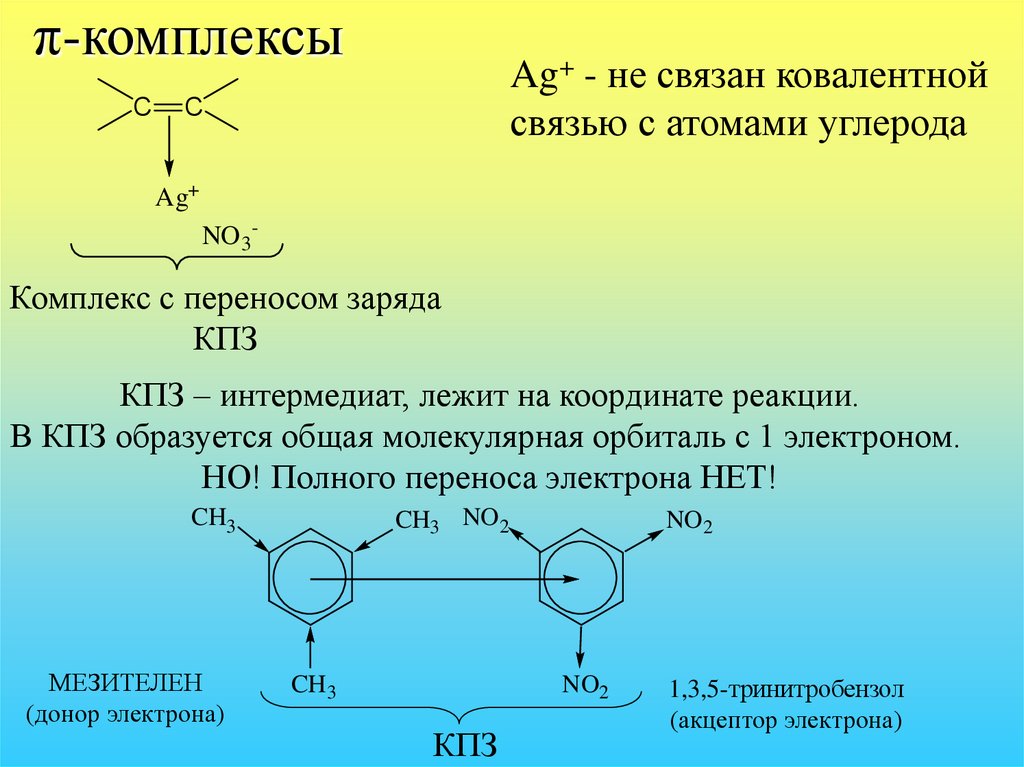
32. π-комплексы
CAg+ - не связан ковалентной
связью с атомами углерода
C
Ag+
NO 3-
Комплекс с переносом заряда
КПЗ
КПЗ – интермедиат, лежит на координате реакции.
В КПЗ образуется общая молекулярная орбиталь с 1 электроном.
НО! Полного переноса электрона НЕТ!
CH3
МЕЗИТЕЛЕН
(донор электрона)
CH3 NO 2
CH 3
NO 2
NO2
КПЗ
1,3,5-тринитробензол
(акцептор электрона)
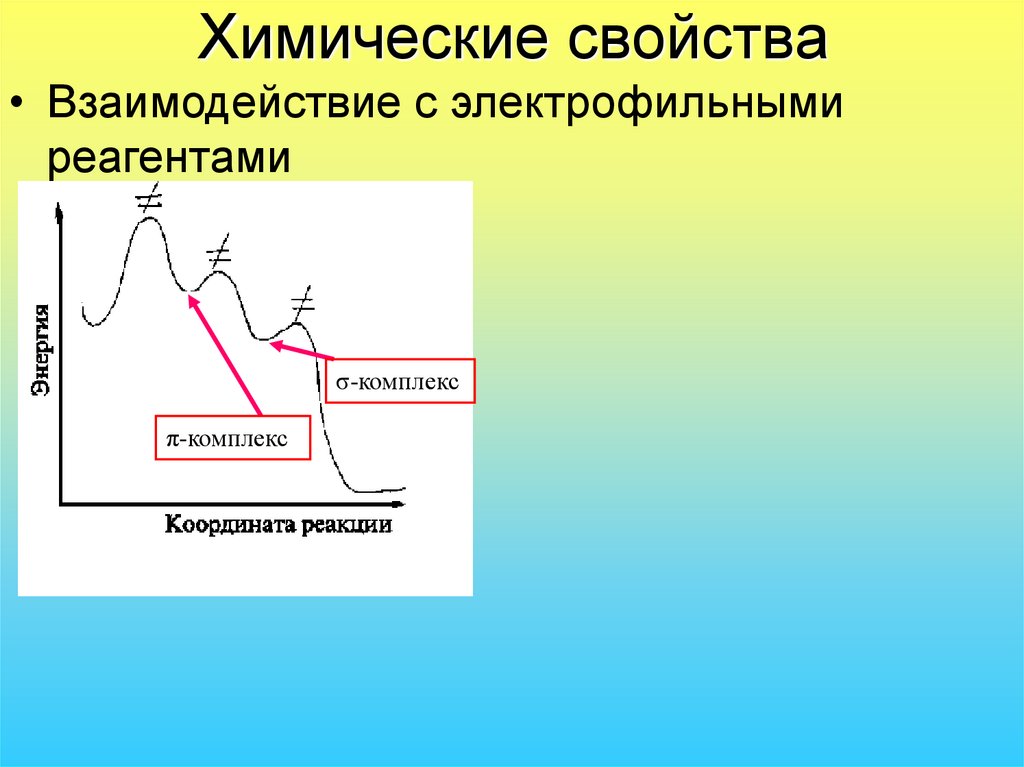
33. Химические свойства
• Взаимодействие с электрофильнымиреагентами
σ-комплекс
π-комплекс
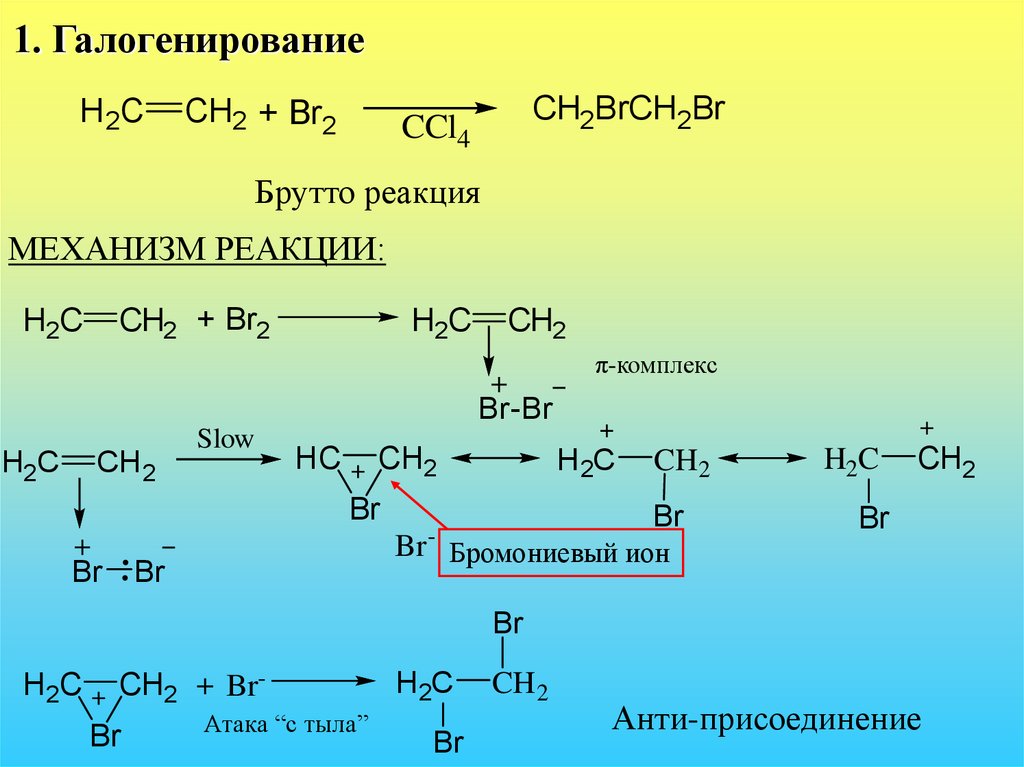
34. 1. Галогенирование
H2CCH2 + Br2
CH2BrCH2Br
CCl4
Брутто реакция
МЕХАНИЗМ РЕАКЦИИ:
CH2 + Br2
H2C
H2C
CH2
π-комплекс
Br-Br
H2C
CH 2
Slow
HC
CH2
H 2C
Br
Br
Br -
Br
CH 2
Br
H2C
CH2
Br
Бромониевый ион
Br
H2C
CH2 + BrBr
Атака “с тыла”
H 2C
Br
CH 2
Анти-присоединение
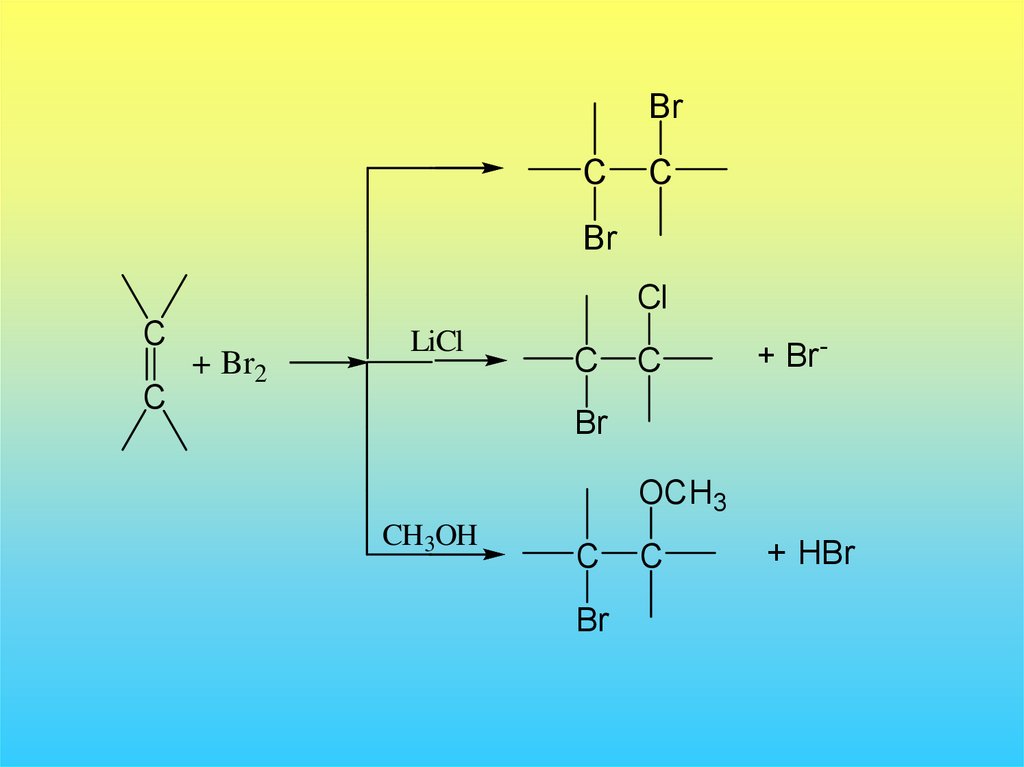
35.
BrC
C
Br
Cl
C
C
+ Br2
LiCl
C
C
+ Br -
Br
OCH3
CH3OH
C
Br
C
+ HBr
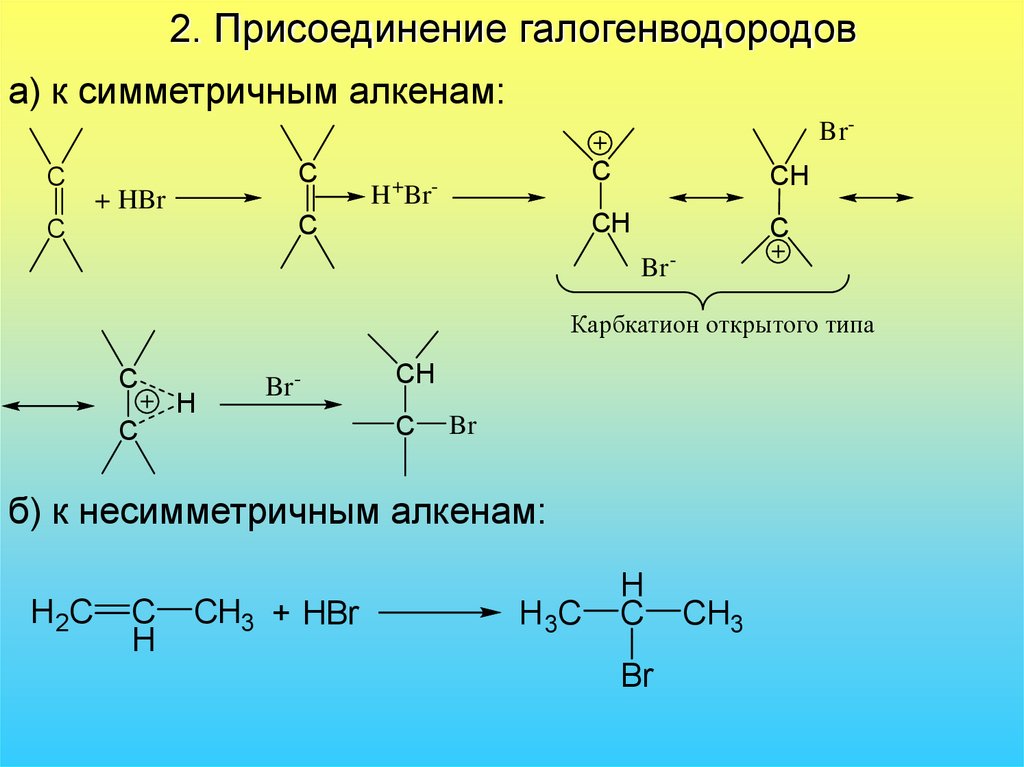
36. 2. Присоединение галогенводородов
а) к симметричным алкенам:Br-
C
C
+ HBr
+
H Br
-
C
C
C
CH
CH
C
Br Карбкатион открытого типа
C
H
Br -
C
CH
C
Br
б) к несимметричным алкенам:
H2C
C
H
CH3 + HBr
H 3C
H
C
Br
CH3
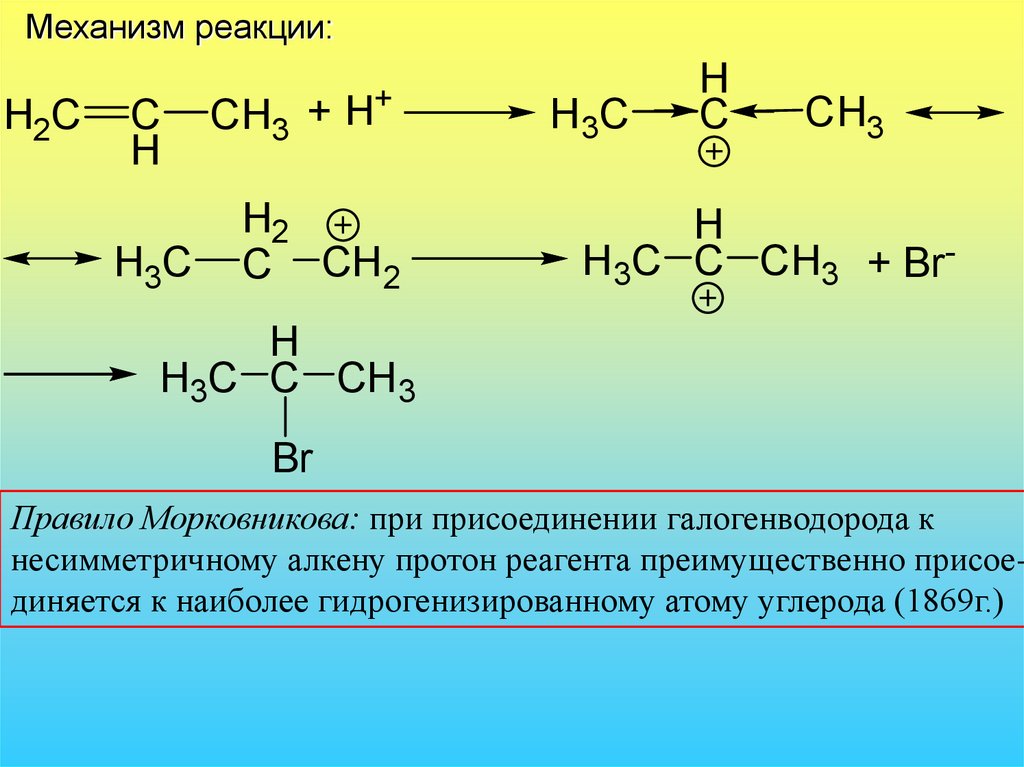
37. Механизм реакции:
H2CC
H
H3C
CH3 +
H+
H2
C CH2
H 3C
H
C
CH3
H
H3C C CH3 + Br-
H
H3C C CH3
Br
Правило Морковникова: при присоединении галогенводорода к
несимметричному алкену протон реагента преимущественно присоединяется к наиболее гидрогенизированному атому углерода (1869г.)













 chemistry
chemistry








