Similar presentations:
Алкины. Физические и химические свойства
1. АЛКИНЫ. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
2.
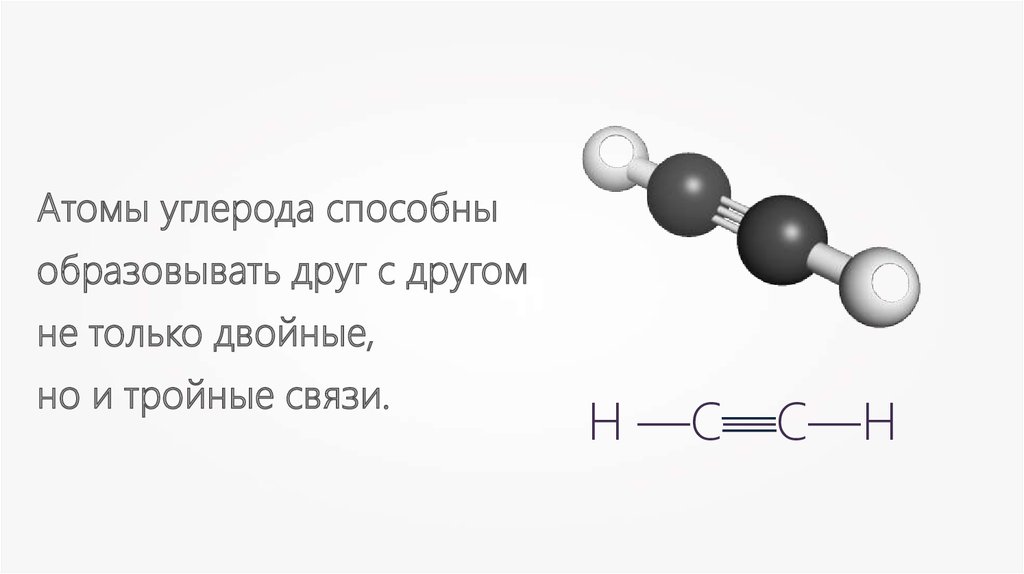
Атомы углерода способныобразовывать друг с другом
не только двойные,
но и тройные связи.
—
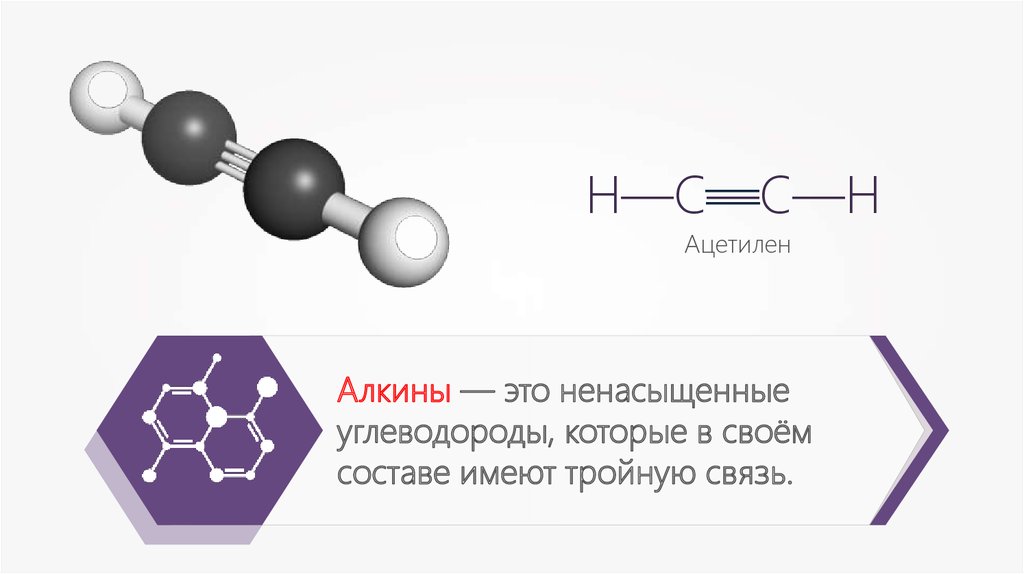
Н —С—С—Н
—
3.
—Н—С—С—Н
—
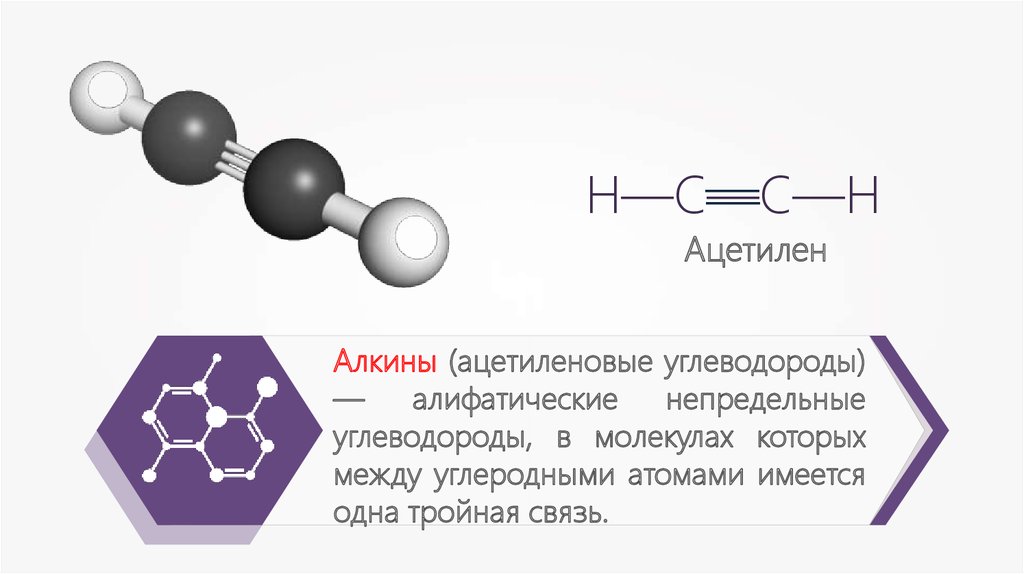
Ацетилен
Алкины (ацетиленовые углеводороды)
—
алифатические
непредельные
углеводороды, в молекулах которых
между углеродными атомами имеется
одна тройная связь.
4.
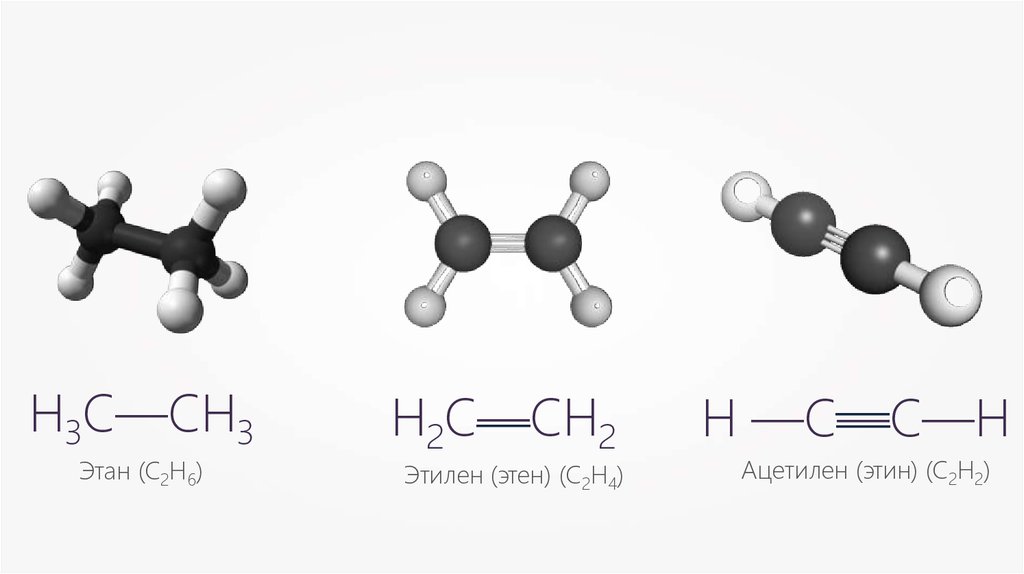
Н3С—СН3Этан (С2Н6)
Н2С—СН
— 2
Этилен (этен) (С2Н4)
—
Н —С—С—Н
—
Ацетилен (этин) (С2Н2)
5.
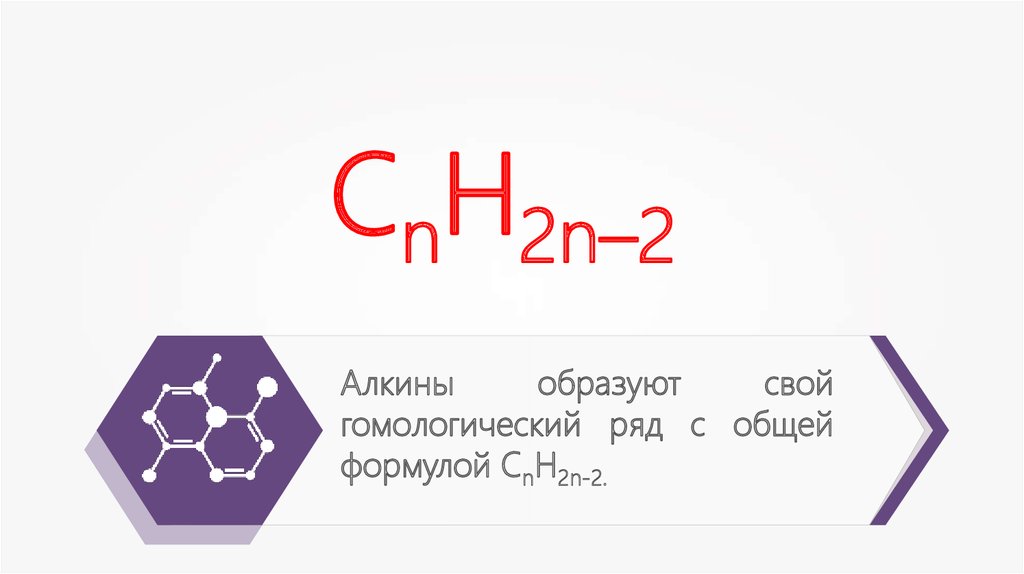
СnН2n–2Алкины
образуют
свой
гомологический ряд с общей
формулой СnH2n-2.
6.
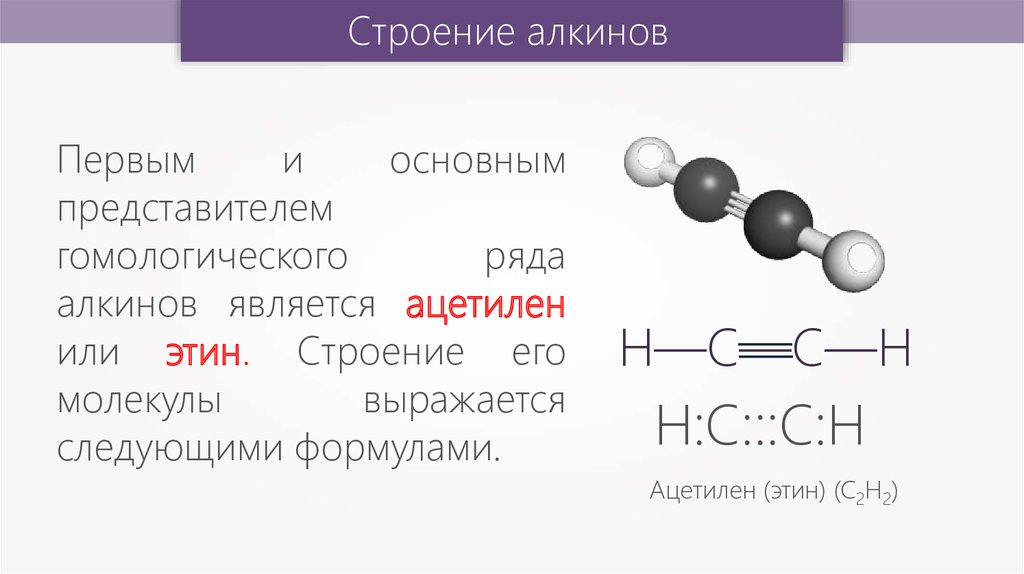
Строение алкиновПервым
и
основным
представителем
гомологического
ряда
алкинов является ацетилен
или этин. Строение его
молекулы
выражается
следующими формулами.
—
Н—С—С—Н
—
Н:С:::С:Н
Ацетилен (этин) (С2Н2)
7.
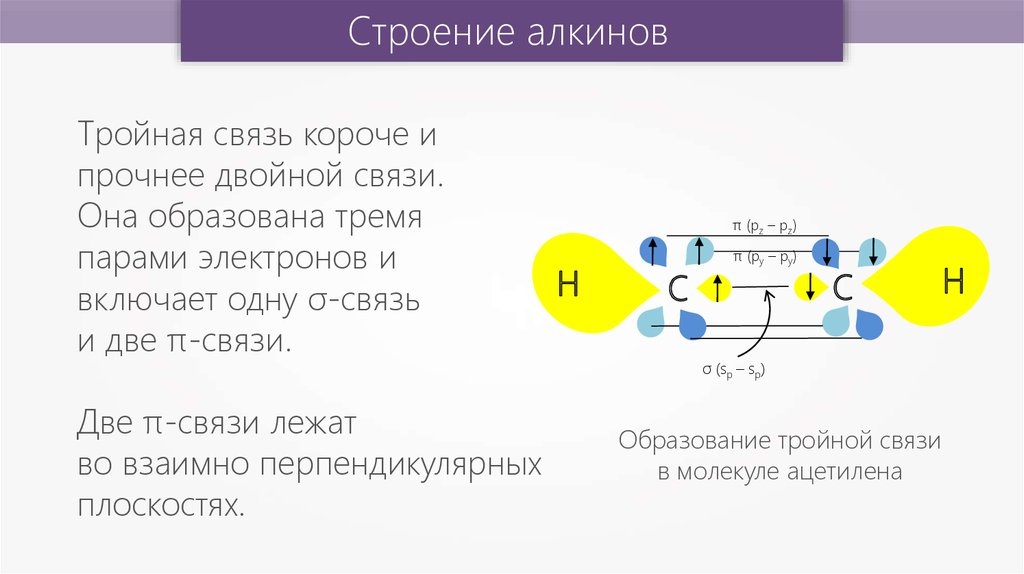
Строение алкиновТройная связь короче и
прочнее двойной связи.
Она образована тремя
парами электронов и
включает одну σ-связь
и две π-связи.
Две π-связи лежат
во взаимно перпендикулярных
плоскостях.
π (pz – pz)
Н
С
π (py – py)
С
σ (sp – sp)
Образование тройной связи
в молекуле ацетилена
Н
8.
Строение алкинов—
Н —С—С—Н
—
Ацетилен (этин) (С2Н2)
По названию первого представителя
этого ряда — ацетилена —
эти непредельные углеводороды
называют ацетиленовыми.
9.
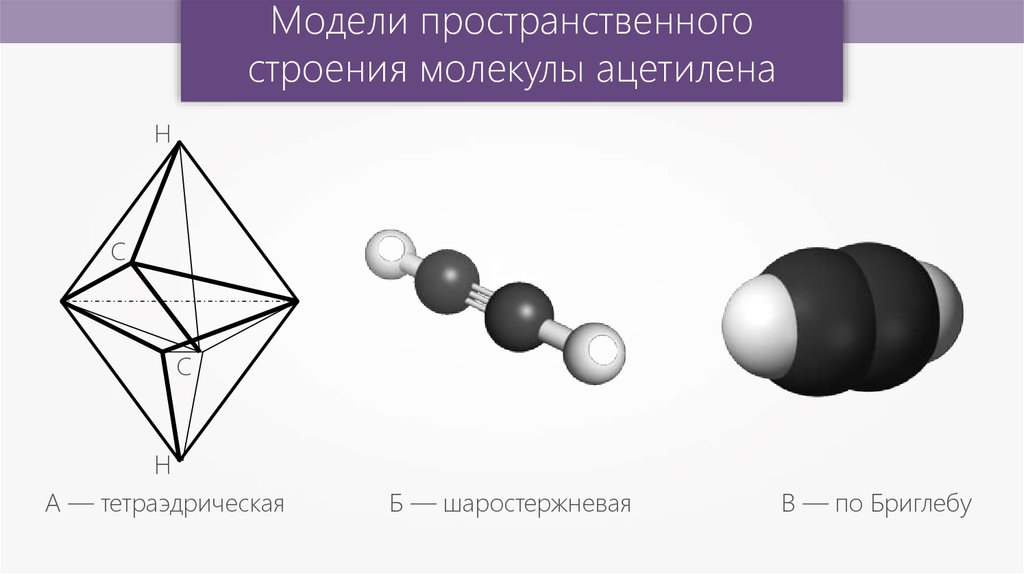
Модели пространственногостроения молекулы ацетилена
Н
С
С
Н
А — тетраэдрическая
Б — шаростержневая
В — по Бриглебу
10.
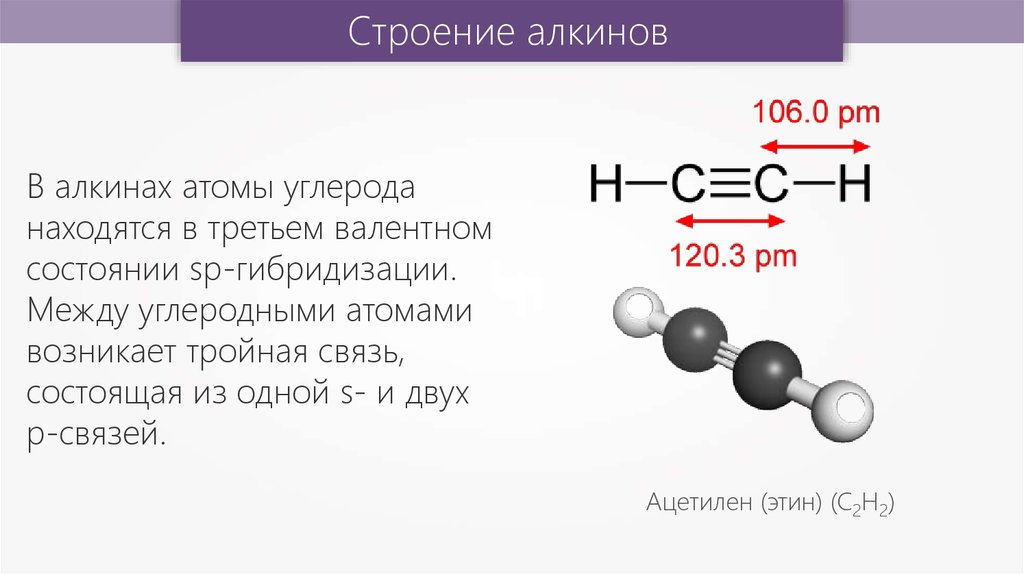
Строение алкиновВ алкинах атомы углерода
находятся в третьем валентном
состоянии sp-гибридизации.
Между углеродными атомами
возникает тройная связь,
состоящая из одной s- и двух
p-связей.
Ацетилен (этин) (С2Н2)
11.
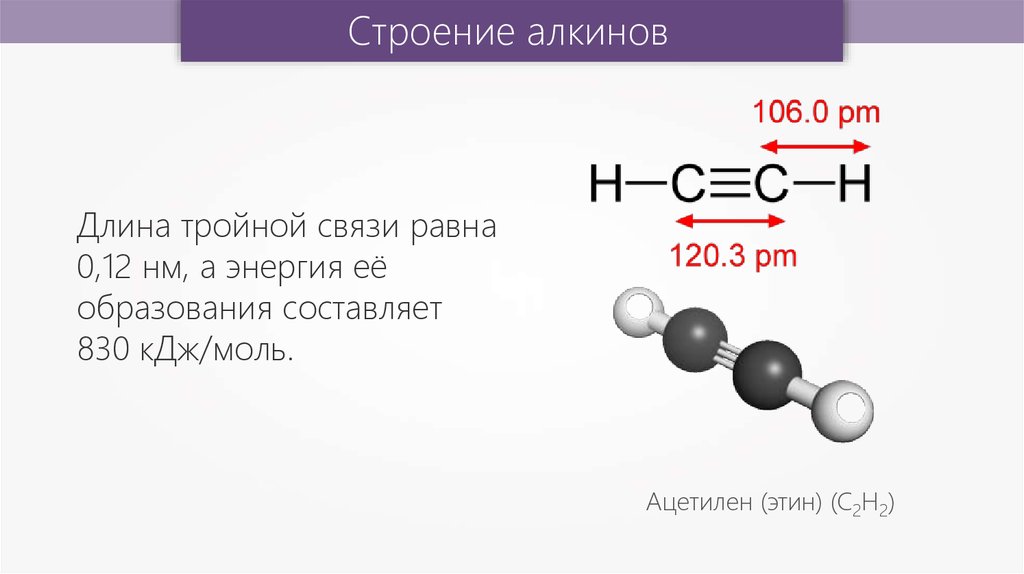
Строение алкиновДлина тройной связи равна
0,12 нм, а энергия её
образования составляет
830 кДж/моль.
Ацетилен (этин) (С2Н2)
12.
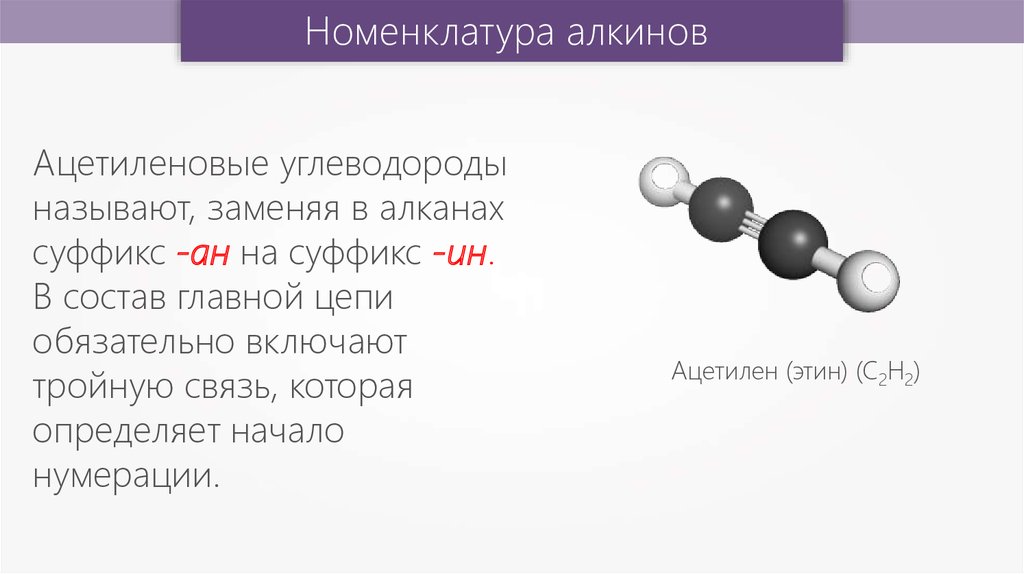
Номенклатура алкиновАцетиленовые углеводороды
называют, заменяя в алканах
суффикс -ан на суффикс -ин.
В состав главной цепи
обязательно включают
тройную связь, которая
определяет начало
нумерации.
Ацетилен (этин) (С2Н2)
13.
Номенклатура алкинов—
Н2С—С—С—С—Н
—
—
—
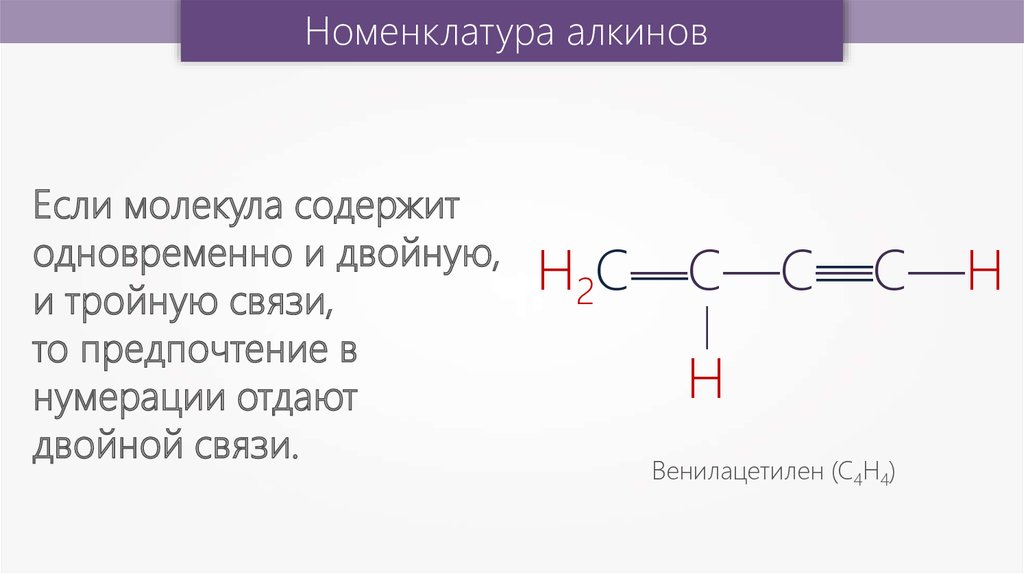
Если молекула содержит
одновременно и двойную,
и тройную связи,
то предпочтение в
нумерации отдают
двойной связи.
Н
Венилацетилен (С4Н4)
14.
Номенклатура алкинов—
Н2С—С—С—С—Н
—
—
—
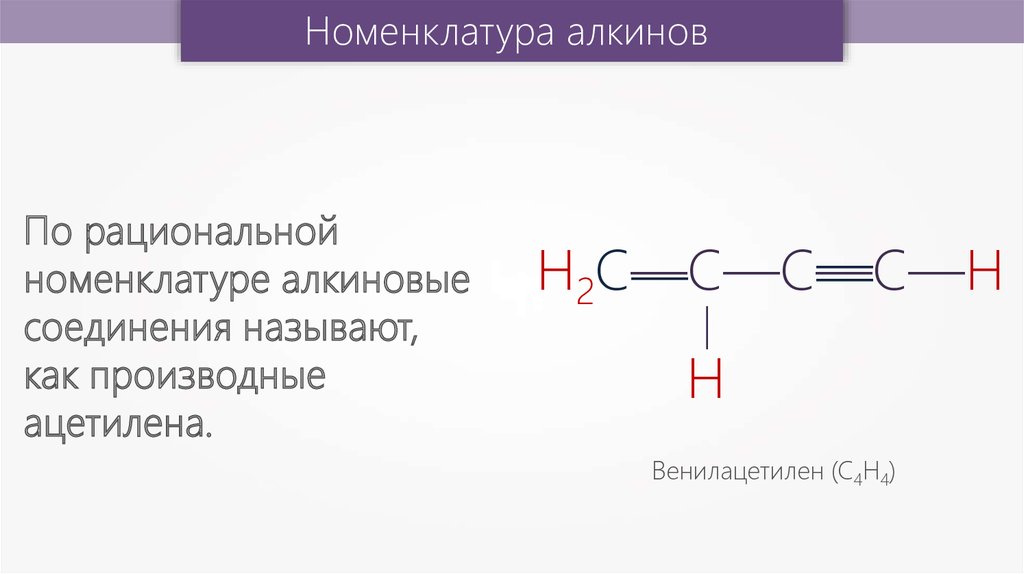
По рациональной
номенклатуре алкиновые
соединения называют,
как производные
ацетилена.
Н
Венилацетилен (С4Н4)
15.
Номенклатура алкинов—
СН3—С—С—СН
—
3
—
СН—С—СН
—
2—СН3
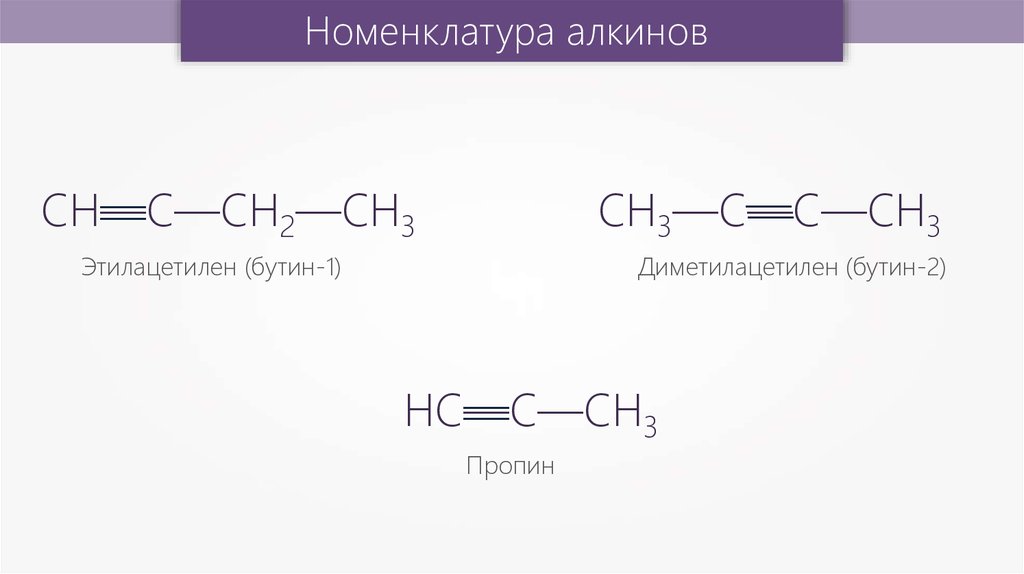
Этилацетилен (бутин-1)
Диметилацетилен (бутин-2)
—
НС—С—СН
—
3
Пропин
16.
Номенклатура алкинов—
—
СН—С—СН—СН
—
3
СН3
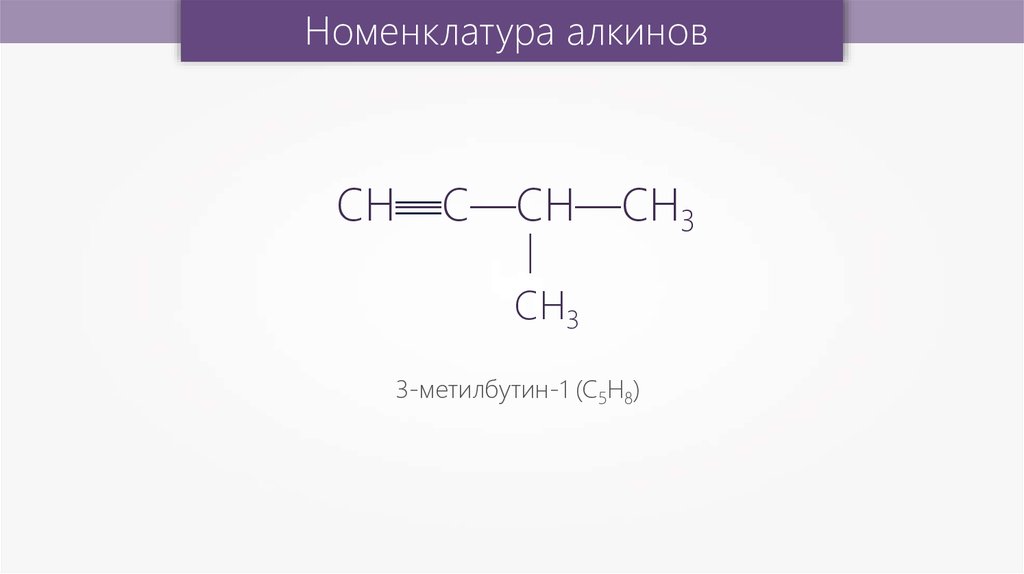
3-метилбутин-1 (С5Н8)
17.
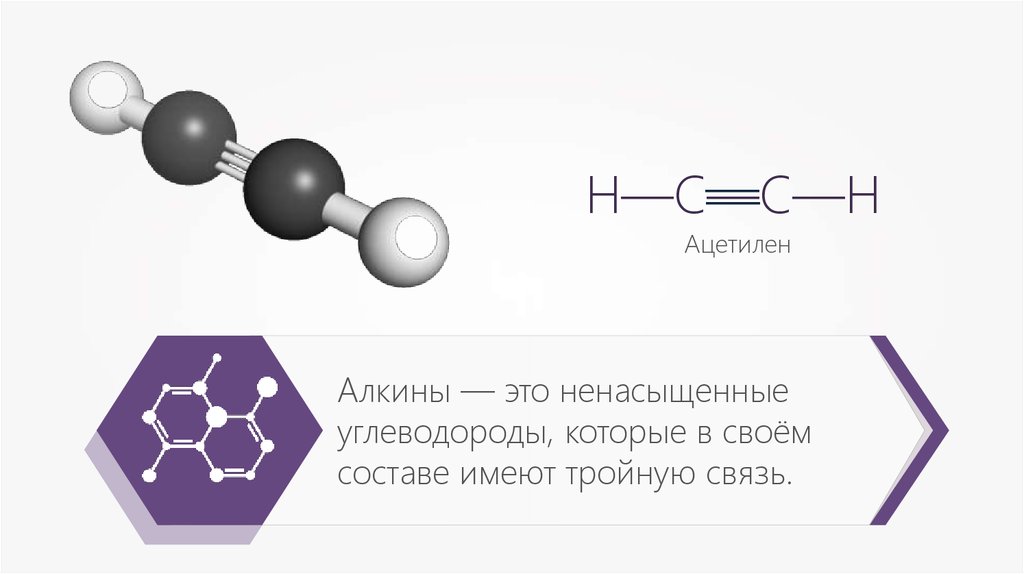
—Н—С—С—Н
—
Ацетилен
Ацетилен или этин — бесцветный газ, без запаха.
Ацетилен мало растворим в воде, хорошо —
в ацетоне. На воздухе горит сильно коптящим
пламенем. При горении в кислороде ацетилен
создает высокотемпературное пламя (до 3000°С).
18. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
19.
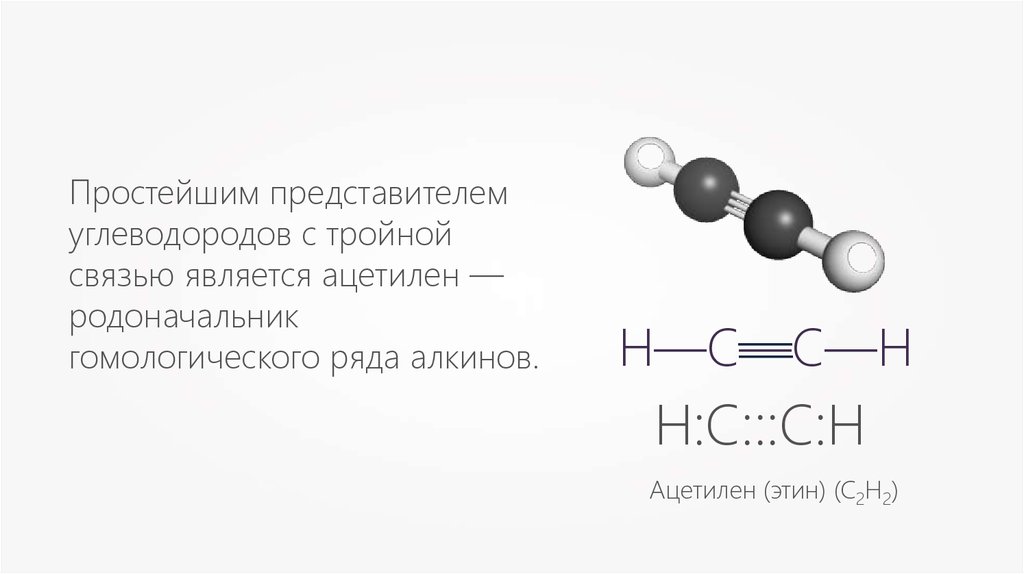
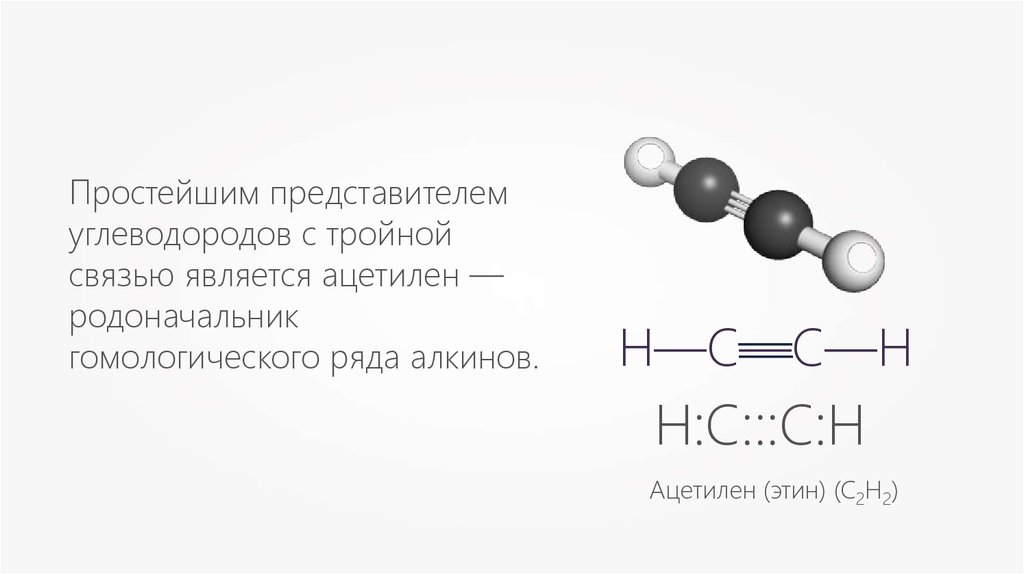
Простейшим представителемуглеводородов с тройной
связью является ацетилен —
родоначальник
гомологического ряда алкинов.
—
Н—С—С—Н
—
Н:С:::С:Н
Ацетилен (этин) (С2Н2)
20.
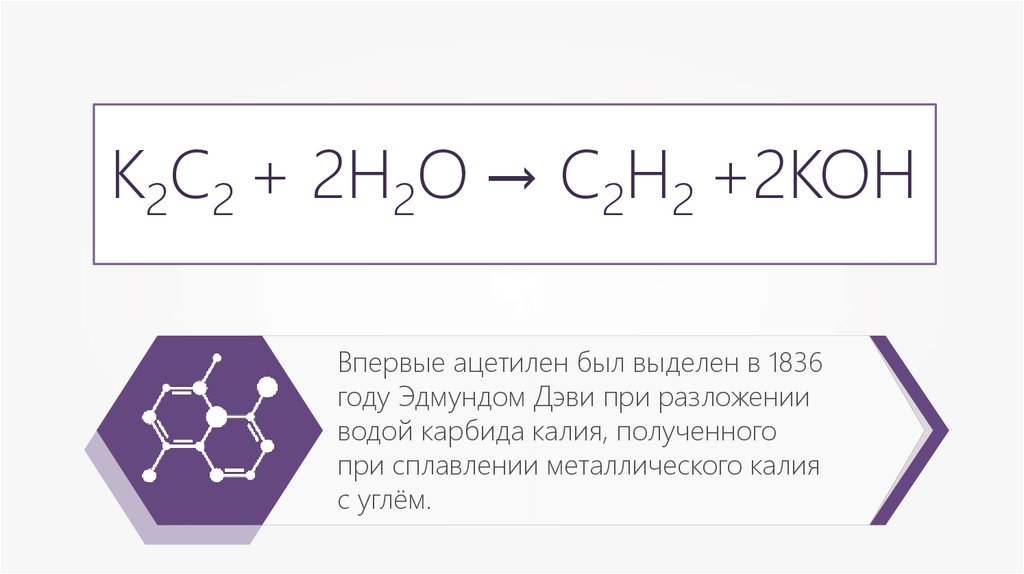
К2С2 + 2Н2О → С2Н2 +2КОНВпервые ацетилен был выделен в 1836
году Эдмундом Дэви при разложении
водой карбида калия, полученного
при сплавлении металлического калия
с углём.
21.
Свойстваацетилена
Способность
реагировать
с хлором
Растворимость
в воде
Плотность
Горение на воздухе
горящим пламенем
22.
В 1860 г. Марселен Бертловпервые получил ацетилен
в разряде дуги между
угольными электродами
в атмосфере водорода.
М. Бертло
1827–1907 гг.
23.
—Н—С—С—Н
—
Ацетилен
Алкины — это ненасыщенные
углеводороды, которые в своём
составе имеют тройную связь.
24.
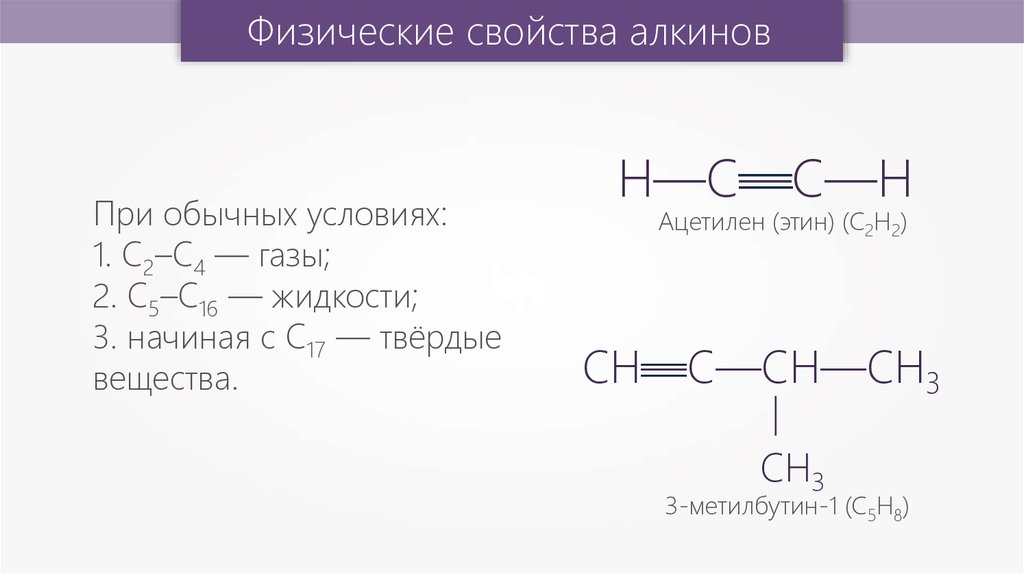
Физические свойства алкиновАцетилен (этин) (С2Н2)
—
СН—С—СН—СН
—
3
—
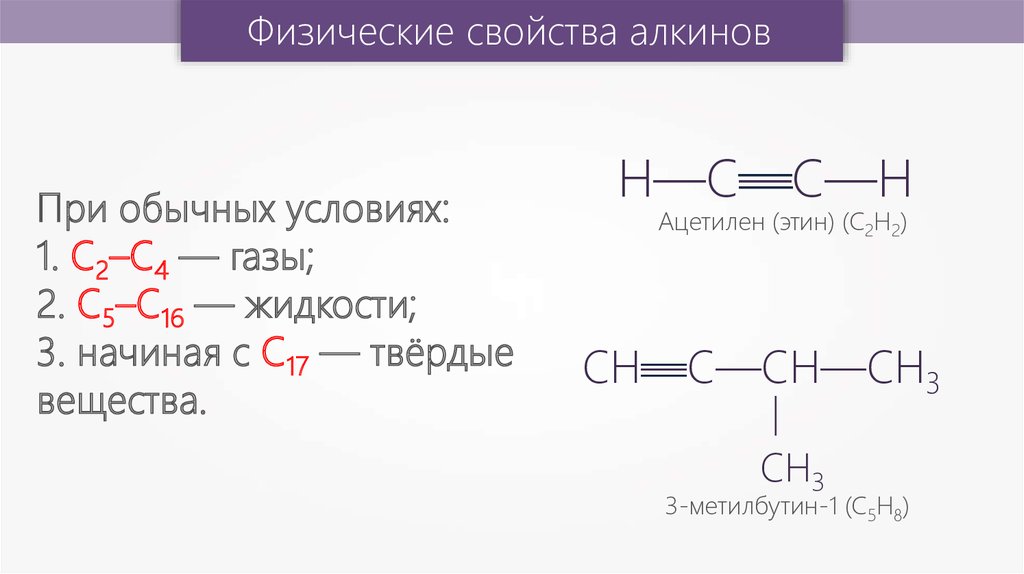
При обычных условиях:
1. С2–С4 — газы;
2. C5–C16 — жидкости;
3. начиная с C17 — твёрдые
вещества.
—
Н—С—С—Н
—
СН3
3-метилбутин-1 (С5Н8)
25.
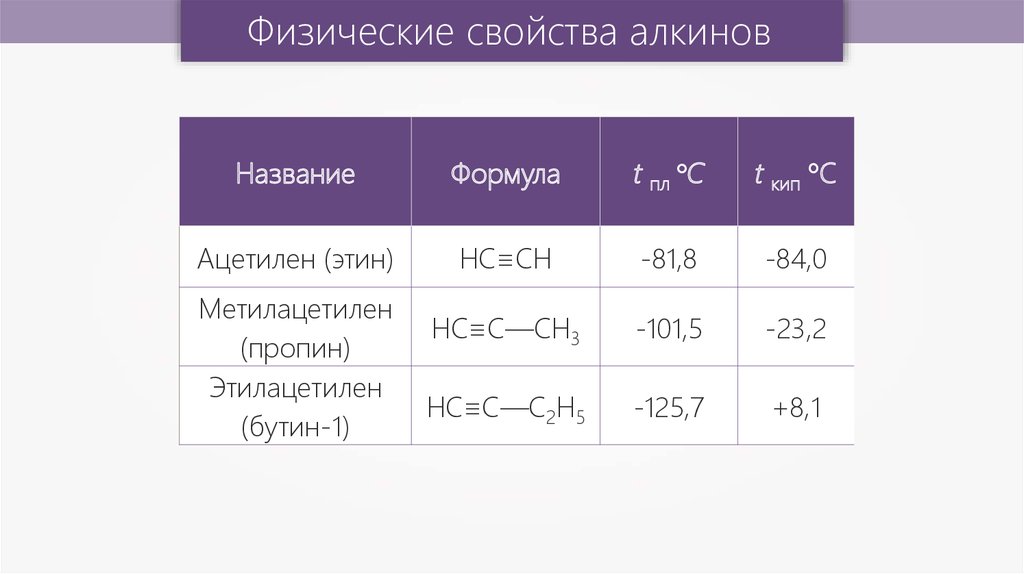
Физические свойства алкиновНазвание
Формула
t пл °С
t кип °С
Ацетилен (этин)
HC≡CH
-81,8
-84,0
НС≡С—СН3
-101,5
-23,2
НС≡С—С2Н5
-125,7
+8,1
Метилацетилен
(пропин)
Этилацетилен
(бутин-1)
26.
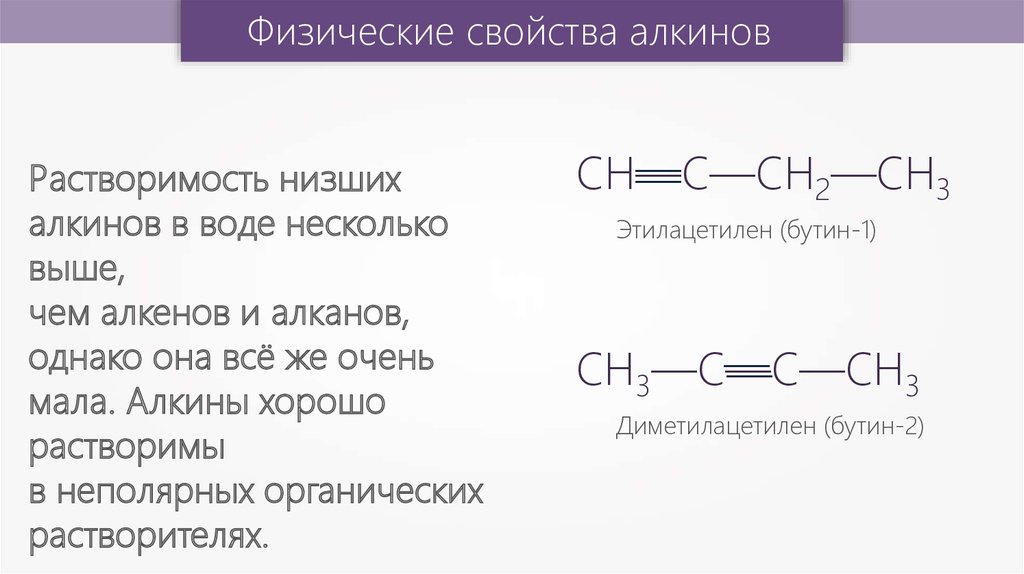
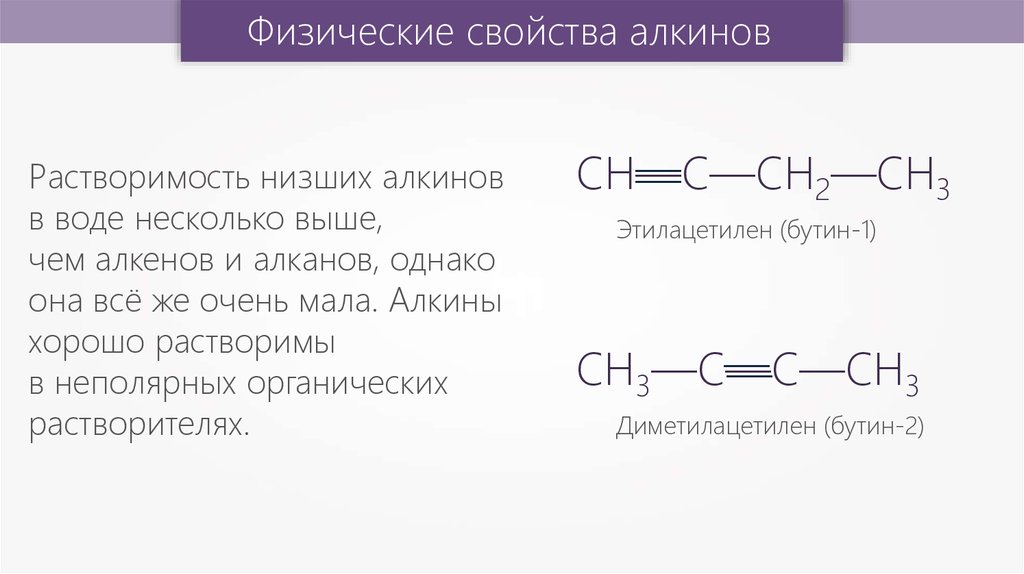
Физические свойства алкиновРастворимость низших
алкинов в воде несколько
выше,
чем алкенов и алканов,
однако она всё же очень
мала. Алкины хорошо
растворимы
в неполярных органических
растворителях.
—
СН—С—СН
—
2—СН3
Этилацетилен (бутин-1)
—
СН3—С—С—СН
—
3
Диметилацетилен (бутин-2)
27.
Химические свойства алкиновАлкины способны вступать
в реакции присоединения,
замещения,
полимеризации
и окисления.
—
СН—С—СН
—
2—СН3
Этилацетилен (бутин-1)
—
НС—С—СН
—
3
Пропин
28.
Простейшим представителемуглеводородов с тройной
связью является ацетилен —
родоначальник
гомологического ряда алкинов.
—
Н—С—С—Н
—
Н:С:::С:Н
Ацетилен (этин) (С2Н2)
29.
К2С2 + 2Н2О → С2Н2 +2КОНВпервые ацетилен был выделен в 1836
году Эдмундом Дэви при разложении
водой карбида калия, полученного
при сплавлении металлического калия
с углём.
30.
Свойстваацетилена
Способность
реагировать
с хлором
Растворимость
в воде
Плотность
Горение на воздухе
горящим пламенем
31.
В 1860 г. Марселен Бертловпервые получил ацетилен
в разряде дуги между
угольными электродами
в атмосфере водорода.
М. Бертло
1827–1907 гг.
32.
—Н—С—С—Н
—
Ацетилен
Алкины — это ненасыщенные
углеводороды, которые в своём
составе имеют тройную связь.
33.
Физические свойства алкиновАцетилен (этин) (С2Н2)
—
СН—С—СН—СН
—
3
—
При обычных условиях:
1. С2–С4 — газы;
2. C5–C16 — жидкости;
3. начиная с C17 — твёрдые
вещества.
—
Н—С—С—Н
—
СН3
3-метилбутин-1 (С5Н8)
34.
Физические свойства алкиновНазвание
Формула
t пл °С
t кип °С
Ацетилен (этин)
HC≡CH
-81,8
-84,0
НС≡С—СН3
-101,5
-23,2
НС≡С—С2Н5
-125,7
+8,1
Метилацетилен
(пропин)
Этилацетилен
(бутин-1)
35.
Физические свойства алкиновРастворимость низших алкинов
в воде несколько выше,
чем алкенов и алканов, однако
она всё же очень мала. Алкины
хорошо растворимы
в неполярных органических
растворителях.
—
СН—С—СН
—
2—СН3
Этилацетилен (бутин-1)
—
СН3—С—С—СН
—
3
Диметилацетилен (бутин-2)
36.
Химические свойства алкиновАлкины способны вступать
в реакции присоединения,
замещения,
полимеризации
и окисления.
—
СН—С—СН
—
2—СН3
Этилацетилен (бутин-1)
—
НС—С—СН
—
3
Пропин
37.
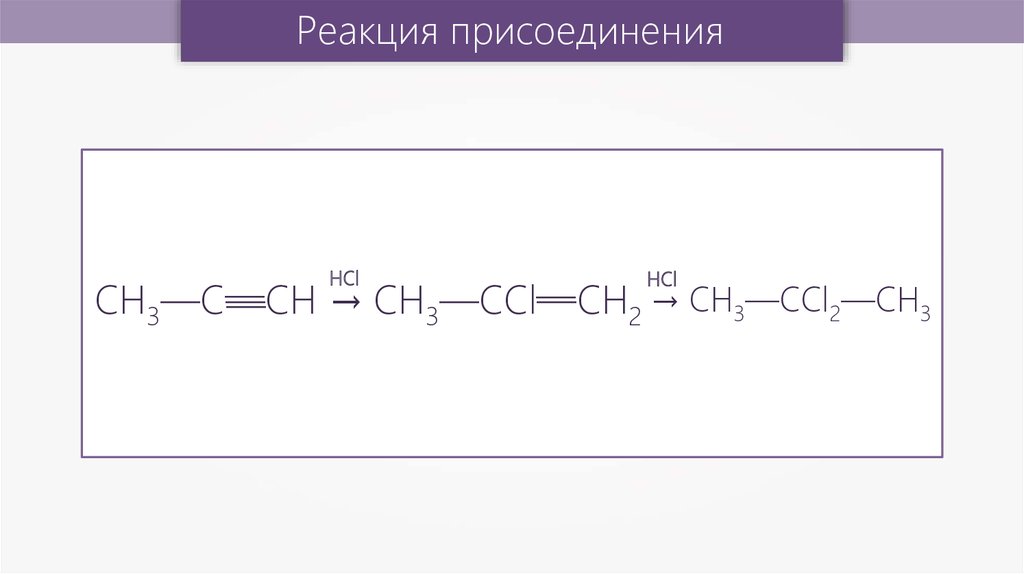
Реакция присоединенияHCl
HCl
—
— 2 → CH3—CСl2—СН3
CH3—C—СН
→ CH3—CСl—СН
—
38.
Химические свойства алкиновУглеродные атомы в молекулах
алкинов расположены ближе
друг к другу, чем в алкенах, и
обладают
большей
электроотрицательностью.
—
СН—С—СН
—
2—СН3
Этилацетилен (бутин-1)
—
НС—С—СН
—
3
Пропин
39.
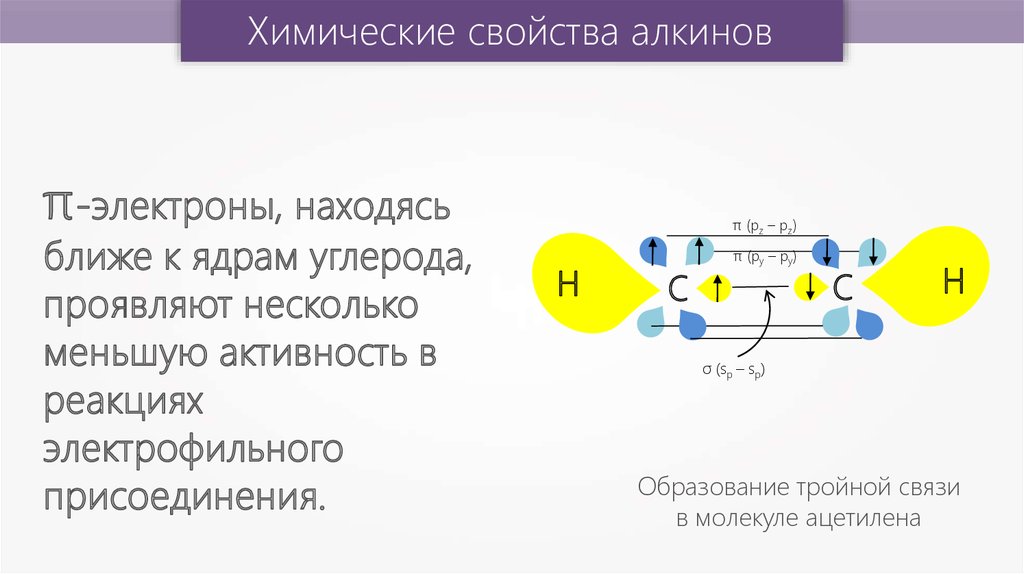
Химические свойства алкиновπ-электроны, находясь
ближе к ядрам углерода,
проявляют несколько
меньшую активность в
реакциях
электрофильного
присоединения.
π (pz – pz)
Н
С
π (py – py)
С
Н
σ (sp – sp)
Образование тройной связи
в молекуле ацетилена
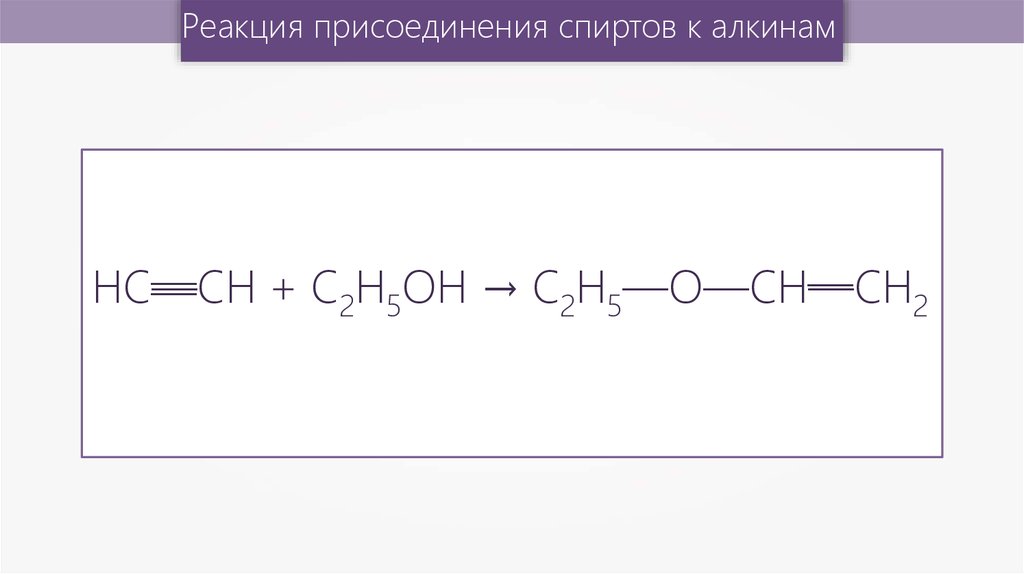
40.
Реакция присоединения спиртов к алкинам—
— 2
НC—СН
+ С2H5ОН → C2H5—О—СН—СН
—
41.
Реакция гидрирования+Н2
+Н2
—
—
→ CH3—CH2—СН3
НC—С—СН
—
t, Ni CH2—CH—СН3 t, Ni
3→
42.
Реакция галогенирования+Br
+Br
—
—
НC—СН
→ Br2HC—CHBr2
— → BrHC—СНBr
2
2
1,2-дибромэтен
1,1,2,2-тетрабромэтан
43.
Реакция присоединения галогеноводородов—
СН3—C—СН
+ HBr → CH3—СBr—CH
—
— 2
2-бромпропен
— 2 + HBr → CH3—СBr2—CH3
CH3—СBr—CH
2,2-дибромпропан
44.
HC≡CH + 2[Ag(NH3 )2]OH → Ag—C≡C—Ag + 4NH3 + 2H2OЗамещение водородных атомов ацетилена
на металлы, называется реакцией
металлирования. В результате образуются
металлические производные ацетилена —
ацетилениды.
45.
Реакция металлирования—
—
HC—CH
+ 2[Ag(NH3 )2]OH → Ag—C—C—Ag
+ 4NH3 + 2H2O
—
—
46.
С ацетиленидами в сухомвиде следует обращаться
очень осторожно: они
крайне взрывоопасны.
47.
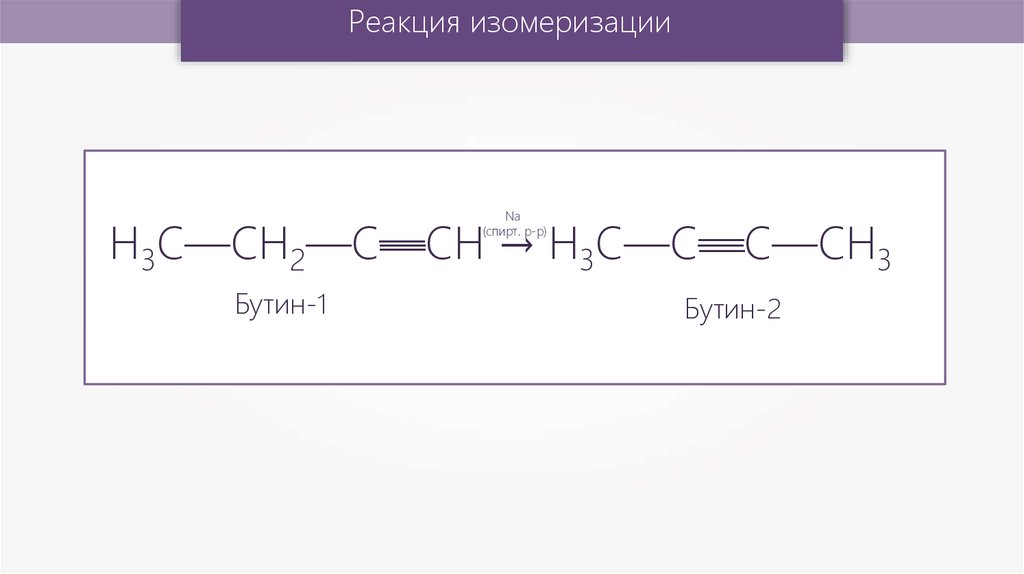
Реакция изомеризации—
—
Н3С—CН2—С—СН
→ H3C—С—С—CH
—
3
Na
(спирт. р-р)
Бутин-1
Бутин-2
48.
Ацетилен в зависимостиот условий реакции способен
образовывать различные
продукты полимеризации —
линейные или циклические.
49.
Реакция полимеризации—
—
—
— 2
НС—CН
+ НС—СН
→ HC—СН—СН—CH
—
—
Cu2Cl2
Винилацетилен
50.
Реакция полимеризацииt °С
—
—
—
3НС—CН
→ CН2—СН—С—CH—3С
—
—
2Н 2 →С6Н6
Бензол
51.
Реакцию полимеризацииоткрыл французский учёный
Марселен Бертло.
М. Бертло
1827–1907 гг.
52.
Doudnick_ValУксусная кислота
Синтетический
каучук
Перчатки
из поливинилхлорида
Растворитель
53.
Кислородно-ацетиленовоесоединение используют
для сварки металлов.
54.
Смеси ацетилена с кислородомили воздухом взрывоопасны,
поэтому ацетилен хранят и
транспортируют в специальных
баллонах.
Ацетилен
























 chemistry
chemistry








