Similar presentations:
Алкины. Строение, изомерия, физические свойства, получение. Химические свойства, применение ацетилена
1. 1. Алкины. Строение, изомерия, физические свойства, получение. 2. Химические свойства, применение ацетилена.
Учитель химии: Таскаева И.Ю.СОШ № 49
2011 г.
2. Алкины – это непредельные углеводороды, содержащие одну тройную связь. Общая формула гомологического ряда Сn Н2n-2
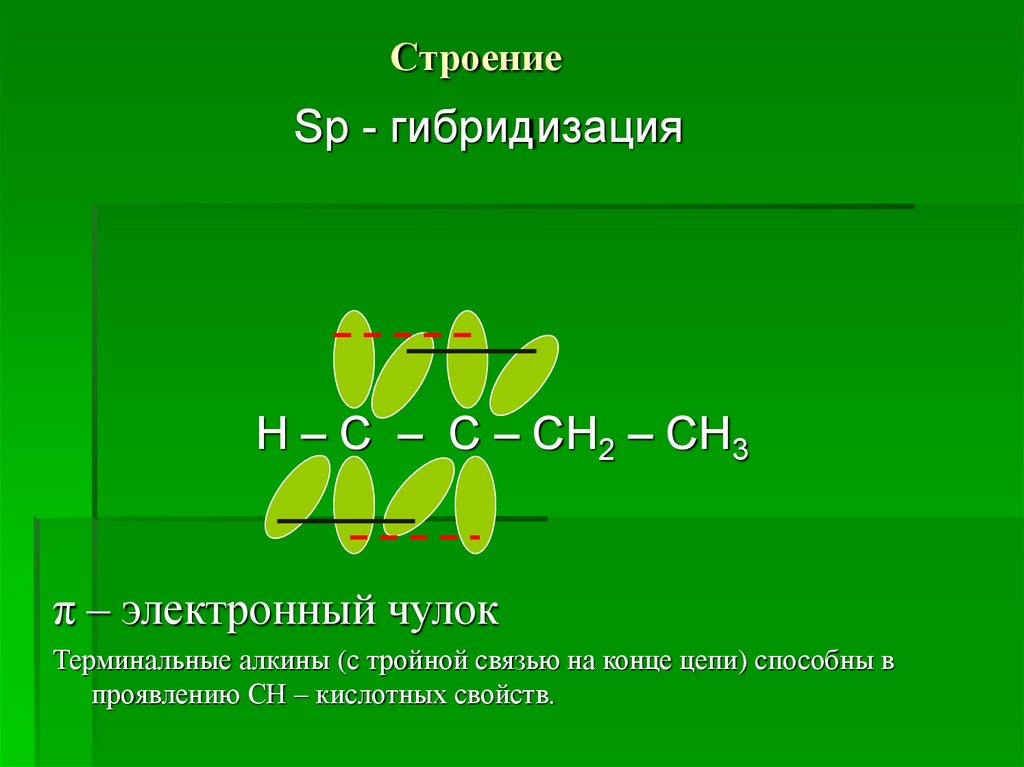
3. Строение
Sp - гибридизацияН – С – С – СН2 – СН3
π – электронный чулок
Терминальные алкины (с тройной связью на конце цепи) способны в
проявлению СН – кислотных свойств.
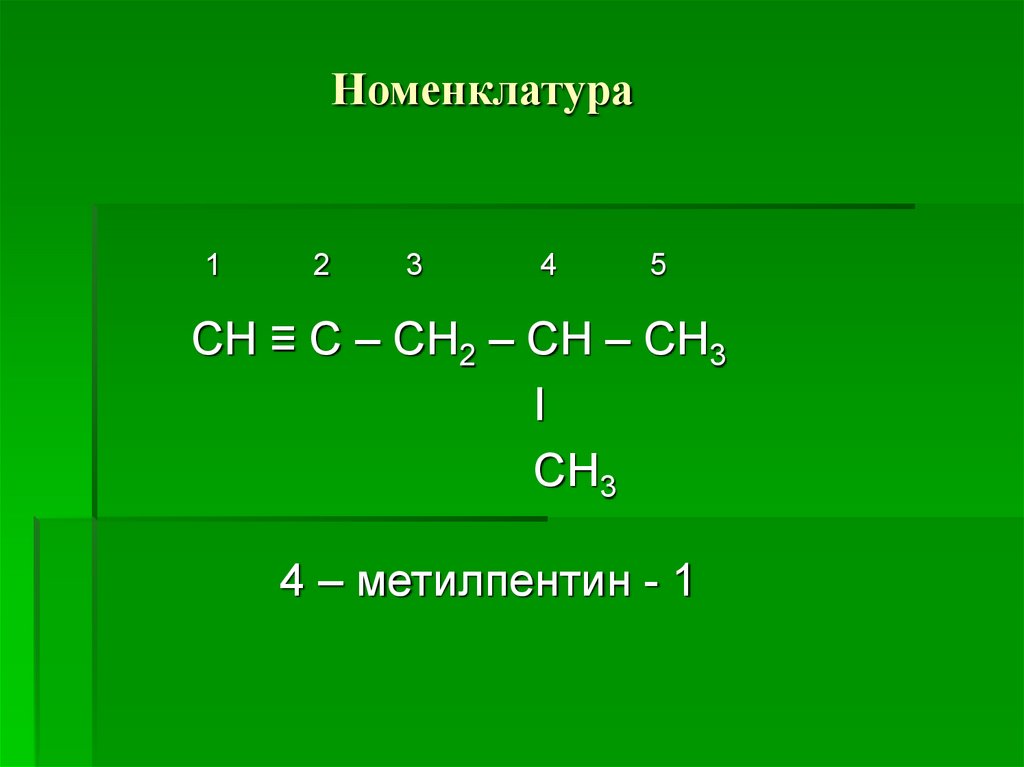
4. Номенклатура
12
3
4
5
СН ≡ С – СН2 – СН – СН3
I
СН3
4 – метилпентин - 1
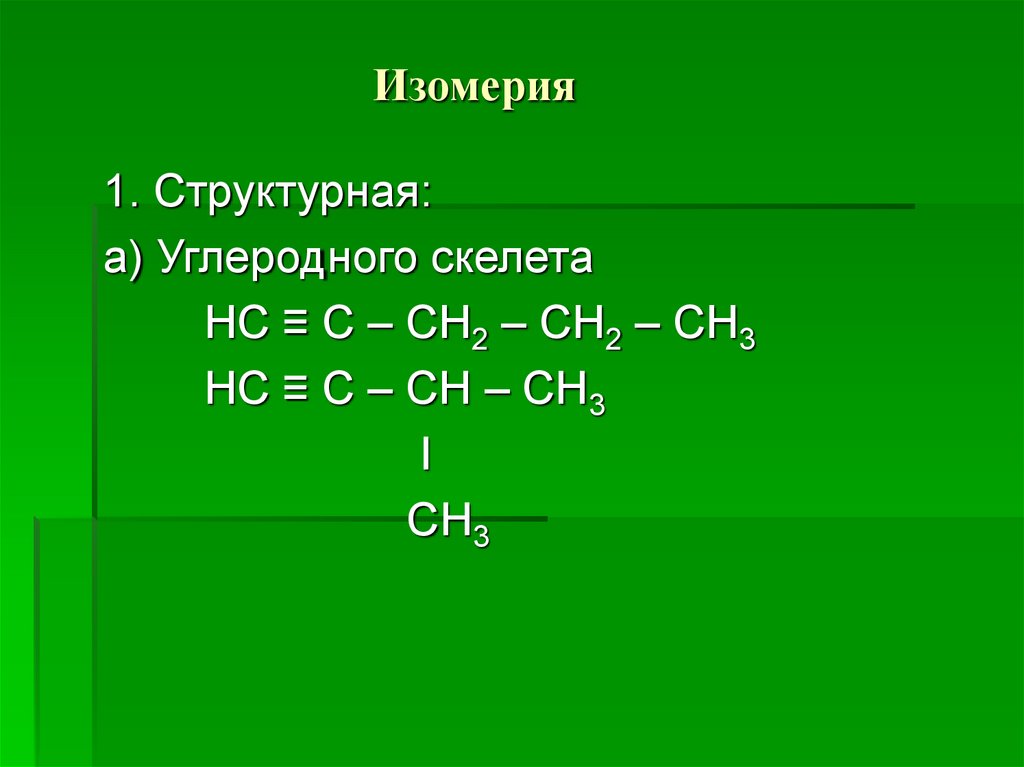
5. Изомерия
1. Структурная:а) Углеродного скелета
НС ≡ С – СН2 – СН2 – СН3
НС ≡ С – СН – СН3
I
СН3
6.
б) положения кратной связиНС ≡ С – СН2 – СН3
СН3 – С ≡ С – СН3
2. Межклассовая
СН3 – С ≡ С – СН3
СН2 = СН – СН = СН2 бутадиен -1,3
СН – СН2 циклобутен
II
I
CН – СН2
7. Методы получения
1. Неполный пиролиз метана1500
0
2СН4
С2 Н2 + 3Н2
2. Карбидный
СаС2 + 2 Н2О
Са(ОН)2 + С2 Н2
t
СаО + 3С
СаС2 + СО
8.
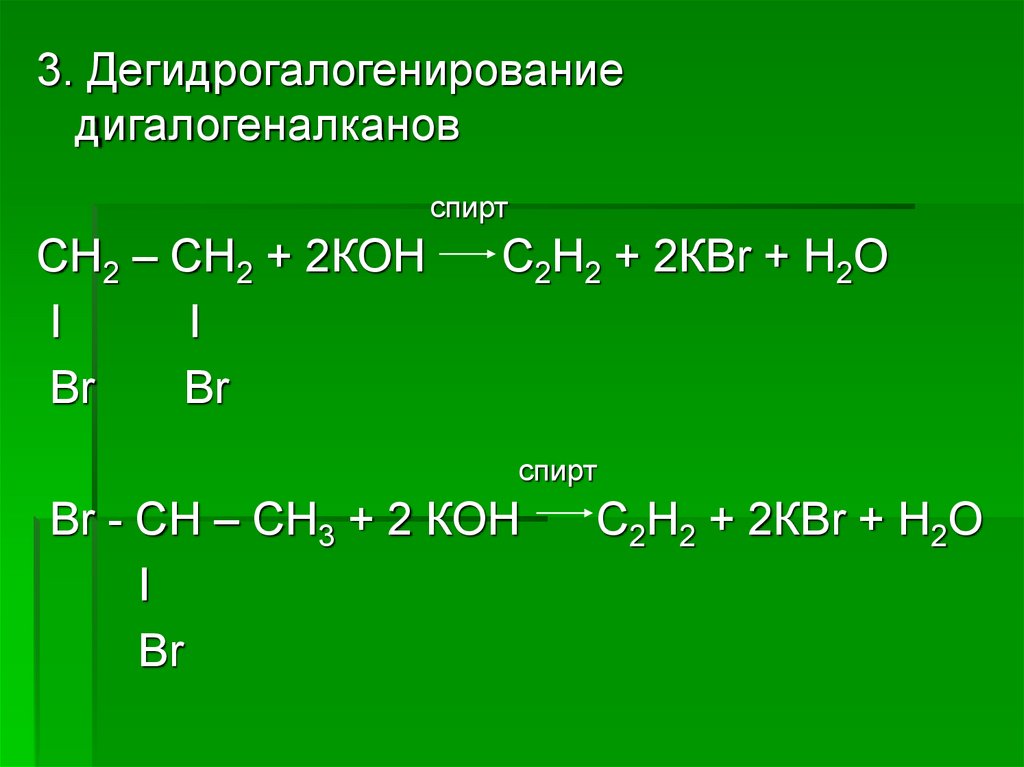
3. Дегидрогалогенированиедигалогеналканов
спирт
СН2 – СН2 + 2КОН
I
I
Br
Br
С2Н2 + 2КВr + Н2О
спирт
Br - СН – СН3 + 2 КОН
I
Br
С2Н2 + 2КВr + Н2О
9.
4. Дегалогенирование тетрагалогеналкановс цинком
2 Zn
Br - СН – СН – Br
C 2H 2
I
I
- 2 ZnBr2
Br
Br
5. Взаимодействие алкилгалогенидов с
ацетиленидами
СН3 – С ≡ С – Аg + СН3Br СН3С ≡ С – СН3
+ АgBr
10. Физические свойства
С2Н2 – бесцветный газ, малорастворим вводе, на воздухе горит коптящим
пламенем. Чистый С2Н2 не имеет запаха.
11. Химические свойства алкинов
1. Окислениеа) полное (горение)
2 С2Н2 + 5 О2 → 4СО2 + 2 Н2О + 2600 кДж
б) неполное
3С2Н2 + 8 КМnО4 (водный) → 3КООС –
СООК + 8МnО2 + 2КОН + 2Н2О
5СН3 – СН2 – С ≡ С – СН3 + 6КМnО4 +
9Н2 SО4 → 5СН3СН2СООН + 5СН3СООН +
6МnSО4 + 3 К2SО4 + 4Н2О
12.
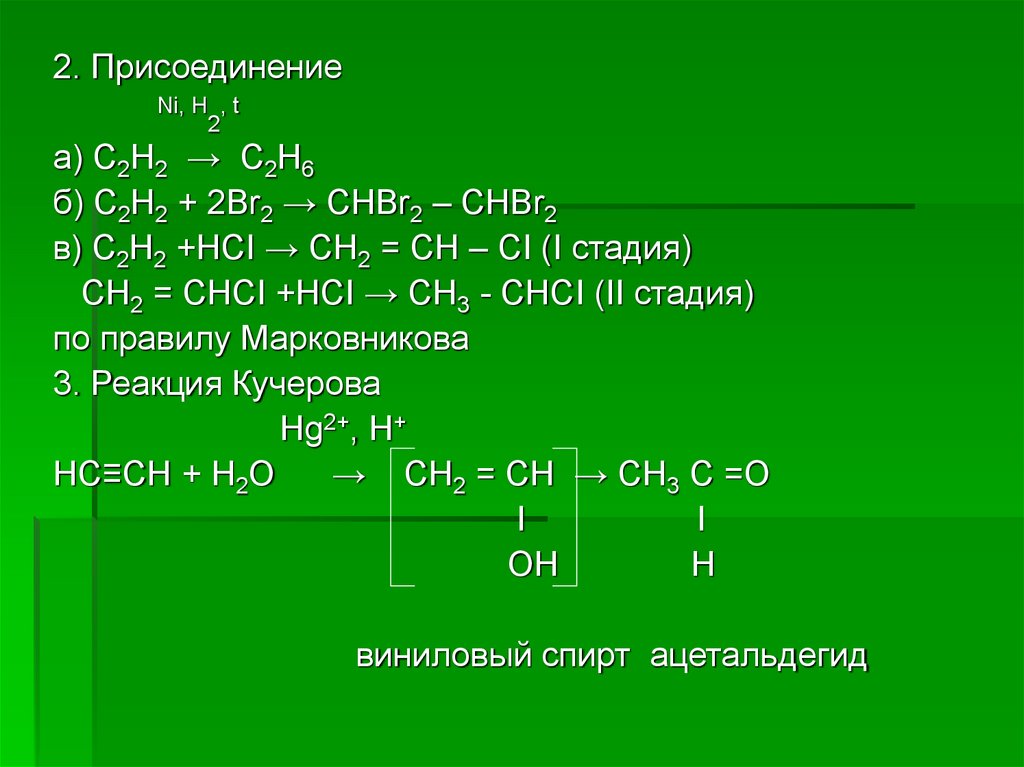
2. ПрисоединениеNi, H , t
2
а) С2Н2 → С2Н6
б) С2Н2 + 2Вr2 → СНВr2 – CHBr2
в) С2Н2 +НСI → СН2 = СН – СI (I стадия)
СН2 = СНСI +НСI → СН3 - СНСI (II стадия)
по правилу Марковникова
3. Реакция Кучерова
Нg2+, Н+
НС≡СН + Н2О
→ СН2 = СН → СН3 С =О
I
I
ОН
Н
виниловый спирт ацетальдегид
13.
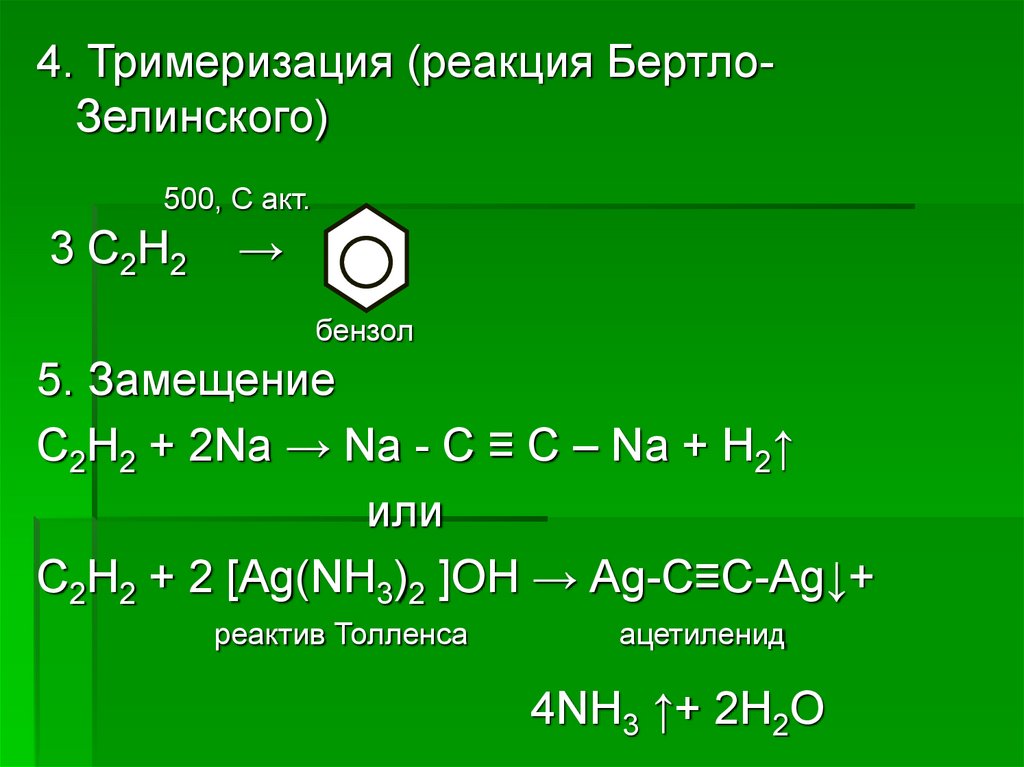
4. Тримеризация (реакция БертлоЗелинского)500, С акт.
3 С2Н2
→
бензол
5. Замещение
С2Н2 + 2Nа → Nа - С ≡ С – Nа + Н2↑
или
С2Н2 + 2 [Аg(NН3)2 ]ОН → Аg-С≡С-Аg↓+
реактив Толленса
ацетиленид
4NН3 ↑+ 2Н2О
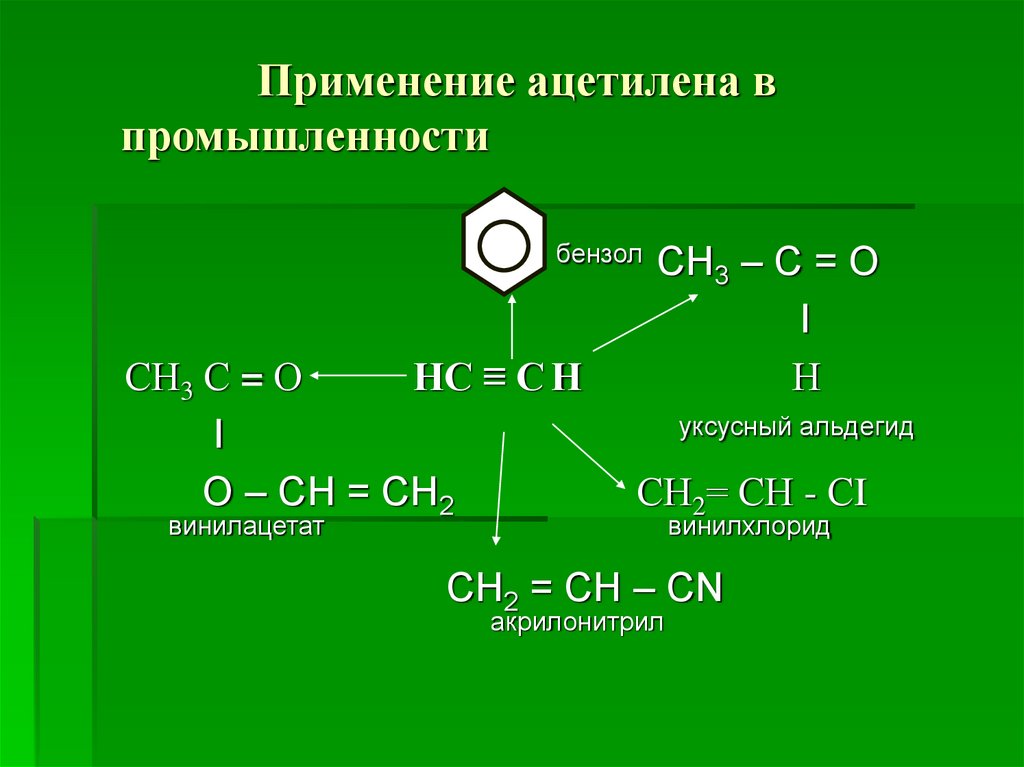
14. Применение ацетилена в промышленности
бензолСН3 С = О
НС ≡ С Н
I
О – СН = СН2
винилацетат
СН3 – С = О
I
Н
уксусный альдегид
СН2= СН - СI
винилхлорид
СН2 = СН – СN
акрилонитрил
15. Домашнее задание
§ 6, № 1-11 с. 51-52.РТ с. 35 -41
синквейн «Ацетилен»








 chemistry
chemistry








