Similar presentations:
Ацетилен. Химические и физические свойства ацетилена
1. ПРИЛОЖЕНИЕ К РАЗРАБОТКЕ УРОКА ПО ТЕМЕ «АЦЕТИЛЕН»
Выполнилаучитель химии
МБОУ СОШ с. Большие Озерки
Усанкина Наталья Алексеевна
1
2. В естественном виде встречается на Уране, Реки из углеводородов на поверхности Нептуне Титана, спутника Сатурна
В естественном виде встречается на Уране,Нептуне
Реки из углеводородов на поверхности
Титана, спутника Сатурна
Из-за сильнейшего окислителя – кислорода этот газ на Земле в естественном
состоянии существовать не может. Он хранится в специальных баллонах.
2
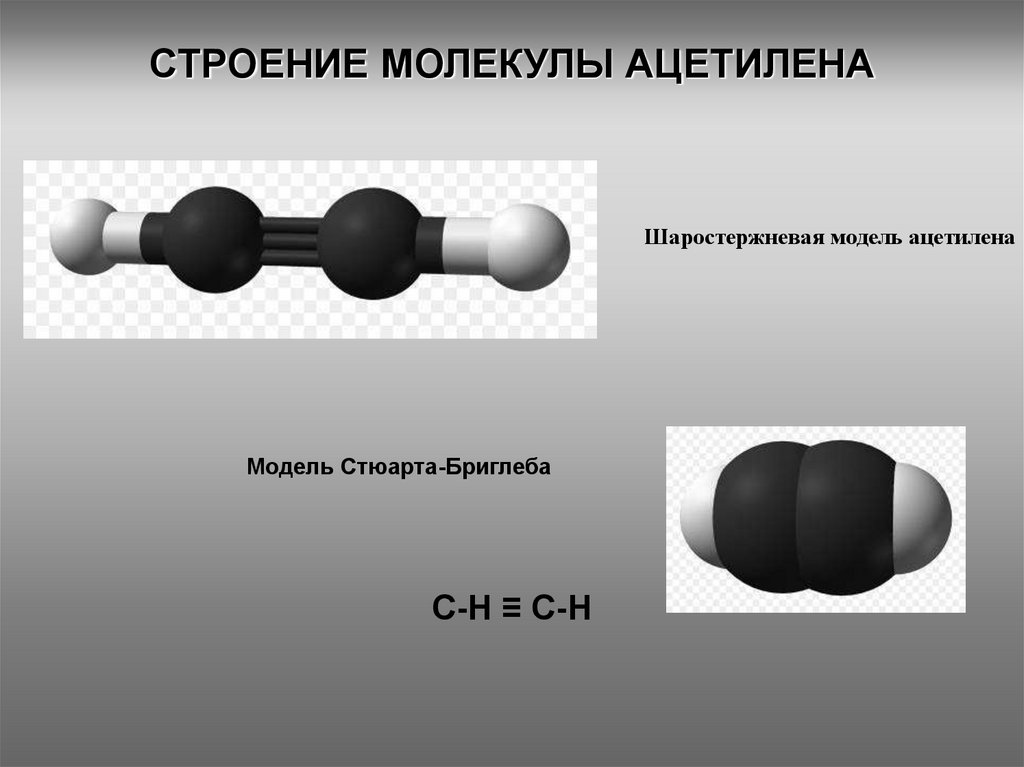
3. СТРОЕНИЕ МОЛЕКУЛЫ АЦЕТИЛЕНА
Шаростержневая модель ацетиленаМодель Стюарта-Бриглеба
С-H ≡ C-H
3
4. ФИЗИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА
1. Не имеет запаха при н.у. Запах придают примеси.2. Ацетилен легче воздуха, плотность его меньше, чем у воздуха.
3. tплавл. = - 80,6⁰С
4. tкип. = - 83,8⁰С
5. Ограниченно растворяется в воде.
6. Неограниченно - в органических растворителях, например, в ацетоне.
1. Смеси ацетилена с кислородом взрываются (причем концентрация ацетилена не
имеет значения). Также взрывоопасны смеси ацетилена с воздухом.
2. Ацетилен взрывается при ударе (при нагреве до 500 ⁰С, при сжатии до 2 МПа при
комнатной температуре.
3. Струя ацетилена, выпущенная на воздух может загореться от малейшей искры, в
том числе от разряда статического электричества с пальца руки.
4. Взрывоопасность ацетилена уменьшается при разбавлении некоторыми другими
газами. Поэтому ацетилен хранят в баллонах, заполненных, например,
активированным углем,пропитанным ацетоном, в котором ацетилен растворяется
4
под давлением в больших количествах.
5. ПОЛУЧЕНИЕ АЦЕТИЛЕНА
1. Высокотемпературный крекинг метана (при t = 1500⁰ С):2CH4 → СH≡CH +3H2.
2. Дегидрирование алканов и алкенов:
CH3-CH3 → СH≡CH +2H2;
CH2=CH2 → СH≡CH + H2.
3. Гидролиз карбида кальция:
CaC2 +2H2O = Ca(OH)2 + C2H2↑
Карбид кальция получают в результате взаимодействия обожженной извести с
коксом в электрических печах при температуре 1900 - 2300оС. При этом происходит
эндотермическая химическая реакция (т. е. с поглощением тепла) по формуле:
СаО + 3С = СаС2 + СО - Q
5
6. ХИМИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА
1. Реакция горения.Тройная внутримолекулярная связь ацетилена обуславливает очень высокую удельную
теплоту сгорания при разрыве этой связи. Пламя может достигать температуры 3200°С, что
обуславливает важнейшее промышленное применение ацетилена – высокотемпературная
сварка. Ацетилен используется при автогенной сварке и резке металлов.
2C2H2 + 5O2 = 4CO2 + 2H2O + Q
6
7. ХИМИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА
2. Реакции присоединенияГалогенирование:
1 стадия СН ≡ СН + Вr2 → ВrСН = СНВr
Br Br
׀
׀
H – C ≡ C – H + Br–Br → H – C = C – H
2 стадия ВrСН=СНВr + Вг2 → Вr2СН–СНВr2
Br Br
Br Br
׀
׀
׀
׀
H – C = C – H + Br–Br → H – C – C – H
׀
׀
Br Br
7
8. ХИМИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА
2. Реакции присоединенияГидрогалогенирование:
СН ≡ СН + HCl → СН2 = СНCl (Катализатором данной реакции является хлорид ртути
HgCl).
Hg+
H–C ≡ C–H + H–Cl → H–C = C–H
׀
׀
H Cl
8
9. ХИМИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА
2. Реакции присоединенияГидрирование:
1 стадия
СН≡СН + H2 → СН2=СН2 (Катализатор платина Pt, никель Ni, палладий Pd).
Ni
H–C ≡ C–H + H–H → H–C = C–H
׀
׀
H H
2 стадия
Ni
СН2=СН2 + H2 → СН3–СН3
H H
׀
׀
Ni
H–C = C–H + H–H → H–C – C–H
׀
׀
׀
׀
H H
H H
9
10. ХИМИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА
2. Реакции присоединенияГидратация:
СН≡СН + H2О → CH3-CHO (Катализатор Hg+, Н+).
H
O
׀
Hg+, Н+
H–C ≡ C–H + H–OH → H–C = C
׀
H
H
10
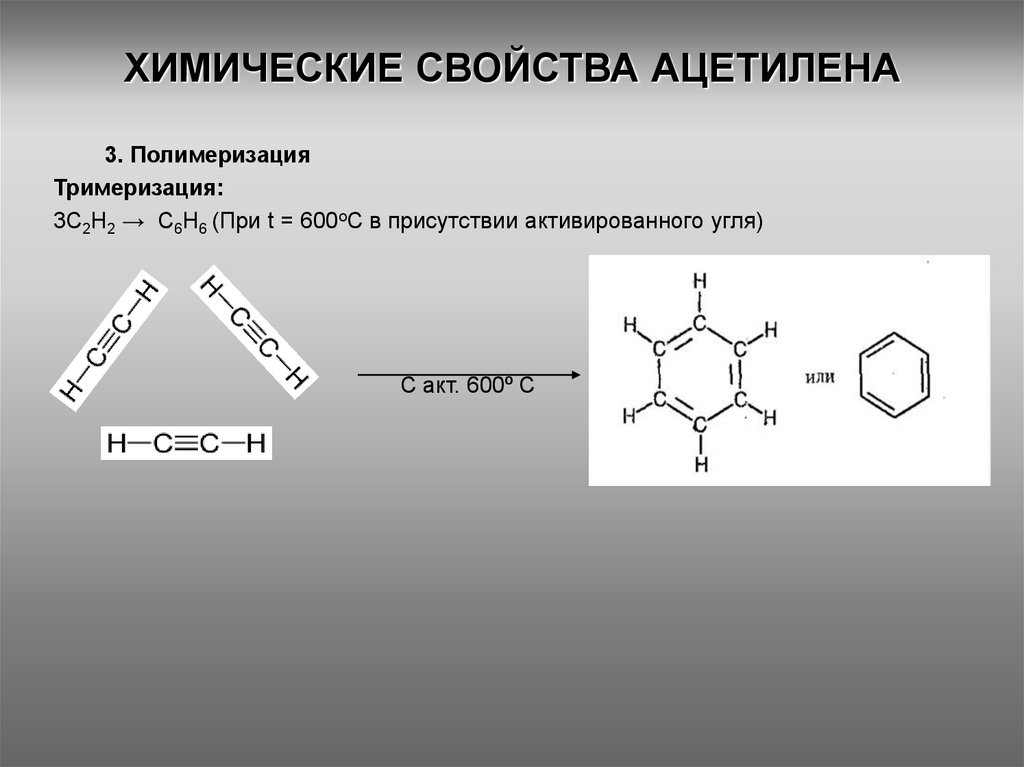
11. ХИМИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА
3. ПолимеризацияТримеризация:
3С2Н2 → С6Н6 (При t = 600оС в присутствии активированного угля)
С акт. 600⁰ С
11
12. ПРИМЕНЕНИЕ АЦЕТИЛЕНА
Лампа - карбидкаПринцип действия
12
13. ПРИМЕНЕНИЕ АЦЕТИЛЕНА
1314. ПРИМЕНЕНИЕ АЦЕТИЛЕНА ПВХ ПВА
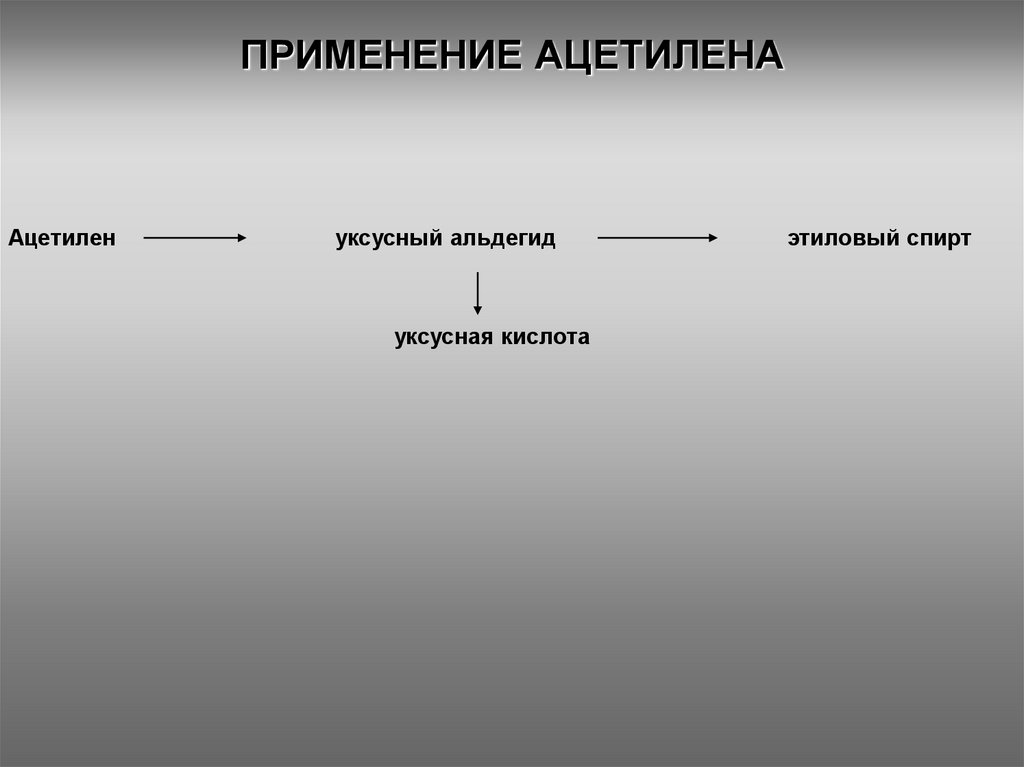
1415. ПРИМЕНЕНИЕ АЦЕТИЛЕНА
Ацетиленуксусный альдегид
этиловый спирт
уксусная кислота
15
16. ТЕСТ ПО ТЕМЕ: АЦЕТИЛЕН
1.Общая формула гомологического ряда ацетилена:а) СnНn+2
б) СnН2n
в) СnН2n-2
г) СnН2n - 6
2. Гомологом пропина является:
а) фенол
б) пентан
в) этилен
г) этин
3. Алкинам не свойственна изомерия:
а) углеродной цепи;
б) положения тройной связи;
в) межклассовая»
г) пространственная ( цис – транс - изомерия)
4. Реакция гидратации возможна для:
а) этина;
б) бензола;
в) декана;
г) циклопентана.
5. Наличием тройной связи обусловлена возможность алкинов вступать в реакции:
а) горения;
б) замещения;
в) дегидрирования;
г) полимеризации.
6. При гидратации этина в присутствии сульфата ртути (II) образуется:
а) НСОН;
б) СН3ОН;
в) НСООН;
г) СН3СНО
7. Превращение ацетилена в бензол – это реакция …
а) тримеризации;
б) дегидрирования;
в) восстановления;
г) оксиления.
8. Найдите ошибку в физических свойствах ацетилена:
а) газ, легче воздуха;
б) чистый ацетилен не имеет запаха;
в) хорошо растворим в воде;
г) при смешивании в воздухом взрывоопасен.
9. Уравнение получения ацетилена в лаборатории:
а) С2Н5ОН→ С2Н4 + Н2О;
б) СаС2 + 2Н2О → С2Н2 + Са(ОН)2;
в) С2Н2 + НОН → СН3СНО;
г) 2СН4 → С2Н2 + 3Н2
10. Масса карбида кальция, содержащего 20 % примесей, необходимого для получения 28 л
ацетилена:
16
а) 64 г;
б) 12 г;
в) 100 г;
г) 35 г.
17. ОТВЕТЫ НА ТЕСТ ПО ТЕМЕ: АЦЕТИЛЕН
1.Общая формула гомологического ряда ацетилена:а) СnНn+2
б) СnН2n
в) СnН2n-2
г) СnН2n - 6
2. Гомологом пропина является:
а) фенол
б) пентан
в) этилен
г) этин
3. Алкинам не свойственна изомерия:
а) углеродной цепи;
б) положения тройной связи;
в) межклассовая»
г) пространственная ( цис – транс - изомерия)
4. Реакция гидратации возможна для:
а) этина;
б) бензола;
в) декана;
г) циклопентана.
5. Наличием тройной связи обусловлена возможность алкинов вступать в реакции:
а) горения;
б) замещения;
в) дегидрирования;
г) полимеризации.
6. При гидратации этина в присутствии сульфата ртути (II) образуется:
а) НСОН;
б) СН3ОН;
в) НСООН;
г) СН3СНО
7. Превращение ацетилена в бензол – это реакция …
а) тримеризации;
б) дегидрирования;
в) восстановления;
г) окисления.
8. Найдите ошибку в физических свойствах ацетилена:
а) газ, легче воздуха;
б) чистый ацетилен не имеет запаха;
в) хорошо растворим в воде;
г) при смешивании в воздухом взрывоопасен.
9. Уравнение получения ацетилена в лаборатории:
а) С2Н5ОН→ С2Н4 + Н2О;
б) СаС2 + 2Н2О → С2Н2 + Са(ОН)2;
в) С2Н2 + НОН → СН3СНО;
г) 2СН4 → С2Н2 + 3Н2
10. Масса карбида кальция, содержащего 20% примесей, необходимого для получения 28 л
ацетилена:
а) 64 г;
б) 12 г;
в) 100 г;
г) 35 г.
17














 chemistry
chemistry








