Similar presentations:
Кровь: состав, функция. Особенности метаболизма в эритроцитах, лейкоцитах, тромбоцитах. Свертывание крови
1.
Кровь: состав, функция. Особенностиметаболизма в эритроцитах, лейкоцитах,
тромбоцитах. Свертывание крови.
Буферные системы крови.
Лекция для студентов 2 курса
Викторович Надежда Николаевна
2.
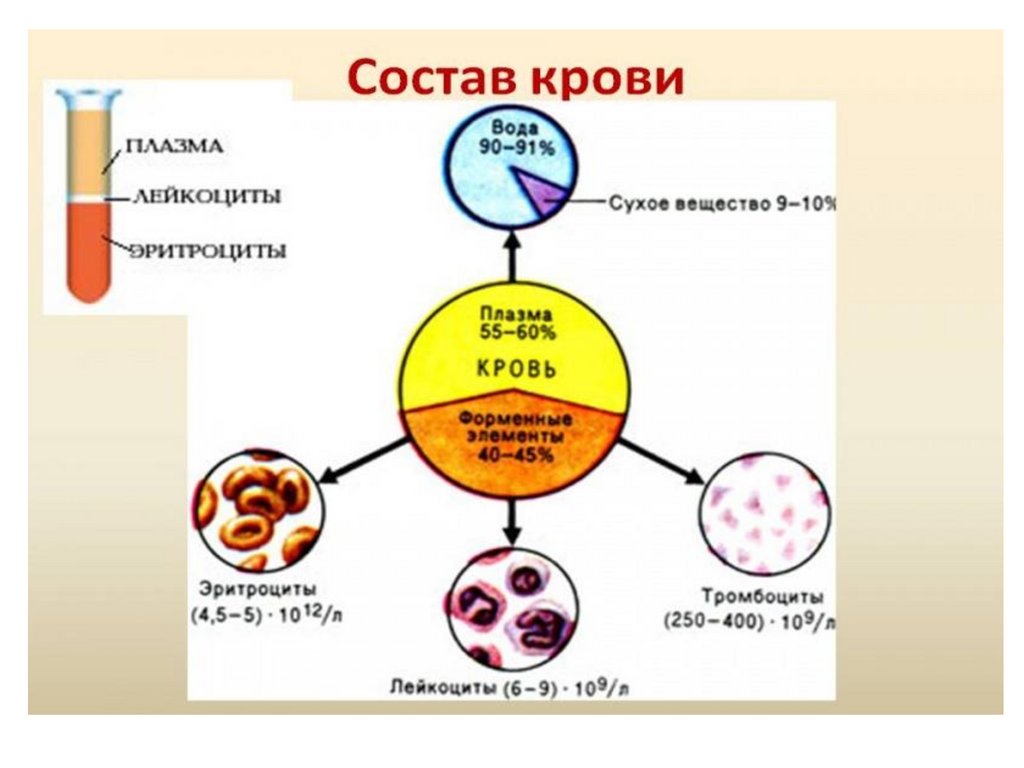
ОБЩАЯ ХАРАКТЕРИСТИКА КРОВИФизиологическая регенерация форменных
элементов крови осуществляется за счёт разрушения
старых клеток и образования новых органами
кроветворения. Главным из них у человека и других
млекопитающих является костный мозг. Среднее
количество крови в теле взрослого человека 6—8 %
от общей массы, а в теле ребёнка — 8—9 %. Т. е.
средний объём крови у взрослого человека
составляет 5000—6000 мл. На жидкую часть
крови(плазму) приходится в среднем 55% общего
объема, оставшаяся часть - форменные элементы
(эритроциты, лейкоциты и тромбоциты).
3.
Функции крови1. Транспортная - одна из основных функций крови
2. Выделительная
3. Терморегуляторная — поддерживает
постоянство температуры тела
4. Гуморальная
5. Защитная
6. Гемостатическая — определяется соотношением
свертывающей и противосвертывающей систем.
Эта функция предохраняет организм от потери
крови путем остановки кровотечения в результате
свёртывания крови.
4.
Белки плазмы кровиСодержание общего белка в сыворотке крови 65-85 г/л
Альбумины- 40-50 г/л
Глобулины- 20-30 г/л
Фибриноген - 2-4 г/л
При помощи электрофореза белки плазмы можно
выделить альбуминовую и глобулиновую фракции.
Использование метода электрофореза на бумаге позволяет
выявить 5 белковых фракций (в порядке убывания
скорости миграции): альбумины, α1-, α2-, β- и γглобулины.
5.
АльбуминыСостоит из 585 аминокислотных остатков.
Молекула альбумина содержит много:
отрицательно заряженных аминокислот ( Асп-, Глу-),
дисульфидных связей (Цис-),
SH- группу (Цис-)
Выполняют транспортную функцию. Транспортируют:
• свободные жирные кислоты
• холестерин
• желчные пигменты
• стероидные гормоны, тироксин, трийодтиронин
• ионы Са2+, Na+, Са2+, Сu2+, Zn2+ а также связывать Mg, Mn
• многие лекарственные препараты: пенициллин, салицилаты,.
6.
АльбуминыКонцентрация альбумина в крови составляет 40-50 г/л.
40% - в крови
60% - в межклеточной жидкости.
При недостатке альбумина, который должен
удержать Nа+, другие катионы и воду, вода уходит
в межклеточное пространство, усиливая отёки.
Гипоальбуминемия может наблюдаться при
заболевании печени, при повышении
проницаемости капилляров, при потерях белка изза обширных ожогов или злокачественных
образований
7.
АльбуминыИмеют:
*небольшой размер молекулы
*высокая концентрация в плазме и
* гидрофильные свойства
Все эти особенности альбуминов играют
роль в поддержании онкотического давления
8.
АльбуминыСвободная сульфгидрильная (—SH) группа альбумина связывает
тяжёлые металлы, например соединения ртути, которые отлагаются в
почках до удаления из организма. Альбумин из крови поступает в
межклеточную жидкость, из которой по лимфатической системе вновь
возвращается в кровь.
9.
а1-ГлобулиныК этой фракции (а1- глобулины) относятся:
• Липопротеиды высокой плотности
• Антитрипсин
• Протромбин
10.
Липопротеиды плазмы кровиЛипопротеиды высокой плотности (ЛПВП)
или α-липопротеиды – богатые белками (50%) и
фосфолипидами (27). Постоянно находятся в
плазме крови здоровых людей в концентрации 1,25
– 4,25 г/л. ЛПВП выполняют две основные
функции: поставляют апопротеины другим
липопротеидам в крови и участвуют в удалении
избытка холестерола из клеток и других
липопротеинов.
ЛПВП образуются в клетках печени и в
небольшом количестве в тонком кишечнике в виде
предшественников ЛПВП.
11.
Строение плазменных липопротеидов12.
α2-ГлобулиныПротромбин —предшественник тромбина, вызывающего
превращение фибриногена в фибрин.
Гаптоглобины – образуют стабильный комплекс с
гемоглобином - гаптоглобин-гемоглобиновый. появляющимся
в плазме в результате внутрисосудистого гемолиза эритроцитов.
Комплексы поглощаются клетками РЭС, где гем и белковые
цепи подвергаются распаду, а железо повторно используется
для синтеза гемоглобина. Тем самым предотвращается потеря
железа.
Церулоплазмин – белок, содержащий ионы меди (одна
молекула церулоплазмина содержит 6-8 ионов Cu2+), которые
придают ему голубую окраску. Является транспортной формой
ионов меди в организме. Обладает оксидазной активностью:
окисляет Fe2+ в Fe3+, что обеспечивает связывание железа
трансферрином
13.
β-ГлобулиныТрансферрин – главный белок βглобулиновой фракции, участвует в связывании и
транспорте трёхвалентного железа (Fe3+) в
различные ткани, особенно в кроветворные.
Фибриноген - белок свертывающей системы
крови
Транскобаламин - транспорт витамина В12
Липопротеиды низкой плотности
14.
Липопротеиды плазмы кровиЛипопротеиды низкой плотности
(ЛПНП) или β-липопротеиды – являются
самым богатым холестерином (ХС - 8%,
эфиры холестерола - 42%) классом. Основной
аполипопротеин В-100. Концентрация их в
плазме крови здоровых людей составляет 3,0 4,5 г/л. Синтезируются β-липопротеиды в
плазме крови из ЛПОНП и ЛППП. Основная
функция - это транспорт холестерола из
печени в периферические ткани
15.
γ-глобулиныИммуноглобулины: IgG, IgM, IgA, IgD,
IgE (антитела) вырабатываются В –
лимфоцитами в ответ на попадание в организм
чужеродных антигенов. Иммуноглобулины
состоят из двух тяжёлых Н и двух лёгких L
цепей, соединенных тремя дисульфидными
мостиками. Это происходит с помощью
специфических антигенсвязывающих участков
разных клонов иммуноглобулинов. Кроме
того, благодаря связыванию антигена с
антителом облегчается процесс разрушения
чужеродных веществ.
16.
ИммуноглобулиныРазличают 5 классов иммуноглобулинов: A, D,
E, G, M. Каждый класс иммуноглобулинов имеет
свой тип тяжелых цепей Н: IgG - γ-цепь, IgM –µ цепь, IgA – α-цепь, IgD – σ-цепь, IgE –ε-цепь,
которые отличаются по аминокислотному составу.
Каждый тип иммуноглобулинов может
специфически взаимодействовать с определенным
антигеном. При хроническом агрессивном гепатите
отмечается повышение IgG, при алкогольном
циррозе – IgA, концентрация IgE увеличивается при
бронхиальной астме, аскаридозе.
17.
18.
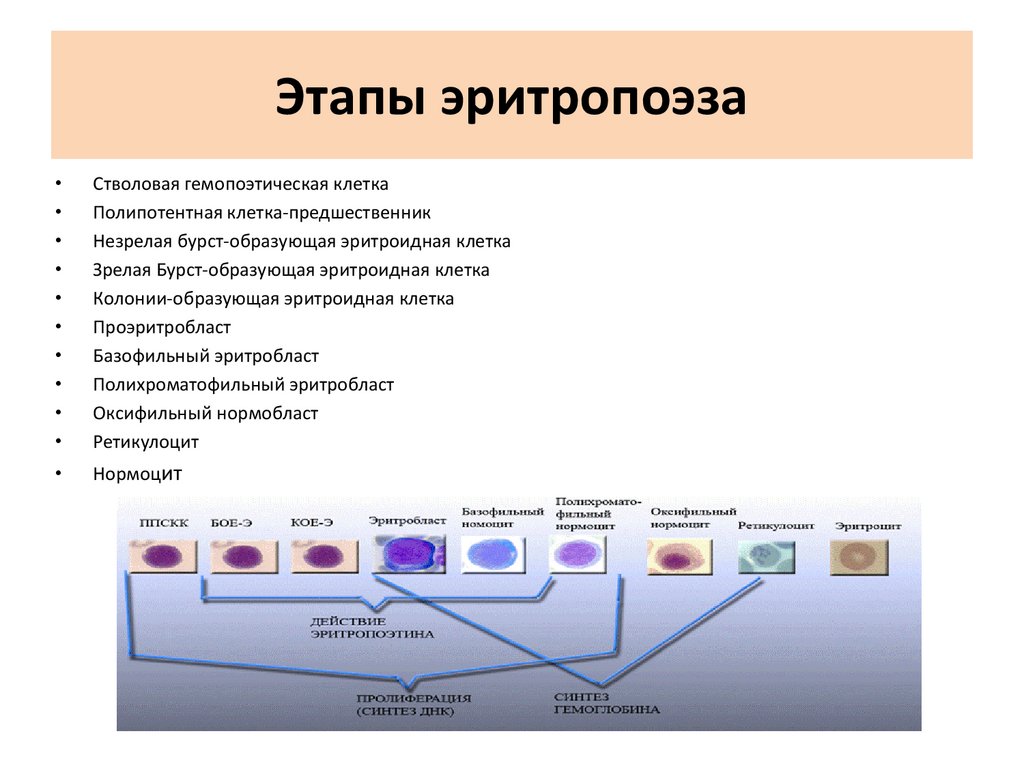
Этапы эритропоэзаСтволовая гемопоэтическая клетка
Полипотентная клетка-предшественник
Незрелая бурст-образующая эритроидная клетка
Зрелая Бурст-образующая эритроидная клетка
Колонии-образующая эритроидная клетка
Проэритробласт
Базофильный эритробласт
Полихроматофильный эритробласт
Оксифильный нормобласт
Ретикулоцит
Нормоцит
19.
Регуляция эритропоэзаУнипотентный предшественник эритроцитов
чувствителен к эритропоэтину.
Решающий стимул для образования эритроцитов –
гипоксия, запускающая синтез эритропоэтина в почке.
Эритропоэтин выходит в кровь и поступает в
костный мозг, где стимулирует размножение и
дифференцировку унипотентного предшественника
эритроцитов и дифференцировку последующих клеток
эритроидного ряда.
В результате количество эритроцитов в крови
увеличивается. Соответственно возрастает количество
кислорода, поступающего в почку, что тормозит
образование эритропоэтина.
20.
ЭритроцитыВ 1 мм3 крови человека в норме
содержится 4,5—5,5 млн. эритроцитов (у
мужчин 4,5—5 млн., у женщин 4—4,5 млн.).
Важную роль в сохранении формы и
способности к обратимой деформации
эритроцитов играют липиды и белки
плазматической мембраны.
Три из них - спектрин, гликофорин, белок
полосы 3 - составляют в сумме по весу более
60% всех мембранных белков.
21.
Белки плазматической мембраныСпектрин-периферический
трансмембранный белок. Спектрин состоит из
α- и β-полипептидных цепей.
Анкирин соединяет спектрин с основным
интегральным
белком
плазматической
мембраны - белком полосы 3. На
цитоплазматической поверхности мембраны
эритроцита имеется гибкая сетеобразная
структура,
состоящая
из
белков
и
обеспечивающая пластичность эритроцита при
прохождении им через мелкие капилляры .
22.
Интегральный белок полосы 3- белок-переносчик ионов С1- и НСО3- через
плазматическую мембрану эритроцитов по механизму
пассивного антипорта. Поступающий из тканей в
эритроциты
СО2
под
действием
фермента
карбоангидразы превращается в слабую угольную
кислоту, которая распадается на Н+ и НСО3-.
Образующиеся при этом протоны присоединяются
к гемоглобину, уменьшая его сродство к О2, а
бикарбонаты с помощью белка полосы 3 обмениваются
на Cl- и выходят в плазму крови
Н2О + СО2 → Н2СО3 → Н+ + НСО3- → обмен на Сl- .
23.
Мембранный фермент Nа+, К+АТФ-азаОбеспечивает поддержание градиента
концентраций Na+ и К+ по обе стороны
мембраны. При снижении активности Na+,
К+-АТФ-азы концентрация Na+ в клетке
повышается, так как небольшие ионы могут
проходить через мембрану простой
диффузией. Это приводит к увеличению
осмотического давления, увеличению
поступления воды в эритроцит и к его гибели в
результате разрушения клеточной мембраны гемолизу
24.
Мембранный ферментСа2+-АТФ-аза
Осуществляющий выведение из
эритроцитов ионов кальция и
поддерживающий градиент концентрации
этого иона по обе стороны мембраны.
25.
Белки аквопорины(Aquaporins (AQPs) транспортирует воду
через клеточные мембраны в ответ на
осмотические градиенты
26.
Белок эритроцитовОсновным
белком эритроцитов, на
долю которого приходится около 98 % всей
массы белков цитоплазмы, является
гемоглобин.
Один моль гемоглобина может связать
до 4 молей кислорода.
27.
Ферменты плазмы кровиВсе ферменты, содержащиеся в плазме крови, можно
разделить на три группы:
1. Секреторные ферменты - синтезируются в печени, выделяются
в кровь, где выполняют свою функцию (например, факторы
свёртывания крови);
2. Экскреторные ферменты - синтезируются в печени, в норме
выделяются с желчью (например, щелочная фосфатаза), их
содержание и активность в плазме крови возрастает при
нарушении оттока желчи;
3. Индикаторные ферменты - синтезируются в различных тканях
и попадают в кровь при разрушении клеток этих тканей. В
разных клетках преобладают различные ферменты, поэтому при
повреждении того или иного органа в крови появляются
характерные для него ферменты. Это может быть использовано
в диагностике заболеваний.
28.
Метаболизм эритроцитовЭритроциты не имеют митохондрий, поэтому в клетке не
протекают реакции ЦТК, окислительного фосфорилирования и
β-окисления жирных кислот.
Основной путь получения энергии – гликолиз, 90%
глюкозы в эритроцитах распадается в процессе анаэробного
гликолиза,
10% глюкозы окисляется в реакциях пентозофосфатного пути.
АТФ в эритроцитах:
• обеспечивает работу Nа+ К+ АТФ-азы
• поддержание самого гликолиза (гексокиназная реакция (слайд
№ 30), фосфофруктокиназная реакция (слайд № 31).
29.
Нарушение гликолиза вэритроцитах
Вследствие снижения скорости синтеза
АТФ падает активность Na+,K+-АТФ-азы,
повышается осмотическое давление и
возникает осмотический шок.
Дефицит НАДН+Н+ приводит к
накоплению метгемоглобина и увеличению
образования активных форм кислорода,
вызывающих окисление SН-групп в
молекулах гемоглобина.
30.
Первая реакция гликолиза31.
Вторая реакция гликолиза32.
Особенности гликолиза вэритроцитах
Это превращение 1,3-бисфосфоглицерата (ДФГ) в 2,3бисфосфоглицерат (слайд №33 – реакция характерна только
для эритроцитов).
2,3-бисфосфоглицерат
служит
важным
аллостерическим регулятором сродства Hb к О2.
Увеличение образования 2,3- ДФГ снижает сродство
Hb к О2, что приводит к сдвигу кривой диссоциации
оксигемоглобина вправо и к усиленному поступлению О2 в
ткани. Сдвиг кривой вправо возникает также при
увеличении температуры тела, возрастании уровня СО2 или
на фоне развития метаболического ацидоза
(этот слайд наизусть).
33.
Реакция образования 2,3бисфосфоглицерат34.
Метаболизм глюкозы вэритроцитах
35.
Активные формы кислородаБольшое содержание кислорода в эритроцитах
определяет высокую скорость образования
активных форм кислорода (АФК): супероксидного
анион-радикала O2-, пероксида водорода Н2О2 и
гидроксил-радикала ОН-. Постоянным источником
активных форм кислорода в эритроцитах является
неферментативное окисление железа гемоглобина:
Нb(Fe2+)
↓ → e- + О2 → О2− → Н2О2 → Н2О + ОН∙
MeтНb(Fe3+)
e-,2Н+
e-,2Н+
36.
Активные формы кислородаАктивные формы кислорода могут вызвать
гемолиз эритроцитов.
Эритроциты содержат ферментативную
систему, предотвращающую токсическое действие
радикалов кислорода и разрушение мембран
эритроцитов.
37.
Антиоксидантная защитаОсобую роль играет глутатион-пероксидаза. Главной
функциональной
группой
глутатиона
является
сульфгидрильная группа, водород которой
обеспечивает
нейтрализацию органических и неорганических окислителей,
действующих на мембрану эритроцита, и защищает липиды
мембраны от свободнорадикального окисления.
Восстановленный глутатион необходим для поддержания
в восстановленной форме SH-групп белков. При снижении
концентрации восстановленного глутатиона эритроцит быстро
«стареет».
38.
Антиоксидантная защитаВосстановленная форма глутатиона (Г-SH)
участвует в реакциях обезвреживания пероксида
водорода и органических пероксидов. При этом
образуются вода и окисленный глутатион.
Превращение окисленного глутатиона в
восстановленный - катализирует фермент
глутатион-редуктаза.
39.
Антиоксидантная защитаВ эритроцитах имеются также ферменты
супероксиддисмутаза и каталаза, защищающие
от активных форм кислорода.
Антиоксидантные системы имеют для
эритроцитов особое значение, так как в
эритроцитах не происходит обновления белков
путём синтеза.
40.
ЛейкоцитыБелые
кровяные тельца
41.
Строение лейкоцитовПолноценные клетки с большим ядром,
митохондриями и высоким содержанием
нуклеиновых кислот.
42.
Метаболизм лейкоцитовВ лейкоцитах активно протекают процессы
биосинтеза нуклеиновых кислот и белков.
Основной путь получения энергии –
аэробный гликолиз. АТФ образуется также в
реакциях β-окисления жирных кислот.
В лейкоцитах сосредоточен весь гликоген крови.
В лизосомах лейкоцитов локализована мощная
система протеолитических ферментов –
протеазы, фосфатазы, эстеразы, ДНК-азы, РНКазы, что обеспечивает участие этих клеток в
защитных реакциях организма.
43.
Функция лейкоцитовПоглощение бактерий лейкоцитами в
процессе фагоцитоза сопровождаются
резким увеличением потребления
кислорода с образованием супероксидного
аниона и пероксида водорода, которые
оказывают бактерицидное действие. Это
явление называется «распираторным
взрывом».
44.
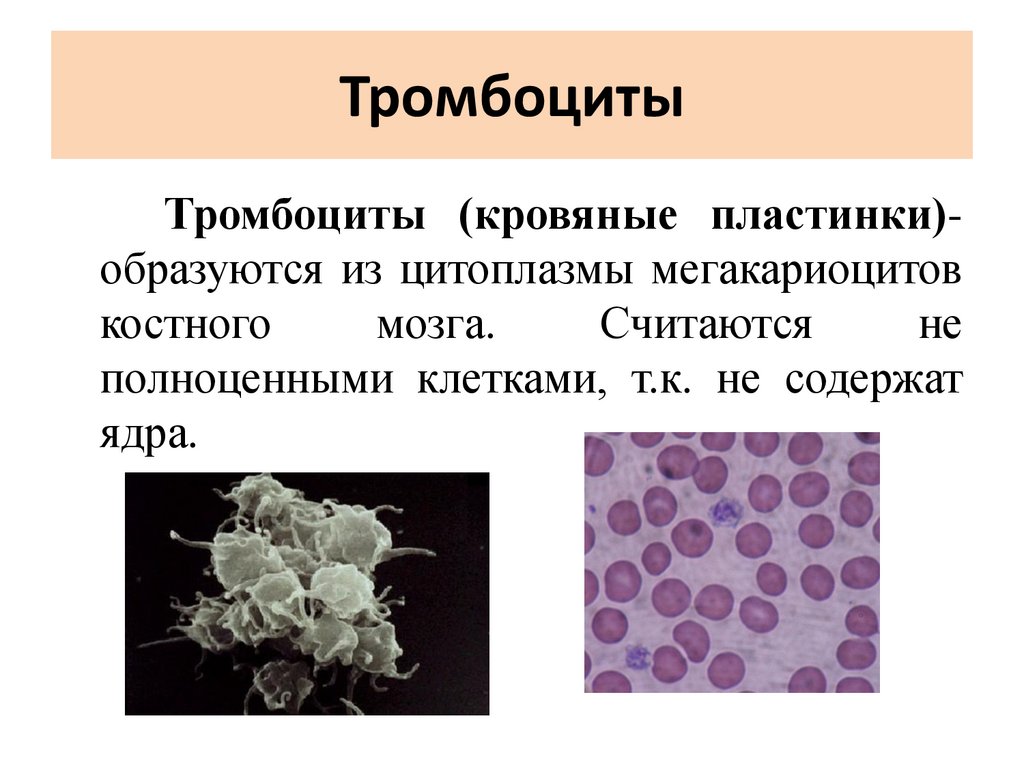
ТромбоцитыТромбоциты (кровяные пластинки)образуются из цитоплазмы мегакариоцитов
костного
мозга.
Считаются
не
полноценными клетками, т.к. не содержат
ядра.
45.
Метаболизм тромбоцитовВ тромбоцитах протекают основные
биохимические процессы: окислительное
фосфорилирование,
ЦТК, синтез белка,
реакции
обмена
углеводов
(гликолиз,
пентозофосфатный путь), реакции обмена
липидов (β-окисления жирных кислот)
Основная функция тромбоцитов – участие
в процессе свертывания крови обусловлена
наличием
тромбоцитарных
факторов
свертывания
46.
Минеральные компонентыплазмы крови
Минеральные
вещества
являются
необходимыми компонентами плазмы крови.
Важнейшими катионами являются ионы
натрия, калия, кальция и магния. Им
соответствуют
анионы:
хлориды,
бикарбонаты, фосфаты, сульфаты.
Натрий – основной катион внеклеточной
жидкости. Его содержание в плазме крови
135 – 150 ммоль/л. Ионы натрия участвуют в
поддержании
осмотического
давления
внеклеточной жидкости. Гипонатриемия
может быть обусловлена надпочечниковой
недостаточностью, диабетическим ацидозом.
47.
Минеральные компоненты плазмыкрови
Калий - является основным внутриклеточным катионом. В
плазме крови он содержится в количестве 3,9 ммоль/л, а в
эритроцитах – 73,5 – 112 ммоль/л. Как и натрий, калий
поддерживает осмотический и кислотно-основный гомеостаз в
клетке. Гиперкалиемия отмечается при усиленном разрушении
клеток (гемолитическая анемия, синдром длительного
раздавливания), при нарушении выделения калия почками, при
обезвоживании организма. Гипокалиемия наблюдается при
гиперфункции коры надпочечников, при диабетическом
ацидозе.
Кальций.
Гиперкальциемия
наблюдается
при
гиперпаратиреозе, гипервитаминозе D, синдроме ИценкоКушинга, деструктивных процессах в костной ткани.
Гипокальциемия встречается при рахите, гипопаратиреозе,
заболеваниях почек
48.
Минеральные компоненты плазмыкрови
Хлориды содержатся в плазме крови в количестве
95 – 110 ммоль/л, участвуют в поддержании
осмотического давления, кислотно-основного состояния
внеклеточной жидкости. Гиперхлоремия наблюдается
при
сердечной
недостаточности,
артериальной
гипертензии, гипохлоремия – при рвоте, заболеваниях
почек.
Фосфаты в плазме крови являются компонентами
буферной системы, их концентрация составляет 1 – 1,5
ммоль/л.
Гиперфосфатемия
наблюдается
при
заболеваниях почек, гипопаратиреозе, гипервитаминозе
D. Гипофосфатемия отмечена при гиперпаратиреозе,
микседеме, рахите.
49.
Буферные системы кровирН крови – от 7,37 до 7,44
Ее кислотно-основное равновесие
поддерживается совместным участием буферных
систем плазмы и клеток крови. Буферные системы
организма состоят из слабых кислот и их солей с
сильными основаниями. Каждая буферная система
характеризуется двумя показателями:
• рН буфера (зависит от соотношения компонентов
буфера);
• буферная ёмкость, т.е. количество сильного основания
или кислоты, которое нужно прибавить к буферному
раствору для изменения рН, на единицу (зависит от
абсолютных концентраций компонентов буфера).
50.
Буферные системы кровиБикарбонатная (H2CO3/NaHCO3);
Фосфатная (NaH2PO4/Na2HPO4);
Гемоглобиновая (дезоксигемоглобин в качестве
слабой кислоты/ калиевая соль оксигемоглобина);
Белковая (действие её обусловлено
амфотерностью белков).
51.
Буферные системы кровиБикарбонатная система представляет собой
сопряженную кислотно-основную пару,
состоящую из молекулы угольной кислоты Н2СО3,
выполняющую роль донора протона, и
бикарбонат-иона НСО3-, выполняющего роль
акцептора протона.
52.
Буферные системы кровиФосфатная буферная система представляет
собой сопряженную кислотно-основную пару,
состоящую из иона Н2РО4– (донор протонов) и
иона НРО42– (акцептор протонов)
53.
Буферные системы кровиГемоглобиновая буферная система состоит
из неионизированного гемоглобина ННb (слабая
органическая кислота, донор протонов) и
калиевой соли гемоглобина КНb (сопряженное
основание, акцептор протонов)
54.
Буферные системы кровиБелковая буферная система. Белки образуют
буферную систему благодаря наличию кислотноосновных групп в молекуле белков: белок–Н+
(кислота, донор протонов) и белок (сопряженное
основание, акцептор протонов).
55.
Гемостаз- это физиологическая реакция, основной целью которой
является остановка кровотечения, сохранение жидкого
состояния крови в сосудах и восстановление поврежденного
сосуда и ткани.
В процессе свертывания крови принимают участие много
факторов, из них 13 находятся в плазме крови и называются
плазменными факторами. Они обозначаются римскими
цифрами (I-XIII). Другие 12 факторов находятся в форменных
элементах крови (особенно тромбоцитах, поэтому их называют
тромбоцитарными) и в тканях. Их обозначают арабскими
цифрами (1-12). Так, в тромбоцитах находятся фактор 3
кровяных пластинок (предшественник тромбопластина),
аналоги факторов V и XIII, фибриногена и др.
56.
Плазменные факторы свертываниякрови
Фактор I – фибриноген – гликопротеин. Под действием тромбина
фибриноген превращается в фибриллярный белок — фибрин.
Фактор II – протромбин - Фактор II cинтезируется в печени при
участии витамина К. Если нарушается функция печени, концентрация
протромбина в крови снижается.
Фактор III – тканевый тромбопластин, апопротеин С — его много
в легких, тканях мозга, сердца, кишечника, матки, в эндотелии. При
контакте с плазменными факторами (VIIa, IV) способен активировать
фактор Х (это внешний путь формирования протромбиназы).
Фактор IV – ионы кальция. Необходим для активации
протромбиназы и превращения протромбина в тромбин. Кальций
способен связывать гепарин, благодаря чему свертывание крови
ускоряется. Без кальция нарушается агрегация тромбоцитов и
ретракция кровяного сгустка.
57.
Плазменные факторы свертываниякрови
Фактор V — проакселерин, или Ас-глобулин. Он необходим
для образования внутренней (кровяной) протромбиназы, при
этом заметно активирует фактор X, и для превращения
протромбина в тромбин, когда в комплекс включаются фактор
Ха, Са2+и фосфолипид.
Фактор VI – акселерин, или сывороточный Ас-глобулин,–
активная форма фактора V. исключен из употребления и
номенклатуры факторов свертывания.
Фактор VII – проконвертин, или конвертин,– синтезируется
в печени при участии витамина К. Факторы ХII, Ха, калликреин
могут превращать фактор VII в VIIa. В основном способствуют
образованию тканевой протромбиназы и превращению
протромбина в тромбин. Фактор VII в циркулирующей крови
активирует фактор X.
58.
Плазменные факторы свертываниякрови
Фактор VIII – антигемофильный глобулин
А, или плазменный тромбопластический
фактор А. VIII-фВ регулирует синтез
коагулянтной части антигемофильного
глобулина – VIIIK
Фактор IX – Кристмас-фактор,
плазменный тромбопластиновый
компонент. Фактор IX образуется в печени.
В процессе свертывания крови фактор IX не
потребляется и остается в сыворотке еще в
более активном состоянии, чем в плазме.
59.
Плазменные факторы свертываниякрови
Фактор Х – Стюарта – Прауэра.
Вырабатывается в печени в неактивном
состоянии при участии вит. К.
Фактор XI – плазменный предшественник
тромбопластина. Активная форма этого
фактора (ХIа) образуется при участии факторов
ХIIа, Флетчера и Фитцжеральда — Фложе.
Форма ХIа активирует фактор IX, который
превращается в фактор IХа
60.
Плазменные факторы свертываниякрови
Фактор XII – фактор контакта Хагемана –
вырабатывается в неактивном состоянии.
Фактор Хагемана – инициатор
внутрисосудистой коагуляции, активирует
прекалликреины плазмы, которые
превращаются в ферменты калликреины,
освобождающие кинины, служит
активатором фибринолиза.
61.
Плазменные факторы свертываниякрови
Фактор XIII – фибринстабилизирующий фактор –
a2-гликопротеид. В плазме находится в виде
профермента, соединенного с фибриногеном.
Фактор XIII под влиянием тромбина превращается в
активную форму (XIIIa).
Фактор Флетчера — плазменный прекалликреин.
Если фактора Флетчера нет в организме, нарушается
общее время свертывания, хотя факторы I – XIII
содержатся в крови в пределах нормы. Фактор
Флетчера активирует факторы VII и IX. Тем самым он
связывает внутреннюю и внешнюю системы
активации фактора X.
62.
Небелковые азотистые компонентыкрови (остаточный азот)
Мочевина, мочевая кислота,
аминокислоты,
креатин, креатинин,
аммиак, индикан, билирубин
Содержание остаточного азота в плазме
крови здоровых людей - 15-25 ммоль/л.
Повышение содержания остаточного азота
в крови называется азотемией.
63.
Нарушения КОС кровиАцидоз - форма нарушения кислотнощелочного равновесия в организме,
характеризующаяся сдвигом отношений между
анионами кислот и катионами оснований в
сторону увеличения анионов.
Снижение величины рН крови ниже 6,8
несовместимо с жизнью
64.
Нарушения КОС кровиАлкалоз - форма нарушения кислотнощелочного равновесия (кислотно-основного
состояния) в организме,
характеризующаяся сдвигом отношений
между анионами кислот и катионами
оснований крови в сторону увеличения
катионов, рН крови при этом увеличивается
Значение рН более 7,7 несовместимо с
жизнью.
65.
Патологические изменения всоставе крови
В разных клетках преобладают различные ферменты, поэтому при
повреждении того или иного органа в крови появляются характерные для него
ферменты. Это может быть использовано в диагностике заболеваний.
В сыворотке крови здоровых людей активность
аланинаминотраноферазы (АЛТ) и аспартатаминотрансферазы (ACT) в
тысячи раз ниже, чем в паренхиматозных органах. Органические поражения
при острых и хронических заболеваниях, сопровождающиеся поражением
клеток приводит к выходу этих ферментов из очага поражения в кровь.
При повреждении клеток печени в крови возрастает активность АЛТ,
изофермента лактатдегидрогеназы -ЛДГ5, глутаматдегидрогеназы,
орнитинкарбамоилтрансферазы.
При повреждении клеток миокарда (инфаркт) в крови возрастает
активность ACT, изофермента лактатдегидрогеназы -ЛДГ1, изофермента
креатинкиназы MB.
При повреждении клеток поджелудочной железы (панкреатит) в крови
возрастает активность трипсина, α-амилазы, липазы.
66.
Патологические изменения всоставе крови
При недостатке альбумина, который
должен удержать Nа+, другие катионы и
воду, вода уходит в межклеточное
пространство, усиливая отёки.
Гипоальбуминемия может наблюдаться
при заболевании печени, повышении
проницаемости капилляров, потерях белка
из-за обширных ожогов или
злокачественных образований.
67.
Патологические изменения всоставе крови
Криоглобулин - появляется при
патологических состояниях. Его можно
обнаружить при миеломе, нефрозе, циррозе
печени, ревматизме, лимфосаркоме, лейкозах и
других заболевания
68.
Патологические изменения всоставе крови
С-реактивный белок – биологическая роль его
определяется
способностью
активировать
фагоцитоз и ингибировать процесс агрегации
тромбоцитов. При остром воспалительном
процессе она увеличивается более чем в 20 раз, в
этом случае С-РБ обнаруживается в крови.
69.
Спасибо за внимание. И ещё развнимательно прочитать слайды
2,4,5,6,7,9,12,13,15,16,17,20,23,26,28,29,30,
32,34,35,36,39,41,42,43,44,45,46,47,50,55,65


































































 biology
biology