Similar presentations:
Биохимия крови. Особенности развития, строения и метаболизма эритроцитов. Белковые фракции сыворотки крови. Энзимодиагностика
1.
ПЯТИГОРСКИЙ МЕДИКО-ФАРМАЦЕВТИЧЕСКИЙ ИНСТИТУТ-филиал федеральногогосударственного бюджетного образовательного учреждения высшего образования
«Волгоградский государственный медицинский университет» Министерства
здравоохранения Российской Федерации.
КАФЕДРА МИКРОБИОЛОГИИ И ИММУНОЛОГИИ С КУРСОМ
БИОЛОГИЧЕСКОЙ ХИМИИ
ДИСЦИПЛИНА: «БИОХИМИЯ»
СПЕЦИАЛЬНОСТЬ: «ЛЕЧЕБНОЕ ДЕЛО»
КУРС 2, СЕМЕСТР 3
Лекция №7
Биохимия крови. Особенности развития, строения и
метаболизма эритроцитов. Белковые фракции
сыворотки крови. Энзимодиагностика
Пятигорск
2023
2.
Кровь - жидкая соединительная ткань многоклеточных организмов, котораячерез межклеточную жидкость контактирует со всеми клетками и тканями,
обеспечивая поддержание гомеостаза и взаимодействие всех структур организма
Функции крови:
1. Транспортная:
а) дыхательная
б) питательная (трофическая)
в) выделительная (экскреторная)
2. Регуляторная:
а) КОС – буферные системы
б) осмотическое давление Росм
в) онкотическое давление Ронк
г) гормональная
д) терморегуляторная
3. Защитная:
а) коллоидная защита
б) иммунохимическая
в) гемостаз
2
3. Состав и физико-химические свойства
КРОВЬплазма 55%
□
□
□
□
□
форменные элементы
рН 7,36-7,42
Росм 7,8-8,1 атм
Ронк 0,03-0,04 атм
Δ t -0,56-(-0,58) °С
Удельные вес 1,050-1,060 г/см3
(плотность)
- эритроциты
- лейкоциты
- тромбоциты
3
4. Состав плазмы крови плазма крови
плотный остаток - 17%минеральные
вещества
органические
вещества
азотсодержащие
катионы анионы
Na+
K+
Ca2+
Fe3+
Мg2+
ClHCO3
2SO4
Н2РО3
2НРО3
вода - 83%
белки
65-85 г/л
небелковые
15-25
ммоль/л
безазотистые
углеводы
4,3-6,2
ммоль/л
липиды
6,0-8,0
г/л
4
5. Жизненный цикл эритроцита
1. пролиферация, клеточнаядифференцировка, созревание:
Нb
исчезновение белоксинтезирующей системы
исчезновение клеточных органелл (ядра,
митохондрий)
резкое ослабление дыхательного
метаболизма
2. период активного
функционирования (90-120 дней)
транспорт газов
поддержание КОС (гемоглобиновая
буферная система)
3. деградация
5
6. Эритроцит
двояковогнутый диск с толстой мембраной (до 6 нм) с низкимдыхательным метаболизмом и высоким содержанием
гемоглобина (32-37%). В эритроците содержится до 100
различных белков, в основном ферментов – гликолиза,
пентозофосфатного цикла, карбоангидраза, антиоксидантные
ферменты (каталаза, пероксидаза, глутатионредуктаза).
Мембрана эритроцита двухслойная, содержит 49% белка, 44%
липидов (большая часть – фосфолипиды, много холестерола и
сфинголипидов) и 7% углеводов.
Белка мембраны эритроцита
1 - гликофорин,
2 - спектрин,
3 - белок типа миозина (сократительный),
4- гликопротеины групповой специфичности крови,
5 - рецепторные трансмембранные белки,
6 – белок полосы 3
8
7. Белки мембран эритроцитов
Спектрин - периферический мембранный белок, нековалентно связанный сцитоплазматической поверхностью липидного бислоя мембраны.
Представляет собой длинную, тонкую, гибкую фибриллу и является основным
белком цитоскелета эритроцитов.
Состоит из α- и β-полипептидных цепей, имеющих доменное строение; α- и βцепи димера расположены антипараллельно, перекручены друг с другом и
нековалентно взаимодействуют во многих точках.
Может прикрепляться к мембране и с помощью белка анкирина (крупный
белок соединяется с β-цепью спектрина и цитоплазматическим доменом
интегрального белка мембраны - белка полосы 3).
Анкирин не только фиксирует спектрин на мембране, но и уменьшает
скорость диффузии белка полосы 3 в липидном слое.
Интегральный белок полосы 3 - белок-переносчик ионов С1- и НСО3- через
плазматическую мембрану эритроцитов по механизму пассивного антипорта
Таким образом, на цитоплазматической поверхности эритроцитов образуется
гибкая сетевидная структура, которая обеспечивает сохранение их формы при
прохождении через узкие капилляры сосудов
8. Функции эритроцитов:
перенос кислорода от лёгких к тканям и диоксидауглерода от тканей к лёгким;
поддержание pH крови (гемоглобин и оксигемоглобин
составляют одну из буферных систем крови);
поддержание ионного гомеостаза за счёт обмена
ионами между плазмой и эритроцитами;
участие в водном и солевом обмене;
адсорбция токсинов, в том числе продуктов распада
белка, что уменьшает их концентрацию в плазме крови
и препятствует переходу в ткани;
участие в ферментативных процессах, в транспорте
питательных веществ — глюкозы, аминокислот.
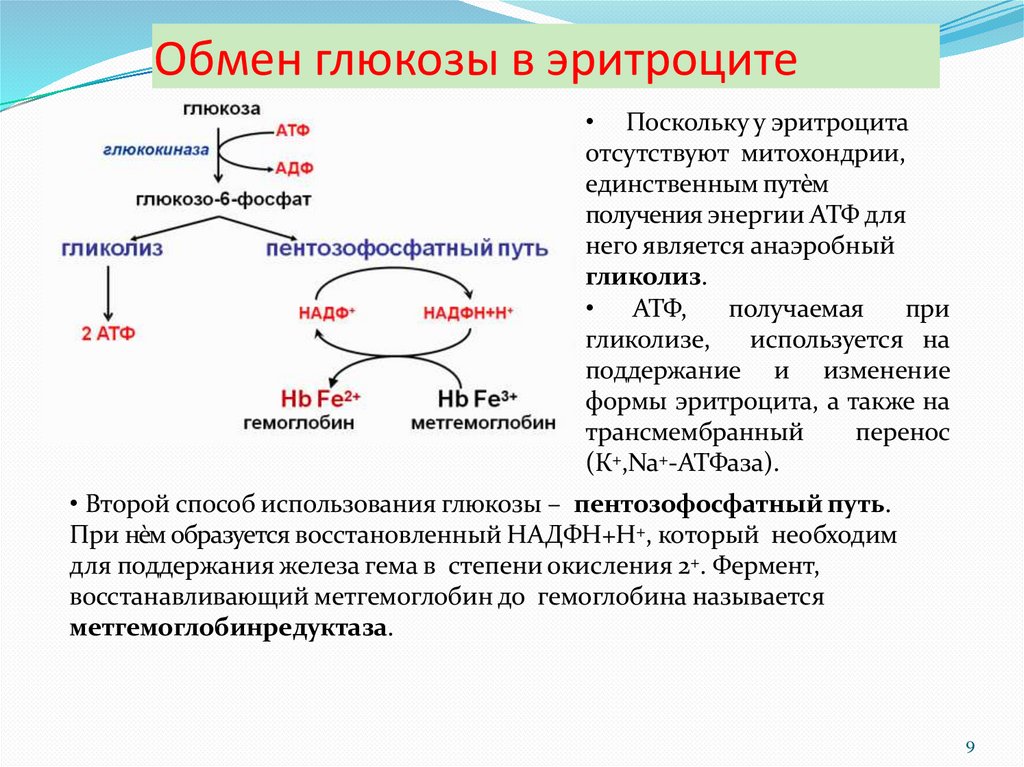
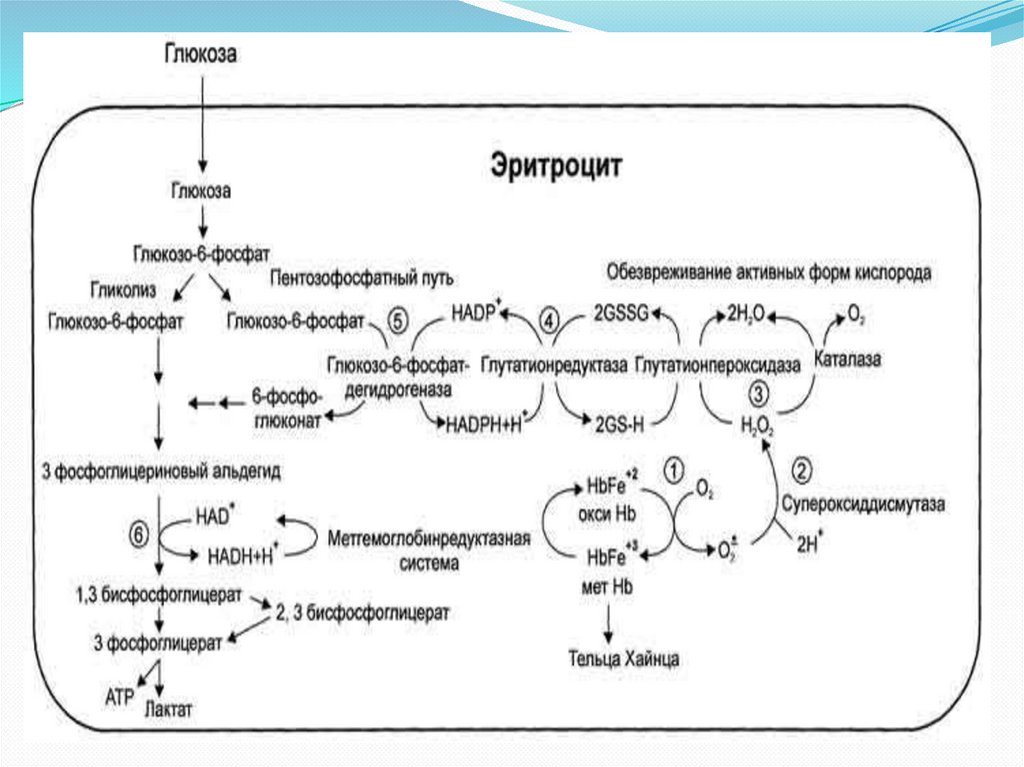
9. Обмен глюкозы в эритроците
• Поскольку у эритроцитаотсутствуют митохондрии,
единственным путѐм
получения энергии АТФ для
него является анаэробный
гликолиз.
• АТФ,
получаемая
при
гликолизе,
используется на
поддержание и изменение
формы эритроцита, а также на
трансмембранный
перенос
(К+,Na+-АТФаза).
• Второй способ использования глюкозы – пентозофосфатный путь.
При нѐм образуется восстановленный НАДФН+Н+, который необходим
для поддержания железа гема в степени окисления 2+. Фермент,
восстанавливающий метгемоглобин до гемоглобина называется
метгемоглобинредуктаза.
9
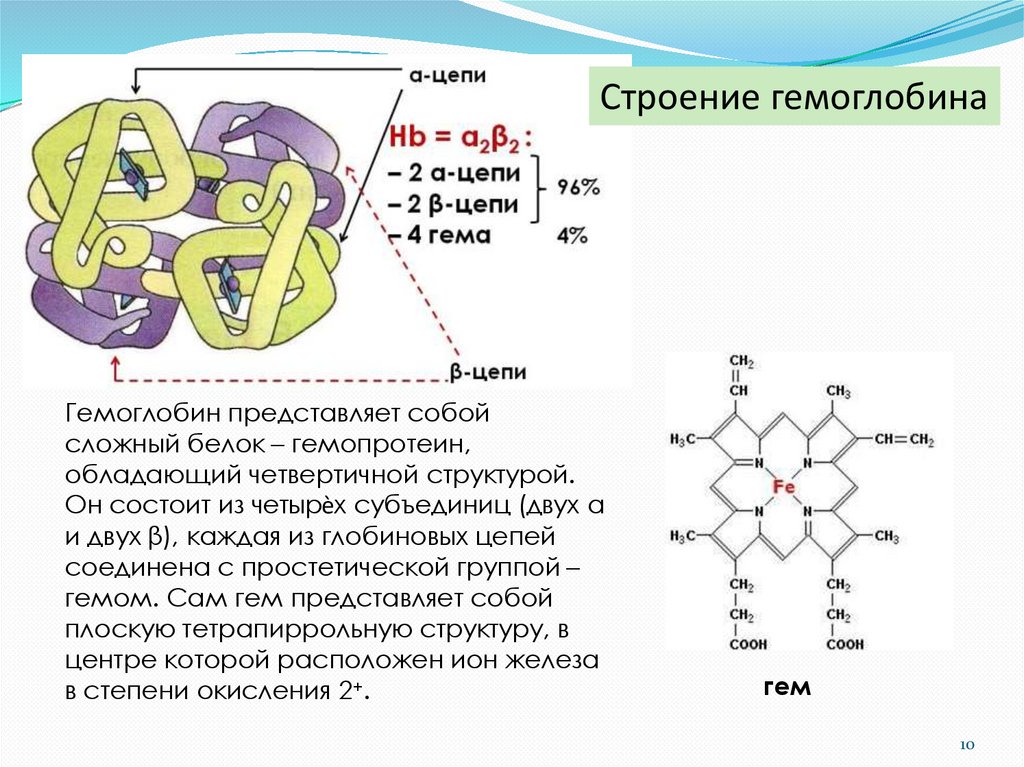
10.
Строение гемоглобинаГемоглобин представляет собой
сложный белок – гемопротеин,
обладающий четвертичной структурой.
Он состоит из четырѐх субъединиц (двух α
и двух β), каждая из глобиновых цепей
соединена с простетической группой –
гемом. Сам гем представляет собой
плоскую тетрапиррольную структуру, в
центре которой расположен ион железа
в степени окисления 2+.
гем
10
11. Транспортная форма О2
Поскольку растворимостькислорода в воде очень низкая, то
он транспортируется только в
связанном с гемоглобином виде (в
виде оксигемоглобина) –
Hb(Fe2+)•4 О2
11
12. Оксигенация гемоглобина
1213. Кооперативность действия субъединиц гемоглобина
Присоединение молекул кислорода к гемоглобинупроисходит постепенно, причѐм оксигенация одной из
субъединиц облегчает присоединение следующих
молекул О2. Это происходит в следствие того, что
взаимодействие гемоглобиновой субъединицы с лигандом
(О2) приводит к изменению конформации глобиновых
цепей и активации их центров связывания.
Взаимовлияние протомеров олигомерного белка друг на
друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина
повышает его сродство к кислороду и ускоряет
присоединение кислорода в 300 раз. В тканях идет
обратный процесс, сродство снижается и ускорение
отдачи кислорода также 300-кратное.
13
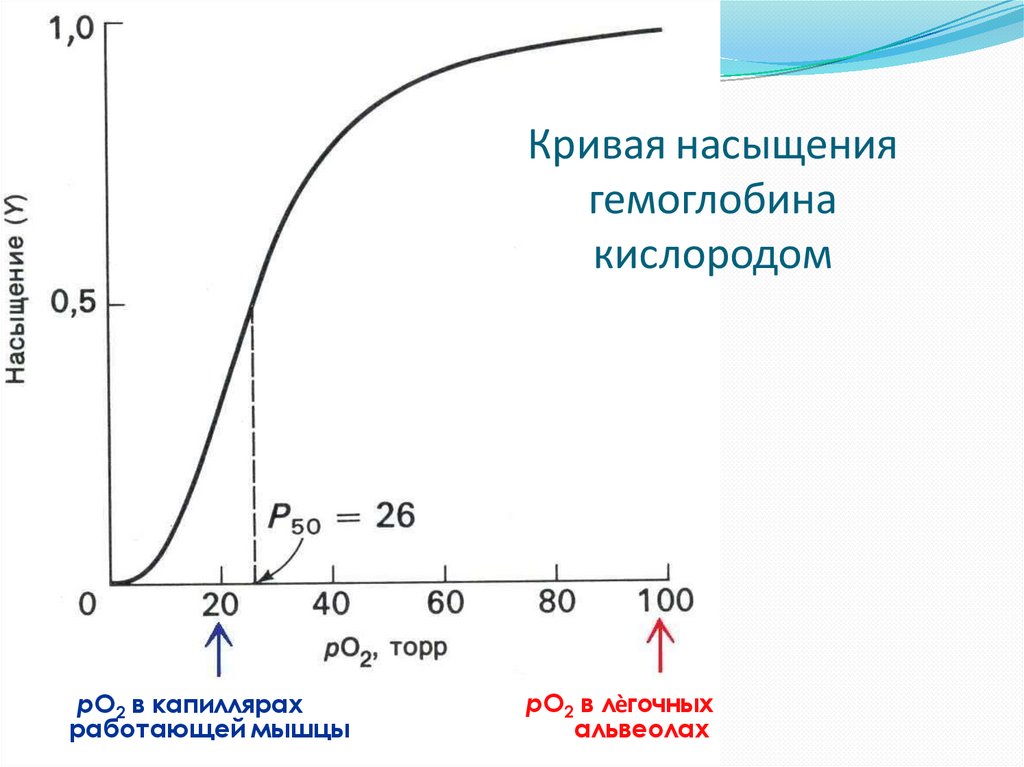
14. Кривая насыщения гемоглобина кислородом
рО2 в капиллярахработающей мышцы
рО2 в лѐгочных
альвеолах
15. Транспортные формы СО2
Растворимость двуокиси углерода значительно выше, чемкислорода, поэтому часть углекислого газа
транспортируется в растворѐнном в плазме виде.
□ Физически растворѐнный - 7-8%
□ Карбгемоглобин – 12-13%
HHb + CO2
HHb-NH-C
O
OH
□ Бикарбонаты – 80% (основная форма транспорта)
NaHCO3 в плазме
КНCO3 в эритроците
16
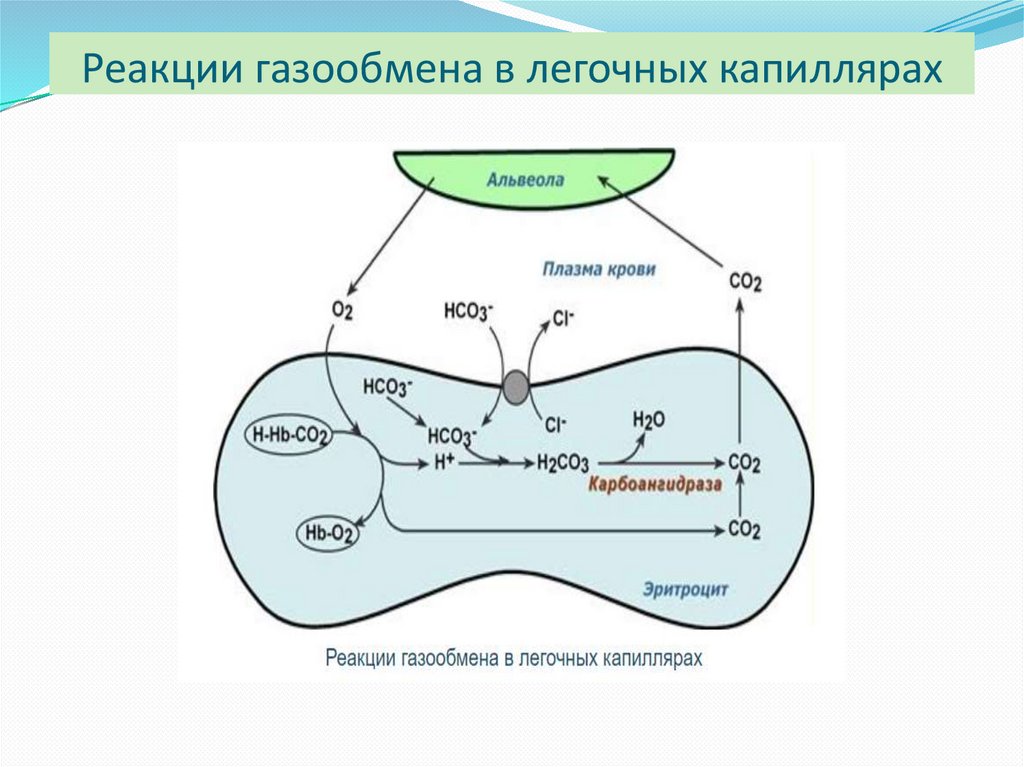
16. Транспорт кислорода и диоксида углерода
Поступающий из тканей в эритроциты СО2 под действиемфермента карбоангидразы превращается в слабую угольную
кислоту, которая распадается на Н+ и НСО3-.
Образующиеся при этом протоны присоединяются к
гемоглобину, уменьшая его сродство к О2, а бикарбонаты с
помощью белка полосы 3 обмениваются на Cl- и выходят в
плазму крови.
Н2О + СО2 → Н2СО3 → Н+ + НСО3- → обмен на Сl-
В лёгких увеличение парциального давления кислорода и
взаимодействие его с гемоглобином приводят к вытеснению
протонов из гемоглобина, обмену внутриклеточного Сl- на
НСО3- через белок полосы 3, образованию угольной кислоты
и её разрушению на СО2 и Н2О.
17.
Карбоангидраза, угольная ангидраза, карбонат-гидролиаза- фермент класса лиаз, катализирующий обратимое
образование угольной кислоты из двуокиси углерода и воды
CO2 + H2O ---- H2CO3
Карбоангидраза — металлопротеид, содержащий Zn;
молекулярная масса около 30 000.
Содержится в эритроцитах, клетках почек, слизистой
желудка, сетчатке глаза и др.
Карбоангидраза эритроцитов обеспечивает в тканях
связывание CO2 кровью и быстрое освобождение последней
от CO2 в лёгких или жабрах.
В почке карбоангидраза обеспечивает образование кислой
мочи, в слизистой желудка — HCl, в поджелудочной железе
— бикарбонатов поджелудочного сока.
18. Реакции газообмена в капиллярах тканей
19. Реакции газообмена в легочных капиллярах
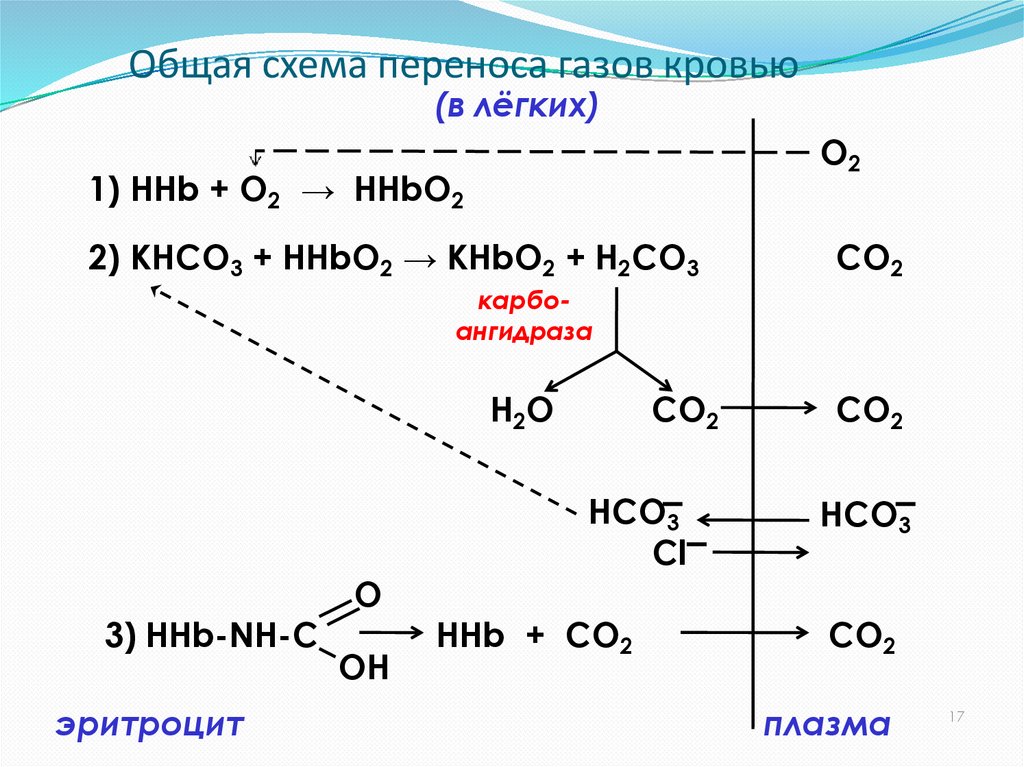
20. Общая схема переноса газов кровью
(в лёгких)O2
1) ННb + O2 → HHbO2
2) KНCO3 + HHbO2 → KHbO2 + Н2CO3
CO2
карбоангидраза
H2O
3) HHb-NH-C
эритроцит
O
OH
CO2
HCO3
Cl
HHb + CO2
CO2
HCO3
CO2
плазма
17
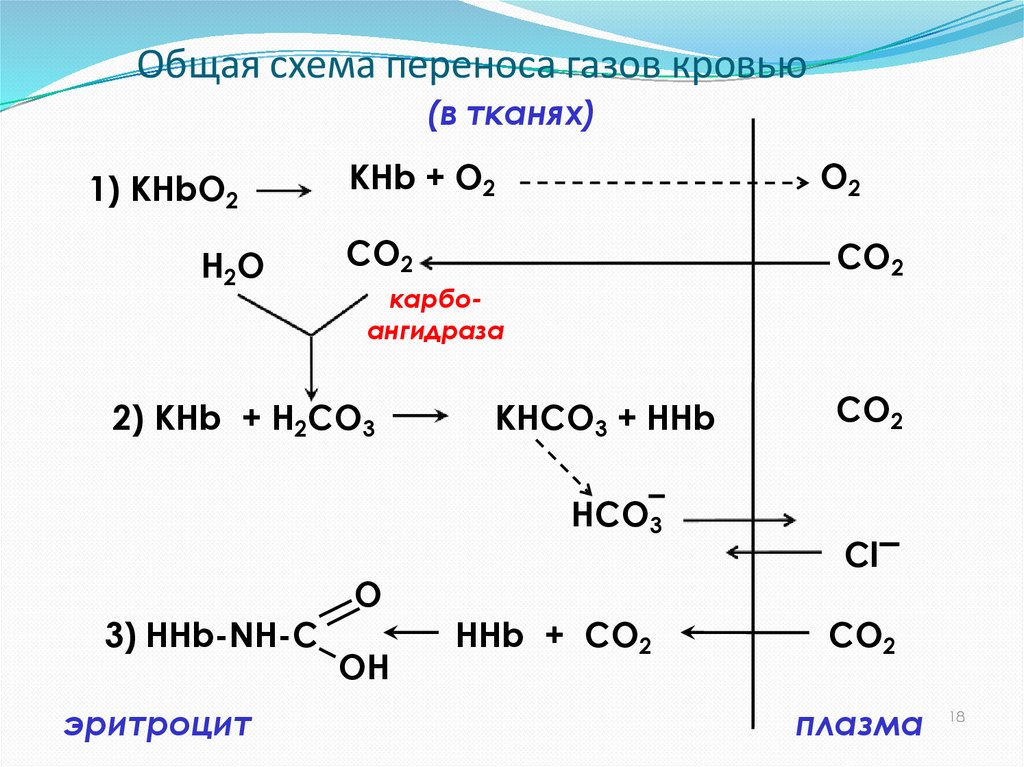
21. Общая схема переноса газов кровью
(в тканях)1) КHbO2
H2O
КНb + O2
O2
CO2
CO2
карбоангидраза
2) KHb + Н2CO3
KНCO3 + HHb
HCO3
3) HHb-NH-C
эритроцит
O
OH
HHb + CO2
CO2
Cl
CO2
плазма
18
22. Связывание газов гемоглобином
□ ОксигемоглобинHb O2 (Fe2+)
□ Карбоксигемоглобин Hb CO (Fe2+)
□ Карбгемоглобин Hb-NH-COOH (Fe2+)
□ Метгемоглобин Мet Hb(Fe3+)
22
23. Эмбриональная гетерогенность Нb
Нb P = α2 ε2Hb F = α2 γ2
Hb A = α2 β2
Hb A2 = α2 δ2
Эмбриональная гетерогенность обусловлена изменяющимися
потребностями развивающегося организма
23
24.
1.с первой недели развития у эмбриона синтезируется эмбриональныйгемоглобин Нb Р α2 ε2 (от англ. preventive – превентивный,
предварительный), состоящий из двух α- и двух ε-глобиновых цепей. У
него очень высокое сродство к кислороду, но малая способность его
удерживать и транспортировать. Цепи ε образуются только в первом
триместре беременности, т.е. ген ε кроме это времени больше
никогда не работает;
2. с 3-4 недели начинает синтезироваться и к четвертому месяцу
достигает максимума глобин γ, т.е. в это время на смену
эмбриональному приходит фетальный гемоглобин Hb F α2 γ2 , сродство
к кислороду у него ниже, но способность его удерживать и
транспортировать выше, чем у эмбрионального (размер плода больше,
но и снабжение кислородом через плаценту лучше);
3.во втором триместре начинают нарабатываться цепи β и образуется
взрослый гемоглобин Hb A α2 β2 (от англ. аdult – взрослый), сродство к
кислороду у него ещѐ ниже, зато способность к транспорту
значительно выше.
К моменту рождения ребѐнка в его крови 80% Hb F и 20% Hb А, к 1-1,5
месяцам – 50 и 50%, к 6 месяцам ген γ затухает и в крови ребѐнка (а
потом и взрослого) остаѐтся около 1% фетального гемоглобина
(минорный компонент). Незадолго до рождения происходит активация
гена δ и образуется второй минорный гемоглобин Нb А2 α2δ2
24
25. Эмбриональная гетерогенность Нb
αα
γ
β
ε
β
δ
γ
β-подобные цепи гемоглобина
α-цепи гемоглобина
22
26. Гетерогенность, обусловленная минорными компонентами
Hb A = α2 β296-98%
Hb F = α2 γ2
1-2%
Hb A2 = α2 δ2
1-2%
У взрослого человека основным гемоглобином является Нb A, но
имеет место гетерогенность, обусловлена наличием минорных
гемоглобинов
23
27. Нормальные формы гемоглобина
HbР (primitive)примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в
эмбрионе между 7-12 неделями жизни
HbF (foetal)
фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12
недель внутриутробного развития и является основным после 3
месяцев
HbA (adult)
гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи,
у плода появляется через 3 месяца жизни и к рождению составляет
80% всего гемоглобина
HbA2
гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи
HbO2
оксигемоглобин
образуется при связывании кислорода в легких, в легочных венах
его 94-98% от всего количества гемоглобина
HbСO2
карбгемоглоби
н
образуется при связывании углекислого газа в тканях, в венозной
крови составляет 15-20% от всего количества гемоглобина
28. Патологические формы гемоглобина
HbSгемоглобин серповидно-клеточной анемии.
Форма гемоглобина, включающая трехвалентный ион железа вместо
двухвалентного. Такая форма образуется спонтанно, при
взаимодействии молекулы O2 и гемового Fe2+, но обычно
ферментативных мощностей клетки хватает на его восстановление.
MetHb
При использовании сульфаниламидов, употреблении нитрита
метгемоглобин
натрия и нитратов пищевых продуктов, при недостаточности
аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+.
Образующийся metHb не способен связывать кислород и возникает
гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике
используют аскорбиновую кислоту и метиленовую синь
Hb-CO
Карбоксигемоглобин, образуется при наличии СО (угарный газ) во
вдыхаемом воздухе. Он постоянно присутствует в крови в малых
концентрациях, но его доля может колебаться от условий и образа
жизни. Карбоксигемоглобин присутствует и в норме в количестве
0,5-1,5%
HbA1С
гликозилирова
HbA1С – гликозилированный гемоглобин. Концентрация его
нарастает при хронической гипергликемии и является хорошим
29.
Высокое содержание О2 в эритроцитах является причинойобразования большого количества активных форм кислорода;
неферментативное окисление гемоглобина в метгемоглобин истоячник активных форм кислорода.
Также свободнорадикальное окисление (СРО) в эритроците
стимулируют различные окислители
Образующиеся активные формы кислорода запускают реакции
СРО, которые приводят к разрушению органических молекул и
являются причиной старения
Ферментативная антиоксидантная система сдерживает СРО. Для
ее работы необходим глутатион и НАДФН2:
Супероксиддисмутаза(Cu2+ иZn2+) превращает супероксидные
анионы в перекись водорода: 2О∙2 + 2H+ → H2O2+ O2
Каталаза- геминовый фермент, разрушает перекись водорода до
воды и кислорода: 2Н2О2 → H2O+ O2
Глутатионпероксидаза(селен) при окислении глутатиона
разрушает перекись водорода и гидроперекиси липидов до воды:
Н2О2+ 2 GSh → 2 Н2О + G-S-S-G.
G-S-S-G + НАДФН2 → 2 GSh + НАДФ+. (Глутатионредуктаза)
30.
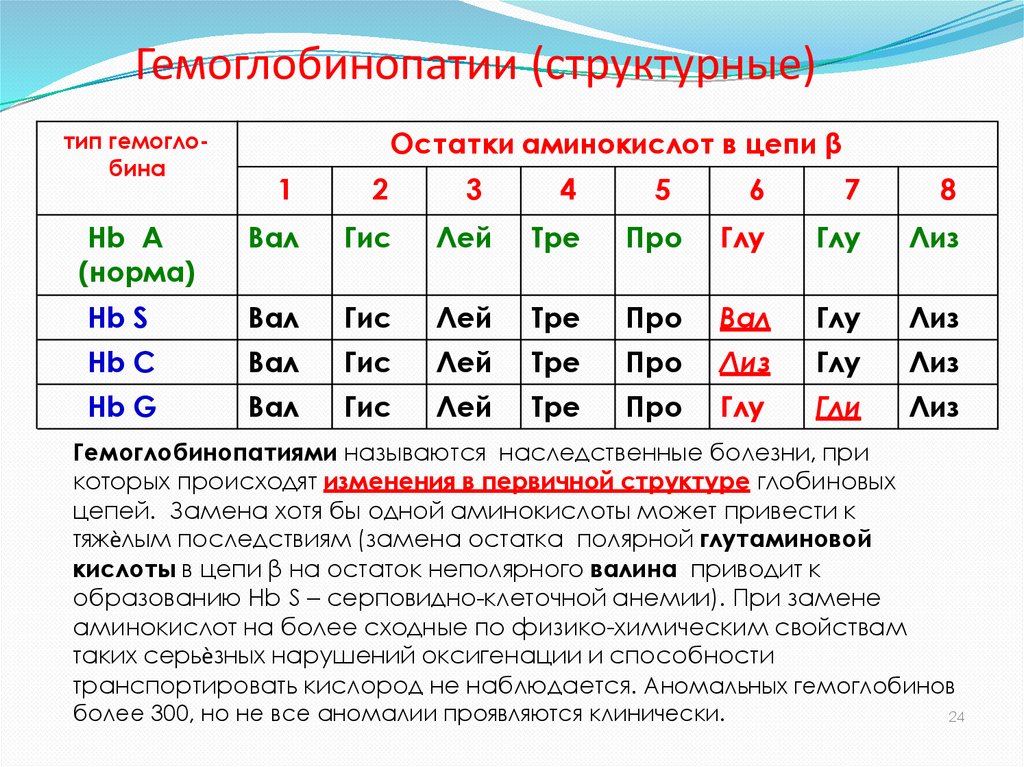
31. Гемоглобинопатии (структурные)
тип гемоглобинаОстатки аминокислот в цепи β
1
2
3
4
5
6
7
8
Hb A
(норма)
Вал
Гис
Лей
Тре
Про
Глу
Глу
Лиз
Hb S
Вал
Гис
Лей
Тре
Про
Вал
Глу
Лиз
Hb C
Вал
Гис
Лей
Тре
Про
Лиз
Глу
Лиз
Hb G
Вал
Гис
Лей
Тре
Про
Глу
Гли
Лиз
Гемоглобинопатиями называются наследственные болезни, при
которых происходят изменения в первичной структуре глобиновых
цепей. Замена хотя бы одной аминокислоты может привести к
тяжѐлым последствиям (замена остатка полярной глутаминовой
кислоты в цепи β на остаток неполярного валина приводит к
образованию Нb S – серповидно-клеточной анемии). При замене
аминокислот на более сходные по физико-химическим свойствам
таких серьѐзных нарушений оксигенации и способности
транспортировать кислород не наблюдается. Аномальных гемоглобинов
более 300, но не все аномалии проявляются клинически.
24
32. Гемоглобинопатии
Hb A = α2 β2HbKansas = β 102асп→тре
HbHiroshima = β 146гис→асп
Hb F = α2 γ2
HbBart = γ4
Hb H = β4
талассемии
(регуляторные)
Талассемии – нарушения соотношения синтеза нормальных
глобиновых цепей. Для талассемий характерно снижение
синтеза α-цепей гемоглобина (α-талассемия) или β-цепей (βталассемия). Это приводит к нарушению эритропоэза, гемолизу и
тяжелым анемиям.
32
33.
Талассемия — заболевание, распространённое всредиземноморских странах, характеризуется значительным
повышением содержания HbF в крови.
При этом образование нормального гемоглобина HbA подавлено.
Нарушено также образование гема.
Различают большую, малую и минимальную талассемию. При
гетерозиготном наследовании - малая, или минимальная, при
гомозиготном — большая.
Для всех форм талассемии характерно наличие в крови
«мишеневидных» эритроцитов, в которых гемоглобин расположен
в центре клетки в виде мишени.
Признаки серповидноклеточной анемии и талассемии (задержка
общего развития, анемия, желтушность, увеличение печени,
селезёнки, изменения костей скелета) появляются с раннего
детства. Осложнением серповидноклеточной анемии являются
тромбозы сосудов кишечника, пигментные камни в жёлчных
путях
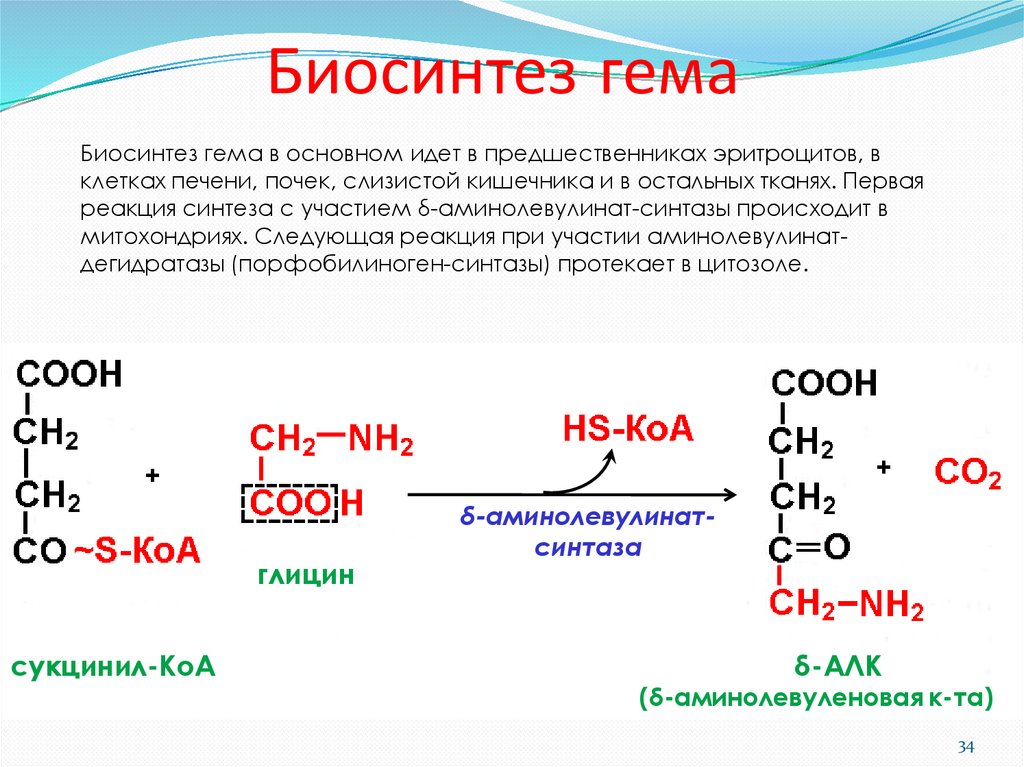
34. Биосинтез гема
Биосинтез гема в основном идет в предшественниках эритроцитов, вклетках печени, почек, слизистой кишечника и в остальных тканях. Первая
реакция синтеза с участием δ-аминолевулинат-синтазы происходит в
митохондриях. Следующая реакция при участии аминолевулинатдегидратазы (порфобилиноген-синтазы) протекает в цитозоле.
+
+
глицин
сукцинил-КоА
δ-аминолевулинатсинтаза
δ-АЛК
(δ-аминолевуленовая к-та)
34
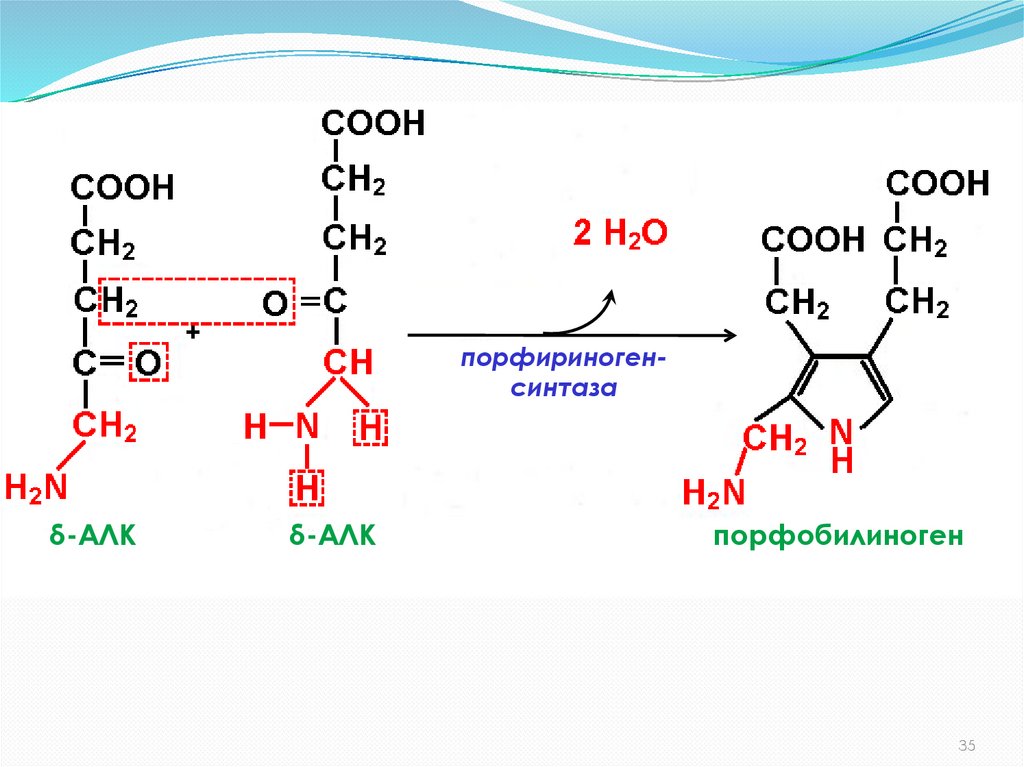
35.
+δ-АЛК
порфириногенсинтаза
δ-АЛК
порфобилиноген
35
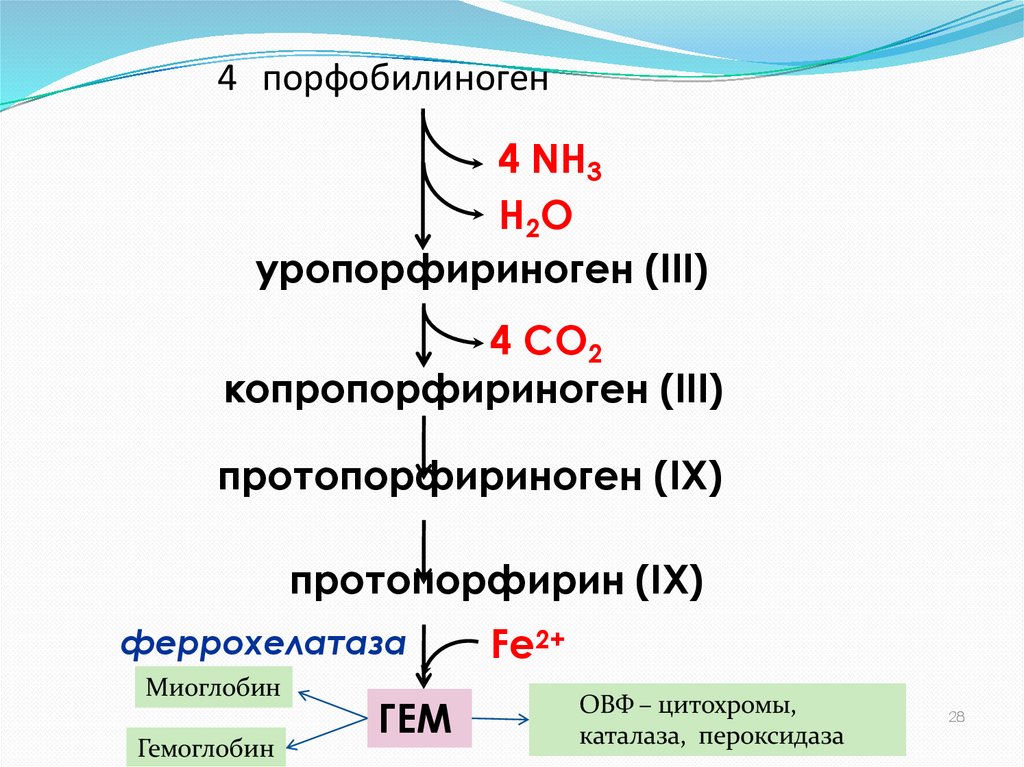
36. 4 порфобилиноген
4 NH3H2O
уропорфириноген (III)
4 СО2
копропорфириноген (III)
протопорфириноген (IХ)
протопорфирин (IХ)
феррохелатаза
Миоглобин
Гемоглобин
ГЕМ
Fe2+
ОВФ – цитохромы,
каталаза, пероксидаза
28
37. Регуляция синтеза гема
□ Гем – аллостерический ингибиторлевулинатсинтазы
□ Активаторы синтеза гема:
• ионы железа,
• внутриклеточная гипоксия,
жирорастворимые вещества,
стероиды
Образование гемоглобина
37
38. Нарушения обмена гемоглобина
количественныеснижение
содержания
Hb
(анемии)
повышение
качественные
нарушения
обмена
глобина
нарушения
обмена
гема
порфирии
гемоглобинопатии
(нарушения первичной
структуры глобина)
талассемии
(нарушения
соотношения
нормальных цепей
глобинов)
38
39. Анемии
Анемии – группа заболеваний, обусловленныхуменьшением количества эритроцитов в крови,
снижением содержания в них гемоглобина или
уменьшением количества циркулирующей крови
Причины анемий:
□ Повышенный гемолиз эритроцитов
□ Нарушенный синтез эритроцитов или гемоглобина
□ Кровопотери
Проявления анемий
□ Снижение кислородной емкости крови
□ Гипоксия тканей
□ Переключение аэробных процессов на анаэробные
□ Развитие гипоэнергетического состояния
□ Метаболические нарушения в тканях
40. Формы железа в организме
Транспортноетрансферрин (Fe3+)
(содержание
в крови 9-29 ммоль/л)
Резервное
ферритин (Fe3+)
гемосидерин (Fe3+)
Функционально-
активное
(гем – Fe2+)
гемоглобин – транспорт О2
кровью
миоглобин – резерв О2
дыхательные ферменты –
усвоение О2 на
молекулярном уровне
36
41. Белковые фракции крови
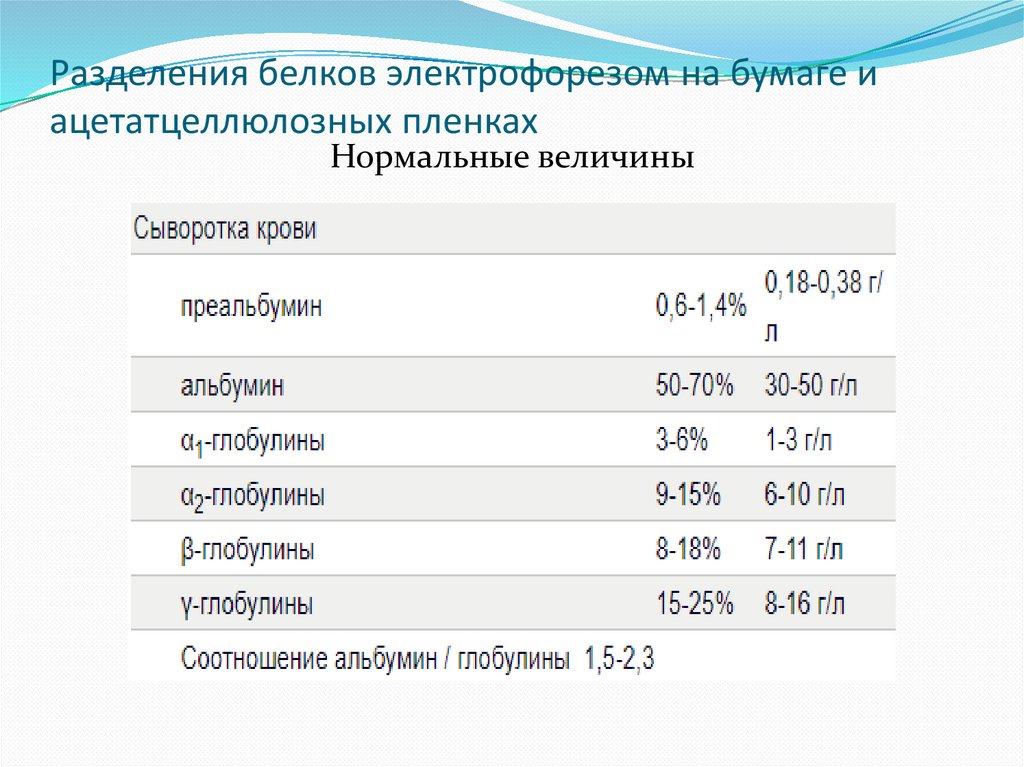
Белковые фракции представляют собой совокупность различныхгрупп белков, которые в сумме составляют общий белок крови. К ним
относятся альфа-1 и альфа 2, бета-1 и бета-2 глобулины и гаммаглобулин, а также альбумин. Эти фракции находятся в определенном
качественном и количественном соотношении.
Состав и количество фракций белков в биологических жидкостях
зависит от применяемого метода фракционирования: осаждение,
электрофоретическое фракционирование, иммунологические методы,
седиментационный анализ, хроматография, гель-фильтрация.
Наиболее распространенным методом фракционирования является
электрофорез, основанный на разной скорости движения белков в
электрическом поле, в зависимости от величины заряда и
молекулярной массы.
Количество выделяемых фракций определяется условиями
проведения электрофореза и качеством поддерживающей средыа (на
бумаге и пленках ацетата целлюлозы выделяют 5 фракций, в то время
как в полиакриламидном геле — до 20 и более.
При использовании более совершенных методов (радиальная
иммунодиффузия, иммуноэлектрофорез и других) в составе
глобулиновых фракций выявляются многочисленные
индивидуальные белки
42. Разделения белков электрофорезом на бумаге и ацетатцеллюлозных пленках
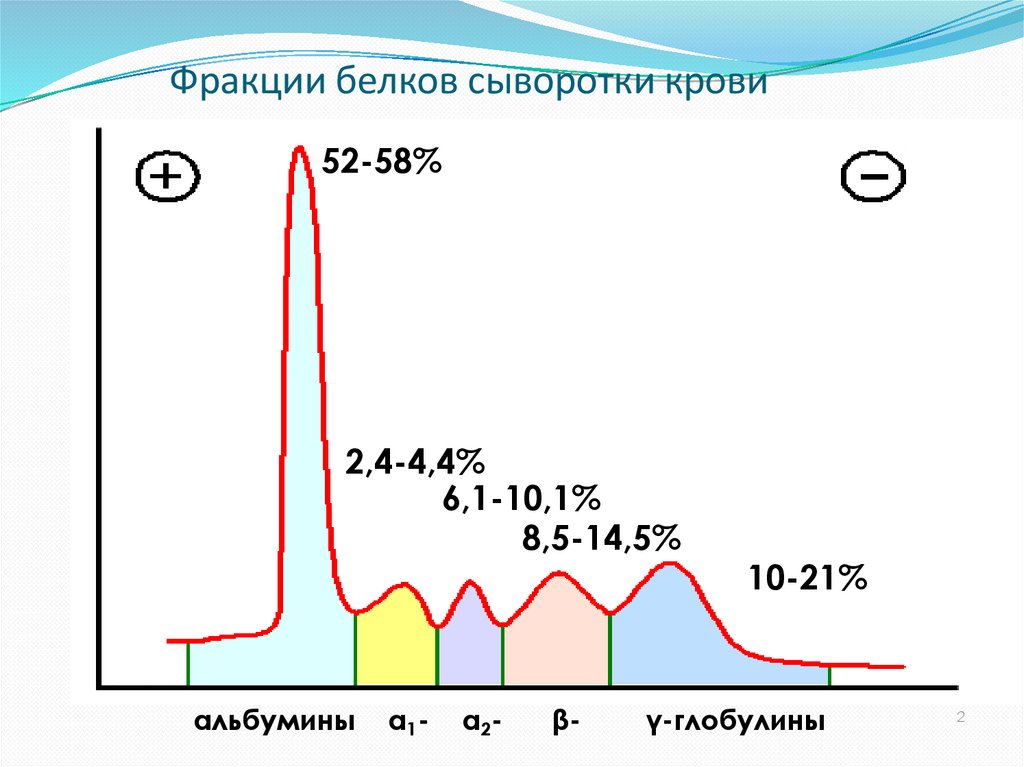
Нормальные величины43. Фракции белков сыворотки крови
52-58%2,4-4,4%
6,1-10,1%
8,5-14,5%
альбумины
α1-
α2-
β-
10-21%
γ-глобулины
2
44. Функции белков сыворотки крови
В норме в крови содержится 65-80 г/л белка. Соотношениефракций альбуминов и глобулинов составляет от 1,6-2,0.
Функции белков сыворотки крови
□ Поддержание онкотического давления (связывание воды и
удержание её в сосудистом русле)
□ Поддержание кислотно-основного состояния (белковая
буферная система)
□ Транспорт плохо растворимых веществ (металлов –
трансферрин, церуллоплазмин, жирных кислот и билирубина –
альбумины и т.д.)
□ Защитная функция – иммунохимическая защита γ-глобулинами ,
свёртывание крови, система комплимента и пр.
□ Белки придают крови вязкость, т.е. от них зависит гемодинамика.
□ При длительном белковом голодании являются резервом
аминокислот для организма.
44
45.
Нарушения белкового составакрови
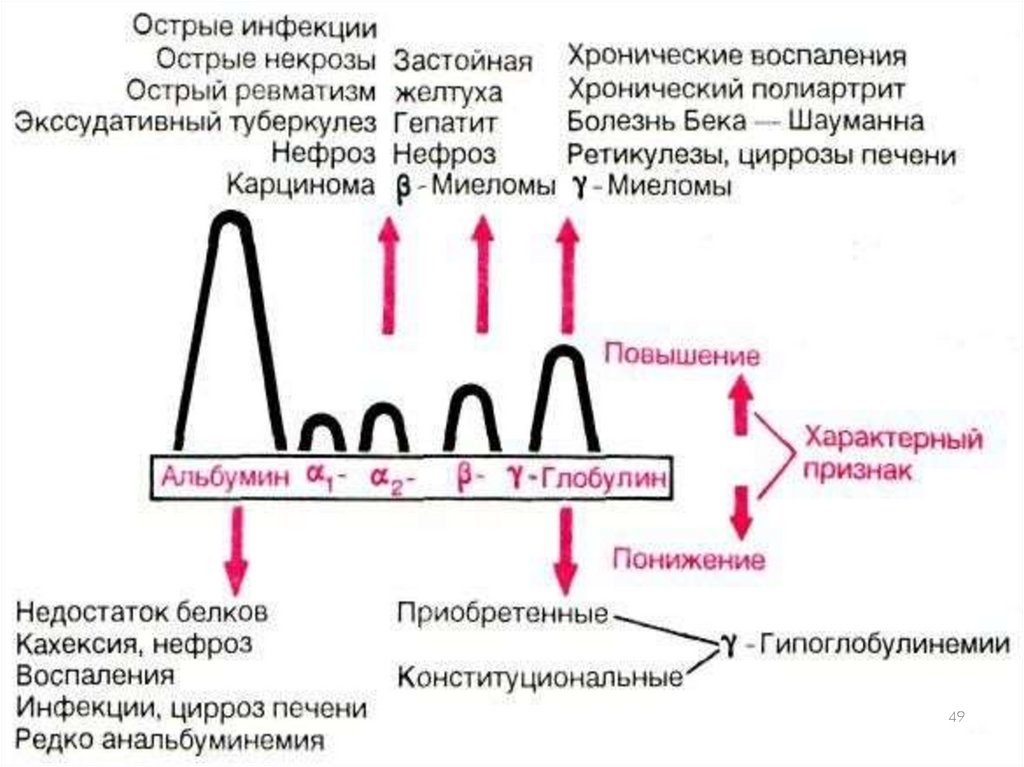
□ Гипопротеинемия
□ Гиперпротеинемия
□ Диспротеинемия
□ Дефектопротеинемия
□ Парапротеинемия
45
46. Гипопротеинемия
Истинная (абсолютная) cвязана с:недостаточным потреблением белка с пищей — заболевания
желудочно-кишечного тракта, сужение пищевода (опухоли), недоедание,
полное или частичное голодание.
снижением синтеза белка — несбалансированный аминокислотный
состав пищи, хронические паренхиматозные гепатиты, интоксикации,
злокачественные новообразования, лечение кортикостероидами.
усиленным распадом — кахексия, тяжелые инфекции, длительные
воспалительные процессы, лихорадочные состояния, тиреотоксикозы.
потерей белка — нарушения проницаемости капиллярных стенок,
кровоизлияния, ожоги, острые и хронические кровотечения,
нефротический синдром и гломерулонефриты.
Относительная связана с нарушением водного баланса —
гипергидратацией при гиперальдостеронизме, при почечной
недостаточности со снижением экскреции солей, при использовании
для питья морской воды, при неадекватных инфузиях солевых растворов.
Гипопротеинемия обычно сопровождается уменьшением фракции
альбуминов крови (разведение).
46
47. Гиперпротеинемия
Истинное повышение концентрации белка в крови обычносопровождается увеличением фракции глобулинов. Встречается
при острых инфекциях– увеличение синтеза белков острой фазы,
при хронических — за счет γ-глобулинемии, при миеломной
болезни, лимфогрануломатозе, саркоидозе.
Относительная гиперпротеинемия вызывается потерями
внутрисосудистой жидкости в результате профузных поносов
(например, при холере), усиленном потоотделении,
неукротимой рвоте, несахарном диабете, тяжелых и обширных
ожогах, генерализованных перитонитах.
47
48. Диспротеинемия – изменение соотношения отдельных
белковых фракций плазмы крови, хотя общее содержаниебелка остается в пределах нормы.
Дефектопротеинемия – генетически обусловленное
отсутствие какой-либо из фракций белков плазмы или
отдельного белка (анальбуминемия, а-γ-глобулиниемия,
отсутствие церуллоплазмина при болезни ВильсонаКоновалова)
Парапротеинемия ̶ появление в крови структурно
аномальных и функционально неполноценных белковых тел из
группы иммуноглобулинов при миеломной и некоторых других
болезнях.
48
49.
4950. Остаточный азот плазмы крови –
это низкомолекулярные азотсодержащие веществаплазмы (т.е. которые остались после удаления белков –
высокомолекулярных азотсодержащих веществ).
Главными компонентами этой фракции являются конечные
продукты азотистого обмена (мочевина, мочевая кислота,
гиппуровая кислота, индикан) и свободные аминокислоты.
В норме содержание остаточного азота составляет
14-25 ммоль/л. Превышение этого значения – азотемия.
Азотемия, также как уремия, бывает продукционная
(связанная с повышенным распадом азотсодержащих
веществ, в первую очередь белков) и ретенционной,
связанной с нарушением выведения остаточного азота из
организма (см. лекцию Обмен белков-3)
50
51. Гемостаз – это совокупность механизмов, которая обеспечивает:
• быструю остановку кровотечения и предотвращениекровопотери при повреждении кровеносных сосудов –
тромбоцитарный и коагуляционный гемостаз (свертывающая
система),
• поддержание жидкого состояния крови внутри сосудов
(антикоагулянтная система),
• удаление образовавшегося при коагуляции тромба
(фибринолитическая система).
Как для коагуляции, так и для поддержания жидкого состояния
крови требуются многочисленные вещества, часто
называемые факторами коагуляции или фибринолиза, или
антикоагуляции. Синтез этих веществ осуществляется в
тромбоцитах, эндотелиоцитах, фибробластах, моноцитах.
Многие белки гемостаза синтезируются в печени.
51
52. Плазменные факторы свёртывания крови
Тромбоцитарные факторы свёртывания кровиобозначаются: ф.1-11 или Р1-11
52
53. Общие особенности
плазменных факторов гемостаза:1. Практически все они находятся в крови в неактивной форме
и только небольшое количество (около 1-2%) фактора VII
циркулирует в активном виде.
2. Активация белков гемостаза происходит по
механизму частичного (ограниченного) протеолиза.
Ограниченный протеолиз способны осуществлять
ферментативные факторы II, VII, IX, X, XI, XII, плазмин.
3. Реакции свертывания не могут происходить
непосредственно в кровотоке, им требуется отрицательно
заряженная твердая поверхность – мембраны
активированных тромбоцитов, фибробластов, макрофагов,
бактерий и др.
4. Многие реакции также нуждаются в наличии ионов кальция,
который обеспечивает связывание факторов свертывания с
поверхностью мембран.
53
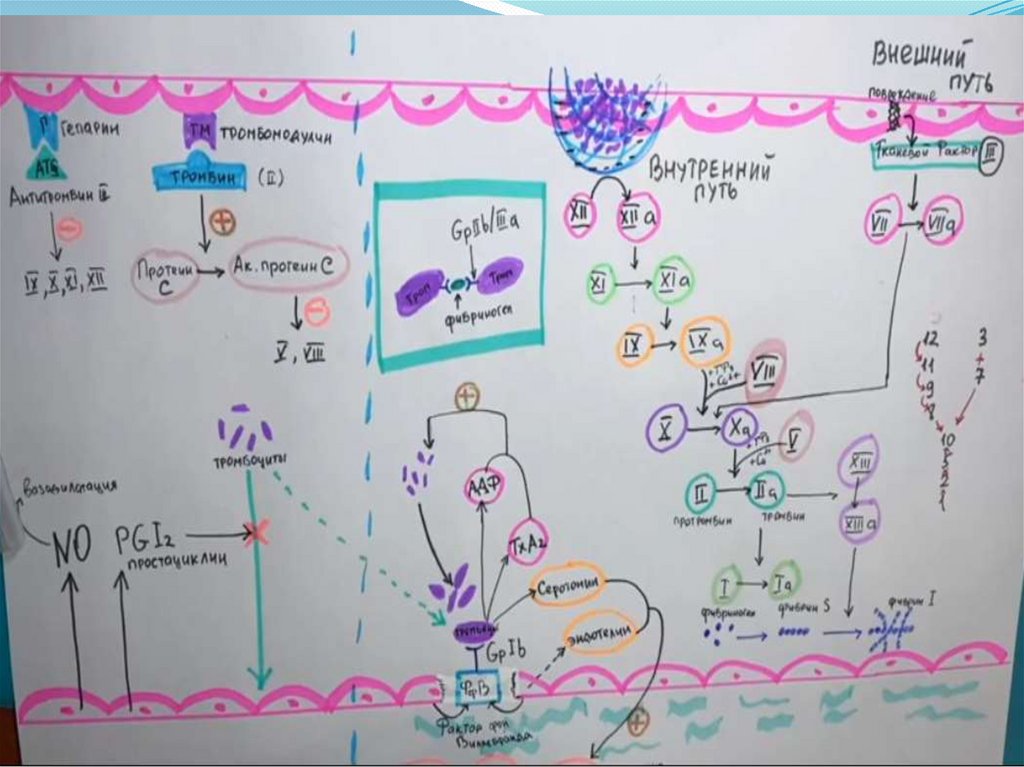
54. Общая схема каскада гемокоагуляции
В упрощённом виде каскад реакций тромбообразования можно представитьтак: при повреждении сосуда запускаются два независимых пути – внешний и
внутренний. При этом происходит последовательная активация факторов
свёртывания и образуются комплексы веществ – внешний (VIIa + III + ф.3 + ионы
кальция) и внутренний (IХa + VIIIa + ф.3 + ионы кальция) активаторы,
необходимые для превращения препротромбиназы (Х фактора, фактора
Прауэра-Стьюарта) в активную протромбиназу (Ха). Протромбиназа в свою
очередь превращает протромбин в активный тромбин
55.
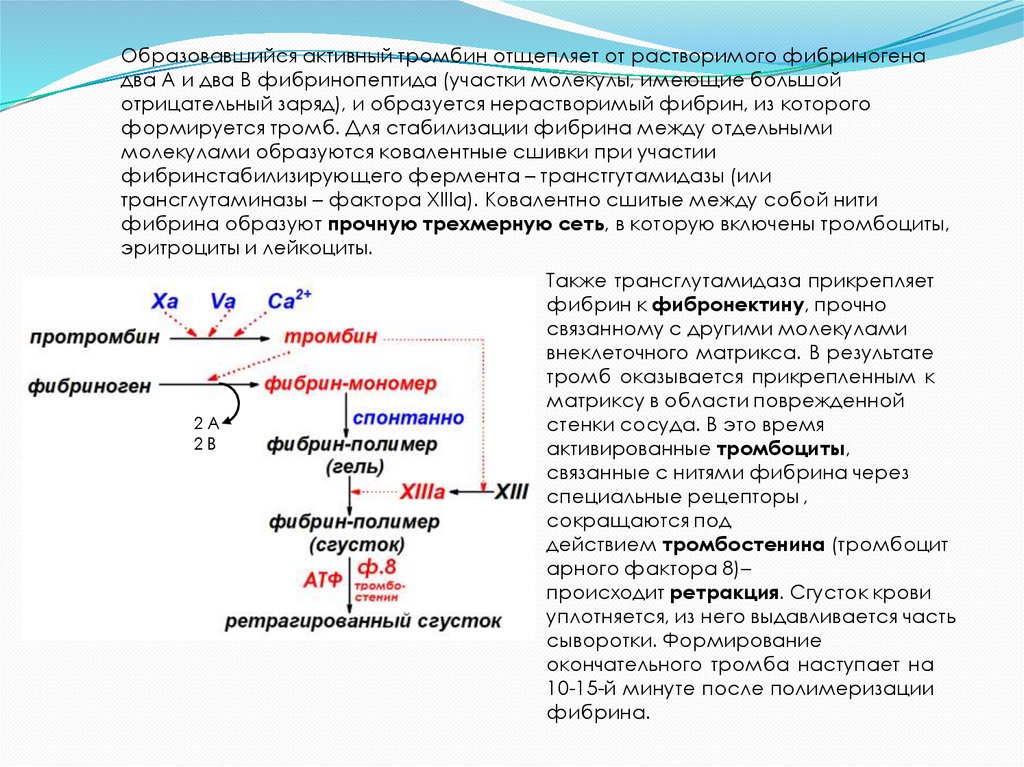
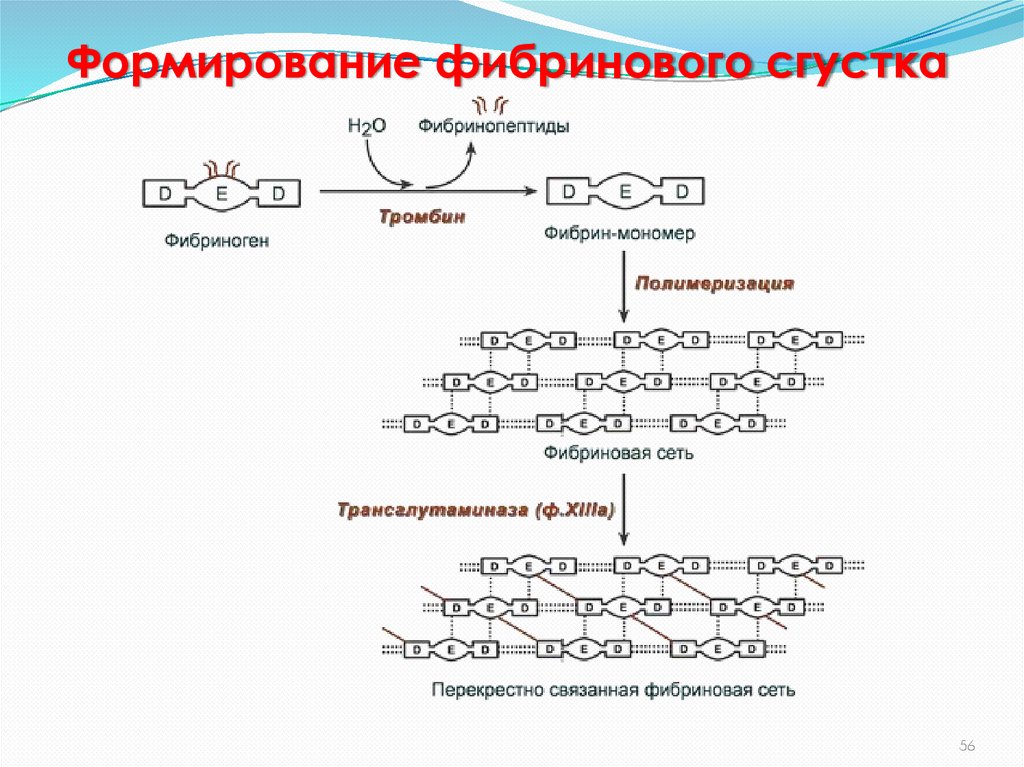
Образовавшийся активный тромбин отщепляет от растворимого фибриногенадва А и два В фибринопептида (участки молекулы, имеющие большой
отрицательный заряд), и образуется нерастворимый фибрин, из которого
формируется тромб. Для стабилизации фибрина между отдельными
молекулами образуются ковалентные сшивки при участии
фибринстабилизирующего фермента – транстгутамидазы (или
трансглутаминазы – фактора XIIIа). Ковалентно сшитые между собой нити
фибрина образуют прочную трехмерную сеть, в которую включены тромбоциты,
эритроциты и лейкоциты.
2А
2В
Также трансглутамидаза прикрепляет
фибрин к фибронектину, прочно
связанному с другими молекулами
внеклеточного матрикса. В результате
тромб оказывается прикрепленным к
матриксу в области поврежденной
стенки сосуда. В это время
активированные тромбоциты,
связанные с нитями фибрина через
специальные рецепторы ,
сокращаются под
действием тромбостенина (тромбоцит
арного фактора 8)–
происходит ретракция. Сгусток крови
уплотняется, из него выдавливается часть
сыворотки. Формирование
окончательного тромба наступает на
10-15-й минуте после полимеризации
фибрина.
56. Формирование фибринового сгустка
5657. Действие фибринстабилизирующего фактора
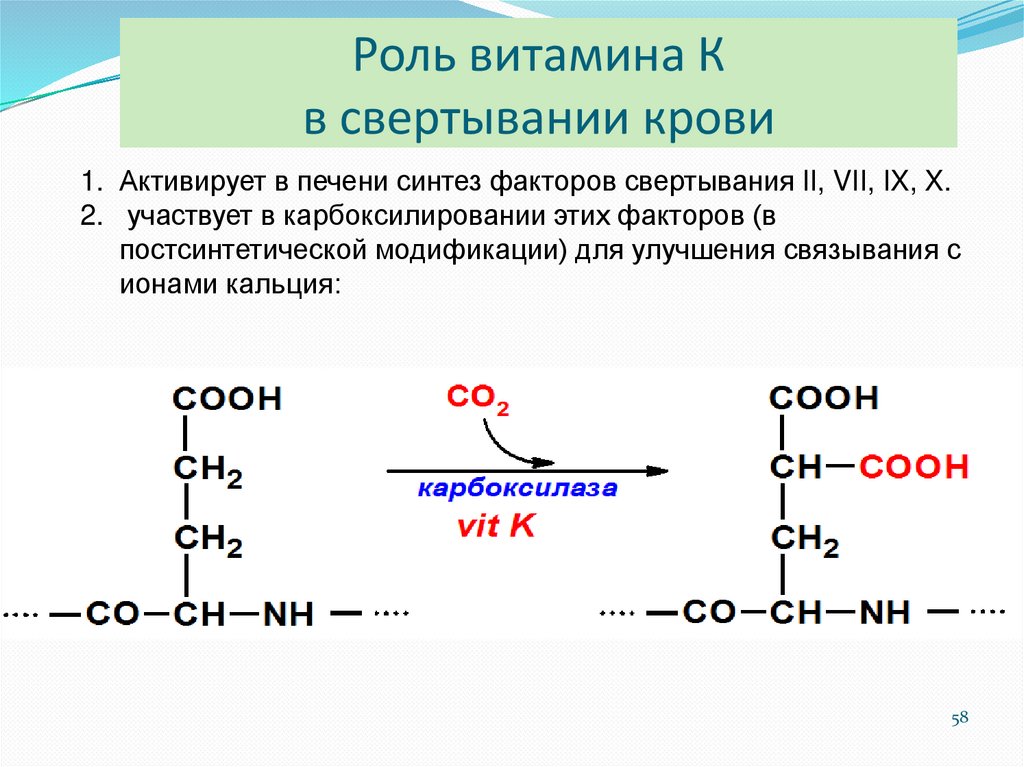
5758. Роль витамина К в свертывании крови
1. Активирует в печени синтез факторов свертывания II, VII, IX, X.2. участвует в карбоксилировании этих факторов (в
постсинтетической модификации) для улучшения связывания с
ионами кальция:
58
59.
60. Ингибиторы ферментов свертывания крови
6061. Антикоагулянтая система (две группы антикоагулянтов)
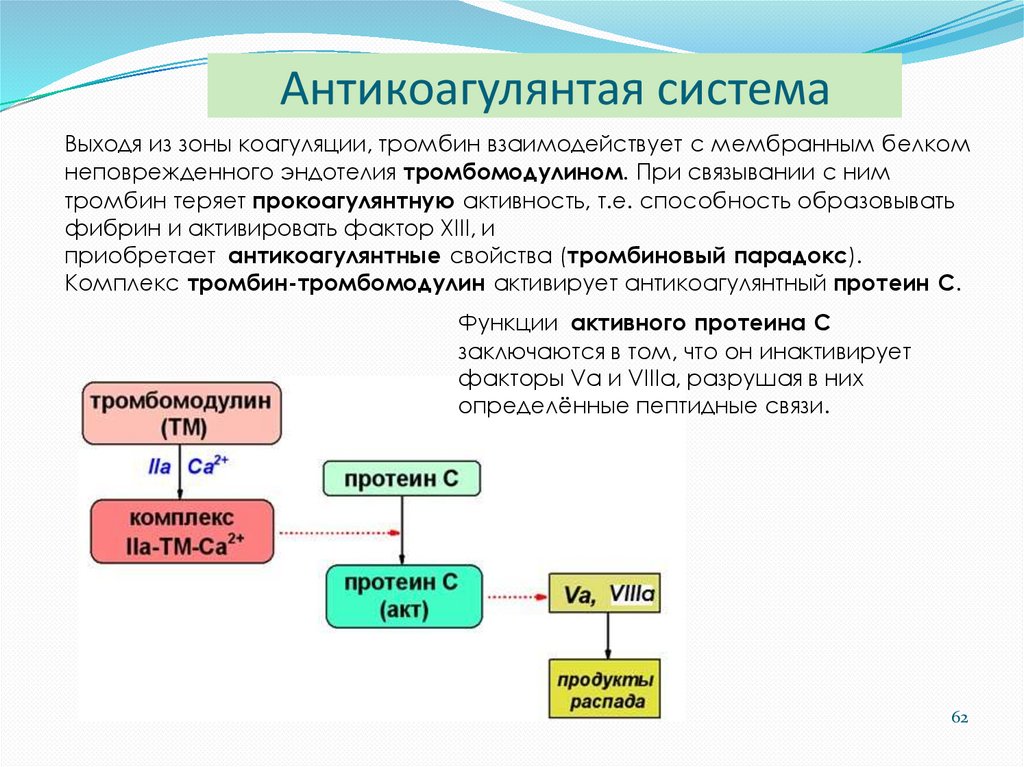
6162. Антикоагулянтая система
Выходя из зоны коагуляции, тромбин взаимодействует с мембранным белкомнеповрежденного эндотелия тромбомодулином. При связывании с ним
тромбин теряет прокоагулянтную активность, т.е. способность образовывать
фибрин и активировать фактор XIII, и
приобретает антикоагулянтные свойства (тромбиновый парадокс).
Комплекс тромбин-тромбомодулин активирует антикоагулянтный протеин С.
Функции активного протеина С
заключаются в том, что он инактивирует
факторы Vа и VIIIа, разрушая в них
определённые пептидные связи.
62
63. Фибринолитическая система
Ретрагированный сгусток фибрина в организме человека иживотных под влиянием протеолитического фермента плазмы
крови – плазмина подвергается постепенному рассасыванию с
образованием ряда растворимых в воде продуктов гидролиза –
пептидов. В норме плазмин находится в крови в форме
неактивного предшественника – плазминогена.
плазминоген
прекалликреин
XIIa, ВМ К
калликреин
плазмин
фибриноген
Плазминоген активируется при
участии калликреина, который
образуется из своего
неактивного предшественника прекалликреина под действием
высокомолекулярного
кининогена (ВМК) и фактора
Хагемана (XIIа)
фибрин
продукты
деградации
фибрина (ПДФ)
63
64. Ингибиторы фибринолиза
□ α2-антиплазмин□ α2-макроглобулин
□ Ингибиторы активаторов
плазминогена
64
65. – коагулопатии
Нарушения свёртивания крови– коагулопатии
врожденные
тромботические
состояния
вторичные
геморрагические
состояния
ДВС
65
66. Заболевания, связанные с гипокоагуляцией (геморрагии)
Тромбоцитопенииприобретенные, например, при ДВС-синдроме (повышенное
потребление тромбоцитов), системная красная
волчанка (повышенное разрушение тромбоцитов),
Наследственные тромбоцитопении.
Гемофилия А – рецессивное заболевание, связанное с
врожденным дефицитом фактора VIII и нарушением активации
плазменных фактора IX и, следовательно, фактора X.
Гемофилия В – аутосомно-рецессивное заболевание, связанное
с врожденным дефицитом фактора IX и нарушением
активации плазменного фактора X.
Гемофилия С – заболевание, связанное с
врожденным дефицитом фактора XI и, следовательно,
нарушением активации плазменного фактора IX.
Распространена преимущественно среди евреев-ашкенази.
66
67. Заболевания, связанные с гиперкоагуляцией (тромботические состояния, тромбофилии)
Состояния, связанные с гиперкоагуляцией, встречаютсячасто, проявляются как тромбофилии и могут быть связаны с
наследственными и приобретенными факторами –
недостатком гепарина, гипергомоцистеинемией, при
гиповитаминозах В6, В9, В12.
ДВС-синдром –
диссеминированное внутрисосудистое свёртывание – это
патологический неспецифический процесс, характеризующийся
образованием тромбов в сосудах микроциркуляторного русла в
сочетании с несвёртываемостью крови, приводящей к
множественным массивным кровоизлияниям.
Может протекать бессимптомно или в виде остро
развившейся коагулопатии. Часто встречается при различной
акушерской патологии, различных видах шока, тяжёлых травмах,
бактериальном сепсисе.
67
68. Стадии ДВС-синдрома
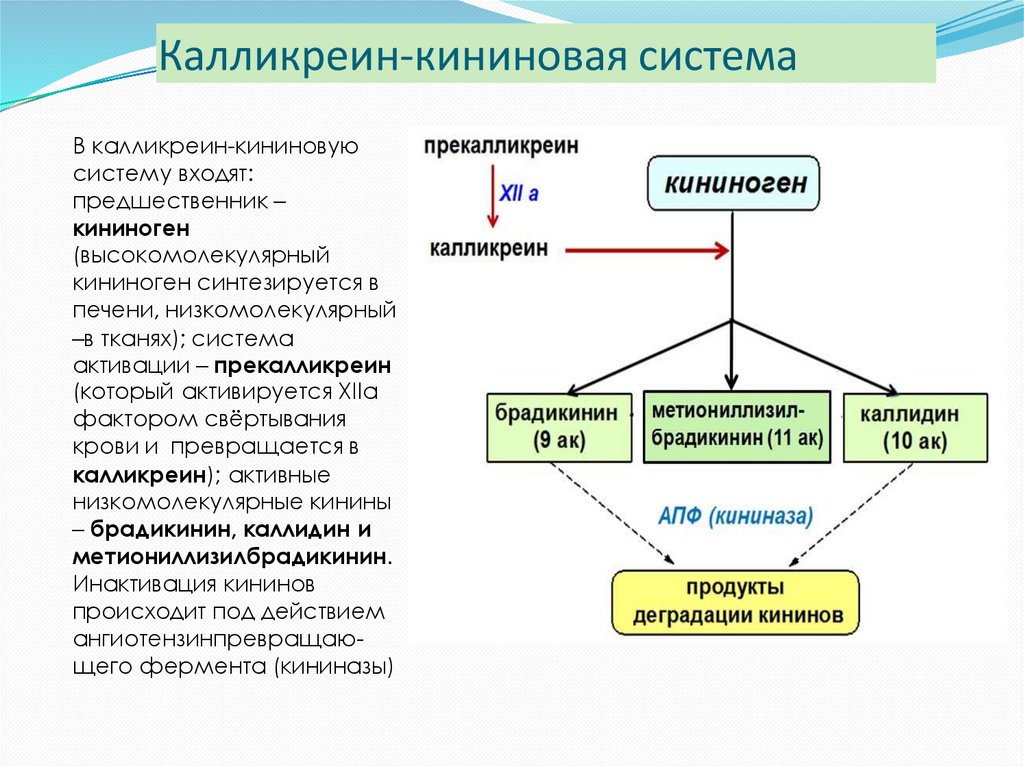
6869. Калликреин-кининовая система
В калликреин-кининовуюсистему входят:
предшественник –
кининоген
(высокомолекулярный
кининоген синтезируется в
печени, низкомолекулярный
–в тканях); система
активации – прекалликреин
(который активируется XIIa
фактором свёртывания
крови и превращается в
калликреин); активные
низкомолекулярные кинины
– брадикинин, каллидин и
метиониллизилбрадикинин.
Инактивация кининов
происходит под действием
ангиотензинпревращающего фермента (кининазы)
70.
Роль кининов□ расширяют сосуды (гипотензивное действие,
снижают АД),
□ оказывают болевой эффект,
□ участвуют в воспалительных реакциях,
□ способствуют выходу лейкоцитов (лейкопедез),
□ сокращают гладкую мускулатуру бронхов,
□ регулируют деятельность экзокринных желез,
□ способствуют выработке простагландинов.
70
71. Ферменты плазмы крови:
Секреторные синтезируются впечени и обеспечивают
функционирование крови –
ферменты системы гемостаза;
□ Индикаторные (клеточные,
органспецифические);
□ Экскреторные (поступающие в кровь
из жёлчи).
□
71
72.
Энзимодиагностика – это определение активности ферментов сдиагностической целью
фермент
примеры
использования
Лактатдегидрогеназа
(изофермент ЛДГ1)
Инфаркт миокарда
Аспартатаминотрансфераза
(АСТ)
Инфаркт миокарда
Аланинаминотрансфераза
(АЛТ)
Заболевания печени,
инфаркт миокарда
Креатинкиназа (КК)
(изофермент ММ – мышечный
тип, изофермент МВ –
сердечный тип)
Кислая фосфатаза
Прогрессирующая
дистрофия
Инфаркт миокарда
Рак предстательной
31
железы
73. Белки «острой фазы»
большая группа белков сыворотки крови, которыеобнаруживаются при многих патологических состояниях,
сопровождающихся воспалением и некрозом тканей.
В норме эти белки отсутствуют или содержатся в крайне
низких концентрациях, но их количество резко возрастает
при острых состояниях или при обострении хронического
заболевания.
□ С-реактивный белок (обнаруживается при многих
патологических состояниях, сопровождающихся воспалением
и некрозом тканей)
□ α2-макроглобулин
□ Антитрипсин
□ Гаптоглобин (количество значительно увеличивается при
внутрисосудистом гемолизе)
□ Криоглобулин (при миеломе, нефрозе, циррозе печени,
ревматизме, лимфосаркоме, лейкозах и других
заболеваниях).
32
74. Вопросы к лекции для письменного ответа
Какие функции выполняет кровь в организме? Опишите ее состави физико-химические свойства.
Опишите строение эритроцита, его мембранные белки.
В чем состоит особенность обмена глюкозы в эритроците?
Какие виды нормального и патологического гемоглобина вам
известны? Дайте каждому виду краткую характеристику
Какие белковые фракции крови вам известны?
Что такое остаточный азот плазмы крови?
Укажите особенности функционирования антикоагулянтной и
фибринолитической систем крови.
Какие виды нарушения работы свертывающей системы крови вам
известны?
В чем заключается особенность функционирования калликреинкининовой системы?
Какие белки относят к белкам «острой фазы»?





















































 biology
biology








