Similar presentations:
Биохимия форменных элементов крови. Химический состав и особенности метаболизма эритроцитов. Гемоглобин
1.
ГУ ЛНР Луганский Государственный медицинский университетимени Святителя Луки
Кафедра медицинской химии
Биохимия форменных элементов крови.
Химический состав и особенности
метаболизма эритроцитов. Гемоглобин.
Дыхательная функция крови.
кислотно-основное состояние организма
Луганск, 2022
2. План лекции
Эритроцит: особенности структуры, химического состава, метаболизма
белков, жиров, углеводов.
Гемоглобин и миоглобин: строение, функции, обмен, диагностическое
значение определения в крови и моче.
Производные и виды гемоглобина, особенности состава, строение,
функции, биологическое клиническое и диагностическое значение.
Эритроцит: пиридинзависимые реакции (НАД, НАДФ),
физиологическая роль, биохимические нарушения при их недостатке,
клинические проявления.
Механизмы транспорта О2 и СО2 кровью: реакции, биологическое
значение.
Эритроцит: пентозофосфатный и 2,3-дифосфоглицератный шунты
гликолиза (схема); особенности функционирования, причины и
последствия нарушений.
Эритроцит: система глутатиона, механизм действия, биологическое и
клиническое значение.
Гемоглобин (НbА2): строение, механизм связывания и отдачи О2
тканям, аллостерическая регуляция, значение.
Эритроцит: пути обмена углеводов (схема), их значение, причины и
последствия нарушений.
Эритроцит: механизм образования активных форм кислорода,
метгемоглобина и антиоксидантной защиты.
3. Эритроциты
форменные элементы крови
образуются в костном мозге,
циркулируют в крови около 100-120 дней,
разрушаются макрофагами в селезёнке,
печени, и костном мозге.
обновляется в сутки 1% эритроцитов
В организме около 25*1012 эритроцитов.
Концентрация у ♂ 3,9*1012 - 5,5*1012 /л,
у ♀ - 3,7*1012 - 4,9*1012/л.
эритропоэз стимулирую андрогены,
тормозят женские половые гормоны.
4.
5. ФУНКЦИИ ЭРИТРОЦИТОВ
1. Газообмен: транспорт О2 и СО22. Регуляция КОС
3. Адсорбция и транспорт на клеточной
мембране различных веществ
(аминокислот, антител, токсинов, лекарств).
4. Участвуют в регуляции вязкости крови,
вследствие пластичности (вязкость крови в
мелких сосудах меньше, чем крупных).
5. Участвуют в свертывании крови, выделяя
эритроцитарные факторы свертывания
(эритроцитин)
6. Строение эритроцита
• безъядерные клетки, утратившие ядро и большинство органелл,имеют цитоплазму и плазмолемму (клеточную мембрану), толщиной
около 20 нм.
• 80% имеют форму дискоцитов (максимальный газообмен, большая
пластичность при прохождении капилляров).
• Диаметр от 7,1 до 7,9 мкм,
• толщина в краевой зоне - 1,9 - 2,5 мкм, в центре - 1 мкм.
• Поверхность равна 125 мкм2, а объём (MCV) – 75-96 мкм3.
I. Цитоплазма эритроцита:
60 % вода
40% сухой остаток
5 % - органические
и неорганические вещества
95% гемоглобин
7.
II. ПлазмолеммаЛипиды:
холестерин
Внешний слой:
• фосфатидилхолин,
• сфингомиелин,
• Гликолипиды 5%.
Внутренний слой:
• фосфатидилсерин
• фосфатидилэтаноламин
Углеводы:
• Олигосахариды
гликолипидов и
гликопротеидов
образуют
гликокаликс
Белки (15 шт):
• Спектрин
• Актин
• Белок 3 полосы
• Гликофорин
• Белок полосы 4.1
• Анкирин
• Na+/K+-АТФ-аза
• Са2+-АТФ-аза
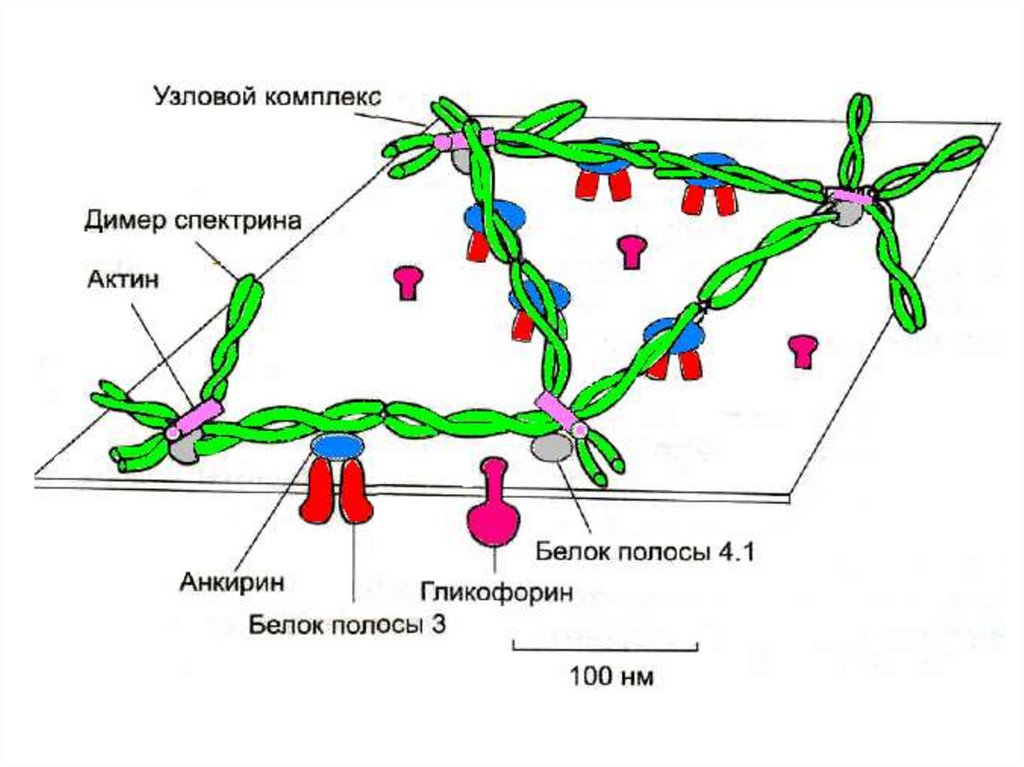
8. Часть белков плазмолеммы образуют цитоскелет
Строение• фибриллярный белок спектрин образует сеть
• глобулярные белки, пронизывающие мембрану:
гликофорин , белок полосы 3, белок полосы 4.1,
актин, анкирин фиксируют сеть спектрина на
мембране
Функция
1. придают эритроциту двояковогнутую форму и
высокую механическую прочность
2. Под действием различных факторов способны с
затратой АТФ изменять конформацию и в целом
- форму эритроцита
9.
олигосахаридHCO3-
Cl-
10.
11.
Самые распространенные мембранные белки (более60%) спектрин, гликофорин и белок полосы 3
Спектрин
• основной белок цитоскелета эритроцитов ( 25% массы
всех белков),
• имеет вид фибриллы 100нм, состоящей из 2
перекрученых друг с другом цепей α-спектрина и βспектрина.
• образуют сеть, которая фиксируется на
цитоплазматической стороне плазмалеммы с помощью
анкирина и белка полосы 3 или актина, белка полосы
4.1 и гликофорина.
Белок полосы 3
трансмембранный гликопротеид, полипептидная цепь
много раз пересекает бислой липидов, является
компонентом цитоскелета и анионным каналом, который
обеспечивает трансмембранный транспорт НСО3- и Сl-
12.
Гликофоринтрансмембранный гликопротеин (30 кДа),
пронизывает плазмолемму в виде
спирали. С наружной поверхности
эритроцита к нему присоединены 20 цепей
олигосахаридов, которые несут
отрицательные заряды. Формирует
цитоскелет и выполняют рецепторные
функции.
13.
Углеводы• олигосахариды гликолипидов и гликопротеидов, на
внешней поверхности плазмолеммы образуют
гликокаликс.
• Олигосахариды гликофорина являются
агглютиногенами (А и В) (определяют антигенные
свойства эритроцитов). Обеспечивают агглютинацию
эритроцитов под влиянием - и -агглютининов,
находящихся в составе -глобулинов.
• На поверхности эритроцитов имеется агглютиноген резус-фактор (Rh-фактор). Он присутствует у 86%
людей, у 14% - отсутствует.
14.
ОСОБЕННОСТЬ ОБМЕНА ВЕЩЕСТВИ ЭНЕРГИИ В ЭРИТРОЦИТЕ
• Эритроцит высокоспециализированная клетка,
хорошо приспособленная для транспорта газов.
• Для эритроцита не характерны анаболические
процессы.
• Необходимые структурные молекулы и
ферменты синтезируются заранее в процессе
дифференцировки и созревания эритроцитов
• Синтез АТФ из АДФ только в анаэробном
гликолизе
15. Особенности обмена нуклеотидов
1.2.
3.
4.
5.
рибозо-5ф + аденин → АМФ
АМФ + АТФ → АДФ + АДФ
АДФ + Фн → АТФ (гликолиз)
SH2 + НАД+ → S + НАДН2 (гликолиз)
SH2 + НАДФ+ → S + НАДФН2 (ПФШ)
16. Особенности обмена углеводов
ГлюкозаГЛЮТ-1
инсулиннезависим
Глюкоза
Гексокиназа
2,3 дифосфоглицератный шунт
2,3-ДФК
Сродство Нb к О2
Глюкозо-6ф
Анаэробный
гликолиз
АТФ, НАДН2
ПФШ
НАДФН2
Мембр. насосы
Синтез глутатиона Метгемогл.
Редукт.
Движ. цитоскелета
система
Антиоксид.
система
17.
АНТИОКИСЛИТЕЛЬНЫЕ ФЕРМЕНТЫСупероксиддисмутаза (СОД)
О*2 + О* -2 + 2Н+
Н2О2 + О2
Каталаза
2Н2О2
2Н2О + О2
Пероксидаза
Н2О2+ НО-S-ОН
Н2О + О= S=О
Глутатионпероксидаза (Se )
2GSH+ROOH
GSSG + ROH+ Н2О
Глутатионредуктаза
GSSG + НАДФ Н + Н+
2GSH + НАДФ+
(метод оценки ПРЭ)
18.
Обмен метгемоглобинаВ течение суток до 3% гемоглобина может
спонтанно окисляться в метгемоглобин:
b (Fe2+) MetHb (Fe3+) + ee- + О2 О2* (Супероксидный анион-радикал)
Восстановление MetHb до b осуществляет
метгемоглобинредуктазная система.
Она состоит из:
• цитохрома b5
• цитохром b5 редуктазы (флавопротеин),
• Для работы нужен НАДН2
MetHb(Fe3+) + цит b5 восст → Hb(Fe2+) + цит b5 окисл
цит b5 окисл + НАДН2 → цит b5 восст + НАД+
Цитохром b5 редуктаза
19.
Восстановлениеметгемоглобина
также
может
осуществляться
неферментативным путём за счёт
витамина В12, аскорбиновой кислоты или глутатиона
Mеt Hb (Fe3+)
аскорбиновая
к - та
GSSG
Н2О2
Hb ( Fe 2+)
дегидроаскорбиновая
к – та
GSH
Генетический
дефект
ферментов
гликолиза
и
метгемоглобинредуктазной системы приводит к накоплению
метгемоглобина и увеличению образования активных форм
кислорода. Те вызывают образование дисульфидных мостиков
между протомерами метгемоглобина, что приводит к их
агрегации
с
образованием телец
Хайнца. Последние
способствуют разрушению эритроцитов и гипоксии.
20. ОБРАЗОВАНИЕ ТЕЛЕЦ ХА ПРИ СЕРПОВИДНОКЛЕТОЧ НОЙ АНЕМИИ
21.
Насосы – потребители АТФNa+/K+-АТФ-аза - мембранный фермент
поддерживает градиент концентраци Na+ и К+
Патология (сфероцитоз): ↓Na+/K+-АТФ-азы
↑
Na+ в клетке ↑осмотического давления
↑ воды в эритроците ↑ гемолиз
(метод оценки ОРЭ)
Са2+-АТФ-аза - мембранный фермент, выводит
из эритроцитов кальций и поддерживает
трансмембранный градиент [Са2+]
22.
23. Особенности липидного обмена
В зрелом эритроците липиды не
синтезируются, эритроцит может
обмениваться липидами с липопротеинами
крови.
• Катаболизм липидов неферментативный,
повреждение и разрушение липидов
происходит в реакциях ПОЛ.
24. Особенности белкового обмена
В зрелом эритроците белки не
синтезируются, т.к. у него нет
рибосом, но в цитоплазме
синтезируется глутатион
Катаболизм белков
неферментативный, происходит под
действием неблагоприятных
факторов: СРО, взаимодействия с
тяжёлыми металлами и токсинами
25. Структура трипептида глутатиона (L-глутамил-L-цистеинилглицин, GSH)
26. Биосинтез глутатиона
• Глутатион синтезируется из аминокислот Lцистеина, L-глутаминовой кислоты и глицина.• Синтез происходит в две АТР-зависимые стадии:
1. Из L-глутамата и цистеина синтезируется γглутамилцистеин, фермент - γ-глутамилцистеин
синтетаза.
2. Глутатион синтетаза присоединяет глицин к Сконцевой группе γ -глутамилцистеина.
27. Особенность метаболизма при старении эритроцитов
↓ образование АТФНарушаются энергозависимые
процессы восстановления формы
эритроцитов сфероцитоз, гемолиз
↓ антиокислительная защита (АОЗ)
↓ повреждение клеточных мембран
гемолиз
↓ 2,3 ДФГ и ↑ сродство Hb к О2
↓ транспортная функция Hb
28. СТРОЕНИЕ ГЕМА
Гем - это порфирин, в центре которого находиться Fe2+.Fe2+ включается в молекулу порфирина с помощью 2 ковалентных и 2
координационных связей.
CH 3
HC
CH 2
CH 2
HC
CH 3
N
N
Fe2+
N
N
H3C
Молекула гема имеет плоское
строение. При окислении
железа, гем превращается в
гематин (Fe3+)
CH 3
CH 2
CH 2
CH 2
CH 2
COOH
COOH
29.
Гем является простетической группой многих белков:гемоглобина,
миоглобина,
цитохромов митохондриальной ЦПЭ, цитохрома Р450,
ферментов каталазы, пероксидазы, цитохромоксидазы,
триптофанпироллазы.
Наибольшее количество гема содержат эритроциты
(Hb), мышечные клетки (миоглобин) и клетки печени
(цитохром Р450).
Гемы разных белков могут содержать разные типы
порфиринов.
В
геме
гемоглобина
находится
протопорфирин IX, в состав цитохромоксидазы входит
формилпорфирин и т.д.
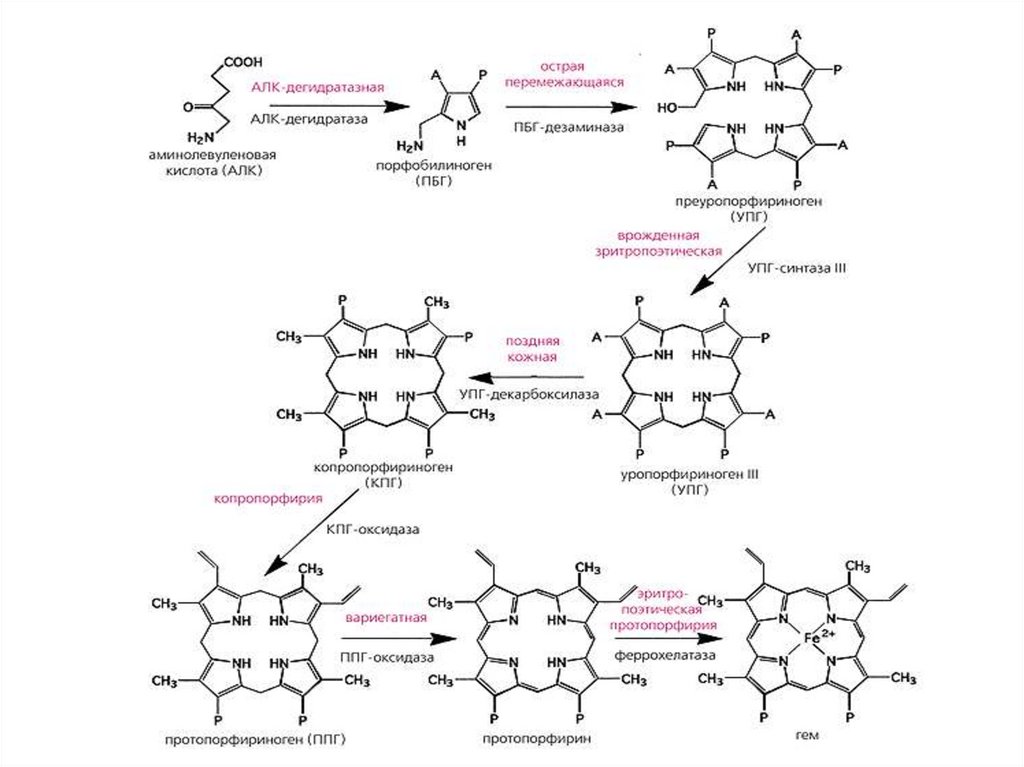
30. СИНТЕЗ ГЕМА
Гем синтезируется во всех тканях, но с наибольшей скоростьюв костном мозге и печени. В костном мозге гем необходим для
синтеза гемоглобина, в гепатоцитах — для образования
цитохрома Р450.
В матриксе митохондрий
COOH
NH 2
CH 2
+
CH 2
C
O
SKoA
Сукцинил-КоА
CH 2
HSKoA CO2
COOH
CH 2
CH 2
5-Аминолевулинатсинтаза
C O
COOH
В6
Глицин
H2C
гем
железо
NH
2
5-Аминолевулиновая кислота
5-АЛК
31.
COOHH2N
H2
C
COOH
CH 2
CH 2
CH 2
CH 2
O
+
C
O
5-Аминолевулиновая
кислота (5-АЛК)
C
CH 2
COOH
В цитоплазме
CH 2
HOOC
2Н2О
CH 2
5-Аминолевулинатдегидратаза
H2N
гем
H2N
5-Аминолевулиновая
кислота (5-АЛК)
Порфобилиногендезаминаза
Уропорфириноген III косинтаза
Уропорфириногендекарбоксилаза
C
H2
N
H
порфобилиноген
Гидроксиметилбилан
Уропорфириноген III
Копропорфириноген III
Копропорфриноген III оксидаза
Протопорфириноген IX
Протопорфирин IX
Гем
Феррохелатаза
CH 2
Протопорфириногеноксидаза
32.
НАРУШЕНИЯ СИНТЕЗА ГЕМА. ПОРФИРИИПорфирии - гетерогенная группа заболеваний, вызванная
нарушениями синтеза гема вследствие дефицита одного или
нескольких ферментов.
Классификации порфирий
Порфирии делят по причинам на:
Наследственные. Возникают при дефекте гена фермента, участвующего
в синтезе гема;
Приобретенные. Возникают при ингибирующем влиянии токсических
соединений (гексохлорбензол, соли тяжелых металлов - свинец) на
ферменты синтеза гема.
В зависимости от локализации дефицита фермента порфирии
делится на:
печеночные – наиболее распространенны. К ним относятся острая
перемежающаяся порфирия (ОПП), поздняя кожная порфирия,
наследственная копропорфирия, мозаичная порфирия;
эритропоэтические – врожденная эритропоэтическая порфирия (болезнь
Гюнтера), эритропоэтическая протопорфирия.
В зависимости от клинической картины, порфирии делят на:
острые.
хронические.
33.
34.
Негативные последствия порфирий связаны с дефицитомгема и накоплением в организме промежуточных продуктов
синтеза гема – порфириногенов и продуктов их окисления.
При эритропоэтических порфириях порфирины
накапливаются в нормобластах и эритроцитах,
при печёночных — в гепатоцитах.
Порфириногены ядовиты
Аминолевулинат и порфириногены являются нейротоксинами,
они при порфириях вызывают нейропсихические расстройства
Приводят к вялому параличу конечностей и парезу
дыхательной мускулатуры
35.
В коже на солнце порфириногены превращаются впорфирины. О2 при взаимодействии с порфиринами
переходит в синглетное состояние. Синглетный О2
стимулирует ПОЛ клеточных мембран и разрушение
клеток, поэтому порфирии часто сопровождаются
фотосенсибилизацией и изъязвлением открытых участков
кожи.
36.
Порфириногены бесцветны и не флуоресцируют, апорфирины имеют интенсивную красную флуоресценцию в
ультрафиолетовых лучах.
Избыток порфиринов который выводиться с мочой, придает
ей темный цвет («порфирин» в переводе с греч. означает
пурпурный).
37. Гемоглобин
• Тетрамерный хромопротеин• 4 гема и 4 глобина ( , , , и т.д.)
• Масса – 65 кДа
• У мужчин 130-160г/л
• У женщин 120-140г/л
Функции Hb:
1. Обеспечивают перенос О2 от легких к тканям. В сутки
600 л;
2. Участвует в переносе СО2 и протонов от тканей к
легким;
3. Образует гемоглобиновый буфер, регулирует КОС крови
38. Синтез гемоглобина
Гемоглобин начинает синтезироваться на стадиибазофильного эритробласта, а заканчивается у
ретикулоцитов.
• Гем индуцируется синтез цепей глобина на
рибосомах. Гены цепей глобина расположены
в 11 и 16 хромосоме.
• Цепи глобина формируют глобулы и
соединяются с гемом.
• Глобулы нековалентно соединяются в
гемоглобин.
В ретикулоцитах также идет синтез пуринов,
пиримидинов, фосфатидов, липида.
39.
Fe+2Fe+2
ГИС
ГИС
ИОННАЯ СВЯЗЬ
Fe+2
Fe+2
ГИС
ГИС
ГИДРОФОБНАЯ СВЯЗЬ
40. Виды гемоглобина
ФизиологическиеПатологические
• Эмбриональный:
• Более 100 видов:
1. Gover I -4 ,
1. HbS (Серповидноклет.
Анемия)
2. Gover II -2 2
3. Фетальный - 2 2
2. HbH (Талассемия)
• Hb Взрослого:
1. Гемоглобин А1 - 2 2
2. Гемоглобин А2 - 2 2
3. Гемоглобин А3 - 2 2 -глутатион
4. Гемоглобин А1с -глюкоза
41.
Схема образования видов гемоглобинаэпсилон
дельта
Синтезируется в 1 недели
развития плода
(желточный мешок)
Синтезируется в 1 -2
месяц развития плода
HbF
А1
А2
Синтезируется к 3 месяцу
развития плода, к
моменту рождения
составляет 50%-80%
У взрослого человека
98 %. Синтезируется с 8
месяца развития плода
У взрослого человека
2%
42. Талассемия
Генетическое заболевание, обусловленное отсутствиемили снижением синтеза одной из цепей гемоглобина.
Причиной являются мутации генов-операторов,
контролирующих транскрипцию структурных генов , ,
, -цепей гемоглобина.
В результате несбалансированного образования
глобиновых цепей образуются тетрамеры гемоглобина,
состоящие из одинаковых протомеров.
В зависимости от того, формирование какой
глобиновой цепи нарушается, выделяют , , , талассемии.
Также талассемии делятся на гомозиготные и гетерозиготные
43.
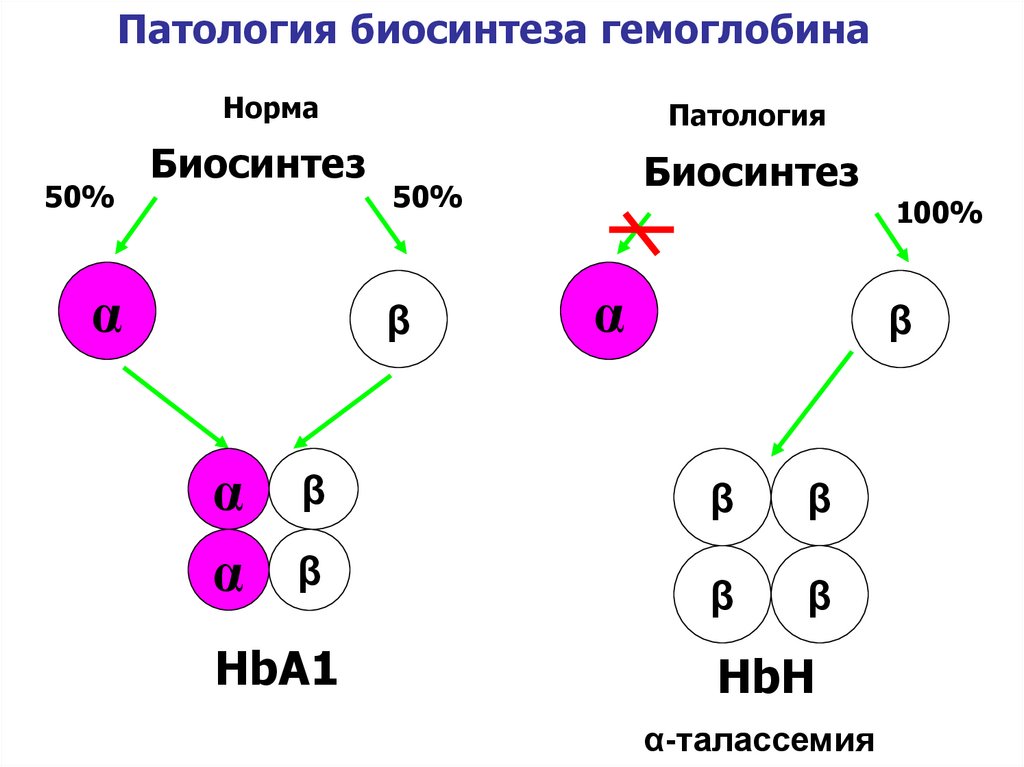
Патология биосинтеза гемоглобинаНорма
50%
Биосинтез
α
Патология
50%
β
α
α
β
β
HbА1
Биосинтез
100%
α
β
β
β
β
β
HbН
α-талассемия
44. β-Талассемия
При талассемии:1). нарушаются пропорции в составе гемоглобина.
2). эритроциты приобретают не нормальную форму (мишеневидную,
каплевидную). Такие эритроциты в пределах 1 дня захватываются
ретикулярной соединительной тканью (например, селезенкой) и
подвергаются распаду (по этой причине селезёнка оказывается
гипертрофированной), что приводит к развитию гемолитической анемии
β-Талассемия
Симптомы через полгода после рождения,
когда прекращается синтез -цепи НвF.
Прогрессирует анемия. Увеличиваются
селезенка и печень. Лицо приобретает
монголоидные черты (из-за чрезмерного
разрастания костного мозга скулы выдаются
вперед, нос приплюснут), при
рентгенологическом исследовании черепа
наблюдается феномен «игл ежа» («hair –
standing –on –end»).
45.
• -субъединицах НвS в шестом положении вместо ГЛУ находиться ВАЛ.Гидрофобные участок НвS, соединяются с гидрофобным карманом
другой молекулы дезоксиНв (в оксиНв нет такого кармана).
• Происходит полимеризация НвS и его осаждение в виде длинных
волокон. Волокна нарушают нормальную форму эритроцитов,
превращая её из двояковогнутого диска в серповидную, которая
блокирует капилляры. Такие эритроциты преждевременно
разрушаются, способствуя развитию анемии.
• В гомозигонном состоянии заболевание может оказаться
смертельным.
• Серповидная красная кровяная клетка «неудобна» для развития
малярийного плазмодия.
• Из за полимеризации дезоксиформы S гемоглобина существенное
ухудшение состояния больных наблюдается в условиях высокогорья
при низких давлениях кислорода.
46.
О2ВАЛ
О2
47.
Оксигемоглобин HbО2 (Fe2+)Соединение молекулярного кислорода с гемоглобином.
Процесс называется оксигенацией, обратный процесс –
дезоксигенацией
Карбоксигемоглобин HbСО (Fe2+)
Связь гема с СО в двести раз прочнее, чем с О2. В норме
содержится 1% HbСО. У курильщиков концентрация HbСО
- до 20%. При отравлении СО, из-за недостаточного
снабжения тканей кислородом может наступить смерть
Метгемоглобин МtHb (Fe3+)
Образуется при воздействии на гемоглобин окислителей
(оксидов азота, хлоратов).
В норме в крови содержится <1%.
Накопление метгемоглобина при некоторых заболеваниях
(недостаточность Гл-6-фосфатДГ), метгемоглобин не
способен к переносу кислорода
48.
Цианметгемоглобин HbСN (Fe3+)образуется при присоединении СN- к
метгемоглобину. Эта реакция спасает
организм от смертельного действия
цианидов. Поэтому для лечения
отравлений цианидами применяют
метгемоглобинообразователи (нитрит
Na)
49.
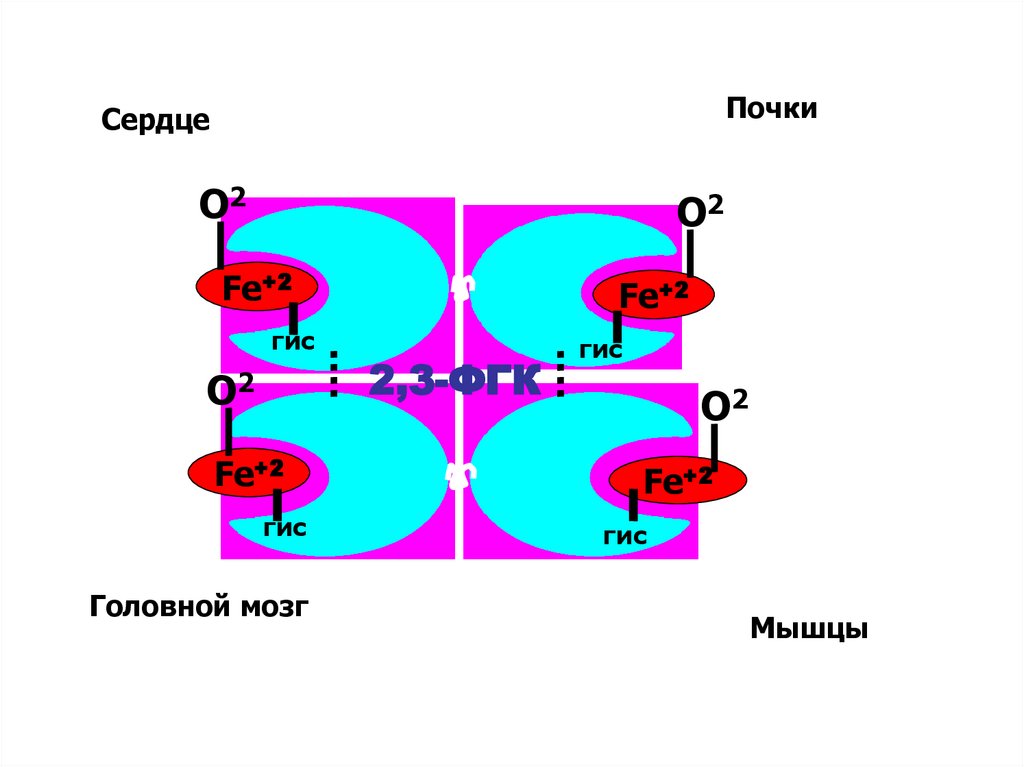
50. Аллостерическая регуляция насыщения гемоглобина кислородом
На насыщение гемоглобина О2 влияют:• Температура
• рH – эффект Бора
• Концентрация 2,3-ДФГ
• рСО2
• Давление
51.
Кривая диссоциации О2 для Hb100
90
2,3ДФК
↑t◦
pCO2
pH
% НАСЫЩЕНИЯ
80
70
60
50
40
30
20
10
0
0
10
20
30
40
50
ММ РТ СТ Р(О2)
60
70
80
90
52.
ПочкиСердце
О2
О2
Fe+2
гис
О2
Fe+2
гис
Головной мозг
Fe+2
2,3-ФГК
гис
О2
Fe+2
гис
Мышцы
53. Обмен веществ в лейкоцитах
• - полноценные клетки, содержат все органеллы.• - присущи все виды обмена (кроме глюконеогенеза).
• Метаболизм быстро реагирует на изменение условий среды –
в кровотоке клетка становится аэробом, в ткани - анаэробом
Антимикробная система фагоцита
1. Зависимая от кислорода
а) Зависимая от миелопероксидазы ( x I2 , Cl2 )
в) Неависимая миелопероксидазы ( Н2О2 ,*О –2 )
2. Независимая от кислорода
а) кислые гидролазы
б) лизоцим
в)лактоферрин
г) катионные белки
д) рН до 3,7
54. АФК
• АФК используются фагоцитами дляразрушения вирусов, онкоклеток
оксидаза
• НАДФН2 + 2О2 -------------> НАДФН+ + 2О2²• О2²¯ + 2Н+ = Н2О2
миелопероксидаза
• Н2О2 + Cl¯ --------------------------> Н2О + ClО¯
гипохлорид и пероксид разрушают стенку
бактерий
55. Образование NO
НАДФНО2
L-АРГИНИН =(NO-СИНТАЗА)= L-ЦИТРУЛЛИН
НАДФ+
NO
56. Фагоцитоз-процесс активного поглощения и переваривания клетками организма попавших в него живых и убитых микробов или других
инородныхчастиц.
Фагоцитоз осуществляется макрофагами и нейтрофилами, но присущ и
другим лейкоцитам.
57. Схема свёртывания крови Шмидта-Моравица
протромбинтромбокиназа
I фаза
Са2+
тромбин
фибриноген
II фаза
фибрин
58. Плазменные факторы свёртывания крови
I- фибриноген
II - протромбин
III - тканевой фактор
VI - Са2+
V - проакцелерин
VII - проконвертин
VIII - антигемофильный фактор А
IX - антигемофильный фактор В (Кристмаса)
X - фактор Прауэра-Стьюарта (препротромбиназа)
XI - плазменный предшественник тромбопластина
XII - фактор Хагемана
XIII - фибринстабилизирующий фермент
59. Общая схема каскада гемокоагуляции
внутреннийпуть активации
ВМК
внешний путь
активации
калликреин
XII
XIIa
XI
XIa
IX
IXa
VIII
VIIIa
Са2+, ФЛ (III)
VII
VIIa
(VIIa, Ca2+, ФЛ)
Va
V
(IХа, VIIIa, Ca2+, ФЛ)
X
Xa
протромбиназа
60.
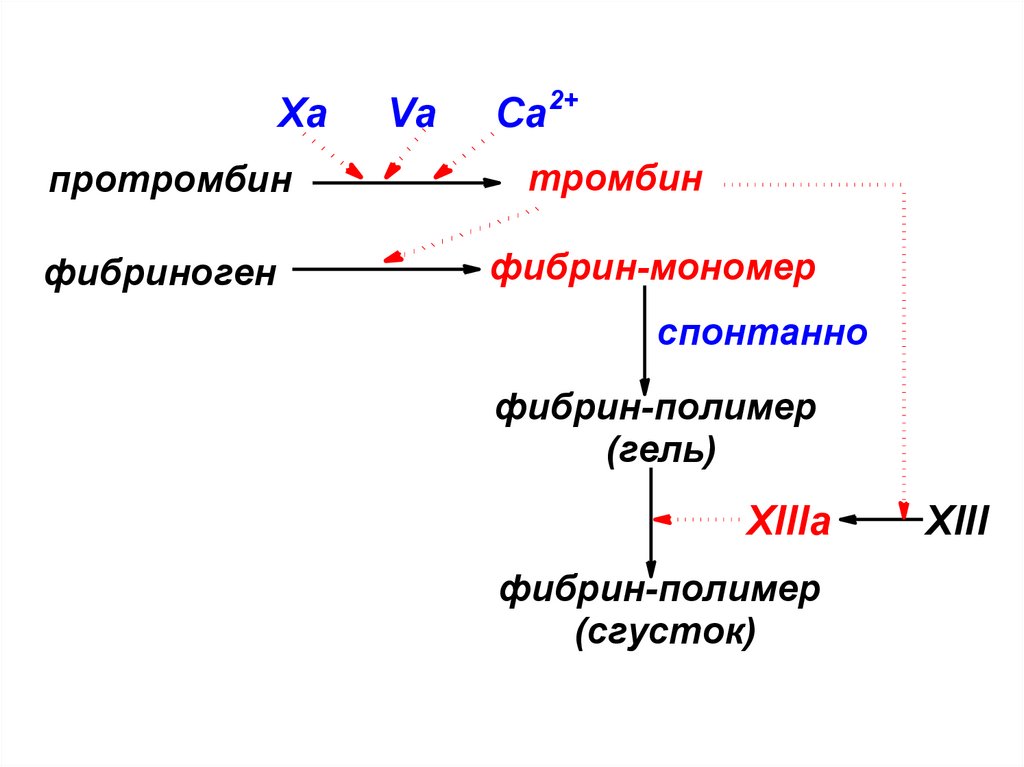
Хапротромбин
фибриноген
Va
Ca2+
тромбин
фибрин-мономер
спонтанно
фибрин-полимер
(гель)
XIIIa
фибрин-полимер
(сгусток)
XIII
61. Механизм активации протромбина
62. Формирование фибринового сгустка
63. Действие фибринстабилизирующего фактора
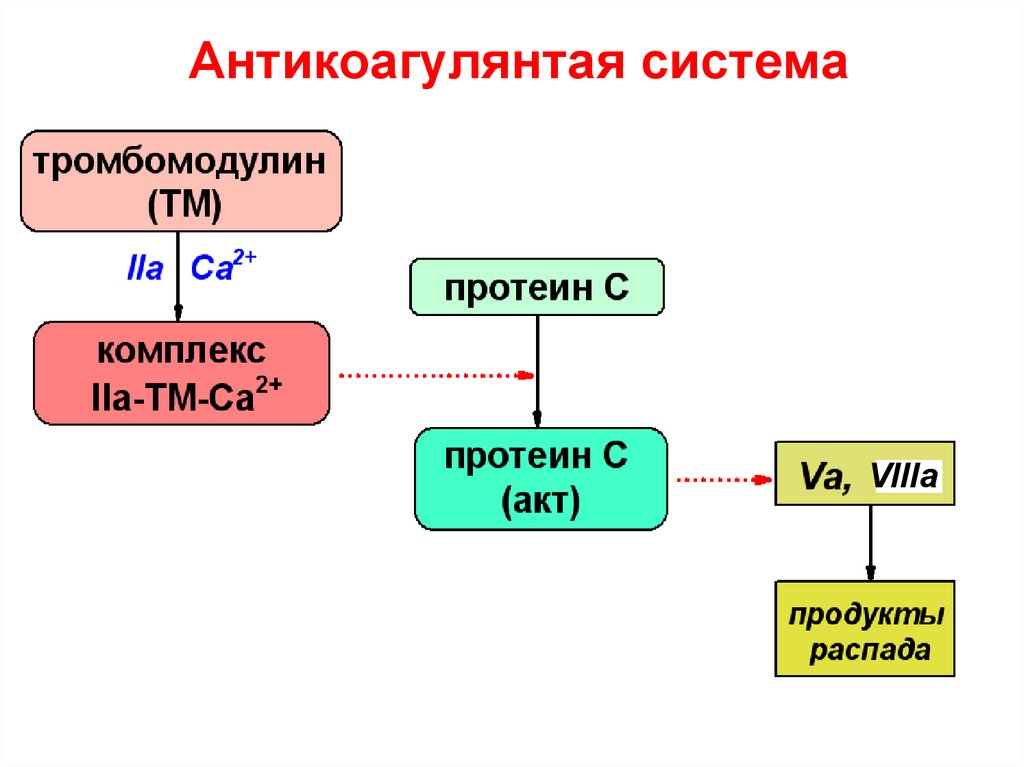
64. Антикоагулянтая система
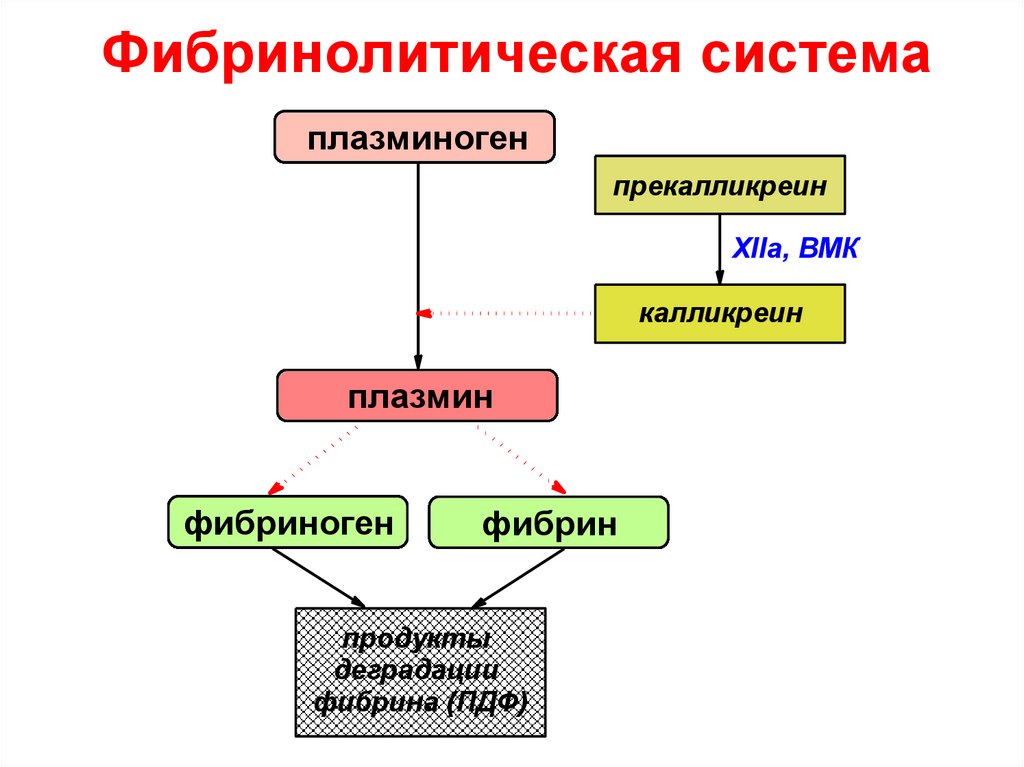
VIIIa65. Фибринолитическая система
плазминогенпрекалликреин
XIIa, ВМК
калликреин
плазмин
фибриноген
фибрин
продукты
деградации
фибрина (ПДФ)
66. Ингибиторы фибринолиза
• α2-антиплазмин• α2-макроглобулин
• Ингибиторы активаторов
плазминогена
67. коагулопатии
врожденныетромботические
состояния
вторичные
геморрагические
состояния
ДВС
68. Распределение воды в организме
69. Распределение воды в организме
ВОДАвнеклеточная
40%
внутрисосудистая
8%
внутриклеточная
60%
межклеточная
32%
70. Состав водно-электролитных пространств
Состав водно5%15%
50-40%
массы тела
электролитных
пространств
HCO3
HCO3
HCO3
K
Na Cl
Na
Cl
органические
фосфаты
сульфат
K
Ca
Mg
белок
Н3РО4
плазма
крови
K
Ca
Mg
Н3РО4
орг.
к-ты
межклеточная
жидкость
Mg
белок
Na
внутриклеточная
жидкость
71. Гормоны, регулирующие водно-электролитный обмен
Гормоны, регулирующие водноэлектролитный обменS
S
Н-Цис-Тир-Фен-Глн-Асн-Цис-Про-Арг-Гли-СО-NH2
вазопрессин
O
H
С
HO
O
С
СН 2ОН
CH3
O
альдостерон
альдостерон
72. Ренин-ангеотензиновая система
73. Нарушения водно-электролитного обмена
Нарушения водноэлектролитного обменагипергидратация
(отёки)
дегидратация
(обезвожживание,
эксикоз)
74. Основные показатели КОС крови
• БО (буферные основания)54 ммоль/л
• СБО
(сдвиг буферных оснований)
2,5 ммоль/л
• СБ (стандартный бикарбонат)
25 ммоль/л
44-
±
21-
75. Механизмы поддержания КОС
• Буферные системы• Лёгочный механизм
• Почечный механизм
76. Буферные системы
Н2СО31
NaНСО3
20
NaН2PО4
1
Na2НPО4
4
НHb
KHb
НHbO2
KHbO2
гемоглобиновая
бикарбонатная
фосфатная
Pt
COO
NH3+
белковая
77. Почечный механизм поддержания КОС
Почечныймеханизм
поддержан
ия КОС
78. Нарушения кислотно-основного состояния
Нарушения кислотноосновного состоянияБО< 44 ммоль/л
АЦИДОЗ
респираторный
БО> 54 ммоль/л
АЛКАЛОЗ
нереспираторный
метаболический
экзогенный
выделительный
компенсаторный
некомпенсаторный
79. Механизм возникновения ацидоза алкалоза
• избыточноенакопление
летучих кислот
• избыточное
накопление
оснований
• избыточное
накопление
нелетучих кислот
• избыточное
выведение
летучих кислот
80. Причины нарушений КОС
• нарушение дыхательнойфункции лёгких
• нарушение выделительной
функции почек
• метаболические нарушения в
тканях
• экзогенные причины
(погрешности питания)









































































 biology
biology