Similar presentations:
Основы термодинамики
1.
Основы термодинамики2.
Число степеней свободы молекулыВнутренняя энергия – кинетическая энергия хаотического (теплового)
движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.)
и потенциальная энергия взаимодействия этих частиц.
Число степеней свободы i - это число независимых координат, с помощью
которых определяется положение тела в пространстве.
Закон Больцмана о равномерном распределении энергии по степеням свободы
молекул:
для статистической системы, находящейся в состоянии
термодинамического равновесия, на каждую поступательную и
вращательную степени свободы приходится в среднем
кинетическая энергия, равная 12 kT , а на каждую колебательную
степень свободы – в среднем энергия, равная kT .
3.
Средняя энергия молекулы:2i kT
где
,
i iпост iвращ 2iколеб
Внутренняя энергия 1 моля газа:
i
i
U m kTN A RT
2
2
Внутренняя энергия для произвольной массы т газа:
m i
i
U
RT RT
M 2
2
,
или U vCvT
где M – молярная масса, - количество вещества,
Сv – молярная теплоемкость при постоянном объеме.
4.
Работа газа при изменении его объемаГаз, расширяясь, производит работу над поршнем
A Fdl pSd pdV
Полная работа A газа при изменение его объема от V1 до V2
A
V2
pdV
V1
Произведенную при том или ином процессе работу можно изобразить
графически
5.
Первое начало термодинамикиВнутренняя энергия системы может изменяться при совершении над системой
работы или сообщении ей теплоты
1) Первое начало термодинамики:
Изменение внутренней энергии системы при ее переходе из одного состояния в
другое равно сумме количества теплоты, подведенного системе из вне, и
работы внешних сил, действующих на нее.
U Q Aвн
U – внутренняя энергия;
A – работа внешних сил.
Q – количество теплоты;
6.
Т.к. работа внешних сил равна работе системы, взятой с противоположнымзнаком, то
U Q A
Q U A
2) Первое начало термодинамики
Количество теплоты, подведенное системе идет на изменение ее внутренней
энергии и на совершение системой работы над внешними телами.
7.
ТеплоемкостьТеплоемкостью тела называется величина равная количеству тепла,
которое нужно сообщить телу, чтобы повысить его температуру на 1 К.
cT
Q
c
dT
Дж
К
Удельная теплоемкость вещества - величина, равная количеству теплоты,
необходимому для нагревания 1 кг вещества на 1 К:
c
Q
mdT
c = [Дж/(кг К)]
Молярная теплоемкость - величина, равная количеству теплоты,
необходимому для нагревания 1 моль вещества на 1 К:
Q
Cm
dT
Cm = [Дж/(моль К)]
Удельная теплоемкость с связана с молярной Cm:
С m cM
8.
Первое начало термодинамики для 1 моль газаСm dT dU m pdVm
Молярная теплоемкость газа при постоянном объеме:
dU m i
CV
R
dT
2
Молярная теплоемкость газа при постоянном давлении:
CP
dU m pdVm
dT
dT
СP CV R - уравнение Майера
СP
i
i 2
R R
R Молярная теплоемкость газа при постоянном давлении
2
2
9.
Применение первого начала термодинамикик изопроцессам
1. Изохорный процесс (V = const)
Газ не совершает работы над внешними
силами, тогда:
A pdV 0
Вся теплота, сообщаемая газу, идет на
изменение внутренней энергии
Q U
Так как
U m CV T , то для произвольной массы газа получим:
m
Q U
CV T
M
10.
2. Изобарный процесс (P = const)Q U А
Работа газа при увеличении объема от V1 до V 2
V2
равна площади прямоуA pdV p(V2 V1 ) гольника
V1
Если использовать уравнение
Менделеева-Клапейрона, то получим:
Количество теплоты:
Внутренняя энергия:
m
Q
C р T
M
m
U
CV T .
M
A
m R
(T2 T1 ).
M p
11.
3. Изотермический процесс (T = const)Работа изотермического расширения газа:
A
V2
pdV
V1
V2
m
dV
m
V2
m
p1
RT
RT
ln
RT
ln
.
V M
V
M
V1 M
p2
1
Так как Т=const внутренняя энергия идеального газа не изменяется:
U 0
Q A
, то из первого начала термодинамики следует
m
p
m
V
RT ln 1
RT ln 2 .
M
p2 M
V1
Q A,
12.
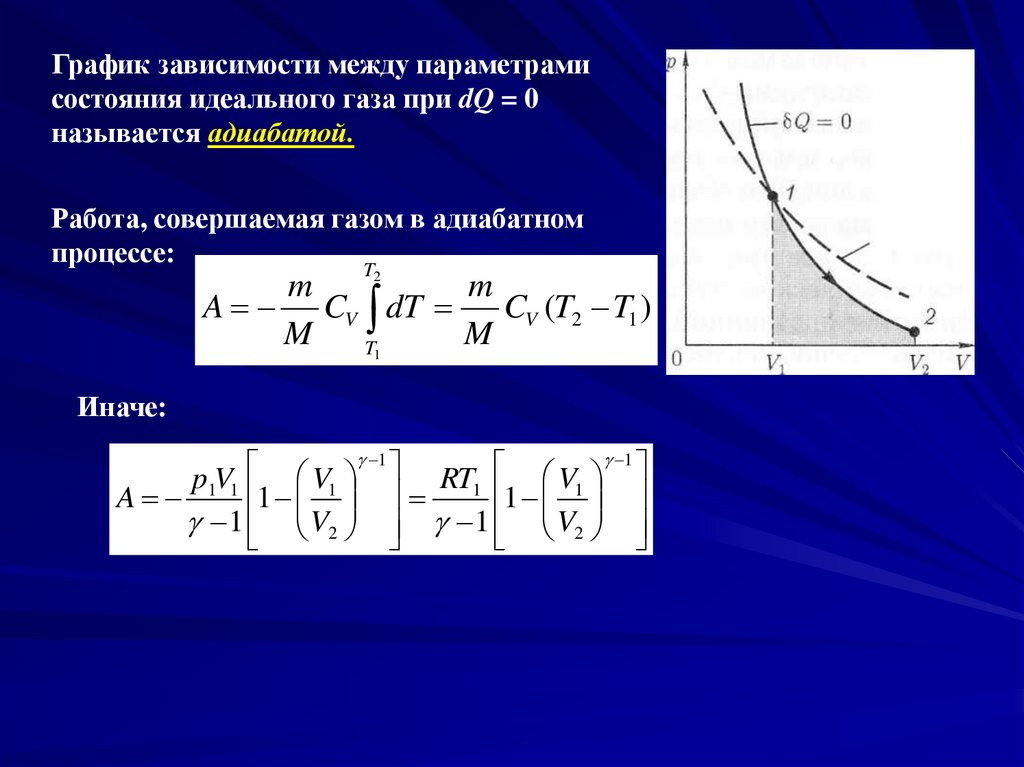
Адиабатный процессАдиабатным называется процесс, при котором отсутствует теплообмен
между системой и окружающей средой (dQ = 0).
Из первого начала термодинамики следует, что: A U
Уравнения адиабатного процесса (уравнение Пуассона):
pV const
TV
1
const
1
T p
const
, где
Сp
i 2 показатель адиабаты
СV cV
i (коэф-т Пуассона)
cp
13.
График зависимости между параметрамисостояния идеального газа при dQ = 0
называется адиабатой.
Работа, совершаемая газом в адиабатном
процессе:
T
2
m
m
A CV dT CV (T2 T1 )
M
M
T1
Иначе:
1
1
V1
V1
p1V1
RT1
1
1
A
1 V2 1 V2
Т = const
14.
Круговой процессОбратимые и необратимые процессы.
Круговым процессом (или циклом) называется процесс, при котором
система, пройдя через ряд состояний, возвращается в исходное.
Прямой цикл – если за цикл совершается положительная работа ( по часовой
стрелке) ; (тепловые двигатели - совершающие работу за счет полученной
извне теплоты.
Обратный цикл – если за цикл совершается отрицательная работа
(холодильные машины, в которых за счет работы внешних сил теплота
переносится к телу с более высокой температурой.
прямой цикл
обратный цикл
15.
Термодинамический процесс называется обратимым, если он можетпроисходить как в прямом, так и в обратном направлении.
Всякий процесс,
необратимым.
не
удовлетворяющий
этим
условиям,
будет
16.
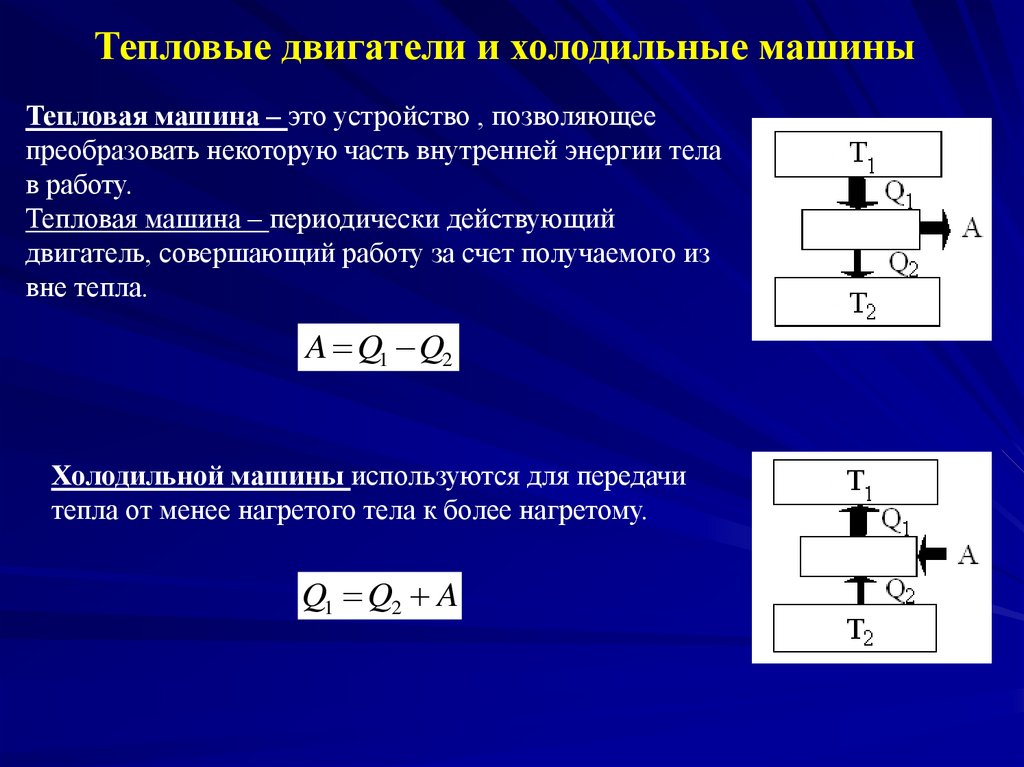
Тепловые двигатели и холодильные машиныТепловая машина – это устройство , позволяющее
преобразовать некоторую часть внутренней энергии тела
в работу.
Тепловая машина – периодически действующий
двигатель, совершающий работу за счет получаемого из
вне тепла.
A Q1 Q2
Холодильной машины используются для передачи
тепла от менее нагретого тела к более нагретому.
Q1 Q2 A
17.
Цикл Карно и его КПД для идеального газаЦикл Карно — круговой процесс, состоящий из четырех последовательных
обратимых
процессов:
изотермического
расширения,
адиабатного
расширения, изотермического сжатия и адиабатного сжатия.
18.
Работа, совершаемая в результате кругового процессаA Q1 Q2
Термический КПД цикла Карно
A Q1 Q2
Q1
Q1
T1 T2
T1
Теорема Карно:
КПД обратимых машин, работающих при одинаковых температурах
нагревателей (Т1) и холодильников (Т2) равны друг другу и не зависят от
природы рабочего тела, а определяются только температурами нагревателя
и холодильника.
19. Энтропия
Энтропия - функция состояния, полным дифференциалом которой является Q/T– приведенное количество теплоты.
dS
Q
T
.
Приведенное количество теплоты – физическая величина, равная отношению
количества теплоты, полученного телом в изотермическом процессе, к
температуре теплоотдающего тела.
Неравенство Клаузиуса: энтропия замкнутой системы может либо возрастать
(необратимые процессы), либо оставаться постоянной (обратимые процессы).
S 0
Для адиабатного процесса
Q 0, S 0 S const
Энтропия – мера вероятности состояния термодинамической системы.
S k nW
k- постоянная Больцмана, W- термодинамическая вероятность
20.
Второе начало термодинамикиВторое начало термодинамики - закон возрастания энтропии замкнутой
системы при необратимых процессах: любой необратимый процесс в
замкнутой системе происходит так, что энтропия системы при этом
возрастает.
Формулировки второго начала термодинамики:
по Кельвину: невозможен круговой прогресс, единственным
результатом которого является превращение теплоты, полученной от
нагревателя, в эквивалентную ей работу;
по Клаузиусу: невозможен круговой процесс, единственным
результатом которого является передача теплоты от менее нагретого
тела к более нагретому.


















 physics
physics