Similar presentations:
Первое начало термодинамики
1. Термодинамика и статистическая физика
2. Лекция № 2
Первое начало термодинамики1. Внутренняя энергия. Макроскопическая
работа. Количество теплоты.
2. Первое начало термодинамики.
3. Условия преобразования теплоты в работу.
4. Основные элементы тепловой машины. Цикл
Карно. Максимальный КПД тепловых машин.
5. Теплоёмкость. Молярная теплоёмкость
идеального одноатомного газа при постоянном
объёме и постоянном давлении.
6. Адиабатический процесс. Уравнение адиабаты.
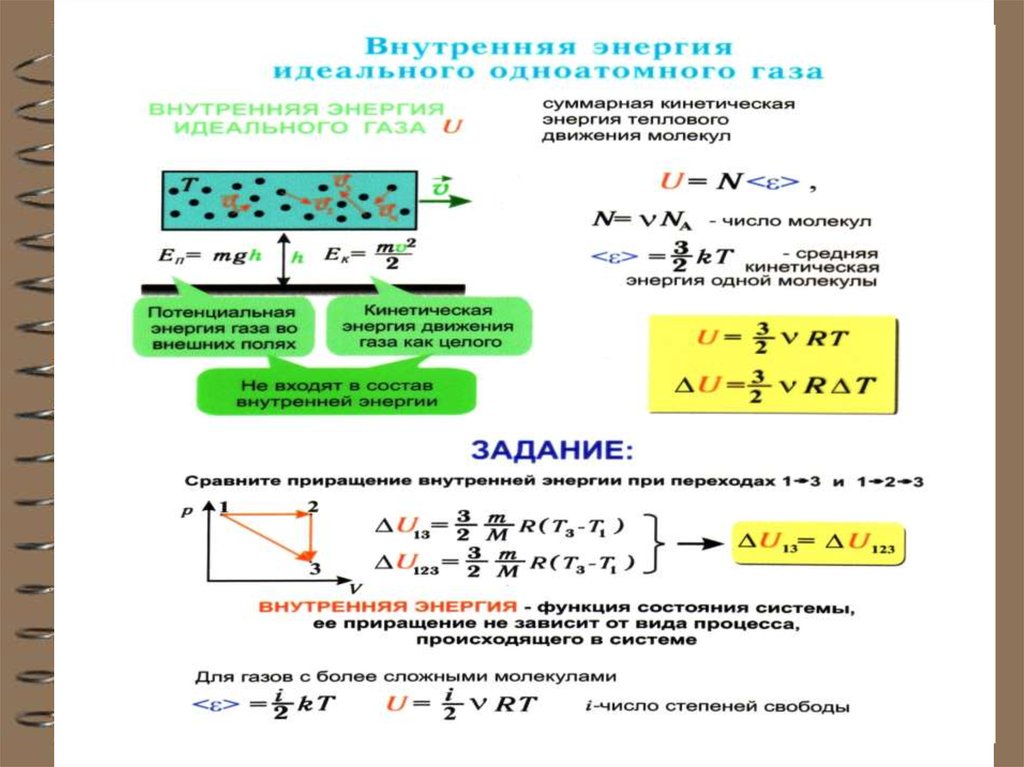
3. Внутренняя энергия
Наряду с механической энергией любоетело (или система) обладает внутренней
энергией.
Внутренняя энергия –
энергия покоя (без движения сосуда).
Она складывается из:
- теплового хаотического движения
молекул,
- потенциальной энергии их взаимодействия (для реального газа),
- кинетической и потенциальной энергии
электронов в атомах, нуклонов в ядрах и
так далее.
4. В термодинамических процессах изменяется только кинетическая энергия движущихся молекул (тепловой энергии недостаточно, чтобы
В термодинамике важно знать неабсолютное значение внутренней энергии,
а её изменение.
В термодинамических процессах
изменяется только кинетическая энергия
движущихся молекул (тепловой энергии
недостаточно, чтобы изменить строение
атома,
а
тем
более
ядра).
Следовательно, фактически
под
внутренней энергией в термодинамике
подразумевают
энергию
теплового
хаотического движения молекул.
5. Внутренняя энергия U одного моля идеального одноатомного газа равна: или Таким образом, внутренняя энергия зави-сит только от
Внутренняя энергия U одного моляидеального одноатомного газа равна:
U Екин
3
3
N A kTN A RT или
2
2
3
U RT
2
Таким образом, внутренняя энергия зависит только от температуры.
Внутренняя энергия U является функцией состояния системы и
dU 0
не зависит от предыстории:
6.
В каждом состоянии система обладаетопределенным и только таким значением
внутренней энергии, поэтому можно
записать:
U2
U dU U 2 U1
U1
Так как U – функция состояния, то
dU
0
Этот справедливо для любой функции
состояния.
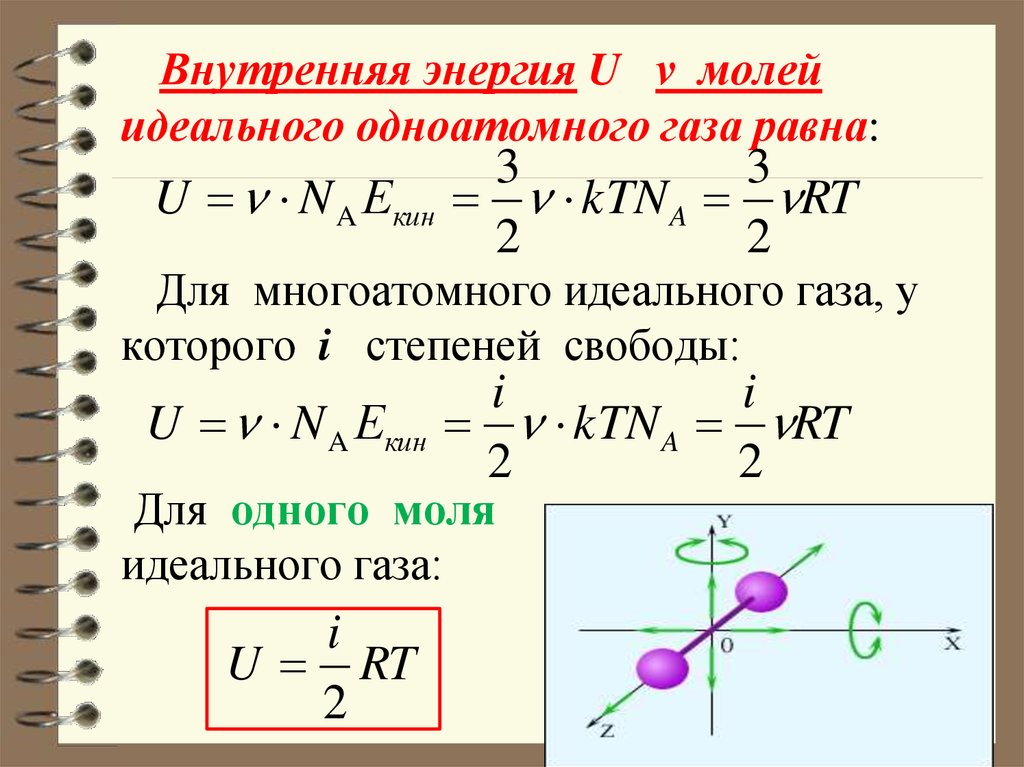
7. Внутренняя энергия U ν молей идеального одноатомного газа равна: Для многоатомного идеального газа, у которого i степеней
Внутренняя энергия U ν молейидеального одноатомного газа равна:
U N A Екин
3
3
kTN A RT
2
2
Для многоатомного идеального газа, у
которого i степеней свободы:
U N A Екин
i
i
kTN A RT
2
2
Для одного моля
идеального газа:
i
U RT
2
8.
9.
10. Работа и теплота
Термодинамическая система можетобладать как внутренней, так и механической энергией и разные системы могут
обмениваться этими видами энергии.
Обмен механической энергией
характеризуется совершённой работой А,
а обмен внутренней энергией –
количеством переданного тепла Q.
Механическая энергия может переходить в тепловую энергию и обратно.
11.
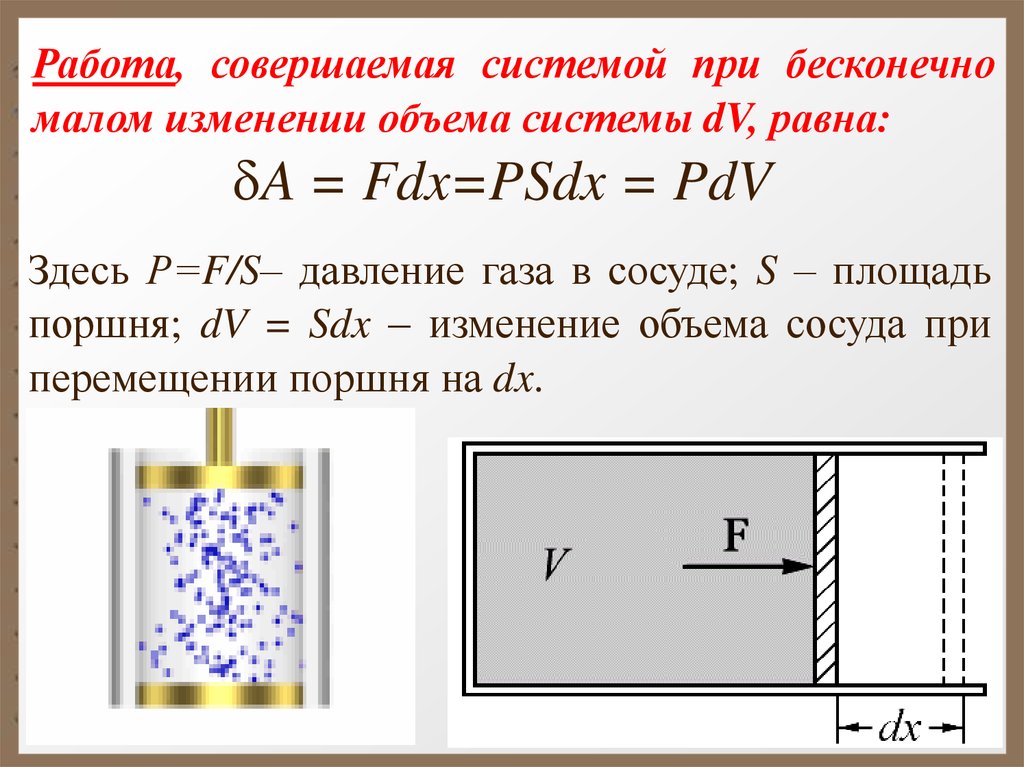
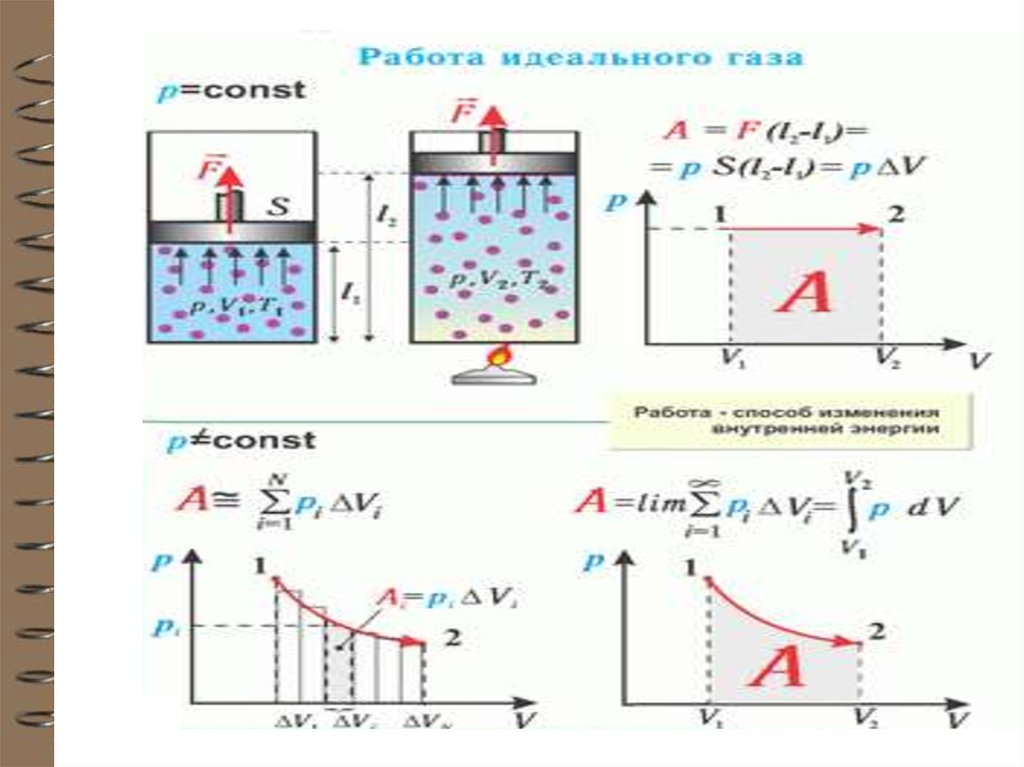
Работа, совершаемая системой при бесконечномалом изменении объема системы dV, равна:
A = Fdx=PSdx = PdV
Здесь Р=F/S– давление газа в сосуде; S – площадь
поршня; dV = Sdx – изменение объема сосуда при
перемещении поршня на dx.
12.
13.
12
При переходе из состояния 1 в
состояние 2 (конечном
изменении объема) давление
может изменяться
2
А
А
V2
V2
V1
V1
А pdV
Геометрическая интерпретация
интеграла – площадь под кривой
1 – 2. Площадь зависит от вида
кривой. Поэтому
макроскопическая работа не
является функцией состояния,
а является функцией процесса.
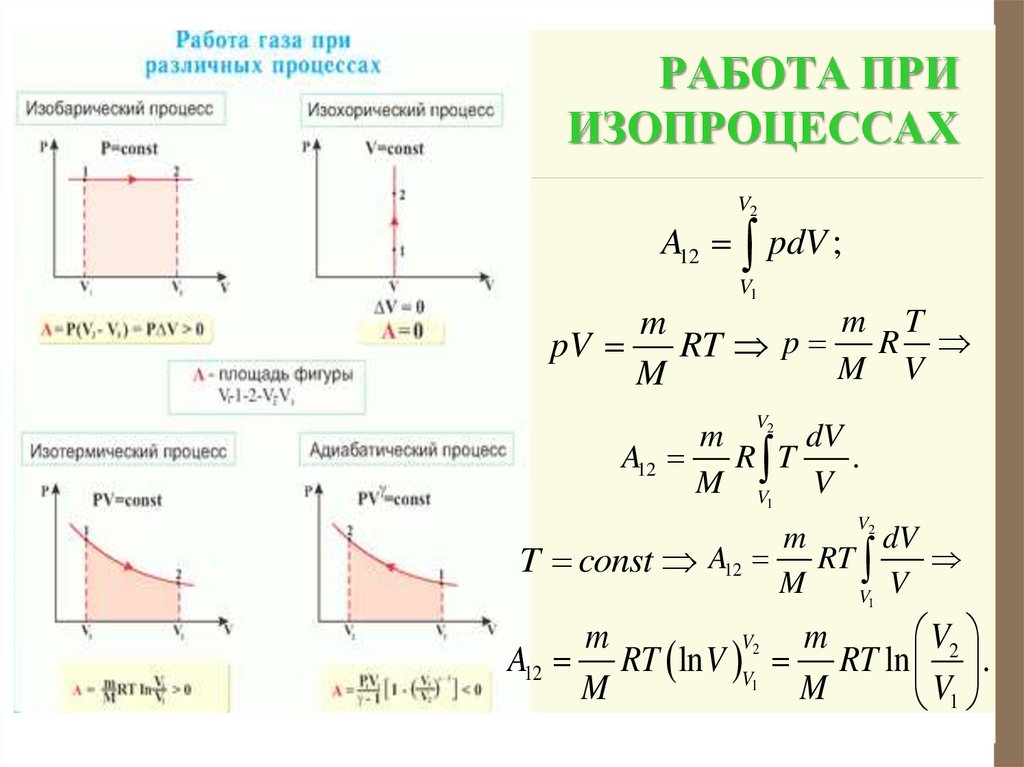
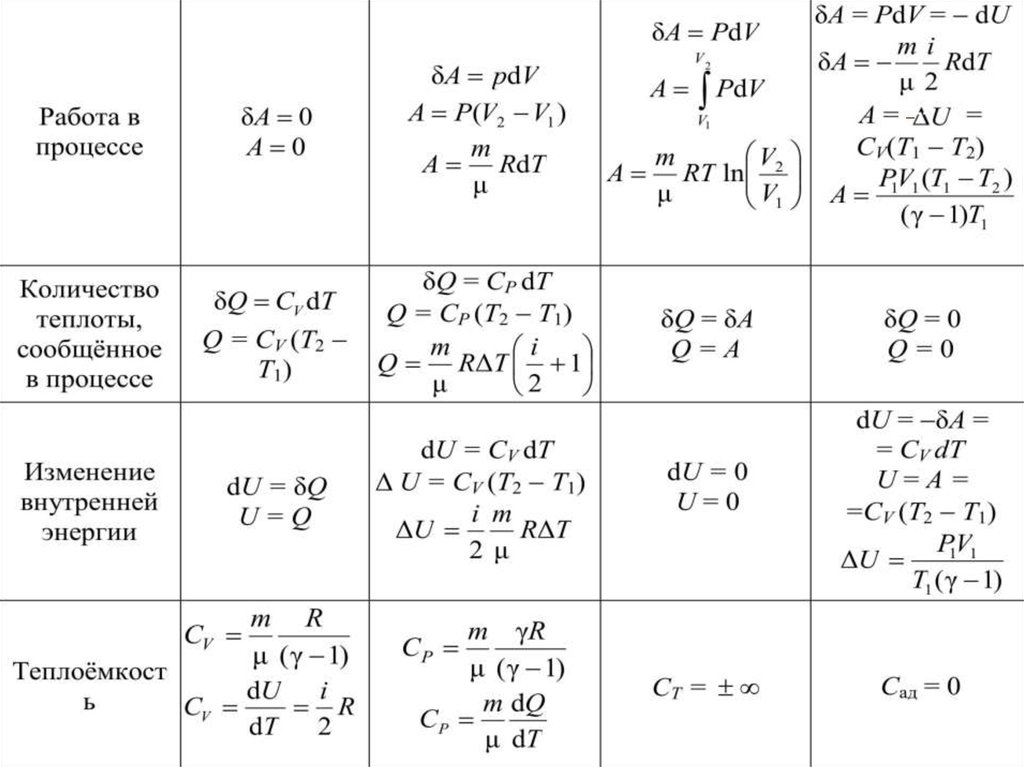
14. РАБОТА ПРИ ИЗОПРОЦЕССАХ
V2A12 pdV ;
V1
m T
m
pV
RT p R
M V
M
V
m 2 dV
A12
R T
.
M V1 V
V
2
m
dV
A
RT
T const 12
M
V
V1
V2
m
m
V2
A12 RT ln V V RT ln .
1
M
M
V1
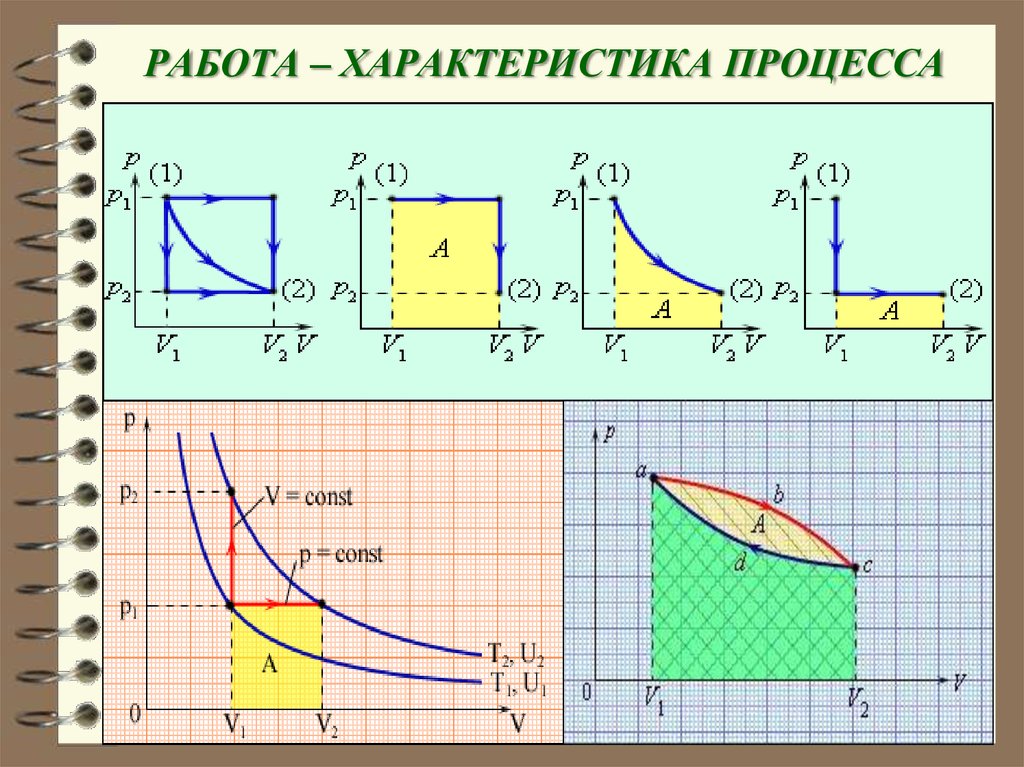
15. РАБОТА – ХАРАКТЕРИСТИКА ПРОЦЕССА
16.
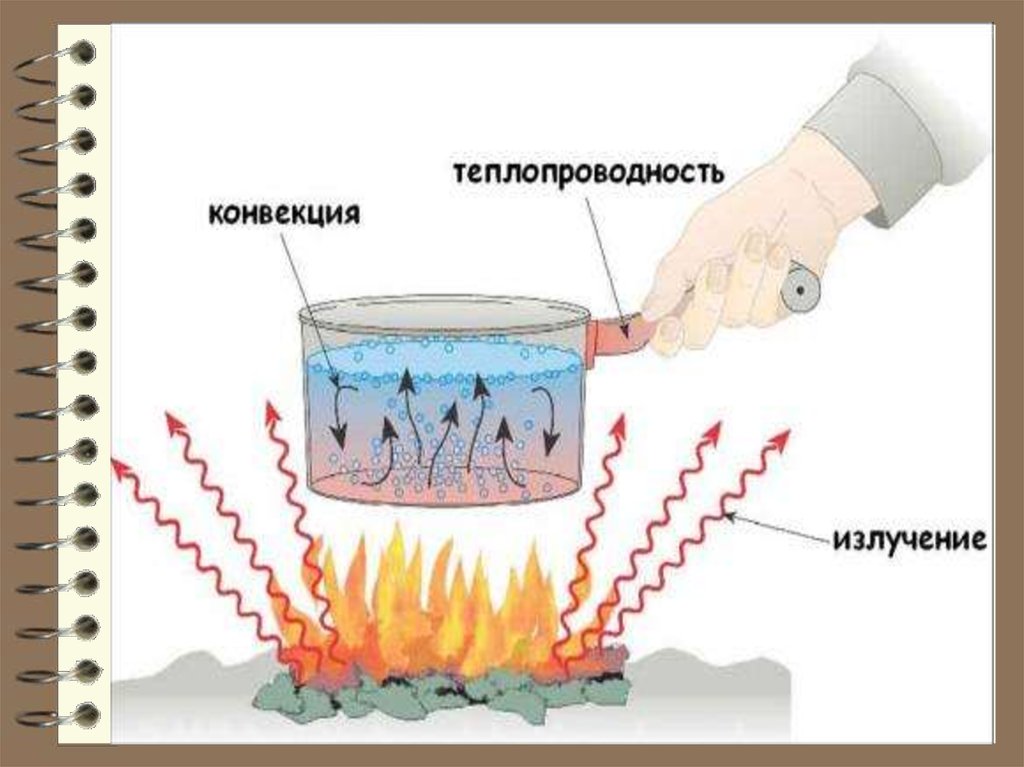
Количество теплоты Q , представляетсобой энергию, которая передаётся от
одного тела к другому при их контакте
(непосредственно или через 3-е тело) или
путём излучения. Количество тепла (теплота) – мера изменения внутренней энергии
системы в процессе теплопередачи: теплопроводность, тепловое
излучение, конвекция
(перенос теплоты, обусловленный различием
температур в разных местах жидкости или газа).
17.
18. Первое начало термодинамики (закон сохранения энергии при тепловых процессах)
Количество теплоты, сообщаемой телу, идётна увеличение внутренней энергии и на
совершение
телом
работы:
Q ΔU A
– это и есть первое начало термодинамики или
закон сохранения энергии в термодинамике.
U Q A
– изменение внутренней энергии тела равно
разности сообщаемой телу теплоты и
произведённой телом работы.
19. Закон сохранения энергии для малого изменения состояния системы будет иметь вид: U – функция состояния системы; dU – её полный
Закон сохранения энергии длямалого изменения состояния
системы будет иметь вид:
Q dU A
U – функция состояния системы;
dU – её полный дифференциал, а
δQ и δА таковыми не являются и их
приращения не являются полными
дифференциалами.
20. Теплота Q и работа А зависят от того, каким образом совершен переход из состояния 1 в состояние 2 (изохорически,
адиабатически), авнутренняя энергия U не зависит.
При этом нельзя сказать, что
система, обладает определенным для
данного состояния значением теплоты и
работы.
Количество теплоты Q выражается
в тех же единицах, что работа и энергия,
т.е. в джоулях [Q] = Дж.
21.
Теплотой называется энергия, передаваемая оттела с более высокой температурой телу с меньшей температурой при контакте (или путём излучения). Такая передача энергии не сопровождается совершением работы, а приводит только
к увеличению внутренней энергии. Но если тепло
передаётся телу, которое при этом может расширяться, то оно может совершать работу (I нач.ТД):
A Q dU
Наибольшая работа совершается при изотермическом процессе, когда внутренняя энергия
не изменяется ( dU 0 ), тогда:
A Q
22.
Если идеальный газ, получив теплоту,изотермически расширится от
объёма V1 до объёма V2 , то при этом
будет совершена работа равная:
V2
V2
m
dV m
V2
A PdV RT
RT ln
V1 V
V1
V1
m
PV RT
23. Если то согласно первому началу термодинамики т.е. нельзя построить периодически действующий двигатель, который совершал бы
Если ΔU 0, то согласно первомуначалу термодинамики A Q,
т.е.
нельзя
построить
периодически
действующий двигатель, который
совершал бы бóльшую работу, чем
количество сообщенной ему извне
энергии. Иными словами, вечный
двигатель первого рода невозможен.
Это одна из формулировок первого
начала термодинамики.
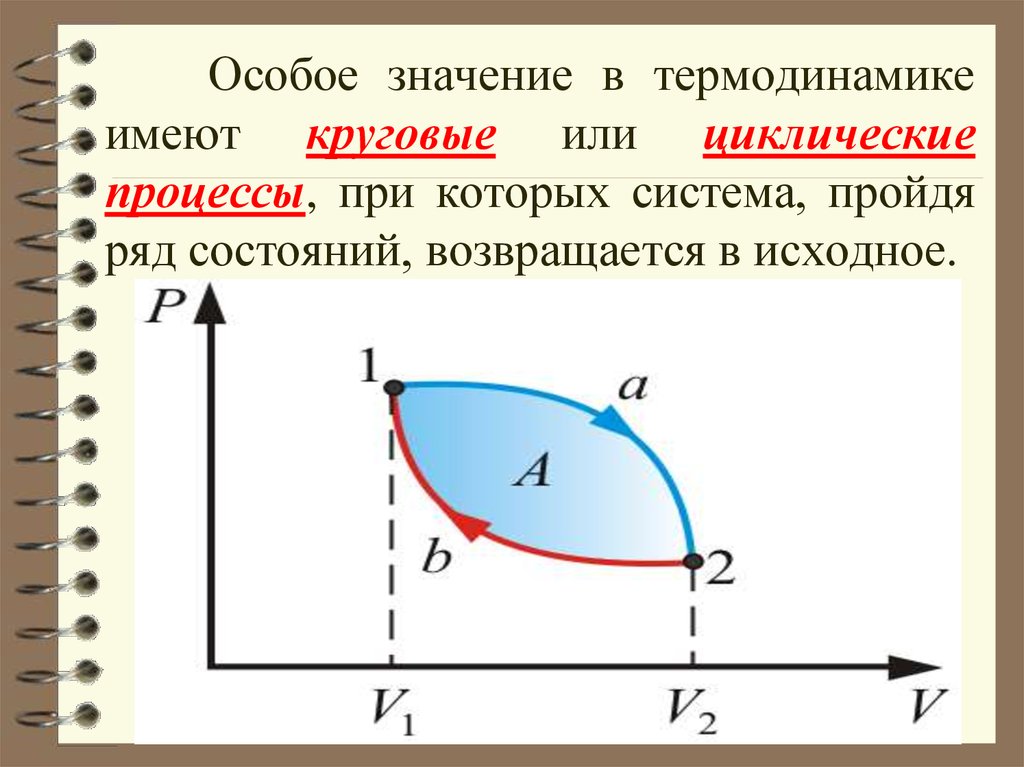
24. Особое значение в термодинамике имеют круговые или циклические процессы, при которых система, пройдя ряд состояний,
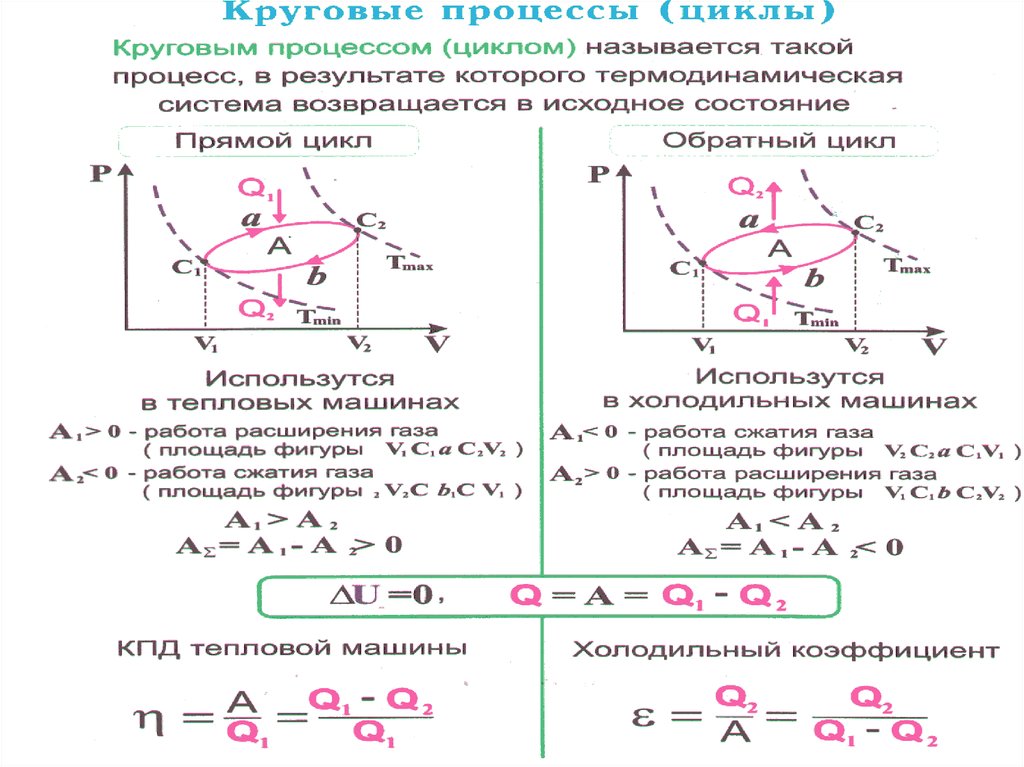
возвращается в исходное.25.
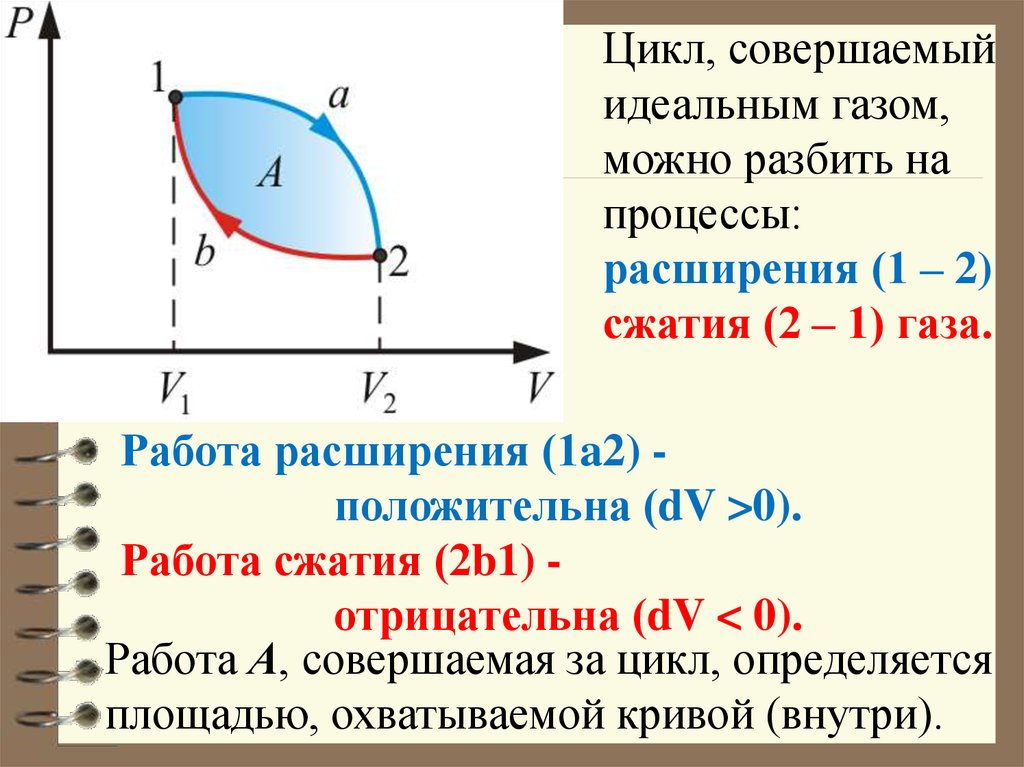
Цикл, совершаемыйидеальным газом,
можно разбить на
процессы:
расширения (1 – 2)
сжатия (2 – 1) газа.
Работа расширения (1a2) положительна (dV >0).
Работа сжатия (2b1) отрицательна (dV < 0).
Работа А, совершаемая за цикл, определяется
площадью, охватываемой кривой (внутри).
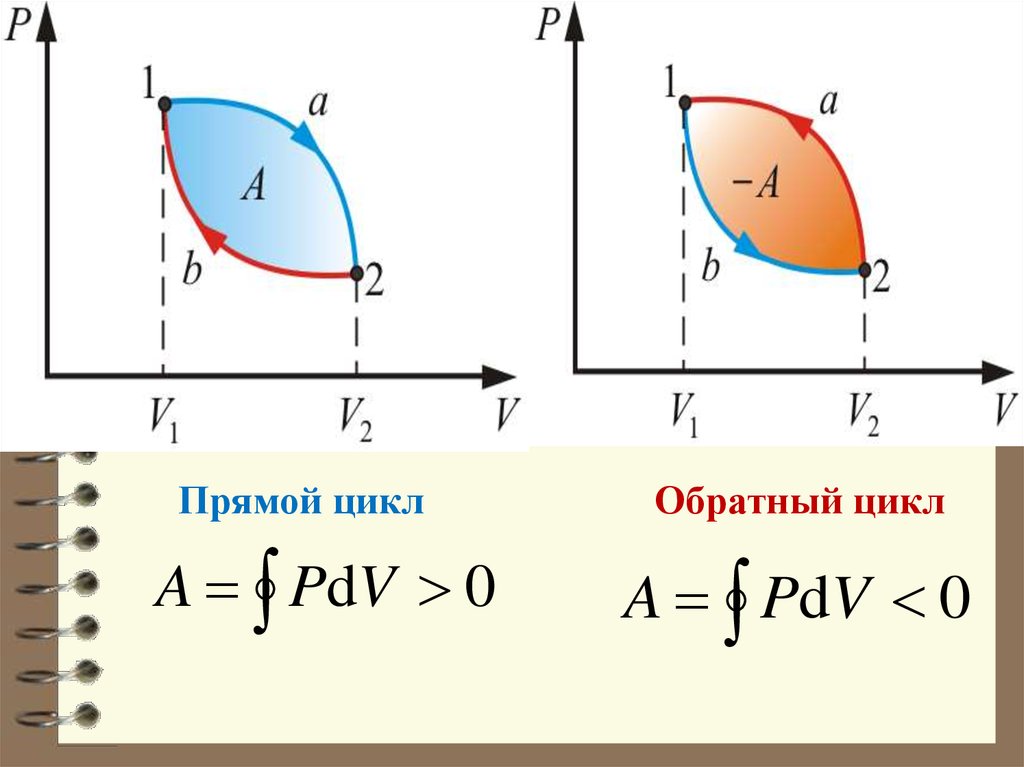
26. Если за цикл совершается положительная работа (цикл протекает по часовой стрелке), то он называется прямым. Если за цикл
Если за цикл совершаетсяположительная работа
A PdV 0
(цикл протекает по часовой стрелке), то он
называется прямым.
Если за цикл совершается
отрицательная работа
A PdV 0
(цикл протекает против часовой стрелки),
то он называется обратным.
27.
Прямой циклA PdV 0
Обратный цикл
A PdV 0
28.
Прямой цикл используется в тепловыхдвигателях
–
периодически
действующих
установках, совершающих работу за счет
получения извне теплоты. Обратный цикл
используется
в
холодильных
машинах
периодически действующих
установках, в
которых за счет работы внешних сил теплота
переносится к телу с более высокой температурой.
В результате кругового процесса система
возвращается
в
исходное
состояние
и,
следовательно, полное изменение внутренней
энергии газа равно нулю ( U 0 ). Поэтому первое
начало термодинамики для кругового процесса:
Q U A A
т.е. работа, совершаемая за цикл, равна количеству
полученной извне теплоты.
29. Т.о. работа, совершаемая за цикл, равна количеству полученной извне теплоты. Однако в результате кругового процесса система
Q AТ.о. работа, совершаемая за цикл, равна
количеству полученной извне теплоты.
Однако в результате кругового
процесса система может теплоту как
получать, так и отдавать, поэтому
Q Q1 Q2 ,
Q1 – количество теплоты, полученное
системой;
Q2 – количество теплоты, отданное
системой.
30. Термический коэффициент полезного действия ( КПД ) для кругового процесса: Все термодинамические процессы, в том числе и
Термический коэффициент полезногодействия ( КПД ) для кругового
процесса:
A Q1 Q2
Q2
1
Q1
Q1
Q1
Все термодинамические процессы, в
том числе и круговые, делят на две
группы: обратимые и необратимые.
31.
Термический процесс называется обратимым,если он может происходить как в прямом, так и в
обратном направлении. Причем, если такой
процесс происходит сначала в прямом, а затем в
обратном направлении и система возвращается в
исходное состояние, то в окружающей среде и в
этой системе не происходит никаких изменений.
Всякий процесс, не удовлетворяющий этим
условиям, является необратимым.
Любой равновесный процесс является обратимым.
Обратимость равновесного процесса, происходящего в системе, следует из того, что ее любое
промежуточное состояние есть состояние термодинамического равновесия; для него "безразлично",
идет процесс в прямом или обратном направлении.
32.
Реальные процессы сопровождаются диссипациейэнергии (из-за трения, теплопроводности и т.д.) и
являются необратимыми.
Обратимые процессы - это идеализация реальных
процессов.
Их рассмотрение важно по двум причинам:
1) многие процессы в природе и технике
практически обратимы;
2) обратимые процессы являются наиболее
экономичными;
Они имеют максимальный термический коэффициент полезного действия, что позволяет указать
пути повышения КПД реальных тепловых
двигателей.
33. При адиабатическом расширении газа условие теплоизолированности системы исключает непосредственный теплообмен между системой и
средой.Поэтому, производя адиабатическое
расширение газа, а затем сжатие,
можно вернуть газ в исходное
состояние так, что в окружающей среде
никаких изменений не произойдет. Это
и будет обратимый процесс.
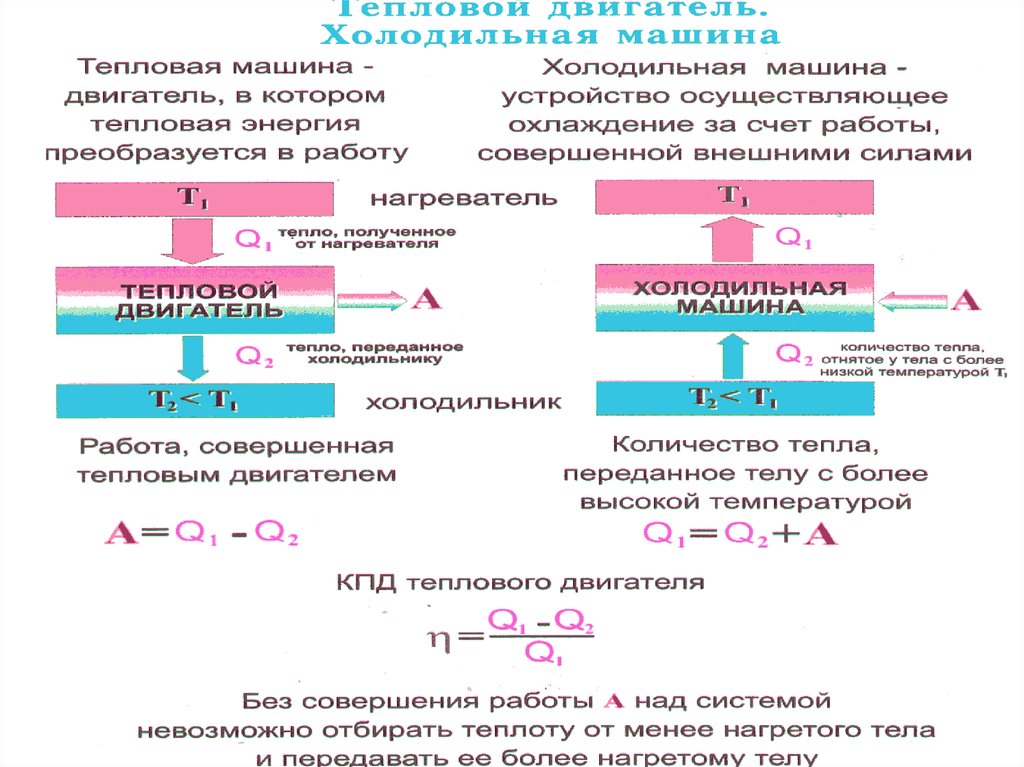
34. Тепловые машины
Тепловой машиной называетсяпериодический действующий двигатель, совершающий работу за счет
получаемого извне тепла. При этом
теплота, взятая у источника, может
быть превращена в работу в циклическом процессе при условии, что кроме
этого должно изменяться состояние
какого-то другого тела или тел.
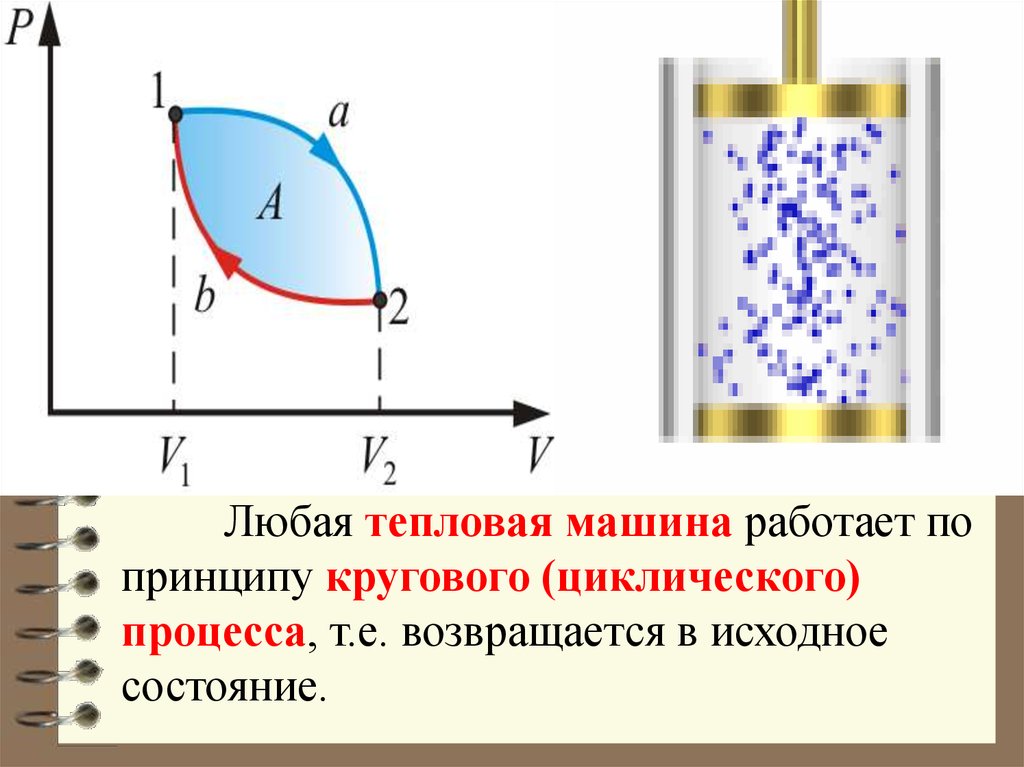
35.
Любая тепловая машина работает попринципу кругового (циклического)
процесса, т.е. возвращается в исходное
состояние.
36. Но чтобы при этом была совершена полезная работа, возврат должен быть произведен с наименьшими затратами. Полезная работа равна
разности работрасширения и сжатия, т.е. равна площади,
ограниченной
замкнутой
кривой.
Обязательными частями тепловой
машины
являются:
нагреватель
(источник энергии), холодильник и
рабочее тело (газ, пар).
37.
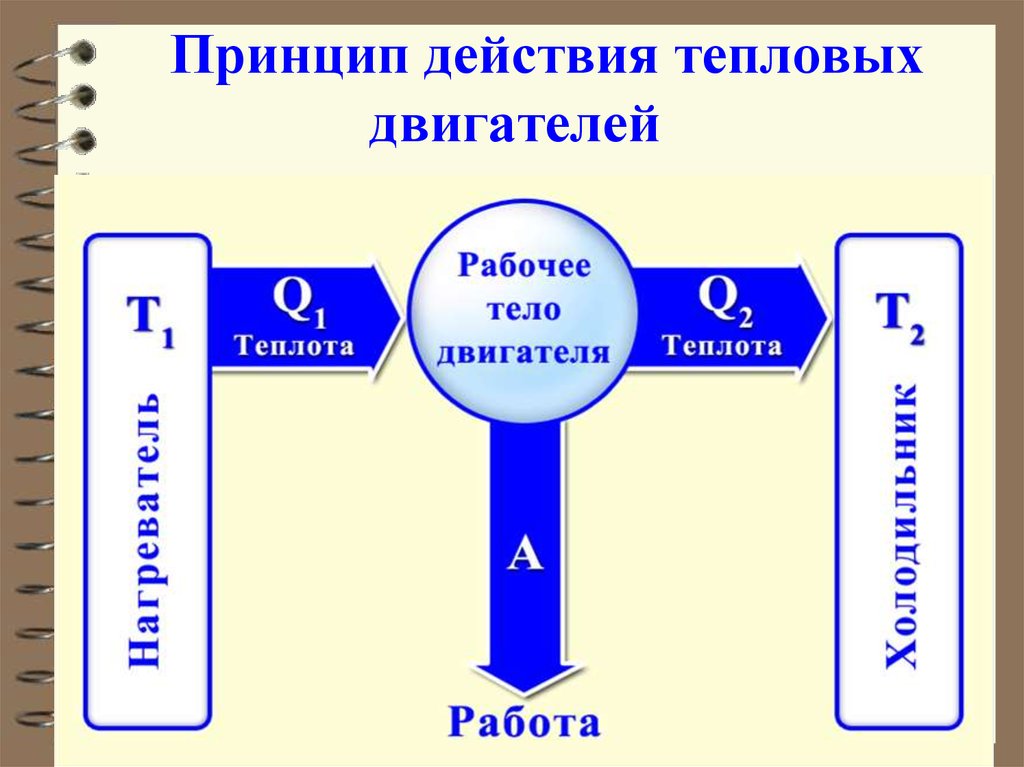
38. Принцип действия тепловых двигателей
39. Зачем холодильник? Так как в тепловой машине реализуется круговой процесс, то вернуться в исходное состояние можно с меньшими
затратами, если отдатьчасть тепла.
Если охладить пар, то его легче
сжать, следовательно, работа сжатия
будет меньше работы расширения.
Поэтому в тепловых машинах
используется холодильник.
40.
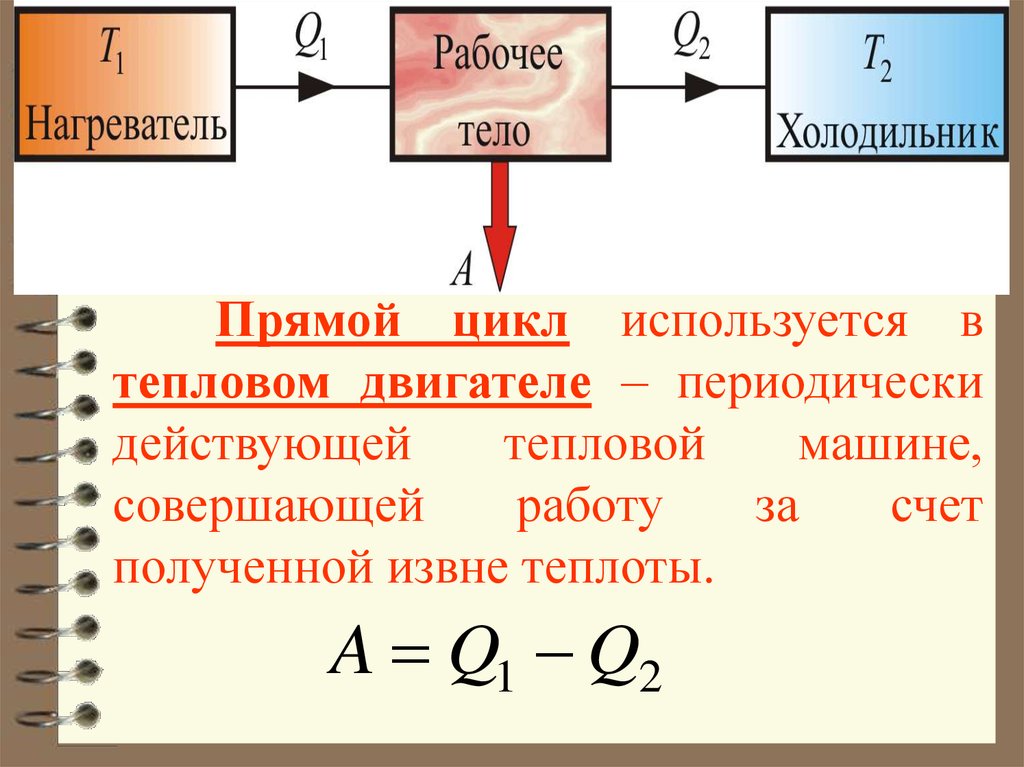
Прямой цикл используется втепловом двигателе – периодически
действующей
тепловой
машине,
совершающей
работу
за
счет
полученной извне теплоты.
A Q1 Q2
41. От термостата с более высокой температурой Т1, называемого нагревателем, за цикл отнимается количество теплоты Q1, а термостату
сболее низкой температурой Т2,
называемому холодильником, за цикл
передается количество теплоты Q2 и
совершается работа A:
A Q1 Q2
42. КПД тепловых двигателей
43. КПД тепловых двигателей
44. КПД тепловых двигателей
45. КПД тепловых двигателей
46. КПД тепловых двигателей
47.
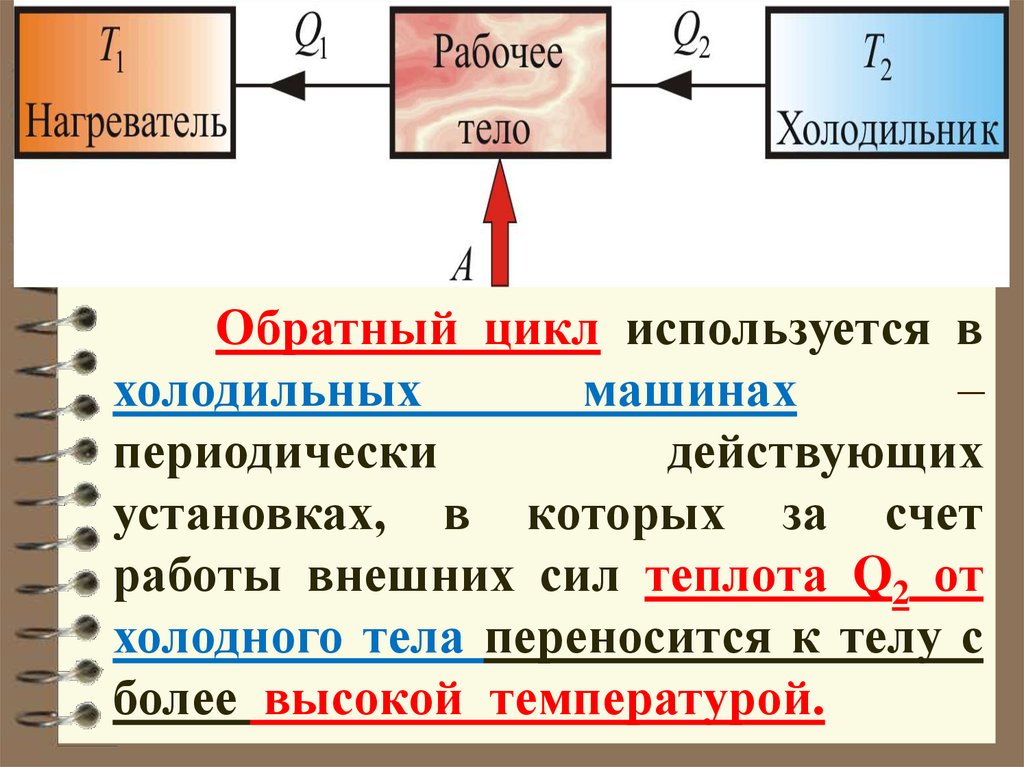
Обратный цикл используется вхолодильных
машинах
–
периодически
действующих
установках, в которых за счет
работы внешних сил теплота Q2 от
холодного тела переносится к телу с
более высокой температурой.
48.
49.
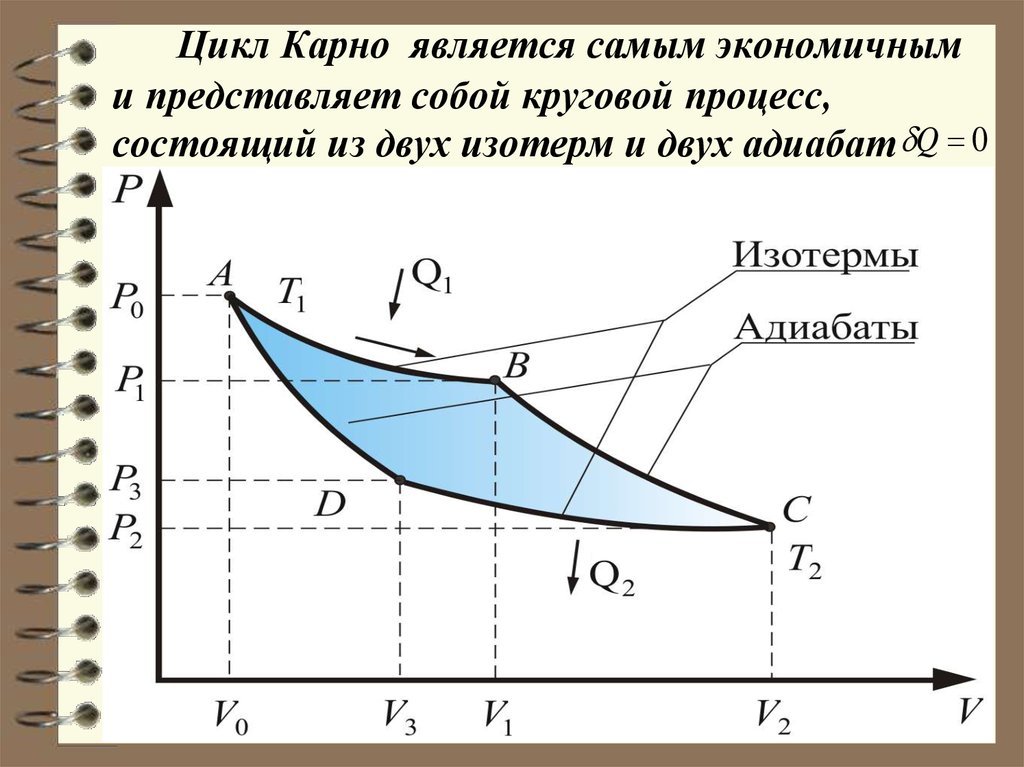
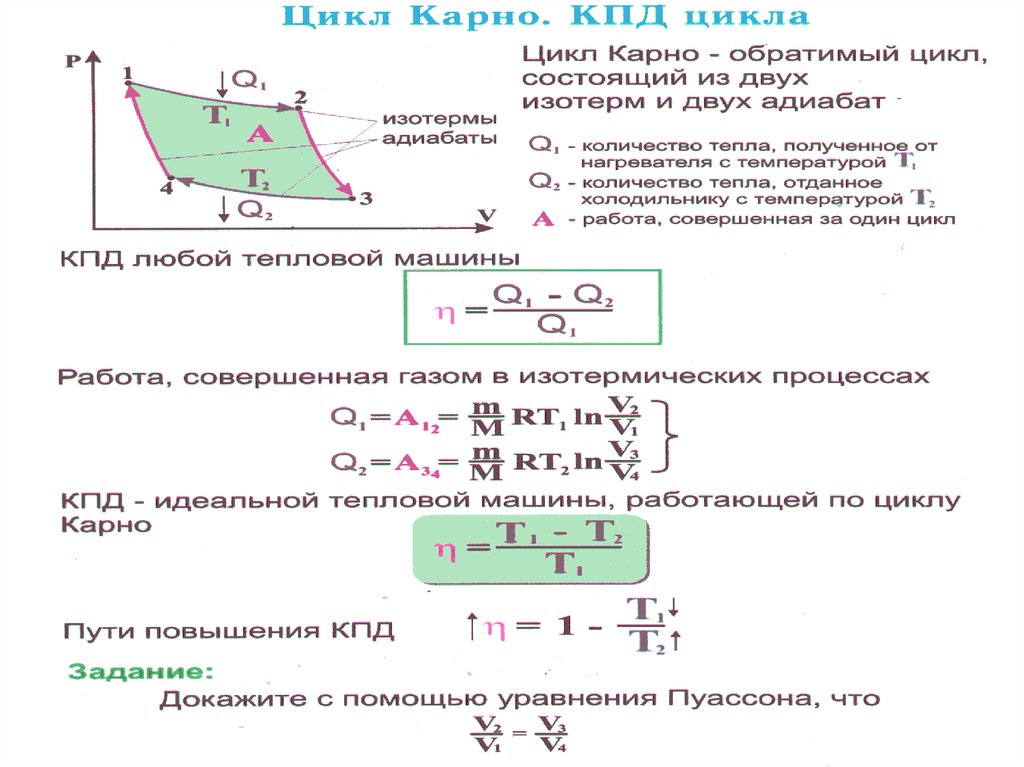
50. Цикл Карно (обратимый).
Карно теоретически проанализировал обратимыйнаиболее
экономичный
цикл, состоящий из двух
изотерм и двух адиабат.
Его называют циклом
Карно.
Прямой цикл Карно в
качестве рабочего тела
использует идеальный газ,
заключенный в сосуд с
подвижным поршнем.
51. Карно Никола Леонард Сади (1796 – 1832) – французский физик и инженер, один из создателей термодинамики. Впервые показал, что
работу можно получить вслучае, когда тепло переходит от
нагретого тела к более холодному. Ввел понятие
кругового и обратимого процессов, идеального
цикла тепловых машин, заложил тем самым основы
их теории. Пришел к понятию механического
эквивалента теплоты. В 1824 г. опубликовал
сочинение «Размышления о движущей силе огня и
о машинах способных развить эту силу».
52. Цикл Карно является самым экономичным и представляет собой круговой процесс, состоящий из двух изотерм и двух адиабат
Q 053.
54. ТЕОРЕМА КАРНО Из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей и холодильников,
наибольшим КПДобладают обратимые машины.
Причем КПД обратимых машин,
работающих по циклу Карно, равны друг
другу и не зависят от конструкции
машины и от природы рабочего вещества.
При этом КПД меньше единицы.
55.
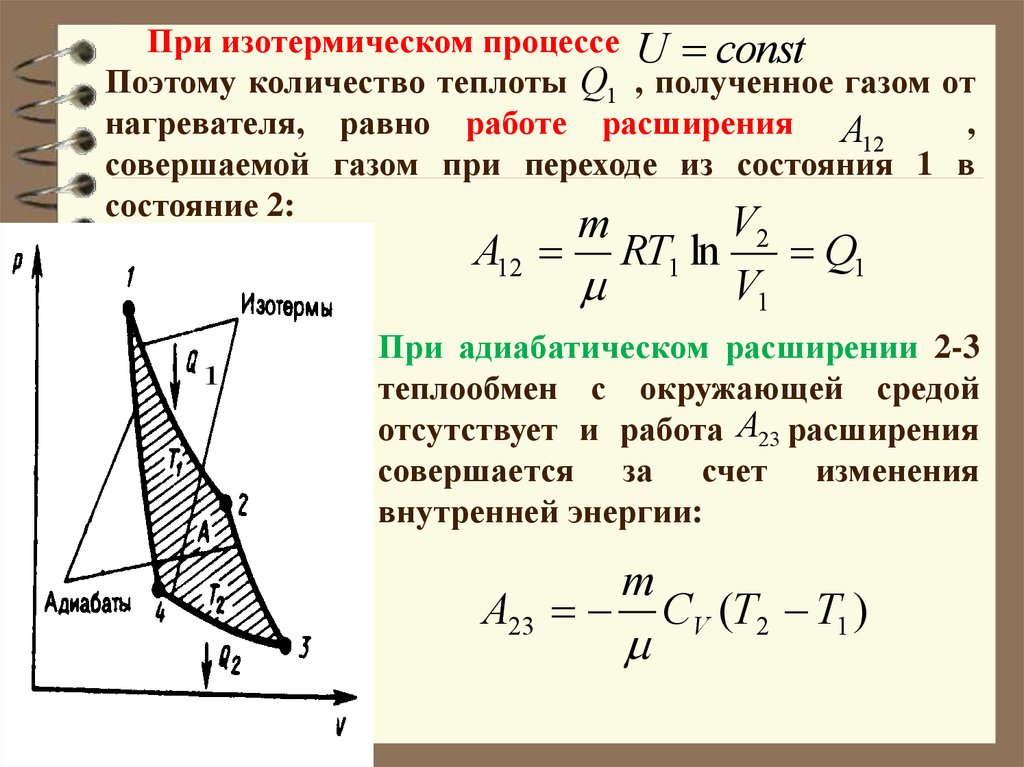
При изотермическом процессе U constПоэтому количество теплоты Q1 , полученное газом от
нагревателя, равно работе расширения A
,
12
совершаемой газом при переходе из состояния 1 в
состояние 2:
V2
A12 RT1 ln
Q1
V1
m
1
При адиабатическом расширении 2-3
теплообмен с окружающей средой
отсутствует и работа A23 расширения
совершается за счет изменения
внутренней энергии:
A23
m
CV (T2 T1 )
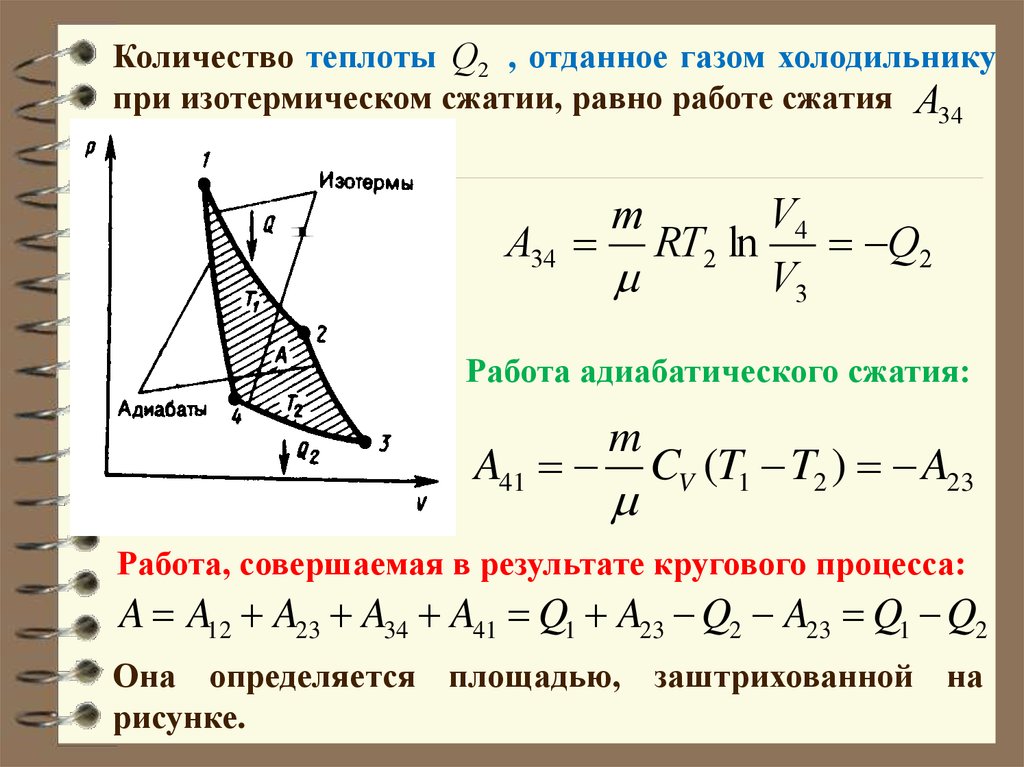
56.
Количество теплоты Q2 , отданное газом холодильникупри изотермическом сжатии, равно работе сжатия A34
1
V4
A34 RT2 ln
Q2
V3
m
Работа адиабатического сжатия:
A41
m
CV (T1 T2 ) A23
Работа, совершаемая в результате кругового процесса:
A A12 A23 A34 A41 Q1 A23 Q2 A23 Q1 Q2
Она определяется площадью, заштрихованной на
рисунке.
57.
Термический КПД цикла Карно:A (Q1 Q2 )
Q1
Q1
Применив уравнение для адиабат 2-3 и 4-1, получим:
T1V2
1
T2V3
1
и
T1V1
1
T2V4
1
, откуда
V2 V3
V1 V4
V3
m
V2 m
RT1 ln RT2 ln
Q1 Q2
V1
V4 T1 T2
m
V2
Q1
T
1
RT1 ln
V1
58. Видно, что η < 1 и зависит от разности температур между нагревателем и холодильником (и не зависит от конструкции машины и рода
Видно, что η < 1 и зависит T T отT
разности температур между нагревателем и
холодильником
(и
не
зависит
от
конструкции машины и рода рабочего
тела). Это ещё одна формулировка
теоремы
Карно.
Цикл Карно, рассмотренный нами, был
на всех стадиях проведен так, что не было
необратимых процессов, (не было
соприкосновения
тел
с
разными
температурами). Поэтому здесь самый
большой КПД. Больше получить в
принципе невозможно.
1
2
1
59.
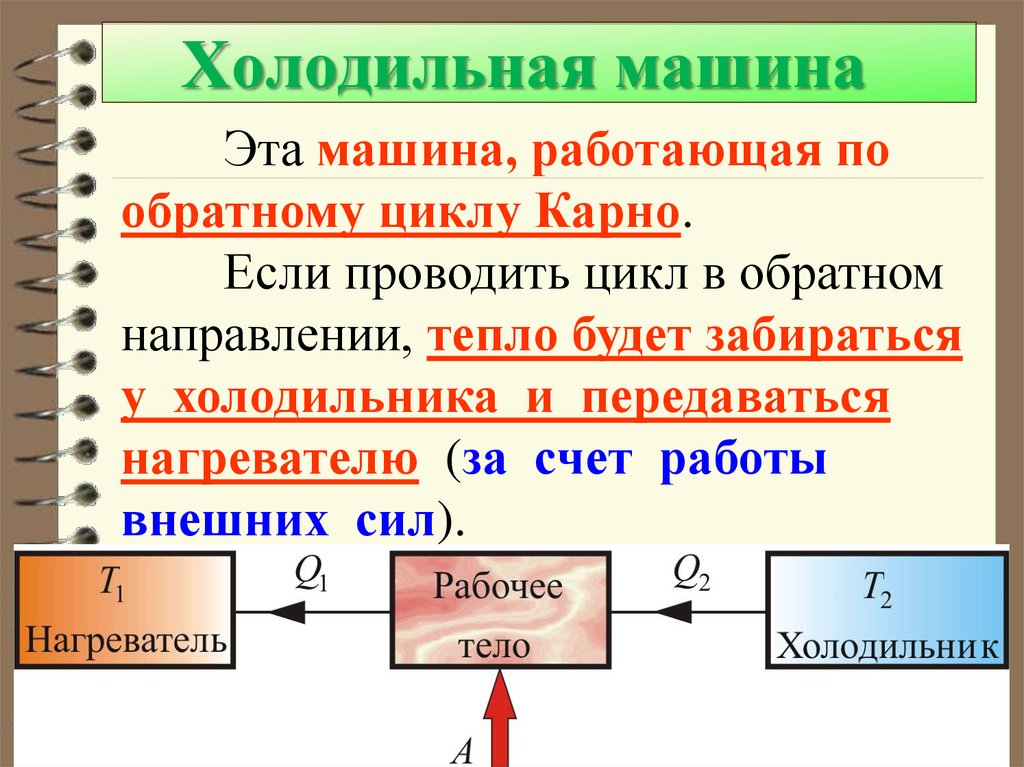
60. Холодильная машина
Эта машина, работающая пообратному циклу Карно.
Если проводить цикл в обратном
направлении, тепло будет забираться
у холодильника и передаваться
нагревателю (за счет работы
внешних сил).
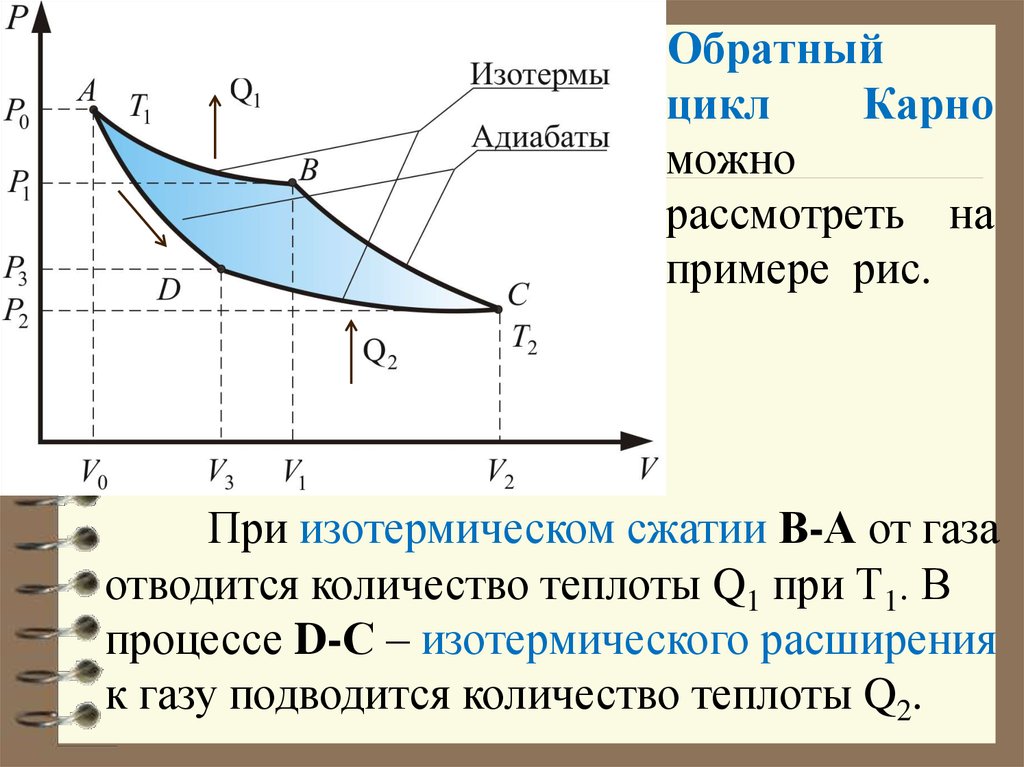
61.
Обратныйцикл
Карно
можно
рассмотреть на
примере рис.
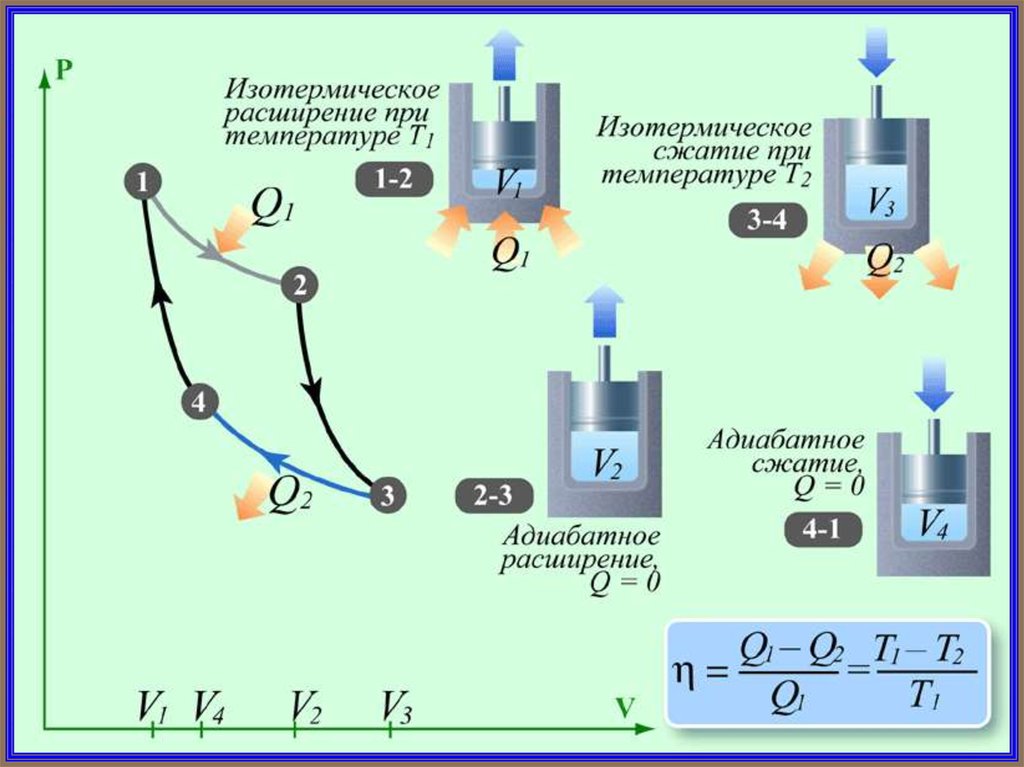
При изотермическом сжатии В-А от газа
отводится количество теплоты Q1 при Т1. В
процессе D-С – изотермического расширения
к газу подводится количество теплоты Q2.
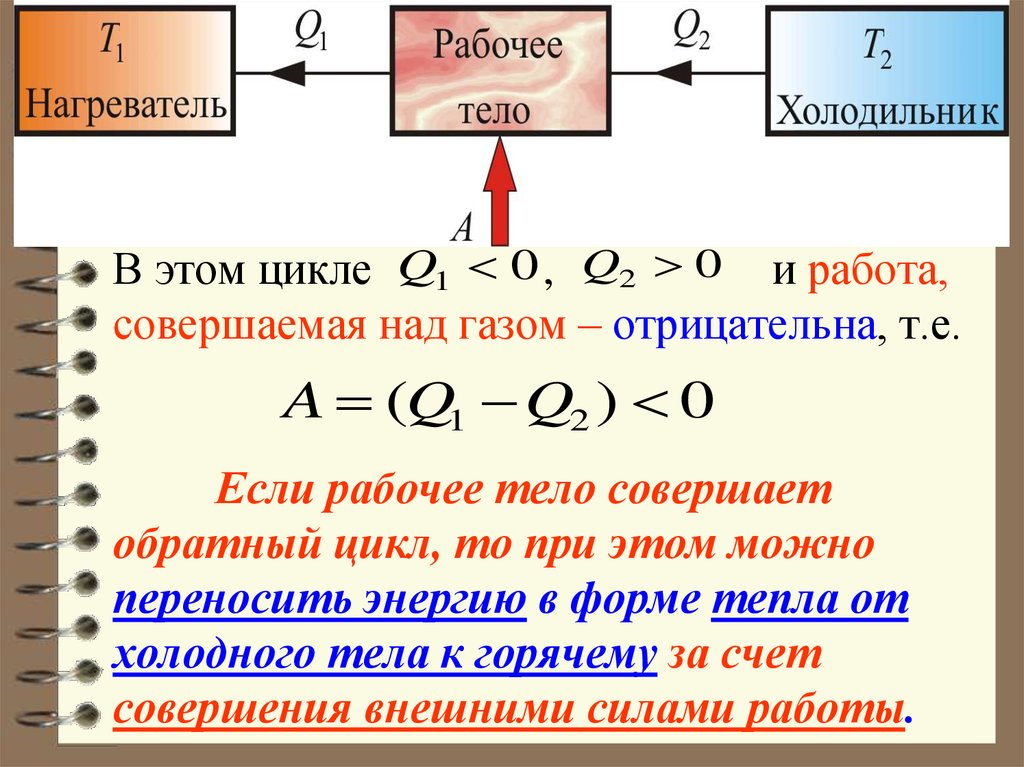
62. В этом цикле , и работа, совершаемая над газом – отрицательна, т.е. Если рабочее тело совершает обратный цикл, то при этом
В этом цикле Q1 0 , Q2 0 и работа,совершаемая над газом – отрицательна, т.е.
A (Q1 Q2 ) 0
Если рабочее тело совершает
обратный цикл, то при этом можно
переносить энергию в форме тепла от
холодного тела к горячему за счет
совершения внешними силами работы.
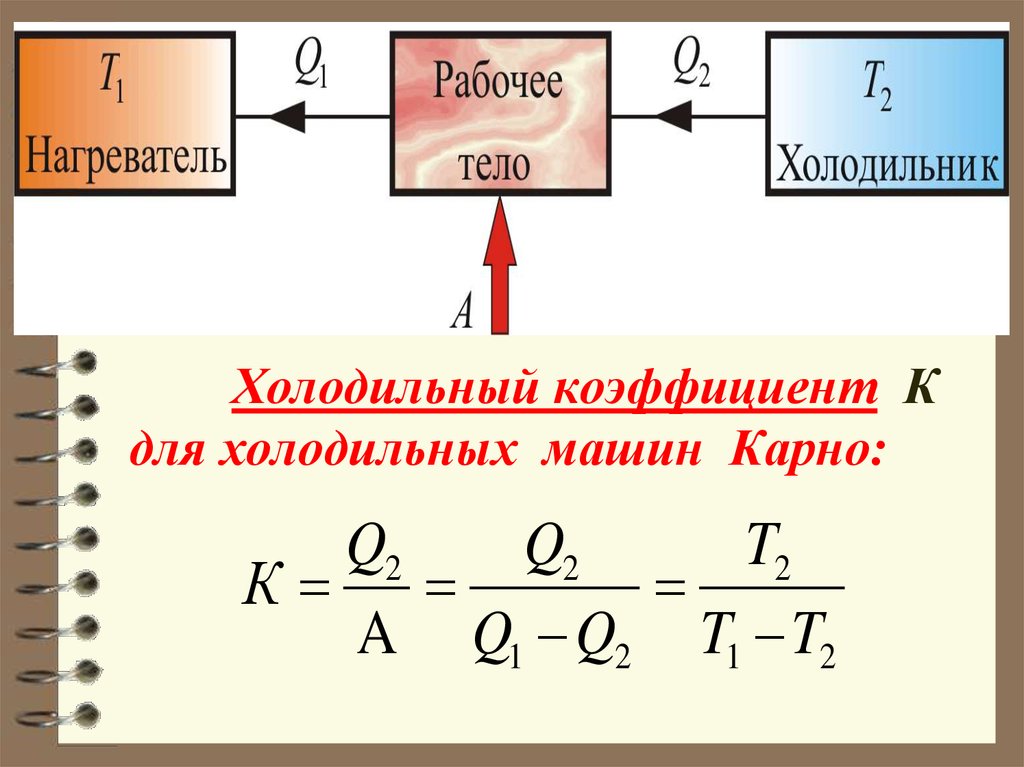
63. Холодильный коэффициент К для холодильных машин Карно:
Q2Q2
T2
К
A Q1 Q2 T1 T2
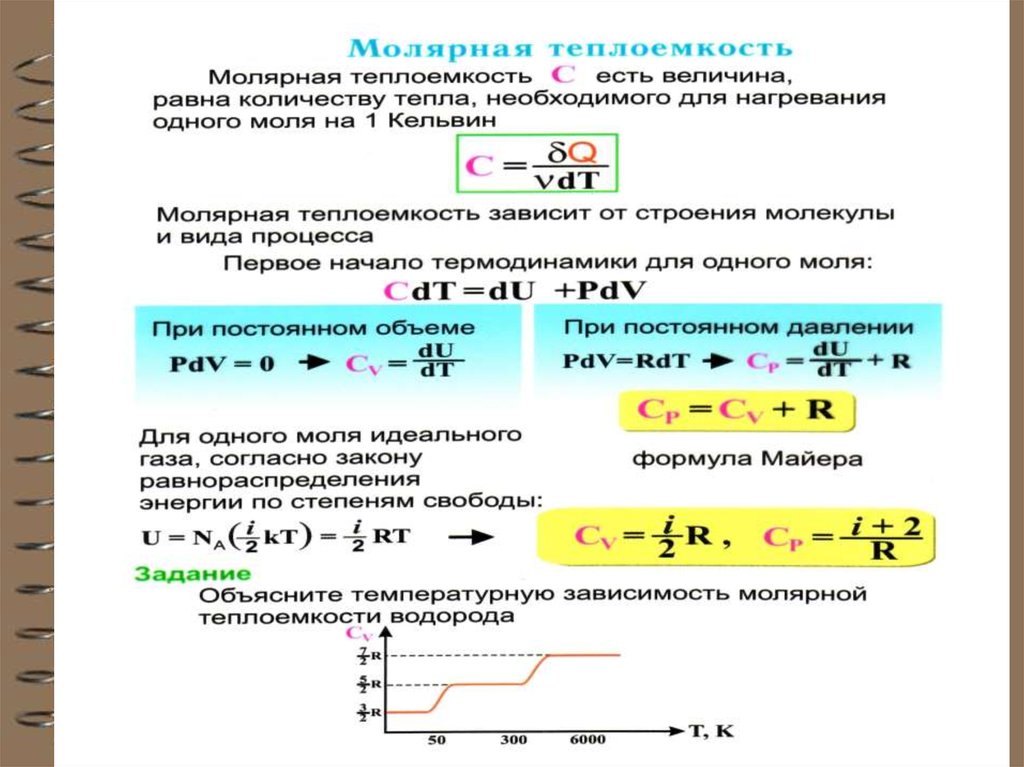
64. Теплоёмкость идеального газа
Теплоёмкость тела характеризуетсяколичеством теплоты, необходимой для
нагревания этого тела на один градус
C
Q
dT
Размерность теплоемкости: [C] = Дж/К.
Теплоёмкость – величина неопределённая,
поэтому пользуются понятиями удельной и
молярной теплоёмкости.
65. Удельная теплоёмкость Суд – есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] =
Удельная теплоёмкость Суд – естьколичество теплоты, необходимое для
нагревания единицы массы вещества на
1 градус С Q .
уд
m dT
[Cуд] = Дж/(кг∙К).
Для газов удобно пользоваться
молярной теплоемкостью Сμ количество
теплоты, необходимое для нагревания
1 моля газа на 1 градус
Cμ Cуд μ
[Cμ] = Дж/(моль К).
66. Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании. Если газ нагревать при
постоянном объёме, то всё подводимоетепло идёт на нагревание
газа, то есть изменение его
внутренней энергии.
Теплоёмкость при
постоянном объёме СV
Q
dU
CV
dT V dT V
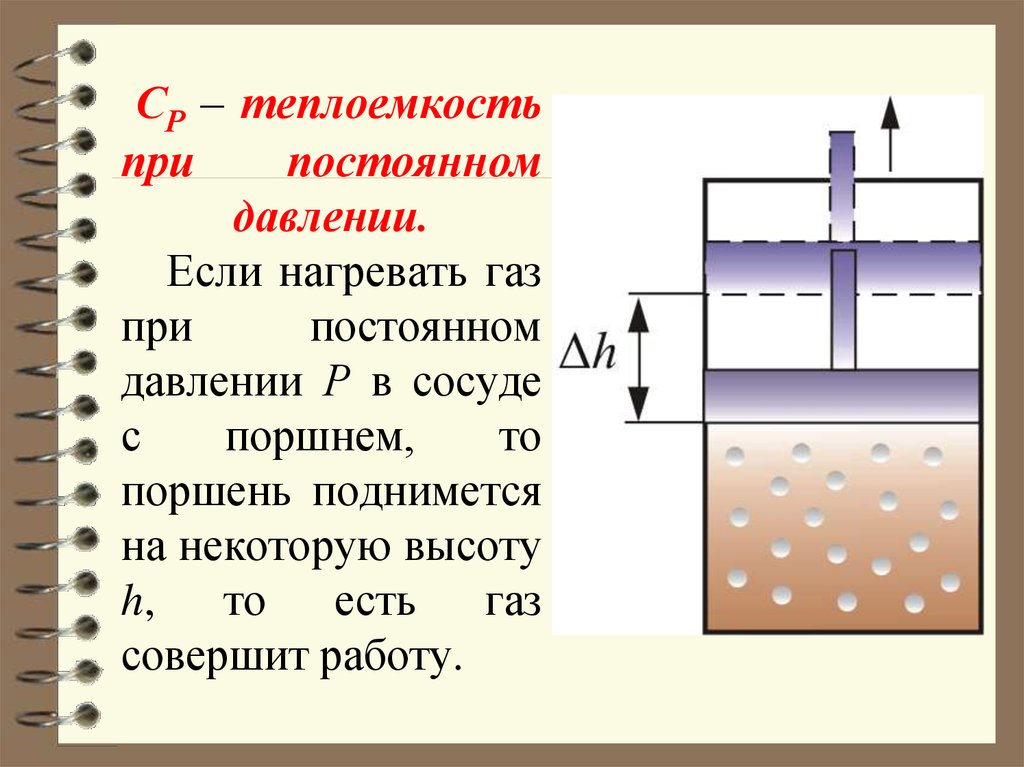
67. СР – теплоемкость при постоянном давлении. Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень
подниметсяна некоторую высоту
h, то есть газ
совершит работу.
68. Следовательно, проводимое тепло затрачивается и на нагревание и на совершение работы. Отсюда ясно, что Итак, проводимое тепло и
Следовательно, проводимое теплозатрачивается и на нагревание и на
совершение работы. Отсюда ясно, что
CP CV
Итак, проводимое тепло и теплоёмкость
зависят от того, каким путём осуществляется передача тепла.
Следовательно Q и С не являются
функциями состояния. Величины СР и СV
оказываются связанными простыми
соотношениями. Найдём их.
69. При изобарическом процессе кроме увеличения внутренней энергии происходит совершение работы газом (из I начала ТД): (для 1
При изобарическом процессе кромеувеличения внутренней энергии происходит
совершение работы газом (из I начала ТД):
QP dU PdV
CP
QP
dT
dU
dT
P
(для 1 моля)
dV
dT
Из основного уравнения молекулярнокинетической теории для 1моля: PV RT .
При изобарическом процессе Р = const.
Тогда получим:
C C R
P
V
70. Это уравнение Роберта Майера для одного моля газа. Из него следует, что физический смысл универсальной газовой постоянной в
CP CV RЭто уравнение Роберта Майера для одного
моля газа. Из него следует, что физический
смысл универсальной газовой постоянной в
том, что R – численно равна работе,
совершаемой одним молем газа при
нагревании на один градус при изобарическом процессе.
Используя это соотношение, Роберт
Майер в 1842 г. вычислил механический
эквивалент теплоты: 1 кал = 4,19 Дж.
Для ν молей: CP CV R
71. В общем случае так как внутренняя энергия U может зависеть только от температуры. В случае 1 моля идеального газа спра-ведлива
В общем случае CV
U
T V
так как внутренняя энергия U может зависеть
только от температуры.
В случае 1 моля идеального газа справедлива формула изм. внутренней энергии:
dU μ CV dT
Из этого следует, что для 1 моля:
T
U μ CV dT CV T
0
U μ CV T
72. Внутренняя энергия идеального газа является только функцией температуры (и не зависит от V, Р и тому подобных величин), поэтому
формулаU CV T справедлива для любого
процесса ( для 1 моля).
Для произвольной массы идеального
газа:
m
U
CV T
73.
Внутренняя энергия одного моляидеального
одноатомного
газа
равна:
3
3
U N A kT RT
2
2
U
3
RT
2
3
Дж
dU
CV
,
R 12,5
2
моль К
dT V
молярная
теплоемкость
при
постоянном объеме СV – величина
постоянная, от температуры не зависит.
74.
Внутренняя энергия одного моляидеального газа c i степенями
свободы равна:
U
i
RT
2
i
dU
CV
R
2
dT V
молярная
теплоемкость
при
постоянном объеме СV – величина
постоянная, от температуры не зависит.
75.
Учитывая физический смысл R дляизобарических процессов можно записать:
dQP dU μ RdT
(для одного моля). Отсюда для одноатомного:
3
5
CP R R R
2
2
Тогда,
молярная теплоемкость при
постоянном давлении для одноатомных
газов:
5
Дж
C P R 20,8
2
моль К
76.
Для одного моля идеального газа:i
i 2
CP R R
R
2
2
Постоянная адиабаты (коэффициент
Пуассона) для идеального
СР i 2
газа:
СV
i
Для одноатомного идеального газа (i = 3): 20,8
12,5
1,67
77.
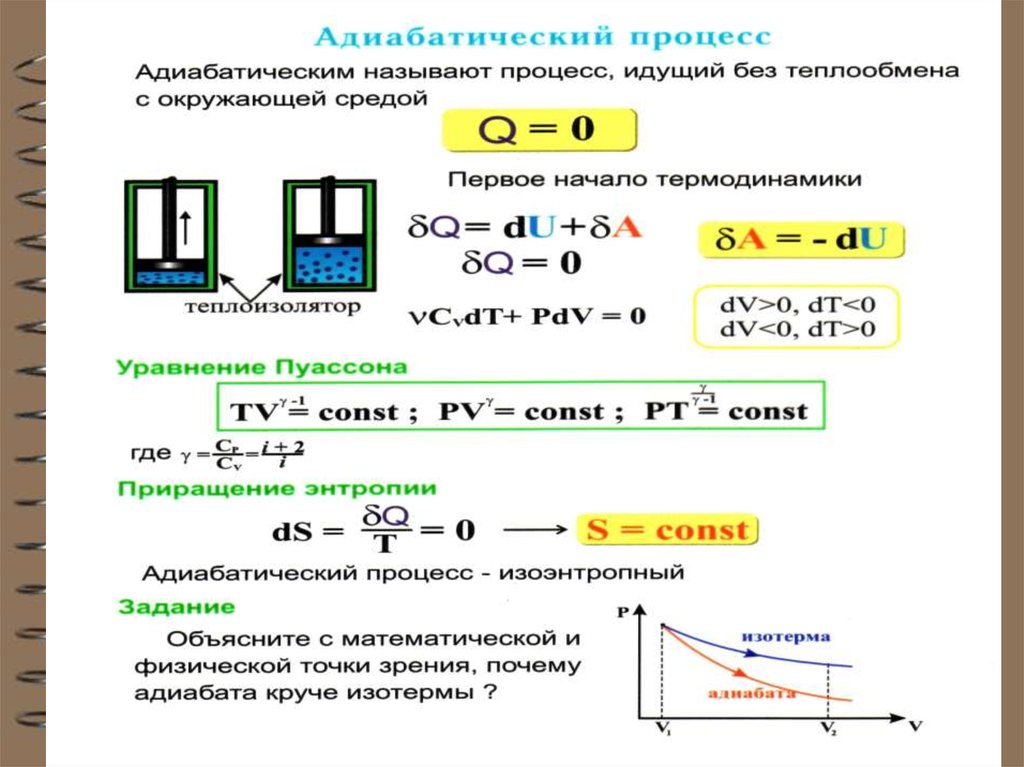
78. Адиабатный (адиабатический) процесс
Это процесс, происходящий безтеплообмена с окружающей средой, т.е. Q 0
При адиабатном процессе работа системы
(или над системой) совершается за счет изменения внутренней энергии газа: dU A 0
(из I начала ТД: Q dU A при Q 0 ).
Вывод уравнения адиабаты.
dU CV dT и A = PdV :
CV dT РdV 0
Для 1 моля идеального газа:
РV RT T PV / R
79.
PdV VdPdT
Подставляя dT в уравнение:
R
R
СV
PdV VdP PdV 0 Группируя PdV:
R
СV R PdV CV VdP 0
CV R CP
C P PdV CV VdP 0
dV dP
0,
V
P
СV PV
СP
CV
Делим на
где
Т.к. γ = const ( для одноатомного газа γ = 5/3 ), то
80.
dVdP
0 ln V ln P const
V
P
ln PV const
PV const -уравнение Пуассона или
уравнение адиабаты для
идеального газа
Или в переменных Т и V уравнение
адиабаты для идеального газа:
ТV
1
const
81.
82. Здесь уместно рассмотреть еще и политропный процесс – такой процесс, при котором изменяются все основные параметры системы,
крометеплоемкости, т.е. С = const.
Уравнение политропы
или
PV
TV
n
n 1
const
const
Здесь n – показатель
C CP
политропы:
n
C CV
83. С помощью показателя n можно легко описать любой изопроцесс: 1. Изобарный процесс Р = const, n = 0 2. Изотермический процесс Т
С помощью показателя n можно легкоописать любой изопроцесс:
1. Изобарный процесс Р = const, n = 0
γR
C
γCV CP .
γ 1
2. Изотермический процесс Т = const, n = 1,
CT .
3. Изохорный процесс V = const, n
R
CV
.
γ 1
84. 4. Адиабатический процесс Q = 0, n = γ, Сад = 0. Во всех этих процессах работу можно вычислить по одной формуле:
4. Адиабатический процесс Q = 0,n = γ, Сад = 0.
Во всех этих процессах работу
можно вычислить по одной формуле:
V1
P1V1
1
A
n 1 V2
n 1
85.
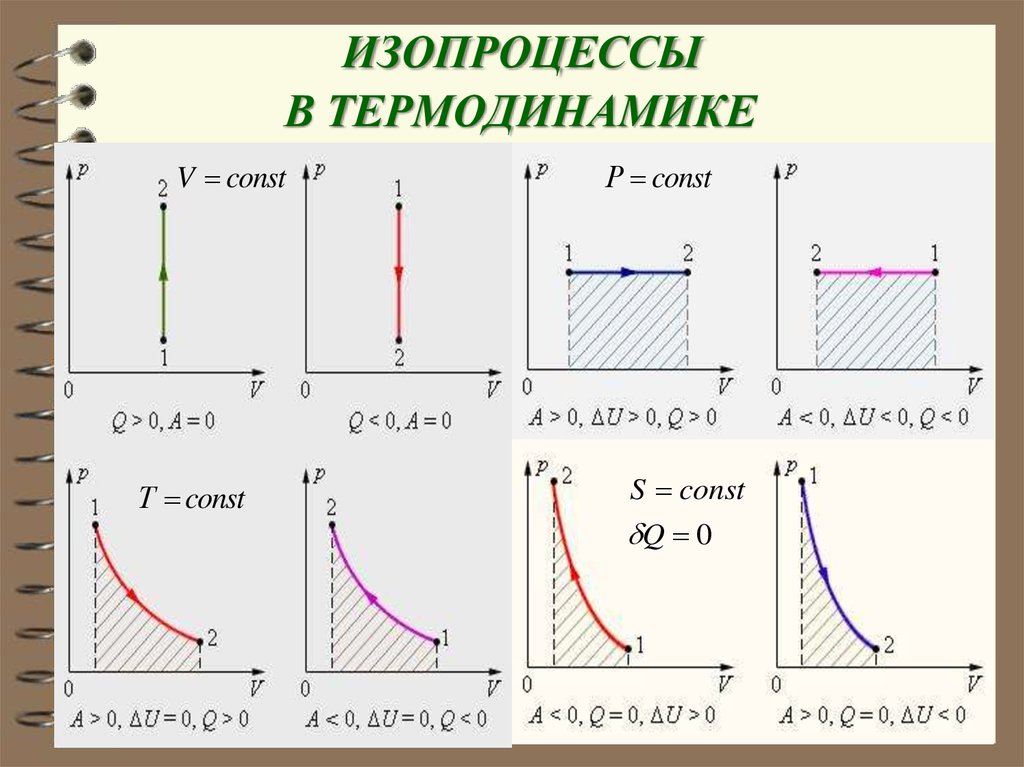
γ86. ИЗОПРОЦЕССЫ В ТЕРМОДИНАМИКЕ
V constТ const
Р const
S const
Q 0







































![Удельная теплоёмкость Суд – есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] = Удельная теплоёмкость Суд – есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [Cуд] =](https://cf.ppt-online.org/files1/slide/r/rDc57PzR3x8eyX6JpaZbfslgKhFHjAtV9nmQBu/slide-64.jpg)



















 physics
physics