Similar presentations:
Первое начало термодинамики. Температура. (Лекция 3)
1. 3.1 Температура
ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ1
2. Термодинамика
– это раздел физики, занимающийся изучением общихсвойств вещества, связанных с тепловым движением.
Термодинамика является наиболее общим способом описания поведения
макроскопических систем, который применим к любым системам независимо
от конкретной физической природы составляющих ее частиц.
Термодинамика базируется на основных законах (постулатах), называемых
началами термодинамики, справедливость которых подтверждается только
опытным путем.
Под общим началом термодинамики понимается следующий постулат: каким
бы ли было начальное состояние тел изолированной системы, в ней, в конце
концов, установится термодинамическое равновесие, при котором прекратятся
все макроскопические процессы. Необходимым условием
термодинамического равновесия является равенство температур всех тел,
составляющих систему.
2
3. Температура
Температурой называется физическая величина, определяющая «степеньнагретости» тел и характеризующая состояние термодинамического
равновесия системы.
Температура зависит от параметров состояния системы, например, от
давления p и объема V, и является функцией внутренней энергии системы
U.
Температура является макроскопической характеристикой
термодинамической системы; она не имеет смысла для систем,
состоящих из одной или нескольких молекул.
Важное физическое содержание термодинамической температуры
заключается в том, что она, согласно МКТ, определяется среднюю
кинетическую энергию молекул
3
4. Термодинамическая шкала температур
Вфизике
наиболее
часто
используется
термодинамическая
шкала
температур
(шкала
Кельвина). Единицей температуры по этой шкале
является кельвин (К), являющийся одной из основных
единиц СИ: [T] = K.
Термодинамическую шкалу температур строят по общей
реперной точке – тройной точке воды Tтр – температуре,
при которой вода, водяной пар и лед находятся в
равновесии при давлении 609 Па.
Tтр = 273,16 К
4
5. Температурные шкалы
Температура по шкале Цельсия t С связана с термодинамическойтемпературой T соотношением,
t C T 273,15
причем точке кристаллизации воды соответствует температура t = 0 C =
273,15 K, а точке кипения воды – температура t = 100 С = 373,15 K.
В ряде стран используется температурная шкала Фаренгейта, которая
обозначается t F. Связь температур по шкале Фаренгейта и шкале
Цельсия определяется соотношениями:
9
t F 32 t C;
5
5
t C (t F 32).
9
5
6. Абсолютный нуль температуры
Температура T = 0 К называется абсолютным нулемтемпературы. Это самая низкая из всех возможных
температур. Абсолютный нуль температуры
принципиальной недостижим, но приблизиться к нему по
мере развития экспериментальной техники удается все
ближе и ближе.
6
7. Характерные значения температур в природе и технике
Температура, КОбъект/процесс с данной температурой
109
Внутренность поверхность горячих звезд
108
Взрыв водородной бомбы
107
Внутренность Солнца
106
Солнечная корона
105
Поверхность горячих звезд
104
Поверхность Солнца
103
Газовая турбина
102
Кипение воды
77
Сжижение азота
4
Сжижение гелия
2 10-8
Самая низкая из достигнутых температур
7
8. 3.2 Термодинамические процессы
ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ8
9. Равновесное состояние термодинамической системы
Равновесным состоянием термодинамической системыназывается состояние, при котором все параметры,
характеризующие систему, определены и не меняются с
течением времени.
Если какой-либо из параметров системы не имеет
определенного значения (например, температура системы
в разных ее частях различна), то такое состояние
термодинамической системы называется неравновесным.
По истечении некоторого времени , называемого
временем релаксации, система самопроизвольно
переходит из неравновесного в равновесное состояние.
9
10. Термодинамический процесс
Термодинамическим процессом называется изменение хотябы одного из параметров состояния термодинамической
системы.
Обычно в термодинамике рассматривают квазиравновесные
(квазистатические) процессы, при которых время изменения t
какого-либо из параметров состояния значительно превосходит
время релаксации , т.е. t >> .
Важным свойством таких процессов является их обратимость.
Процесс называется обратимым, если он может быть
осуществлен в обратном порядке через ту же совокупность
квазиравновесных состояний, по которым был реализован
прямой процесс.
10
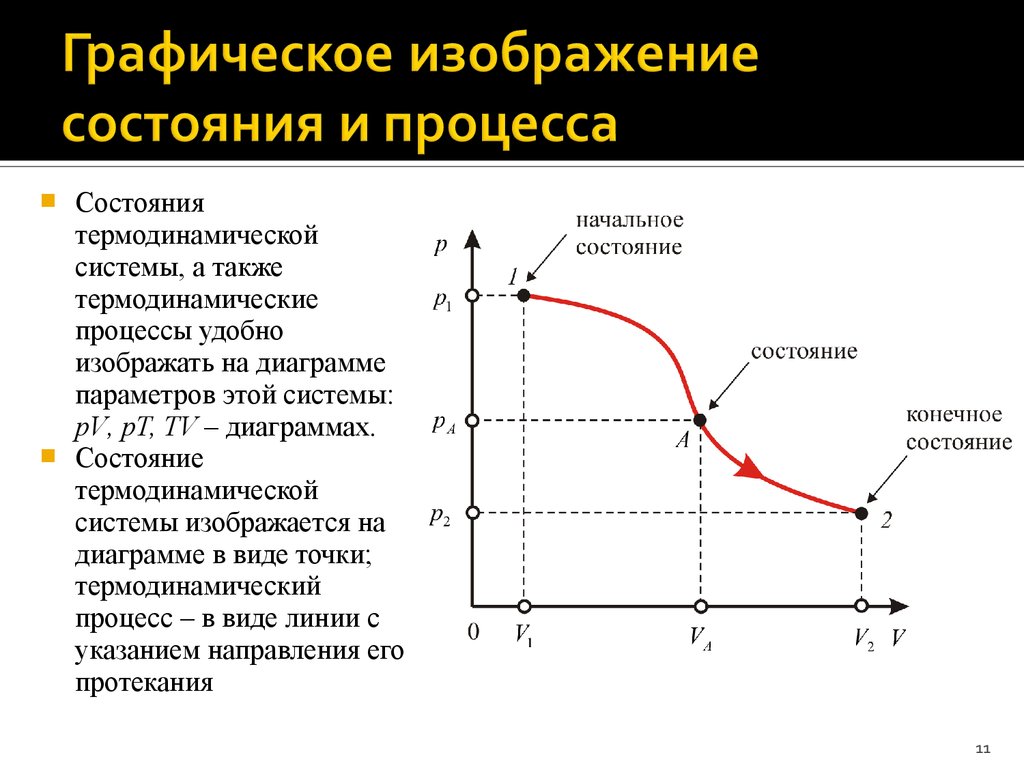
11. Графическое изображение состояния и процесса
Состояниятермодинамической
системы, а также
термодинамические
процессы удобно
изображать на диаграмме
параметров этой системы:
pV, pT, TV – диаграммах.
Состояние
термодинамической
системы изображается на
диаграмме в виде точки;
термодинамический
процесс – в виде линии с
указанием направления его
протекания
11
12. 3.3 Внутренняя энергия идеального газа. Работа. Количество теплоты
ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ12
13. Работа идеального газа
При бесконечном малом изменении объема термодинамической системына величину dV совершается элементарная работа
A pdV
где p – давление газа.
При изменении объема термодинамической системы от значения V1 до
значения V2 совершает работа
A12 A
V2
p(V )dV
V1
Если A12 > 0 (расширение), то работа совершается самой
термодинамической системой над внешними силами; если A12 < 0
(сжатие), то внешние силы совершают работу над системой.
13
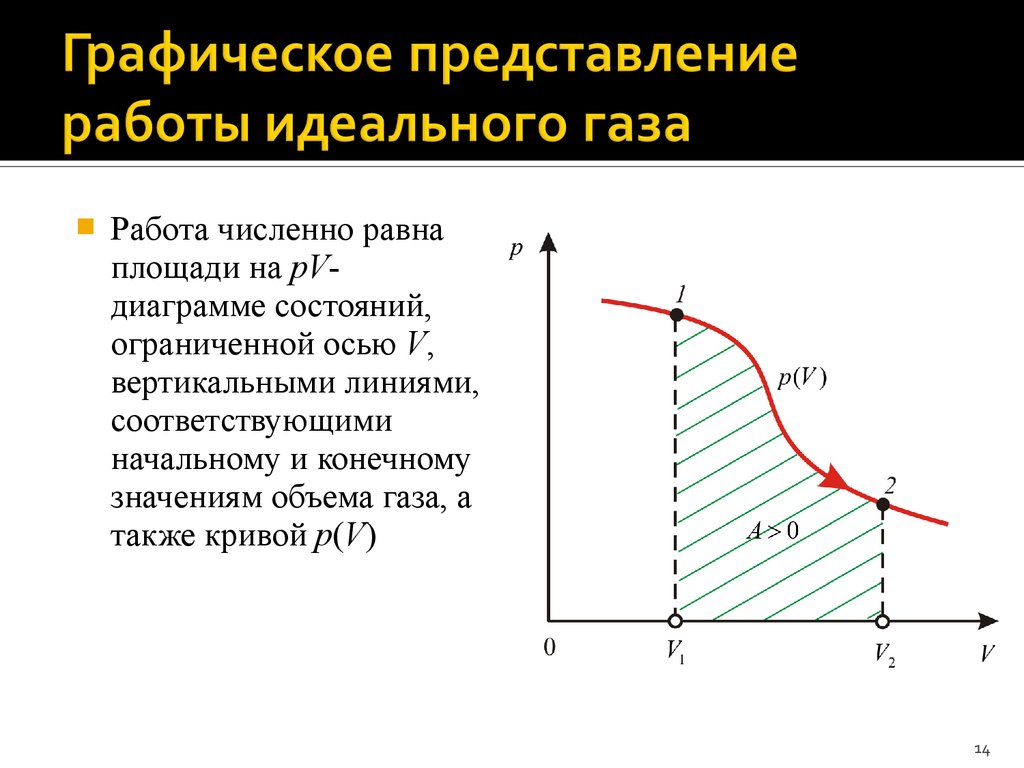
14. Графическое представление работы идеального газа
Работа численно равнаплощади на pVдиаграмме состояний,
ограниченной осью V,
вертикальными линиями,
соответствующими
начальному и конечному
значениям объема газа, а
также кривой p(V)
14
15. Внутренняя энергия термодинамической системы
Важной физической величиной, характеризующей равновесное состояниетермодинамической системы, является внутренняя энергия U –
величина, равная сумме:
кинетической энергии поступательного движения молекул пост,
кинетической энергии вращательного движения молекул вращ,
кинетической и потенциальной энергии колебательного движения молекул и атомов в
молекулах кол , кол,
потенциальной энергии взаимодействия между молекулами вз,
внутримолекулярной энергии в/м :
U пост вращ кол кол вз в/м
Отметим, что кинетическая энергия системы как целого и ее
потенциальная энергия во внешнем поле во внутреннюю энергию не
входят.
15
16. Свойства внутренней энергии
Внутренняя энергия определена с точностью до произвольнойпостоянной. Поскольку в термодинамических системах
внутримолекулярная энергия, включающая в себя энергию электронных
оболочек атомов и внутриядерную энергию, остается, как правило,
неизменной, то ее вклад во внутреннюю энергию можно не учитывать.
Внутренняя энергия является аддитивной величиной: внутренняя энергия
системы U представляет собой сумму внутренних энергий Ui отдельных
частей, образующих эту систему:
U U i
i
Внутренняя энергия является функцией состояния термодинамической
системы: приращение внутренней энергии U при переходе системы из
состояния 1 в состояние 2 не зависит от пути перехода, а определяется
лишь разностью значений U в конечном и начальном состояниях:
U U 2 U 2 U (вид процесса)
16
17. Внутренняя энергия идеального газа
Для идеального газа потенциальная энергия взаимодействия междумолекулами равна нулю: вз = 0, поэтому
U пост вращ кол кол
С учетом равнораспределения энергии по степеням свободы молекул
энергия одного моля идеального газа Uмол выражается через число
степеней свободы его молекул i соотношением
U мол
i
i
kT N A RT
2
2
Внутренняя энергия молей идеального газа ( - показатель адиабаты)
i
RT
U RT
2
1
i 2
i
17
18. Внутренняя энергия смеси идеальных газов
находится по формулеj
см
U U j
RT
RT
см 1
j
i j 1
Здесь см – полное число молей смеси газов, а см – показатель
адиабаты смеси:
см
см
1
j
j 1
j
18
19. Количество теплоты
При приведении в соприкосновение двух термодинамических систем ихвнутренняя энергия изменяется. Такой процесс обмена энергией может
происходить без совершения макроскопической работы; в этом случае он
называется теплообменом (теплопередачей).
Энергия, переданная одной системе другой без совершения механической
работы (т.е. в результате теплообмена) называется количеством теплоты,
или просто теплотой Q.
Существует 3 вида теплообмена: теплопроводность (процесс, при
котором перенос тепла происходит за счет передачи энергии от более
энергичных частиц (молекул, атомов) менее энергетичным и не
сопровождается переносом массы вещества), конвекция (процесс
переноса тепла в движущихся средах с неоднородным полем температуры)
и лучистый теплообмен (процесс переноса энергии, обусловленный
превращением части внутренней энергии вещества в энергию излучения)
19
20. Циклические процессы
Циклическим (круговым)процессом называется процесс, в
результате которого
термодинамическая система
возвращается в исходное
состояние.
Такой процесс на pV-диаграмме
изображается замкнутой кривой.
Работа A, совершенная системой
при круговом процессе, численно
равна площади, охватываемой
циклом.
20
21. 3.4 Первое начало термодинамики
ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ21
22. Первое начало термодинамики
представляет собой законсохранения энергии для тепловых процессов и устанавливает
количественные соотношения при превращении энергии из одних
видов в другие
Оно формулируется следующим образом: количество теплоты Q,
переданное термодинамической системе, идет на приращение ее
внутренней энергии U и на совершение системой работы A над
внешними телами:
Q U A
В этом соотношении все величины являются алгебраическими, т.е.
могут принимать как положительные, так и отрицательные значения.
22
23. Дифференциальная форма первого начала термодинамики
В дифференциальной форме первое начало термодинамики имеетследующий вид:
Q dU A
Бесконечно малое изменение внутренней энергии U представляет
собой полный дифференциал dU, поэтому интеграл
2
dU U
2
U 1 U
1
не зависит от пути перехода из состояния 1 в состояние 2 и равен
разности внутренних энергий системы в конечном и начальном
состояниях (внутренняя энергия является функцией состояния)
23
24. Дифференциальная форма первого начала термодинамики
Бесконечно малые величины (не приращения!) A и Q представляютсобой элементарные работу и количество теплоты соответственно;
они не являются полными дифференциалами. Интегралы от этих
величин
2
Q Q
12
1
2
;
A A
12
1
зависят от пути перехода из состояния 1 в состояние 2. Таким
образом, количество теплоты Q12 и работа A12 не являются функциями
состояния термодинамической системы, они являются функциями
процесса.
24
25. Первое начало термодинамики и perpetuum mobile
Применительнок вечному двигателю
первое начало термодинамики
формулируется так: вечный двигатель
первого рода невозможен, т.е. невозможен
такой двигатель, совершающий
периодический процесс, при котором
совершенная им работа была бы больше
полученной извне энергии.
25
26. 3.5 Теплоемкость
ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ26
27. Теплоемкость тела
Теплоемкостьютела Стела называется
количество теплоты, которое нужно
сообщить телу, чтобы повысить его
температуру на 1 К:
C тела
Q
dT
27
28. Удельная и молярная теплоемкости
Удельной теплоемкостью с называется теплоемкость единицы массывещества (количество теплоты, которое нужно сообщить единице массы
вещества, чтобы повысить его температуру на 1 К).
Молярной теплоемкостью С называется теплоемкость одного моля
вещества (количество теплоты, которое нужно сообщить одному молю
вещества, чтобы повысить его температуру на 1 К)
Размерности этих величин: [cтела] = Дж/К; [c] = Дж/(К кг); [С] = Дж/(К моль);
Удельная и молярная теплоемкости связаны соотношением
где M – молярная масса вещества.
c
C
M
28
29. Связь между c и Q
Найдем количество теплоты Q, которое нужно сообщить телу массыm для того, чтобы нагреть его от температуры T1 до температуры T2:
Q
c
Q cmdT ,
mdT
T2
Q cmdT cm(T2 T1 )
T1
29
30. Молярная теплоемкость при постоянном объме
Наибольший интерес представляют теплоемкости процессов, вкоторых объем или давления являются постоянными (V = const или p
= const).
Молярная теплоемкость идеального газа при постоянном объеме:
Q
dU мол pdVm
dU мол
CV
dT
dT
dT
V
V
V
Отсюда внутренняя энергия одного моля газа
U
С T
а внутренняя энергия массымолm газаV
m
U СV T
CV T
M
30
31. Молярная теплоемкость при постоянном давлении
Молярная теплоемкость газа при постоянном давленииQ
C dT pdV
dV
C p мол V
C
p
V
dT
dT
dT
p
p
p
Разность теплоемкостей:
dV
C p CV p
dT
p
Из уравнения состояния идеального газа получим:
R
dV
pdV RdT при p const
dT
p p
31
32. Уравнение Майера
Таким образом, получаем уравнение Майера, изкоторого определим физический смысл универсальной
газовой постоянной:
C p CV R
Универсальная газовая постоянная R численно равна
работе, совершаемой одним молем идеального газа при
повышении его температуры на один кельвин при
постоянном давлении.
Ap
dV
C p CV R p
dT p dT
32
33. Молярные теплоемкости и число степеней свободы молекул газа
Молярные теплоемкости CV и Cp идеального газа выражаются черезчисло степеней свободы молекул i:
CV
i
i 2
R; С p CV R
R
2
2
Отношение теплоемкостей
Cp
i 2
CV
i
является характерной для каждого идеального газа величиной и
называется показателем адиабаты.
33
34. Выражение теплоемкостей и внутренней энергии идеального газа через постоянную адиабаты
RR
CV
; Cp
1
1
RT
pV
U CV T
1 1
34
35. 3.6 Изопроцессы
ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ35
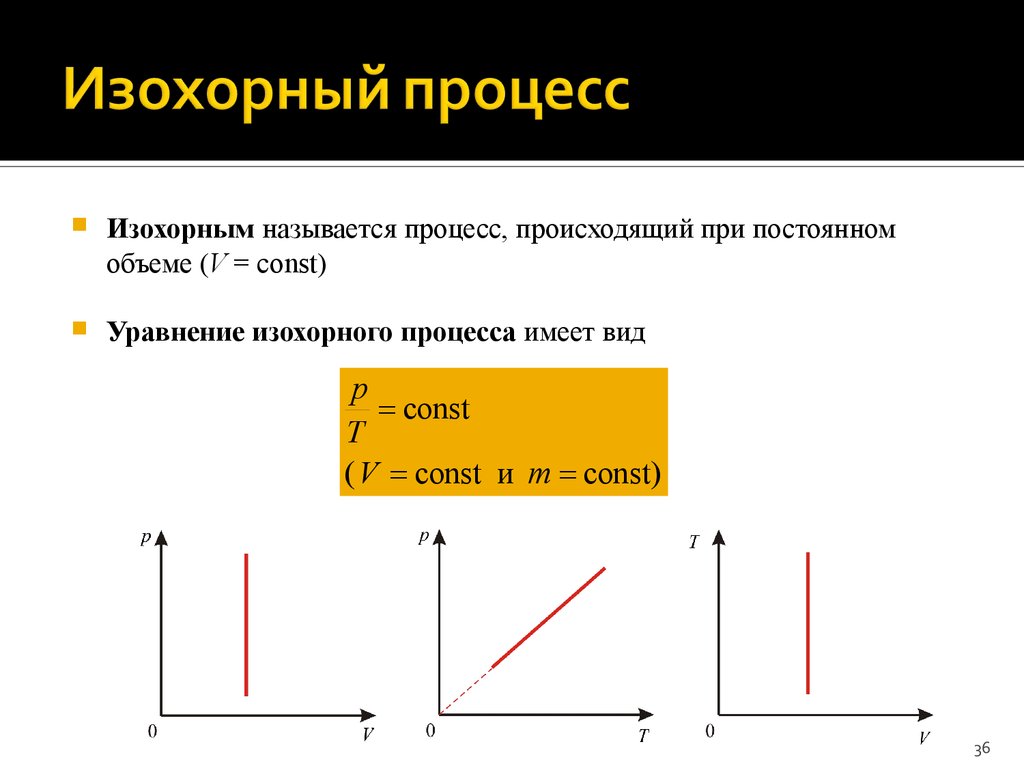
36. Изохорный процесс
Изохорным называется процесс, происходящий при постоянномобъеме (V = сonst)
Уравнение изохорного процесса имеет вид
p
const
T
( V const и m const)
36
37. Изохорный процесс
Работа идеального газа при изохорном процессе равна нулю(поскольку объем газа не изменяется):
( A)V ( pdV )V 0,
( A12 )V A 0
Уравнение первого начала термодинамики для изохорного
процесса имеет вид:
Q U ,
Q dU
Т.е. все сообщаемое газу тепло идет на увеличение его внутренней
энергии.
Теплоемкость при изохорном процессе:
CV iR 2
37
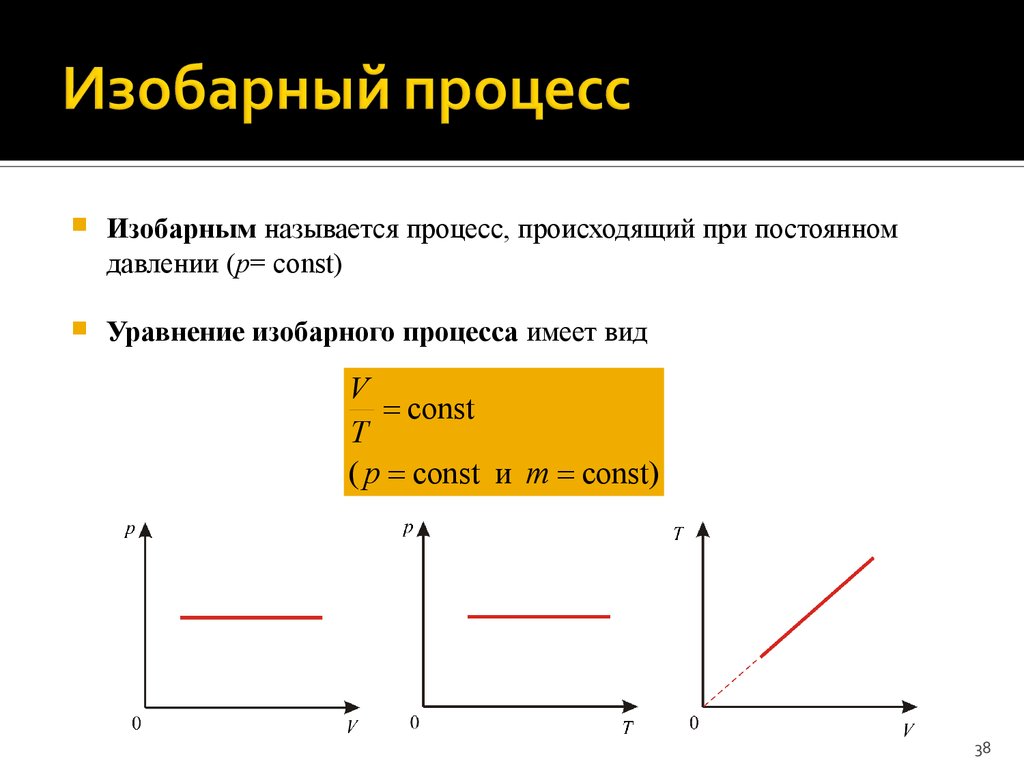
38. Изобарный процесс
Изобарным называется процесс, происходящий при постоянномдавлении (p= сonst)
Уравнение изобарного процесса имеет вид
V
const
T
( p const и m const)
38
39. Изобарный процесс
Работа идеального газа при изобарном процессе:( A12 ) p
V2
pdV p dV p(V
2
V1
V2
V1 ) p V
V1
Уравнение первого начала термодинамики для изобарного
процесса сохраняет свой вид:
Q U A
Q dU A
Теплоемкость при изохорном процессе:
C p CV R
i 2
R
2
39
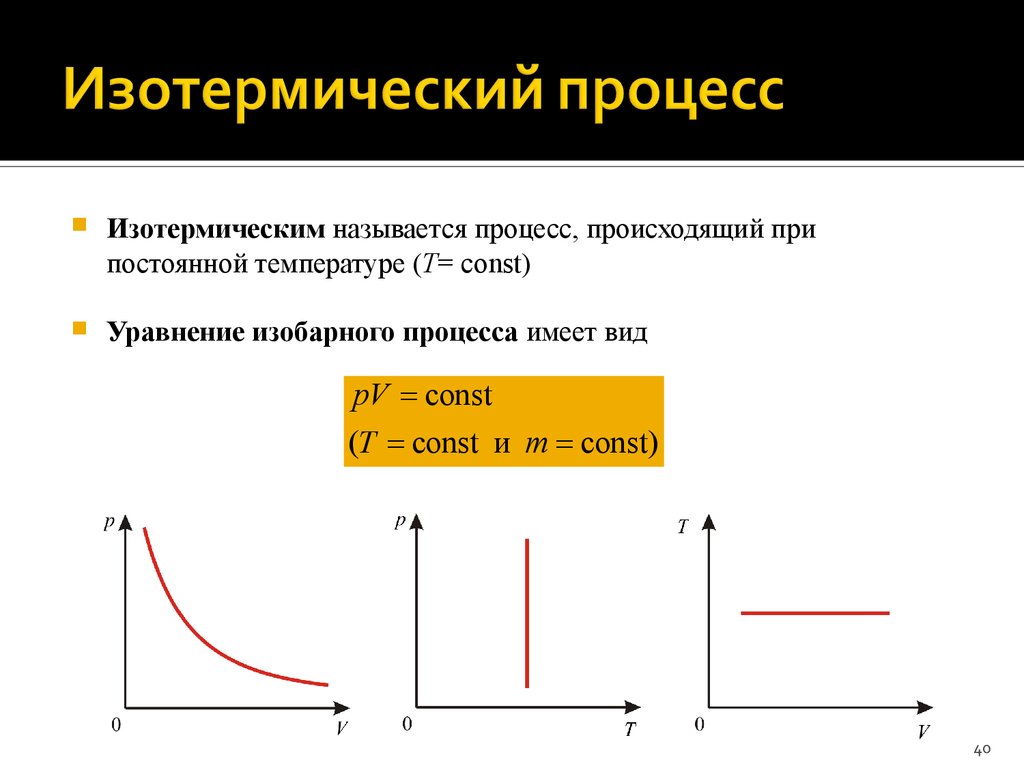
40. Изотермический процесс
Изотермическим называется процесс, происходящий припостоянной температуре (T= сonst)
Уравнение изобарного процесса имеет вид
pV const
(T const и m const)
40
41. Изотермический процесс
Работа идеального газа при изотермическом процессе:( A12 )T
V2
p(V )dV
V1
V2
RT
V2
V2
dV
RT
ln
p
V
ln
1, 2 1, 2
V V
V
V1
1
1
Уравнение первого начала термодинамики для изотермического
процесса:
Q A,
Q A
Теплоемкость при изотермическом процессе CT = , т.к. при подведении к
газу теплоты его температура не повышается:
Q Q
dT
0
Изотермический процесс должен идти достаточно медленно, чтобы температура
газа могла успеть выравниваться до температуры окружающей среды.
CT
41
42. 3.7 Адиабатический процесс
ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ42
43. Адиабатический процесс
– это процесс, происходящий безтеплообмена с окружающей средой (Q = 0).
Уравнение первого начала термодинамики для адиабатического
процесса:
A U ,
A dU
т.е. при адиабатическом процессе газ совершает работу за счет убыли
своей внутренней энергии
Адиабатический процесс можно легко осуществить, быстро
производя сжатие или разрежение газа.
43
44. Вывод уравнения адиабатического процесса
Получим уравнение адиабатического процесса, рассмотрев уравнениеМенделеева – Клапейрона и уравнение первого начала термодинамики в
дифференциальной форме для одного моля газа:
pV RT ;
CV dT pdV
Получим уравнение адиабаты в переменных pV. Для этого возьмем
дифференциал от обеих частей уравнения Менделеева – Клапейрона:
pdV Vdp RdT ;
R
pdV
Vdp
pdV pdV Vdp ( 1) pdV
pdV
dT
.
CV
CV
dp
dV
ln p ln V ln const
p
V
pV const
44
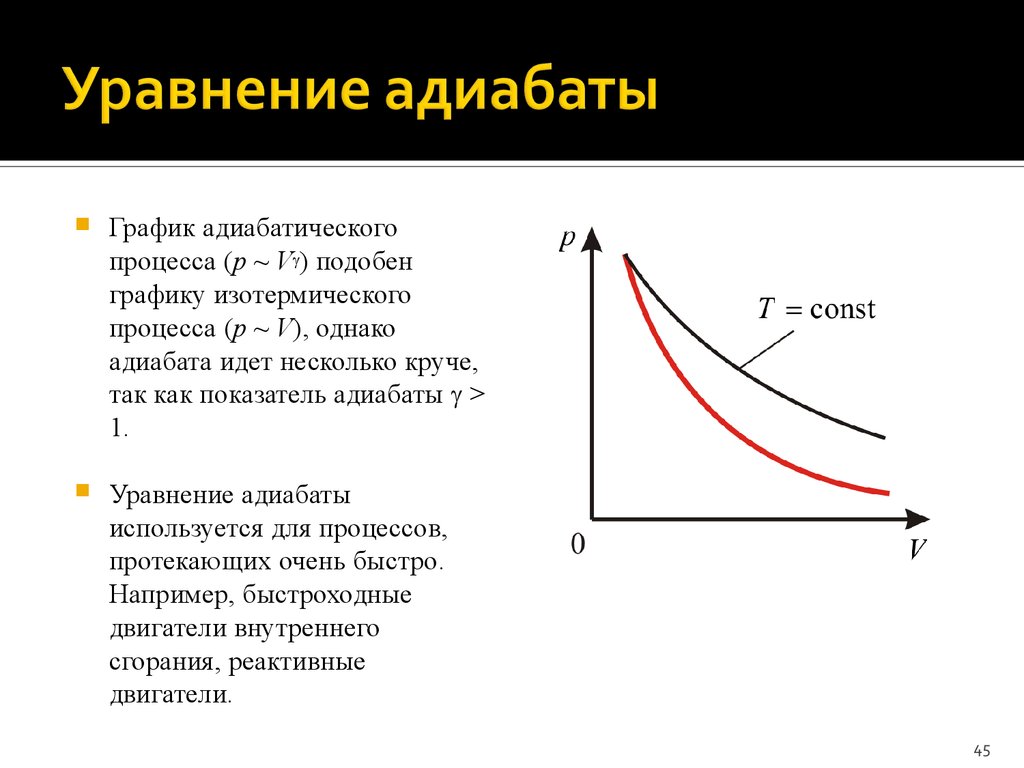
45.
График адиабатическогопроцесса (p ~ V ) подобен
графику изотермического
процесса (p ~ V), однако
адиабата идет несколько круче,
так как показатель адиабаты >
1.
Уравнение адиабаты
используется для процессов,
протекающих очень быстро.
Например, быстроходные
двигатели внутреннего
сгорания, реактивные
двигатели.
45
46. Уравнение адиабаты
Выражая из уравнения Менделеева – Клапейрона давление p, получимуравнение адиабаты в переменных TV:
TV 1 const
Из этого уравнения следует, что при адиабатическом расширении
идеальный газ охлаждается, а при адиабатическом сжатии – нагревается.
Адиабатическое расширение газов используется для их охлаждения и
сжижения.
Примером быстропротекающего адиабатического процесса является
распространение звука в воздухе. При этом показатель адиабаты связан со
скоростью звука в воздухе соотношением
где - плотность воздуха.
2
vзв
p
46
47. Работа и теплоемкость газа в адиабатическом процессе
Для вычисления работы, совершаемой идеальным газом вадиабатическом процессе, используем уравнение первого начал
термодинамики и уравнение адиабаты:
или
RT1 T2
1
A12 U CV (T2 T1 )
1 T1
1
1
V1
V1
RT1
p1V1
1
1
A12
1 V2 1 V2
Теплоемкость газа при адиабатическом процессе равна нулю,
поскольку
C
Q
0
0
dT T
47
48. 3.8 Политропический процесс
ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ48
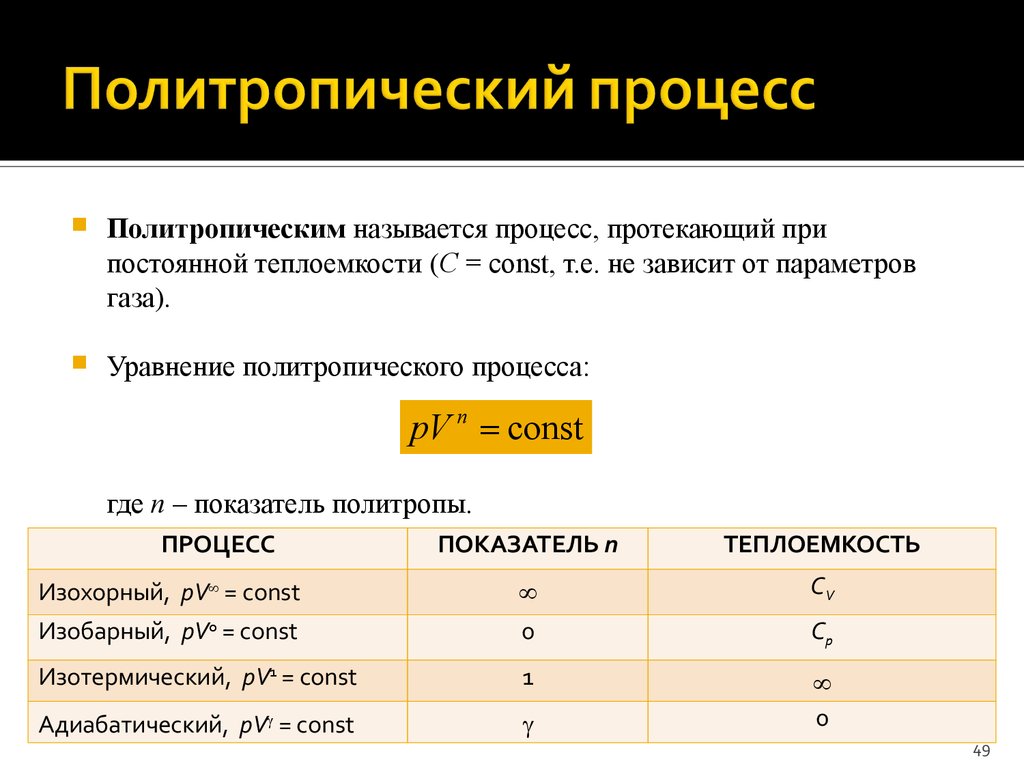
49. Политропический процесс
Политропическим называется процесс, протекающий припостоянной теплоемкости (C = const, т.е. не зависит от параметров
газа).
Уравнение политропического процесса:
pV n const
где n – показатель политропы.
ПРОЦЕСС
ПОКАЗАТЕЛЬ n
ТЕПЛОЕМКОСТЬ
Изохорный, pV = const
CV
Изобарный, pV0 = const
0
Cp
Изотермический, pV1 = const
1
Адиабатический, pV = const
0
49
50. Теплоемкость при политропическом процессе
Найдем теплоемкость при политропическом процессе. Согласноопределению теплоемкости
Q dU
dV
dV
C
p
CV p
dT dT
dT
dT
Рассмотрим уравнения Менделеева – Клапейрона и уравнение
политропического процесса. Возьмем от низ дифференциалы:
pV RT ,
pdV Vdp RdT ,
pdV Vdp RdT ,
n
n 1
n
Vdp npdV 0
pV const V dp npV dV 0
Вычтем из одного уравнение второе, тогда
dV
R
R
R
C CV p
CV
dT
p (1 n)
p (1 n)
1 n
C
nCV C p
n 1
50
51. Работа газа при политропическом процессе
Найдем выражение для работы газа при политропическом процессе.Из уравнения политропы найдем:
n
p
V
p1V1n pV n p (V ) 1 n1
V
Подставим найденное выражение для давления в выражение для
работы:
A12
V2
V2
V1
V1
p(v)dV
p1V1n
p1V1n 1
1
n 1 n 1
dV
n
V
n 1 V2
V1
n 1
n 1
V1
V1
p1V1
RT1
1
1
n 1 V2 n 1 V2
51












































 physics
physics








