Similar presentations:
Феноменологическая термодинамика. (Тема 11)
1. Раздел 3: Статистическая физика и термодинамика
Тема10. Молекулярно-кинетическая теория газовТема 11. Феноменологическая термодинамика
Тема 12. Элементы физической кинетики
2. Тема 11. Феноменологическая термодинамика (ТД)
1. Термодинамическая система (ТДС).2. Энергия термодинамической системы, работа и
теплота. Теплоемкость.
3. Первое начало термодинамики.
4. Основные термодинамические процессы(ТДП)
идеального газа.
5. Тепловые и холодильные машины. Цикл Карно.
6. Энтропия. Второе начало термодинамики.
3. 1 учебный вопрос: Термодинамическая система (ТДС).
Пример – газ в цилиндре под поршнем.Параметры состояния ТДС:
1. Давление p;
2. Температура T;
3. удельный объем (плотность)
4. количество вещества
3. Объем V.
4.
ТДС, в которых параметры состояния имеют определенныезначения, одинаковые по всей системе и не меняющиеся со
временем, называются равновесными.
5.
6.
Термодинамический процесс (ТДП) –переход ТДС из одного состояния в
другое.
ТДП изображается графически на
диаграммах. Диаграмма – график на осях
которого откладываются параметры
состояния. ТДП соответствует линия из
точек, изображающих ТДС в различные
моменты времени.
7.
Равновесные процессы обратимы.8.
Круговой процессили цикл
9. 2 учебный вопрос: Энергия термодинамической системы, работа и теплота.
Энергия – это количественная мера движенияматерии.
Э Eкин Eпот U кин U пот
внешняя
внутренняя
Внутренняя энергия системы U равна сумме всех
видов энергий движения и взаимодействия частиц,
составляющих данную систему.
10.
U газа включает:- кинетическую энергию поступательного и
вращательного движения молекул;
- кинетическую энергию колебательного движения
атомов в молекуле;
- потенциальную энергию взаимодействия молекул и
атомов внутри молекулы;
- энергию электронных оболочек атомов;
- энергию движения и взаимодействия нуклонов в
ядрах атомов.
Для идеального газа нет сил межмолекулярного
взаимодействия
U U кин U T
11.
Внутренняя энергияидеального газа:
M i
U
RT
2
(МКТ17)
Работа – это способ передачи энергии, связанный с
изменением внешних параметров системы (чаще V).
Теплота – это способ передачи энергии, связанный с
изменением внутренних параметров системы (εпост,
<v>).
Измеряются в джоулях.
12.
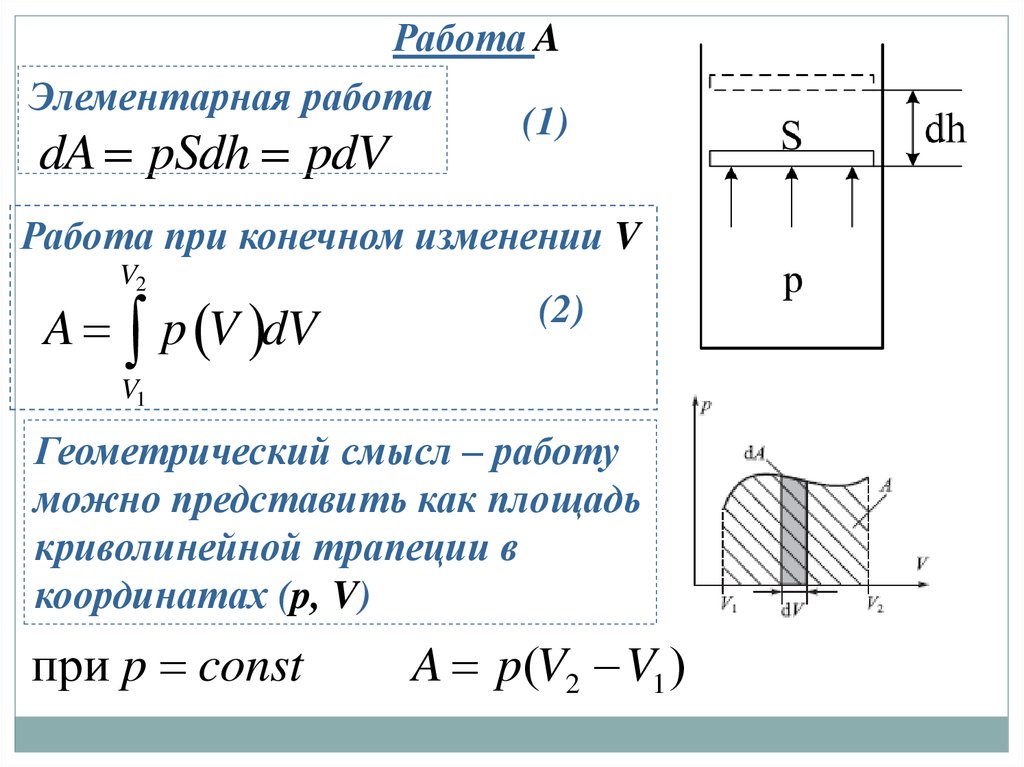
Работа AЭлементарная работа
(1)
dA pSdh pdV
Работа при конечном изменении V
V2
A p V dV
(2)
V1
Геометрический смысл – работу
можно представить как площадь
криволинейной трапеции в
координатах (p, V)
при p const
A p(V2 V1 )
13.
Теплота Q (количество теплоты) – процесспередачи энергии от одних тел к другим за счет
обмена энергией между хаотически движущимися
частицами тел.
В отличие от энергии работа и теплота являются
функциями состояния.
14.
ТеплоемкостьПередача тепловой энергии (теплоты)
сопровождается изменением температуры тела.
Теплоемкость С – скалярная физическая величина,
характеризующая связь между количеством
сообщенного системе тепла и изменением ее
температуры.
Различают полную, удельную и молярную
теплоемкости.
15.
Полная теплоемкость (теплоемкость тела) сполчисленно равна количеству тепла, которое
необходимо сообщить системе, чтобы повысить ее
температуру на один градус:
спол
dQ
dT
Дж
К
(3)
Удельная теплоемкость (с) - теплоемкость единицы
массы:
1 dQ Дж
c
M dT кг К
(4)
16.
Молярная теплоемкость С - теплоемкость одногомоля вещества:
1 dQ Дж
C C
(5)
M dT моль К
(4) и (5)
с
С
(6)
17.
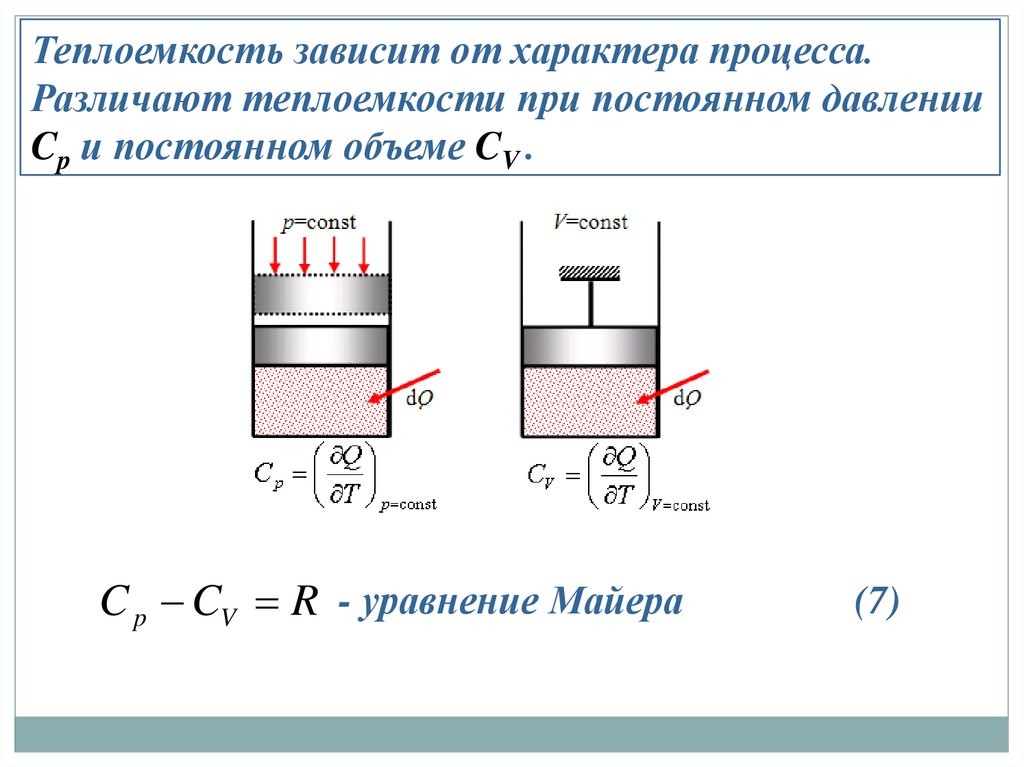
Теплоемкость зависит от характера процесса.Различают теплоемкости при постоянном давлении
Cp и постоянном объеме CV .
C p CV R - уравнение Майера
(7)
18.
Q1 2T2
спол dT спол Т 2 Т1
(8)
T1
Q1 2
T2
M cdT M c Т 2 Т1
(9)
T1
Q1 2
T2
T1
M
C dT
M
C T2 T1
(10)
19. 3 учебный вопрос: Первое начало термодинамики
В основе термодинамики лежат два закона – дваначала термодинамики.
Первое начало представляет собой формулировку
закона сохранения и превращения энергии
применительно к тепловым процессам.
Второе начало уточняет первое и показывает
направление протекания всех процессов –
стремление любой системы к минимуму
потенциальной энергии.
20.
Первое начало термодинамикиQ U A dQ U dA
(11)
Количество теплоты, сообщенное системе, идет на
приращение ее внутренней энергии и на совершение
работы над внешними телами.
21.
Если система работает позамкнутому
термодинамическому
процессу (циклу), то
U dU 0
Q A
Следствие 1-го начала ТД:
В тепловых двигателях невозможно совершить
работу, превышающую получаемую энергию, т.е.
вечный двигатель 1-го рода невозможен.
22.
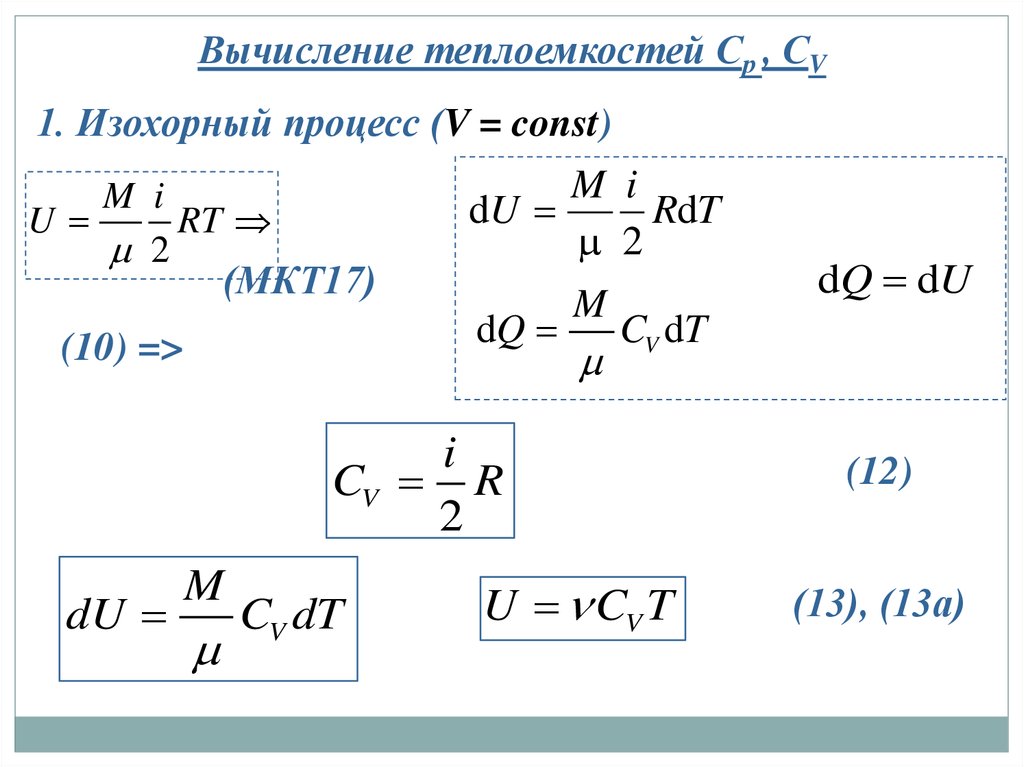
Вычисление теплоемкостей Ср , СV1. Изохорный процесс (V = const)
M i
U
RT
2
(МКТ17)
(10) =>
M i
dU
RdT
2
dQ
M
CV dT
i
CV R
2
dU
M
CV dT
dQ dU
U CV T
(12)
(13), (13а)
23.
2. Изобарный процесс (p = const)dQ dU pdV
M
pdV
RdT
(13)dU CV dT (М-К)
M
(10) dQ
C p dT
M
M
C p dT
M
CV dT
M
RdT
C p CV R
i
i 2
C p CV R R R
R
2
2
(14)
24.
МайерПусть
Cp
CV
CV R
R
1
CV
CV
R
CV
1
RT
PV
U
1 1
(12), (14)
Cp
i
CV i 2
(15)
(16), (16а)
(17)
25.
26.
ПРИМЕНЕНИЕ 1 ЗАКОНА ТЕРМОДИНАМИКИ К ИЗОПРОЦЕССАМ.График
Изменение
внутренней
энергии
Запись
1-го закона
термодинамики
Процесс
Постоянные
Изотермическое
расширение
m=const
M=const
T=const
pV=const
U=const
ΔU=0
Q=A'
Изотермический процесс не может происходить
без теплопередачи. Все количество теплоты,
переданное системе, расходуется на совершение
этой системой механической работы.
Изотермическое
сжатие
m=const
M=const
T=const
pV=const
U=const
ΔU=0
A=-Q
Изотермический процесс не может происходить
без теплопередачи.
Вся работа внешних сил выделяется в виде тепла.
Изохорное
нагревание
m=const
M=const
V=const
p↑
T↑
U↑
ΔU>0
A=0
Q= ΔU
Все количество теплоты, переданное системе,
расходуется на увеличение ее внутренней
энергии.
Изохорное
охлаждение
m=const
M=const
V=const
A=0
Q= ΔU<0
Система уменьшает свою внутреннюю энергию,
отдаваятепло окружающим телам.
Изобарное
расширение
(нагревание)
m=const
M=const
p=const
Изобарное
сжатие (охлаждение)
m=const
M=const
p=const
V↓
T↓
U↓
ΔU<0
Адиабатное
Расширение
m=const
M=const
=const
ΔU<0
U↓
T↓
Адиабатное
сжатие
m=const
M=const
=const
ΔU>0
U↑
T↑
p↓
T↓
U↓
ΔU<0
V↑
T↑
U↑
ΔU>0
Q=ΔU+A'
ΔU=Q-А'>0
ΔU=Q+A<0
Q<0
Q=0
A' > 0
ΔU=-A' < 0
A'=-ΔU
Q=0
A>0
ΔU=A
Физический
смысл
Количество теплоты, переданное системе,
превышает совершенную еюмеханическую
работу. Часть тепла расходуется на совершение
работы, а часть – на увеличениевнутр. энергии.
Количество теплоты, отдаваемое системой,
превышает работу внешних сил.
Часть тепла система отдает за счет
уменьшениявнутр. энергии.
Система совершает механическую работу только
за счет уменьшения своей внутренней энергии.
Внутренняя энергия системы увеличивается за
счет работы внешних сил.
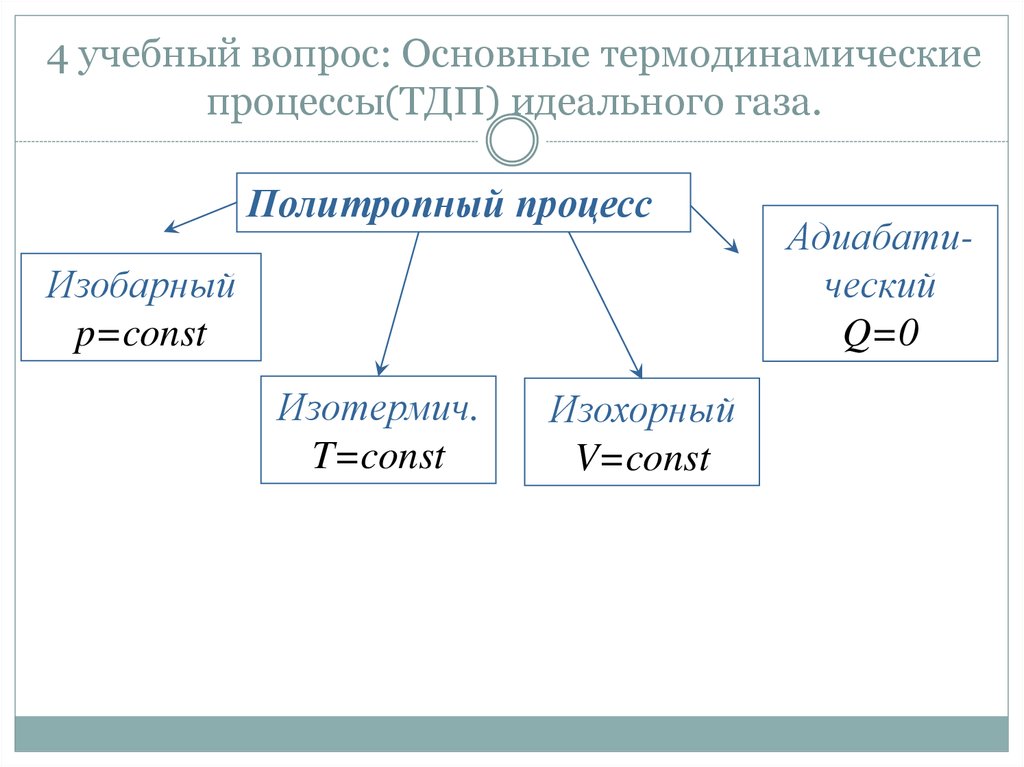
27. 4 учебный вопрос: Основные термодинамические процессы(ТДП) идеального газа.
Политропный процессИзобарный
p=const
Изотермич.
T=const
Изохорный
V=const
Адиабатический
Q=0
28.
Политропным называется равновесный обратимыйпроцесс, удовлетворяющий условиям:
1. рабочее тело – идеальный газ;
2. z я часть подводимой теплоты расходуется на
изменение внутренней энергии (dU=zdQ),
оставшаяся часть теплоты расходуется на
совершение работы ( dA=(1-z)dQ);
3. теплоемкость политропного процесса С=const.
M i
R dT
dU
i
2
z
dQ M i 2 RdT i 2
2
(18)
при i = 5 z = 0,71
для двухатомного газа 71% подводимого тепла идет на нагрев газа и 29%
на работу расширения
29.
1 начало ТД + ур-е М-К=>
pV const
(19)
TV n 1 const
(20)
n
где
n
C Cp
C CV
n
C CV
n 1
(21)
(22)
уравнения
политропы
показатель
политропы
30.
Теплота в политропном процессе(22)
n
CdT
CV
dT
(10) dQ
n 1
M
M
(23)
Работа в политропном процессе
n
p
V
n
n
(19) pV p1V1 p 1 n1
VV
A
V2
V1
1 n
1 n
V
V
p1V1 p2V2
d
V
V
n
n
n 1
2
pdV p1V1 n p1V1
p1V1
V
1 n V
n 1
n 1
V1
V2
M R T1 T2
A
n 1
1 n
2
1
(М-К)
(24а)
(24б)
31.
Частные случаи политропного процессаа) n 0 p V n pV 0 p const изобарный процесс
V2
A pdV p V2 V1
(25а)
V1
0 C p CV
n
C CV
CV
Cp
n 1
0 1
32.
Частные случаи политропного процессаM
n
1
б) n 1 p V pV RT const изотермич. процесс
Это бесконечно медленный процесс
M i
RdT 0
dQ dU dA dU
2
V2
V2
M
dV M
V2
A pdV
RT
RT ln
V
V1
V1
V1
1 C p CV
n
C CV
CV
n 1
1 1
(25б)
dQ dA
33.
Частные случаи политропного процессав) n p V n p1/ nV const V const
изохорный процесс
dQ dU dA
dA 0
(25в)
dQ dU
т.е. все подводимое тепло идет
на увеличение внутренней
энергии - на нагрев газа.
n
1 n
C CV
CV
CV
n 1
1 1 n
34.
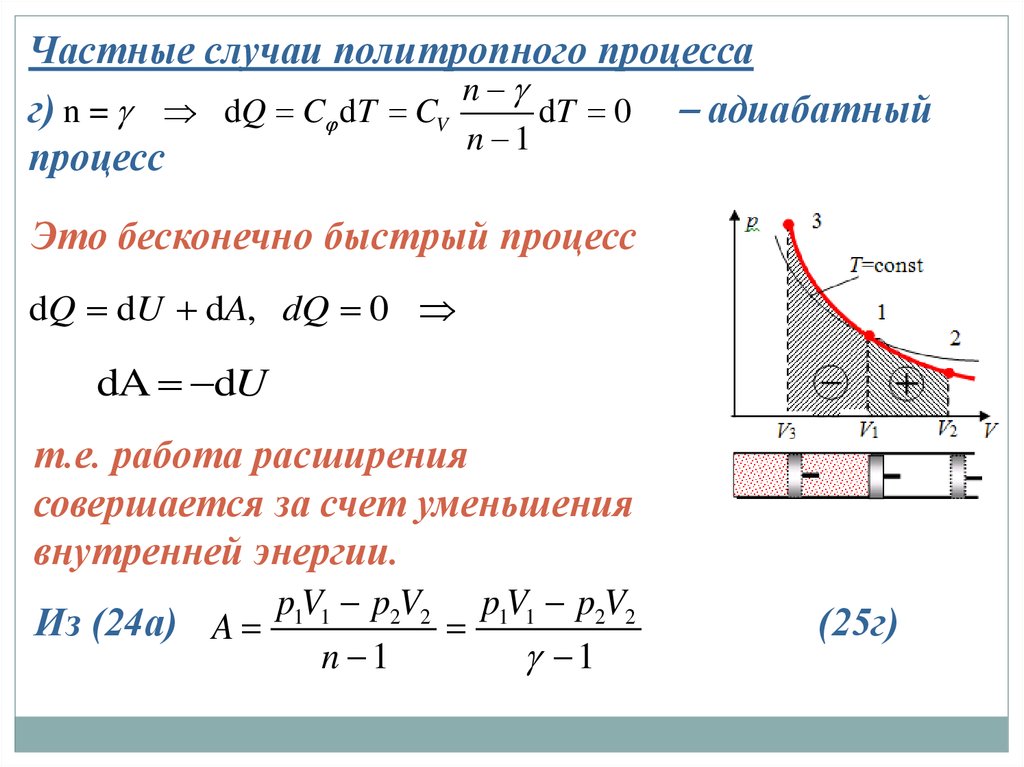
Частные случаи политропного процессаn
г) n = dQ C dT CV
dT 0 адиабатный
n 1
процесс
Это бесконечно быстрый процесс
dQ dU dA, dQ 0
dA dU
т.е. работа расширения
совершается за счет уменьшения
внутренней энергии.
p1V1 p2V2 p1V1 p2V2
Из (24а) A
n 1
1
(25г)
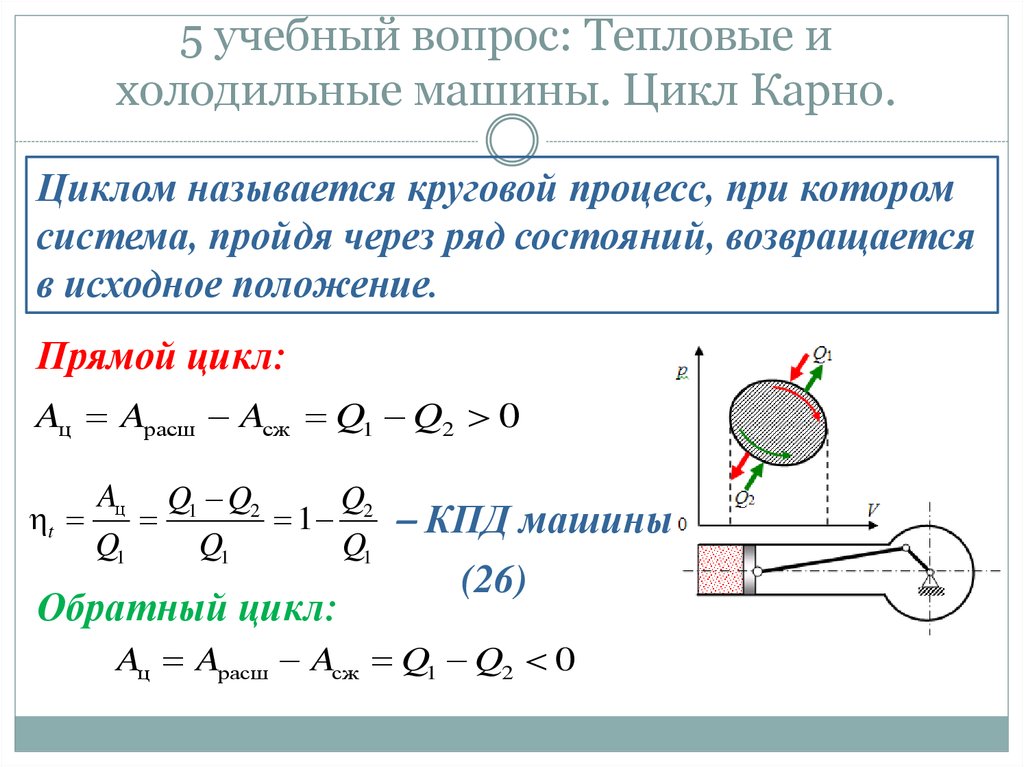
35. 5 учебный вопрос: Тепловые и холодильные машины. Цикл Карно.
Циклом называется круговой процесс, при которомсистема, пройдя через ряд состояний, возвращается
в исходное положение.
Прямой цикл:
Aц Aрасш Aсж Q1 Q2 0
Aц Q1 Q2
Q2
t
1
Q1
Q1
Q1
Обратный цикл:
КПД машины
(26)
Aц Aрасш Aсж Q1 Q2 0
36.
Теорема Карно:Из всех периодически действующих
тепловых машин, имеющих одинаковые
температуры нагревателей и
холодильников, наибольшим К.П.Д.
обладают обратимые машины
Nicolas Léonard Sadi Carnot









































 physics
physics








