Similar presentations:
Первый закон термодинамики и основные законы идеального газа
1. Первый закон термодинамики и основные законы идеального газа
1.2.
3.
4.
Понятие термодинамического процесса.
Внутренняя энергия и работа расширения и сжатия
рабочего тела.
Первый закон термодинамики. Энтальпия газа.
Процессы изменения состояния идеального газа.
2. Термодинамический процесс
• Изменение состояния термодинамическойсистемы во времени называется
термодинамическим процессом. Так, при
перемещении поршня в цилиндре объём,
а с ним давление и температура
находящегося внутри газа будут
изменяться, будет совершаться процесс
расширения или сжатия газа.
3. Термодинамический процесс
Система, выведенная из состояния равновесия, ипредоставленная при постоянных параметрах
окружающей среды самой себе, через некоторое
время вновь придет в равновесное состояние,
соответствующее этим параметрам. Такое
самопроизвольное (без внешнего воздействия)
возвращение системы в состояние равновесия
называется релаксацией, а промежуток времени, в
течение которого система возвращается в состояние
равновесия, называется временем релаксации.
4. Равновесный термодинамический процесс
Термодинамический процесс называется равновесным, если всепараметры системы при его протекании меняются
достаточно медленно по сравнению с соответствующим
процессом релаксации. В этом случае система фактически все
время находится в состоянии равновесия с окружающей
средой, чем и определяется название процесса.
Чтобы процесс был равновесным, скорость изменения параметров
системы dA d должна удовлетворять соотношению
dA d cрел ΔA рел
где А — параметр, наиболее быстро изменяющийся в
рассматриваемом процессе; срел — скорость изменения этого
параметра в релаксационном процессе; τрел — время
релаксации.
5. Равновесный термодинамический процесс
Равновесный процесс состоит из непрерывного рядапоследовательных состояний равновесия, поэтому в
каждой его точке состояние термодинамической системы
можно описать уравнением состояния данного рабочего
тела. Именно поэтому классическая термодинамика в
своих исследованиях оперирует только равновесными
процессами. Они являются удобной идеализацией
реальных процессов, позволяющей во многих случаях
существенно
упростить
решение
задачи.
Такая
идеализация вполне обоснована, так как условие
выполняется на практике достаточно часто. Поскольку
механические возмущения распространяются в газах со
скоростью звука, процесс сжатия газа и цилиндре будет
равновесным, если скорость перемещения поршня много
меньше скорости звука.
6. Неравновесные термодинамические процессы
Процессы, не удовлетворяющие условиюdA d cрел ΔA рел
,
протекают с нарушением равновесия, т. е. являются
неравновесными.
Если,
например,
быстро
увеличит
температуру окружающей среды, то газ в цилиндре будет
постепенно прогреваться через его стенки, релаксируя к
состоянию равновесия, соответствующему новым параметрам
окружающей среды. В процессе релаксации газ не находится в
равновесии с окружающей средой и его нельзя характеризовать
уравнением состояния хотя бы потому, что в разных точках
объема газа температура имеет различные значения.
7. 2. Внутренняя энергия и работа расширения и сжатия рабочего тела
8. Основы термодинамики
Внутренняя энергия идеального газа -этокинетическая энергия хаотического
(теплового) движения молекул.
Среднее значение энергии одной
молекулы:
i
ср
kT
2
Энергия N молекул:
i
U N kT
2
kN A R
N N A
8
9.
Внутреняя энергия – функция состояния, зависит оттемпературы.
i
U RT
2
Температура – мера интенсивности теплового
движения молекул.
Изменение внутренней энергии:
i
U U 2 U1 R T
2
9
10.
Внутренняя энергия изменяется путёмсовершения работы и путём теплообмена.
Работа – это процесс изменения внутренней
энергии системы за счет упорядоченного
движения молекул.
10
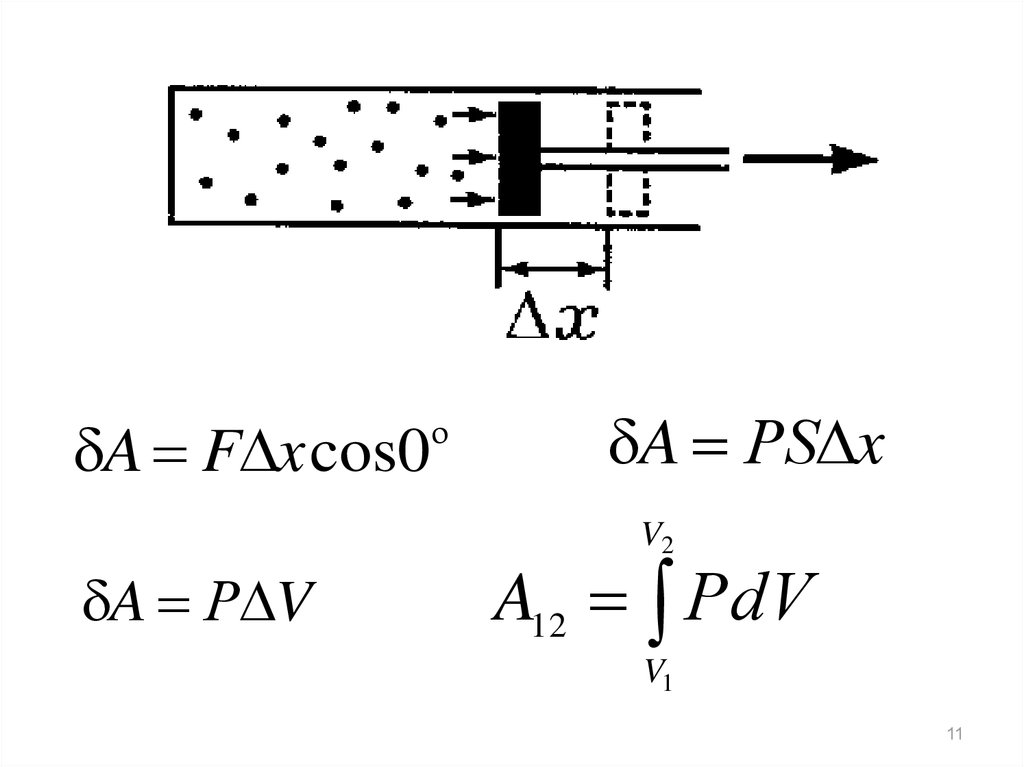
11.
A F x cos0o
A РS x
V2
A Р V
A12 РdV
V1
11
12.
Графически работа равна площади подкривой процесса в границах изменения
объёма.
12
13.
Приращение внутренней энергии впроцессе чистого теплообмена называется
количеством теплоты или просто –
теплотой (Q).
Теплота – это процесс изменения
внутренней энергии за счет хаотического
(неупорядоченного) движения молекул.
13
14. 3. Первый закон термодинамики. Энтальпия газа
15. Первое начало термодинамики
Количество теплоты, которое системаполучает в процессе теплообмена идет на
изменение внутренней энергии и на
совершение работы.
Для равновесных процессов:
Q U 2 U1 A
15
16.
В более общем случае:Q dU A
A и Q– это количественные характеристики
процесса изменения энергии – элементарные
теплота и работа.
dU – бесконечно малое изменение внутренней
энергии.
16
17. Энтальпия
В термодинамике важную роль играет суммавнутренней энергии системы U и произведения
давления системы р на ее объем V, называемая
энтальпией и обозначаемая Н:
H U pV
Так как входящие в нее величины являются функциями
состояния, то и сама энтальпия является функцией
состояния. Так же как внутренняя энергия, работа и
теплота, она измеряется в джоулях (Дж).
Энтальпия обладает свойством аддитивности.
18. Энтальпия
Величинаh u pVud
,
называемая удельной энтальпией (h = H/M), представляет собой
энтальпию системы, содержащей 1 кг вещества, и измеряется в
Дж/кг.
Поскольку энтальпия есть функция состояния, то она может быть
представлена в виде функции двух любых параметров состояния:
; h p, T
; h V ,T ,
h 1 p,V
2
3
а величина dh является полным дифференциалом.
Изменение энтальпии в любом процессе определяется только
начальным и конечным состояниями тела и не зависит от
характера процесса.
19. Энтальпия
Если давление системы сохраняется неизменным,т. е. осуществляется изобарный процесс (dp=0), то
и
δq p dh
q p h2 h1
т. е. теплота, подведенная к системе при
постоянном давлении, идет только на изменение
энтальпии данной системы.
20. 4. Процессы изменения состояния идеального газа
21. Применение 1 закона термодинамики к изопроцессам
Изотермический.dT = 0), (dU = 0). РV = const.
Q A
V2
RT
dV
A РdV
dV RT
RT ln
V
V
V1
V1
V1
V1
V2
V2
Q
Сm
dT
V2
CТ
21
22.
Изохорный процесс.Р/Т = const.
А PdV =0
i
Q dU CV R
2
Изобарный процесс (P = const)
V/T const
V2
A РdV Р (V2 V1 )
V1
i
i 2
CP R R
R
2
2
22
23.
Адиабатическим называется процесс,протекающий без теплообмена
с окружающей средой
dQ = 0
dA = - dU
23
24.
Адиабатный процесс.dU A 0
РV const
СР
СV
– показатель адиабаты.
24
25.
Уравнение адиабатического процессав переменных Т и V :
TV
1
const
25
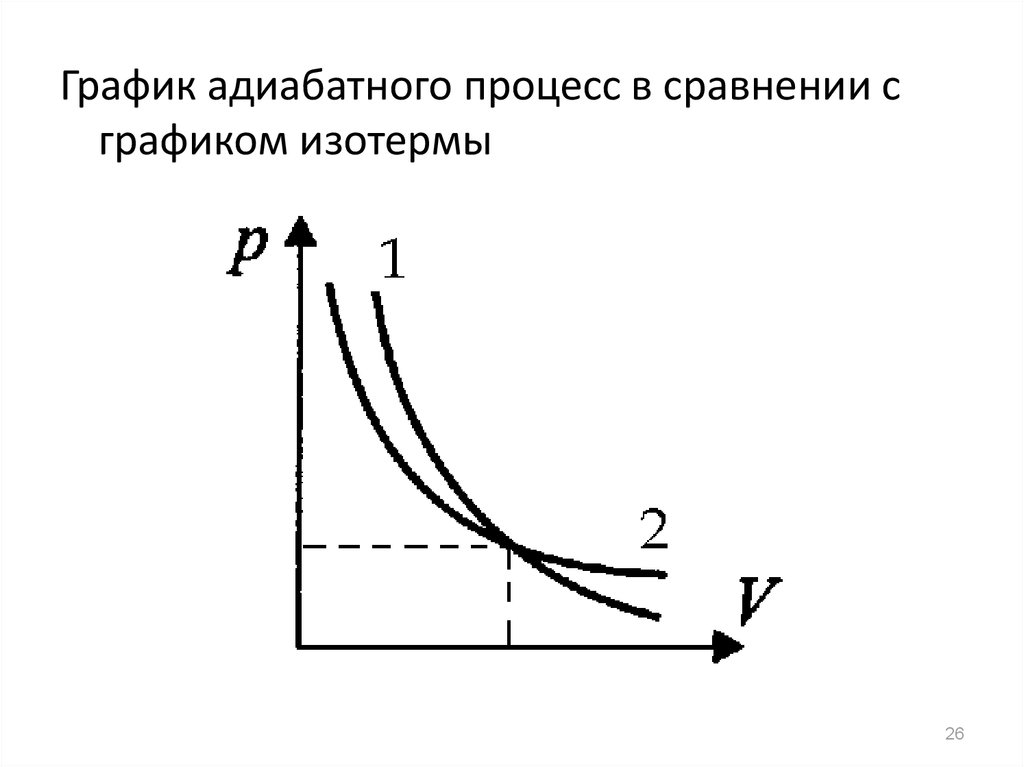
26.
График адиабатного процесс в сравнении сграфиком изотермы
26
27. Работа при адиабатном процессе
A = nCV (T1 - T2 )27
28. Политропный процесс
• Все процессы – частный случай политропного.p1V1m= p2V2m
Изохорный –
Изобарный –
Изотермический –
Адиабатный -
V = const, m= ∞
Q = 0,
m= ϒ
29. Политропный процесс
Уравнение процесса:
p1V1m= p2V2m
Первый закон термодинамики: Q = cΔT
Теплоемкость:
Изменение внутренней энергии:
ΔU = cV ΔT
1
Работа:
p1V1 p2V2
A
m 1
• Энтропия:
• Энтальпия:



























 physics
physics