Similar presentations:
Катализ. Классификация каталитических процессов. Механизм действия катализаторов
1. Катализ
Лекция 62. Катализ
• В общем случае катализ это ускорениереакции под действием особых химических
соединений – катализаторов.
• Катализатор – это вещество или тело,
которые вступают в реакцию в одной или
нескольких стадий и выходит в конце
реакции в неизменном виде.
3. Катализаторы
• Если катализатор не выходит в неизменном виде, а расходуется в побочныхреакциях, то такие стадии реакции
называются стадиями отравления
катализатора (ингибирования) и вещества,
способствующие протеканию побочных
реакций называются каталитическими
ядами
4. Классификация каталитических процессов
По фазовому составу каталитические реакцииделятся:
- Гомогенный катализ (Исходные вещества и
катализатор находятся в одной фазе)
- Гетерогенный катализ (Реакционная смесь и
катализатор находятся в разных фазах). Реакция
протекает на границе двух фаз, например,
газ – твердый катализатор
- Ферментативный катализ ( Занимает промежуточное положение между гомогенным и гетерогенным катализом, часто относят к микрогетерогенному)
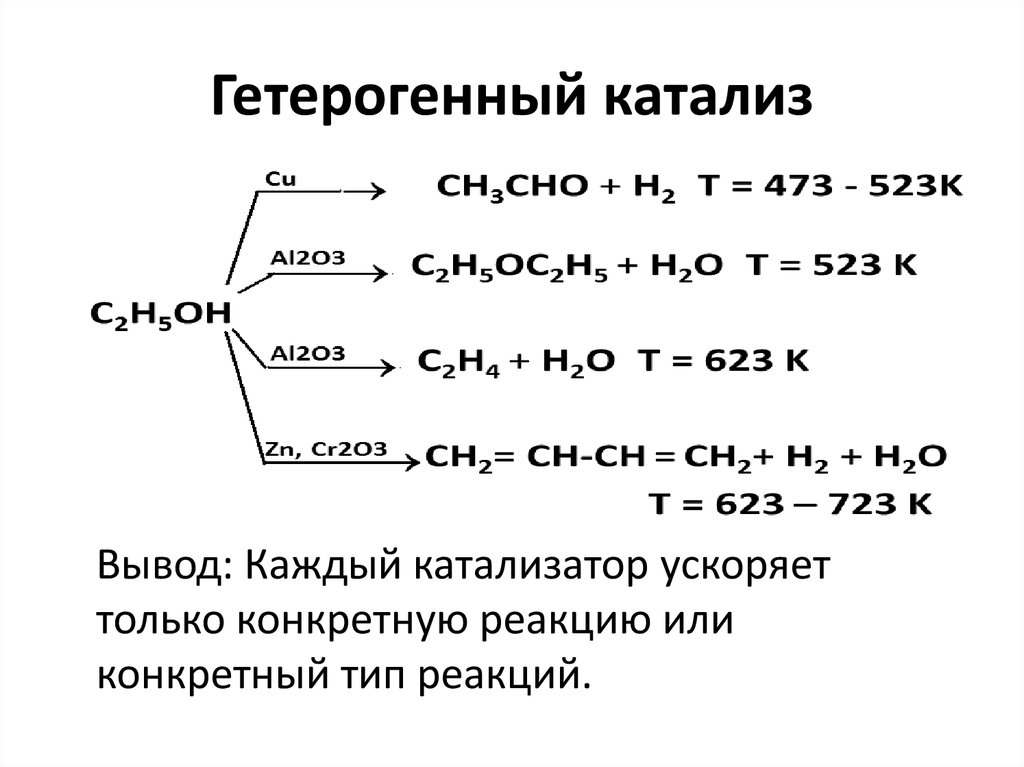
5. Гетерогенный катализ
Вывод: Каждый катализатор ускоряеттолько конкретную реакцию или
конкретный тип реакций.
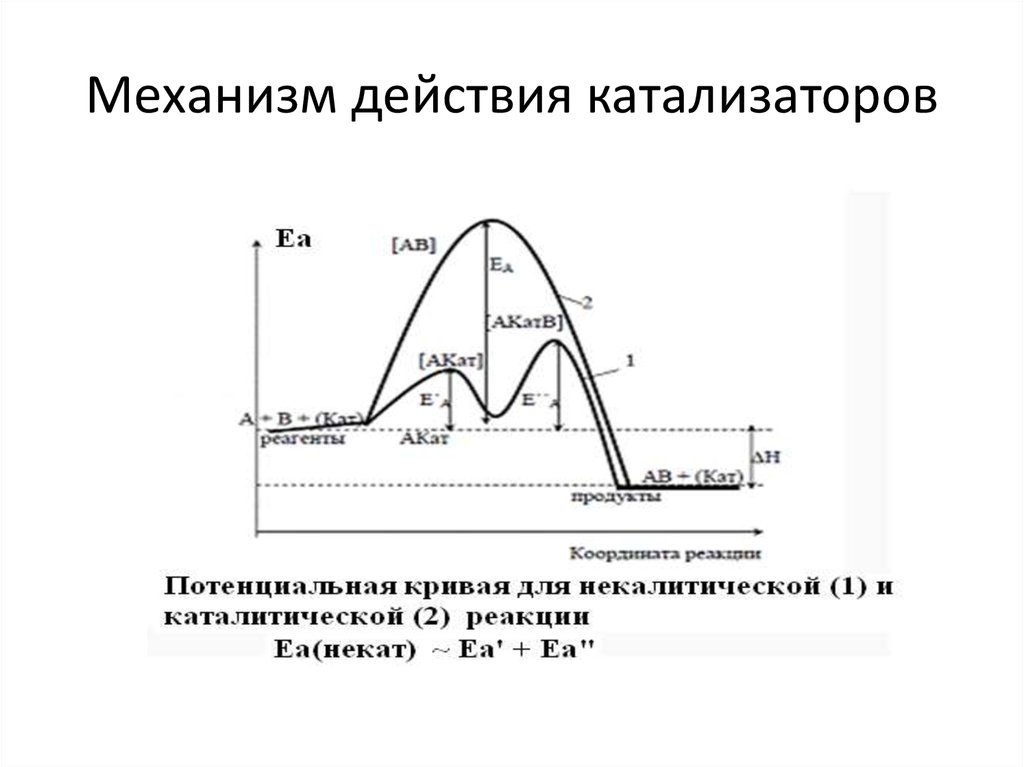
6. Механизм действия катализаторов
7. Эффективность катализатора
• В гомогенном катализе мерой активностиявляется число оборотов реакции nk (TOF),
т.е. количество молекул, превращающихся
за единицу времени на одном активном
центре : nk = W/Cкат ; С[моль/л]
• В гетерогенном катализе – удельная
активность a = W/Sкат или a = W/mкат
8. Эффективность катализатора
• Интегральная избирательность илиселективность – отношение количества
целевого продукта к теоретически
возможному из взятого количества
исходного вещества: = СПР/ СПР,теор*100%
• Самой высокой селективностью обладают
ферменты и ряд гомогенных катализаторов (95-100%). Для гетерогенного катализа
обычно ниже ( 70%).
9. Виды гомогенного катализа
• Кислотно – основной (Катализатор –кислота или основание)
• Металло –комплексный ( катализатор –
ионы или металл, металлокомплексные
соединения)
• Ферментативный (биокатализаторы ферменты)
10.
Кислотно – основнойгомогенный катализ
11. Кислотно – основной катализ
• По C.Аррениусу (1884 г) кислота – этосоединение, образующее при диссоциации
в воде ионы водорода H3O+ , а основание –
это соединение, образующее при
диссоциации в воде гидроксид - ионы OН• Недостаток – применимо только для
водных растворов
12. Кислотно – основной катализ
• По Дж.Брестеду и Т.Лоури (1923 г) кислота –это вещество, являющее донором протона,
а основание – вещество, являющее
акцептором протона. В растворе существует кислотно – основное равновесие:
HA + H2O H3O+ +
AКислота Основание Кислота Основание
13. Кислотно – основной катализ
• По Г.Льюису кислота – это акцепторнеподеленной пары электронов, а
основание вещество, являющее донором
электронной пары.
• Кислотами Льюиса являются такие
соединениями, как FeCl3, AlCl3, AlBr3, BF3
FeCl3 + :Cl- = FeCl-4
• Основания: NH3, N2H4, NO3-, C6H5N
NH3 + Н+ = NН+4
14. Общий механизм кислотно – основного катализа
k1S + ВН+ SH+ + Вk-1
k2
SH+ P + H+
K3
В- + H+ ВН+ - протекает быстро и не может
быть лимитирующей стадией.
Стадия протекающая после лимитирующей
не входит в кинетическое уравнение реакции
15. Вывод уравнения
k1S + ВН+ SH+ + В- ; r1 = k1CSCBH+
k-1
r-1 = k-1CSH+CBk2
r2 = k2CSH+
SH+ P + H+
Wp = r2 = ?
Применим метод МКСК : WSH+ = 0
WSH+ = r1 -r-1 - r2 = k1CSCBH+ - k-1CSH+CB- - k2CSH+ = 0
CSH+ = k1CSCBH+/(k-1CB- + k2) и окончательно:
Wp = r2 = k1k2CSCBH+/(k-1CB- + k2)
16. Анализ уравнения
• Wp = k1k2CSCBH+/(k-1CB- + k2)1. Предположим, что k-1CB- << k2 и получим:
Wp = k1k2CSCBH+/ k2 = k1CSCBH+
Вывод: лимитирующая стадия первая (k1)
Скорость реакции имеет первый порядок по
катализатору ВН+ (n=1), что подтверждает
каталитический характер реакции
Это случай - общего кислотного
(неспецифического) катализа.
17. Итоги по общему кислотно – основному катализу
• Общий кислотный катализ . В этом случаекатализатором являются кислоты Бренстеда,
т.е. НА (или ВН+):
S + ВН+ SH+ + В• Общий основной катализ . В этом случае
катализатором являются основания Бренстеда,
т.е. В :
S + В ВH+ + SЛимитирующая стадия – это первая стадия
образования SH+ или S-
18. Кислотно – основной катализ
• По Дж.Брестеду и Т.Лоури (1923 г) кислота –это вещество, являющее донором протона,
а основание – вещество, являющее
акцептором протона. В растворе существует кислотно – основное равновесие:
HA + H2O H3O+ +
AКислота Основание Кислота Основание
19. Общий (Неспецифический) кислотный катализ
Wp = k1CSCBH+= kнаблCS ; kнабл = Wp/CS ;kнабл = k’1CB’H+ k”1CB”H+ = kiCBiH+
Например реакция йодирования ацетона:
СH3COCH3 + HCl СH3C=CH2(OH) + ClСH3C=CH2(OH) + J2 СH3COCH2 J + HJ
kнабл = k’1C HCl + k”1CHJ + k’”1CH2O
20. Вернемся к общей схеме
k1S + ВН+ SH+ + Вk-1
k2
SH+ P + H+
Wp = r2 = k1k2CSCBH+/(k-1CB- + k2)
2 случай: k-1CB- >> k2
21.
2. При условии k-1CB- >> k2 и получим:Wp = k1k2CSCBH+/k-1CB- = k2(k1/k-1)*CSCBH+/CB-
Wp = k2K1*CSCBH+/CBВоспользуемся третьей стадией
регенерации катализатора
K3
В- + H+ ВН+
В растворе вместо Сi надо использовать
активность ионов аi = i*Ci
K3 = аBH+ /аB-aH+
22.
K3 = аBH+ /аB-aH+ = CBH+/CB- aH+ *( B-/ BH+ )Обратите внимание, что мы оставили aH+
Отсюда получим, что
CBH+/CB- = K3 aH+* B-/ BH+ и окончательно
Wp = k2K1K3CSaH+* B- / BH+
Этот случай называют
специфическим кислотным
катализом
23. Реакции специфического кислотно – основного катализа
• Специфический кислотный катализ. В этомслучае катализатором являются кислоты
Аррениуса, т.е. ионы H3O+ :
S + H3O+ SH+ + H2O P + H3O+
• Специфический основный катализ. В этом
случае катализатором являются основания
Аррениуса, т.е. ионы OН- :
S + OН- H2O + S- P + HA
Лимитирующей стадией является вторая стадия
– распада SH+ или S-
24. Специфический кислотный катализ в разбавленных растворах
Wp = k2K1K3CSaH+* B- / BH+В разбавленных растворах
B- / BH+ = 1 и aH+= СH+ , тогда получим:
Wp = k2K1K3CS СH+ = kнаблCS СH+
Лимитирующая стадия вторая и
скорость реакции зависит от СH+
25. Кислотно – основной катализ
• По C.Аррениусу (1884 г) кислота – этосоединение, образующее при диссоциации
в воде ионы водорода H3O+ , а основание –
это соединение, образующее при
диссоциации в воде гидроксид - ионы OН-
26. Специфический кислотный катализ в концентрированных растворах
Wp = k2K1Ka3CSaH+* B- / BH+ =kнаблCS(aH+ B- / BH+)• Гаммет ввел новую функцию называемую –
кислотность: h0 = aH+ B- / BH+ или
функция кислотности Н0 = -ln(aH+ B- / BH+ )
Окончательно: Wp = kнаблCS h0
Функция Н0 является аналогом рН , который
работает в области существенно большем
чем значений рН = 0-14. (рН за пределами
этого интервала не работает )
27.
28. Реакции электрофильно – нуклеофильного катализа
• Электрофильный катализ. В этом случаекатализаторами являются кислоты Льюиса и
механизм включает образование с одним из
реагентов донорно – акцепторных связей.
• Примеры: - реакция Фриделя –Крафта –
29. Реакции электрофильно – нуклеофильного катализа
• Нуклеофильный катализ. В этом случаекатализаторами являются основания Льюиса:
амины,R3N, R2HN, RNH2 .
• Принято обозначать нуклеофильное
замещение символом SN2 и для
мономолекулярного замещения SN1.
• Напомним, что по Г.Льюису кислота – это
акцептор неподеленной пары электронов, а
основание вещество, являющее донором
электронной пары.
30. Суперкислоты
• Термин суперкислота введён ДжеймсомКонантом в 1927 году для классификации
более сильных кислот, чем обычные
минеральные кислоты. В 1994 году Джордж
Олах был удостоен Нобелевской премии[1]
за своё исследование суперкислот и их
применения в прямом наблюдении
карбкатионов.
31. Cуперкислоты
• Магическая кислота получила своё названиеза исключительную способность растворять
воск. Она является смесью пентафторида
сурьмы, который является кислотой Льюиса, и
фторсульфоновой кислоты — кислоты
Брёнстеда.
• Сильнейшей суперкислотной системой
является гексафторсурьмяная кислота, смесь
плавиковой кислоты и пентафторида сурьмы
[H+ SbF6−].
• Фторсурьмяная кислота в 2·1019 раз сильнее
100%-ой серной кислоты
32. Протонные суперкислоты
• К простым суперкислотам относяттрифторметансульфоновую (CF3SO3H),
хлорную , хлорсульфоновую,
пентафторэтансульфоновую,
фторсульфоновую (FSO3H) кислоты.
• Во многих случаях суперкислота является
не одиночным соединением, а смесью
соединений, совмещаемых для достижения
высокой кислотности.
33. Карборановая кислота
• Карборановая кислота — самая сильная кислота(суперкислота) из допускающих возможность
хранения в специальных сосудах.
• Химическая формула — H(CHB11Cl11).
Карборановая часть молекулы имеет
икосаэдрическую структуру.
• Карборановая кислота приблизительно в
миллион раз сильнее концентрированной серной
кислоты и позволяет растворять не только
металлы, но и стекло, при достаточно долгом
воздействии.
34.
35. МЕТАЛЛОКOМПЛЕКСНЫЙ КАТАЛИЗ
МЕТАЛЛОКOМПЛЕКСНЫЙ КАТАЛИЗ• Основан на взаимодействии субстрата
с реагентом в координационной сфере
комплекса металла.
Металлокомплексный катализ может
осуществляться под действием гомогенных
и гетерогенных металлокомплексных
катализаторов.
• Основные типы реакций, катализируемых
комплексами металлов: гидрирование,
синтезы с участием оксида углерода,
полимеризация.
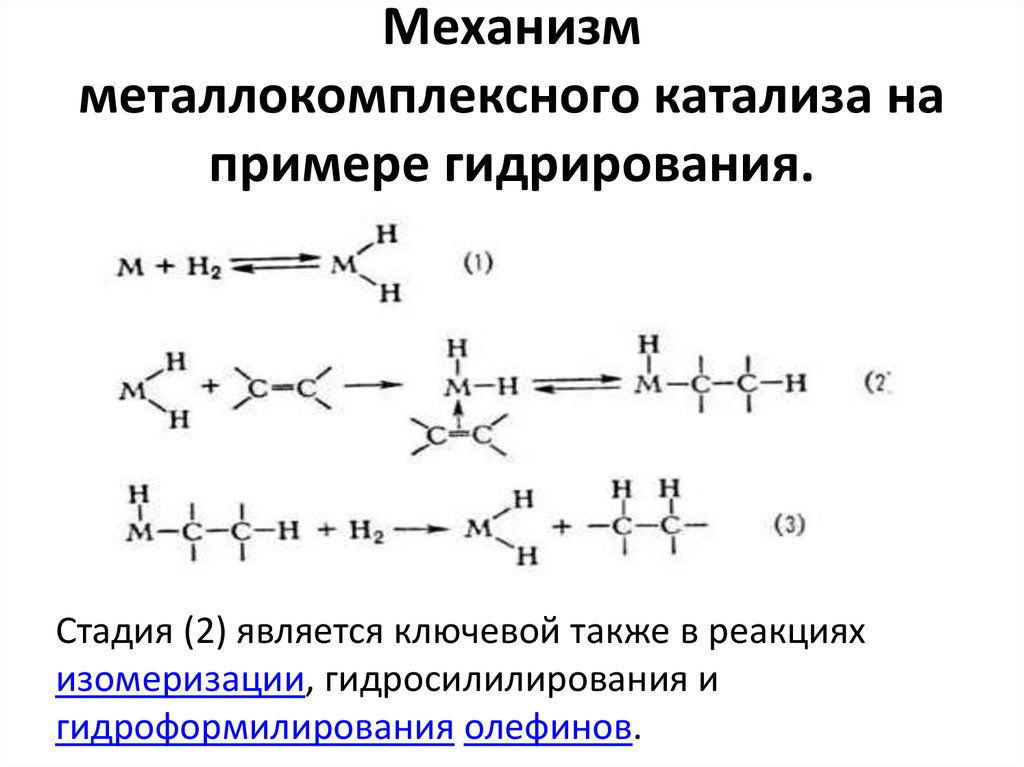
36. Механизм металлокомплексного катализа на примере гидрирования.
Механизмметаллокомплексного катализа на
примере гидрирования.
Стадия (2) является ключевой также в реакциях
изомеризации, гидросилилирования и
гидроформилирования олефинов.
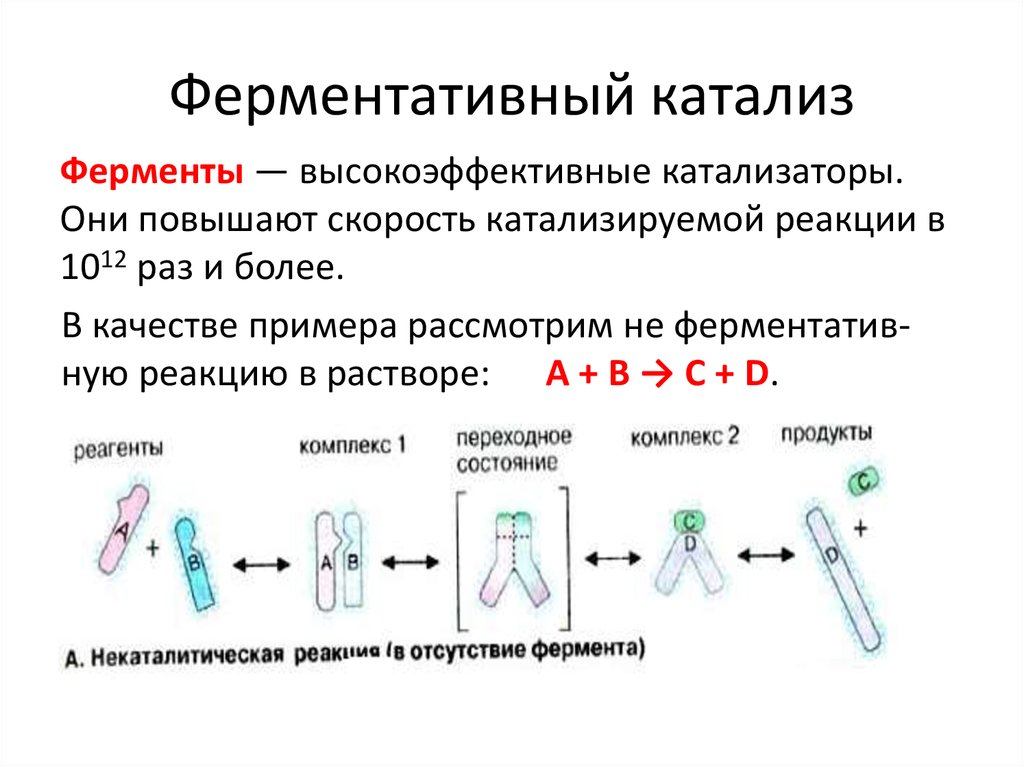
37. Ферментативный катализ
Ферменты — высокоэффективные катализаторы.Они повышают скорость катализируемой реакции в
1012 раз и более.
В качестве примера рассмотрим не ферментативную реакцию в растворе: А + В → С + D.
38. Неферментативный катализ
• Вещества A и В в растворе окружены оболочкой измолекул воды (гидратной оболочкой) и под
действием теплового движения перемещаются
случайным образом. Они могут вступать в реакцию
друг с другом только в том случае, когда
сталкиваются в благоприятной ориентации, что
маловероятно и происходит редко.
• В растворе большая часть Еа расходуется на
преодоление гидратных оболочек между A и В,
сближение реагентов и другие химические
процессы, в которых эти реагенты участвуют.
39.
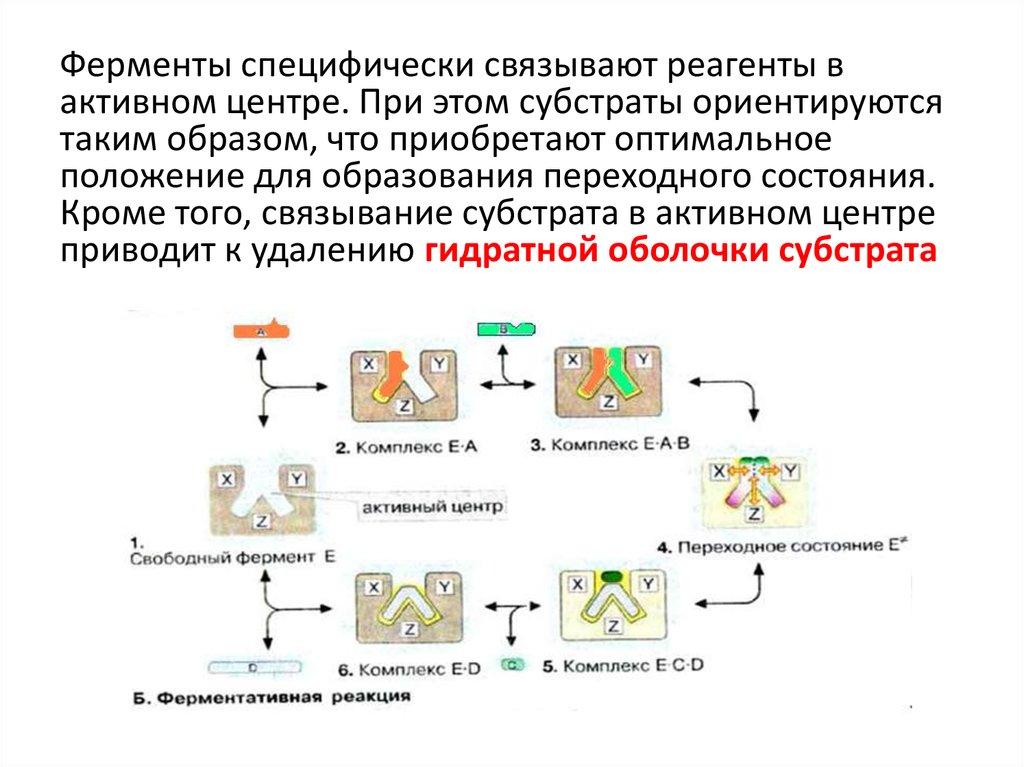
Ферменты специфически связывают реагенты вактивном центре. При этом субстраты ориентируются
таким образом, что приобретают оптимальное
положение для образования переходного состояния.
Кроме того, связывание субстрата в активном центре
приводит к удалению гидратной оболочки субстрата
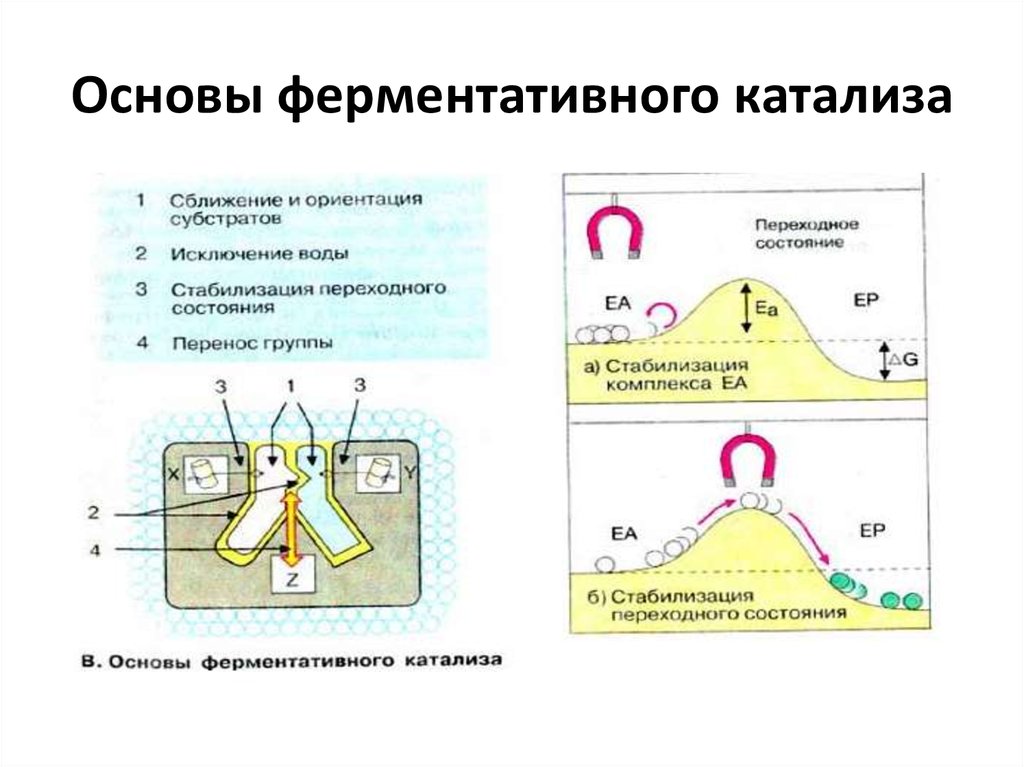
40. Основы ферментативного катализа
41.
Основные стадии катализа1. Присоединение субстрата (S)к ферменту (Е) с
образованием фермент –субстратного комплекса ЕS.
2. Преобразование фермент – субстратного комплекса
в один или несколько переходных комплексов (Е-Х) за
одну или несколько стадий
3. Превращение переходного комплекса в комплекс
фермент – продукт (Е-Р)
4. Отделение конечных продуктов от фермента.
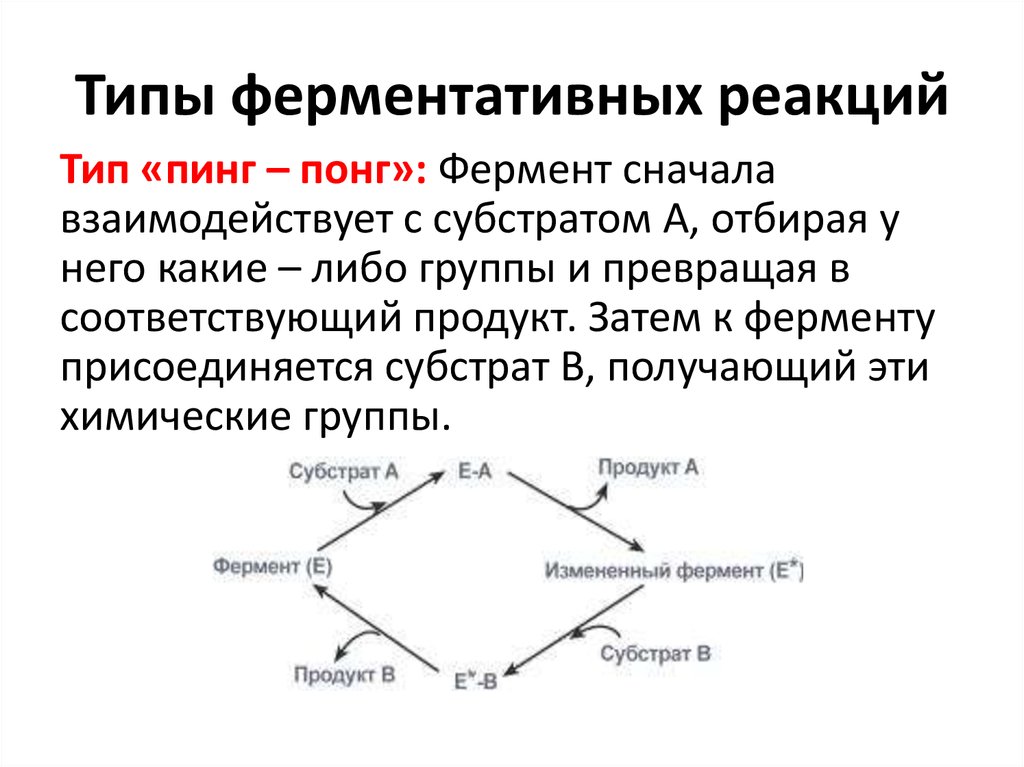
42. Типы ферментативных реакций
Тип «пинг – понг»: Фермент сначалавзаимодействует с субстратом А, отбирая у
него какие – либо группы и превращая в
соответствующий продукт. Затем к ферменту
присоединяется субстрат В, получающий эти
химические группы.
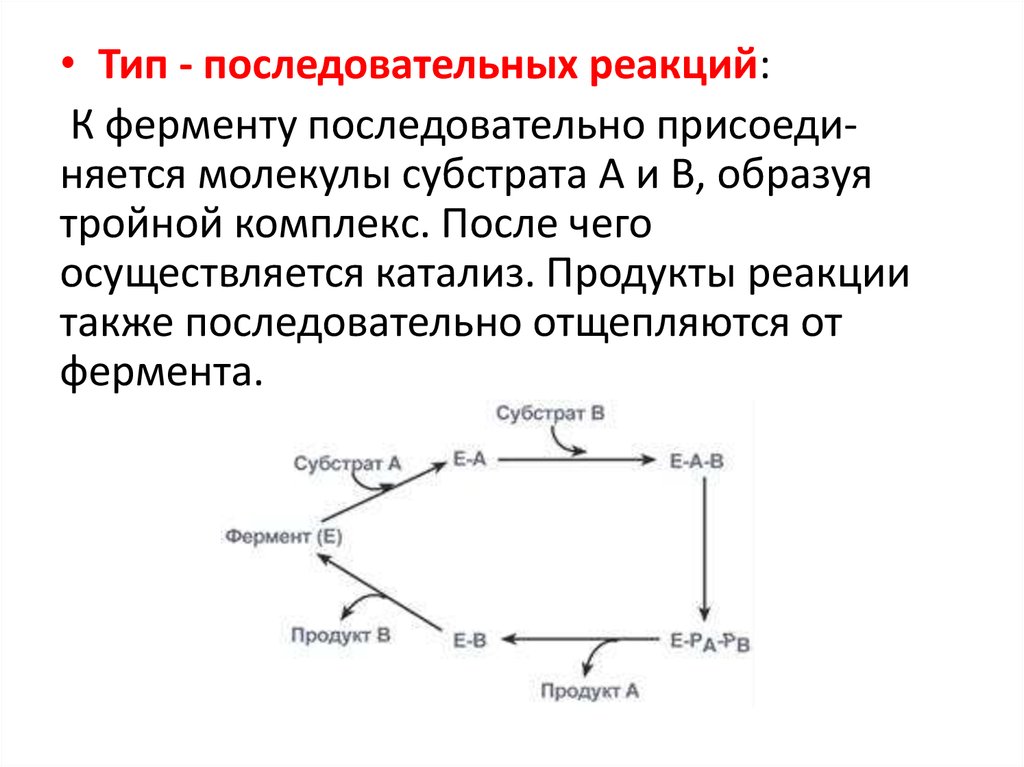
43.
• Тип - последовательных реакций:К ферменту последовательно присоединяется молекулы субстрата А и В, образуя
тройной комплекс. После чего
осуществляется катализ. Продукты реакции
также последовательно отщепляются от
фермента.
44. Механизмы катализа
• Кислотно – основной катализ - в активномцентре фермента находятся группы
специфических аминокислотных остатков,
которые являются донорами или
акцепторами протонов.
45.
46.
47. Механизм Л.Михаэлиса и М.Ментена
Механизм простейшей кислотно – основной(КО) ферментативной реакции: E enzyme
k1
Е + S ЕS ;
r1 = k1CSCE
k-1
r-1 = k-1CES
k2
r2 = k2CES
ЕS P + Е; где Е – фермент и S - субстрат
Лимитирующей стадией специфического КО
катализа является вторая стадия – распада
ES : Wp = r2 = ? ; Второе условие S0 >> Е0
48. Вывод уравнения
Для нахождения концентрации CES применимМКСК:
WES = r1 - r-1 - r2 = k1CSCE - k-1CES - k2CES =0
CES = k1CSCE /(k-1 + k2) = KМCSCE;
Введем обозначение
KМ = (k-1 + k2)/k1 ,
где KМ – константа Михаэлиса ;
Тогда CES = CSCE/KМ
49. Вывод уравнения
• Текущая концентрация CE по уравнению МБCE = CE0 - CES ;
CES = CSCE/KМ = CS(CE0 - CES )/KМ отсюда
CES = CSCE0/(KМ + CS)
Окончательно
Wp = k2CES = k2CSCE0/(KМ + CS)
Напомним, что CS0 >> CE0 и следовательно:
CS CS0 - (метод избыточных концентраций)
50. Анализ уравнения
• Wp = k2 CS0CE0/(KМ + CS0)Обозначим : Wmax = k2CE0
– это максимальная скорость образования
продукта в начальный момент времени и
тогда:
Wp = WmaxCS0/(KМ + CS0)
- уравнение Михаэлиса – Ментена для
ферментативного катализа
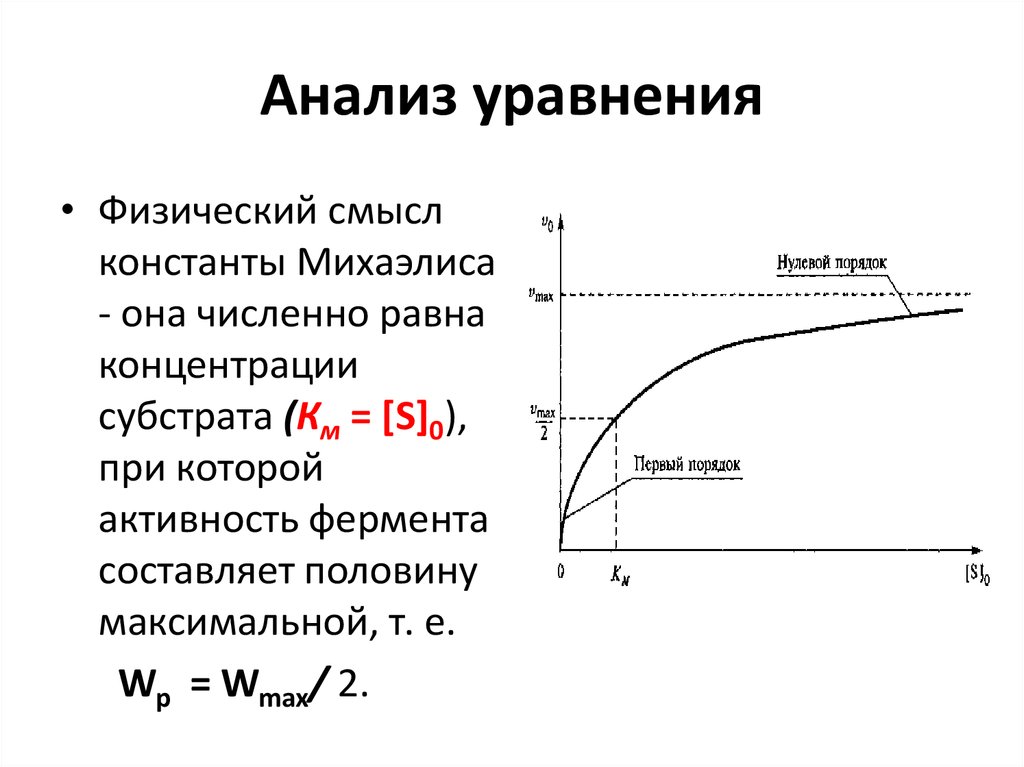
51. Анализ уравнения
• Физический смыслконстанты Михаэлиса
- она численно равна
концентрации
субстрата (Км = [S]0),
при которой
активность фермента
составляет половину
максимальной, т. е.
Wp = Wmax/ 2.
52.
Продолжение необходимогоматериала для экзамена
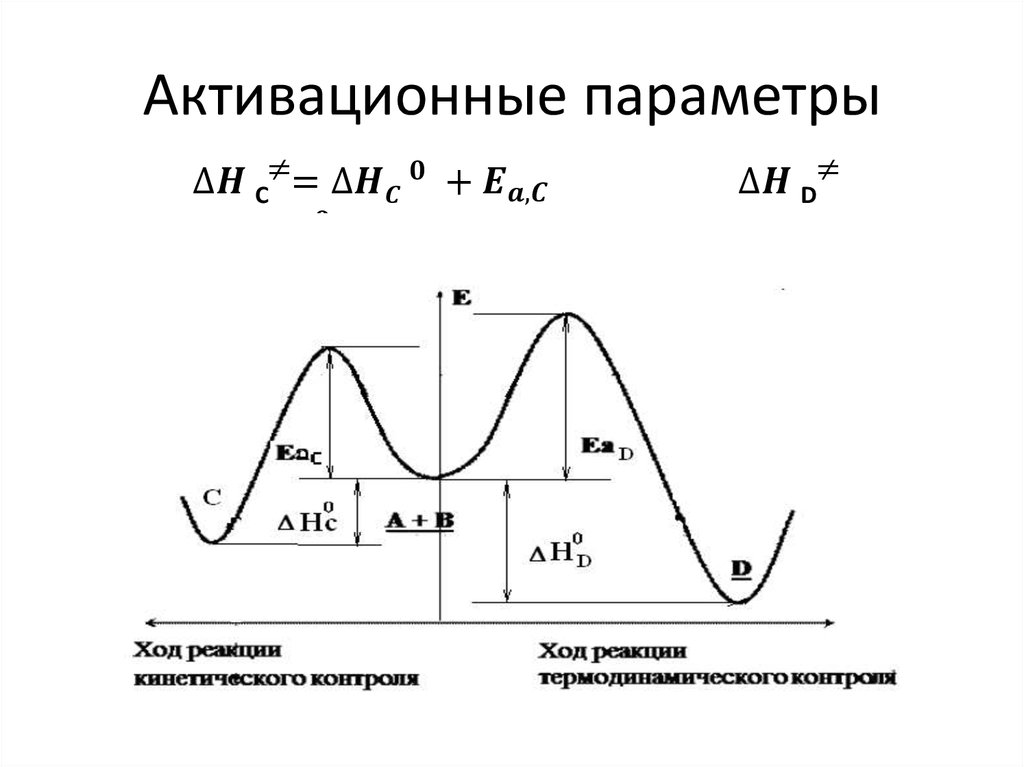
53. Кинетический и термодинамический контроль реакции
А +В С + DРеагенты А +В образуют два продукта С и D
и их соотношение зависит от температуры.
Состав продуктов может определятся
термодинамикой равновесной системы, т.е.
реакция подчинятся термодинамическому
контролю. В других случаях, состав смеси
продуктов может определяться скоростями
конкурирующих реакций образования
возможных продуктов (кинетический контроль
реакции).
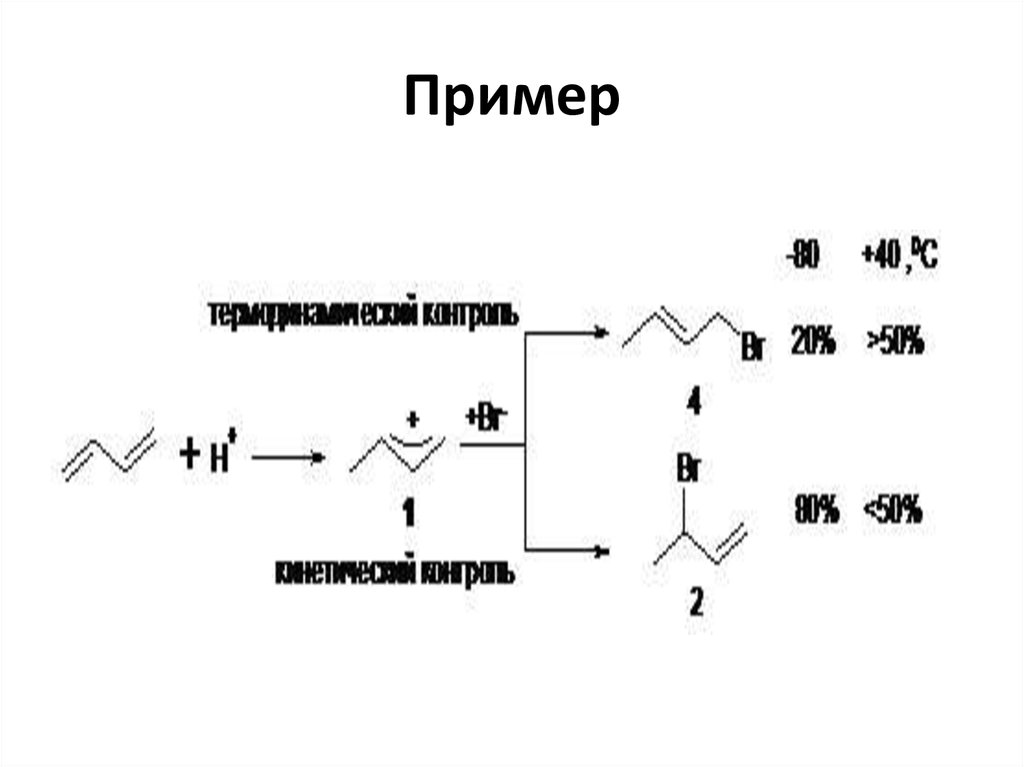
54. Температурный режим
О кинетическом контроле прохожденияхимической реакции говорят когда из двух
или более возможных продуктов реакции
образуется преимущественно продукт более
быстрой реакции, как правило, менее
энергетически выгодный и образуется при
более низких температурах.
Термодинамический контроль - продукт
образуется при более высоких температурах.
55. Пример
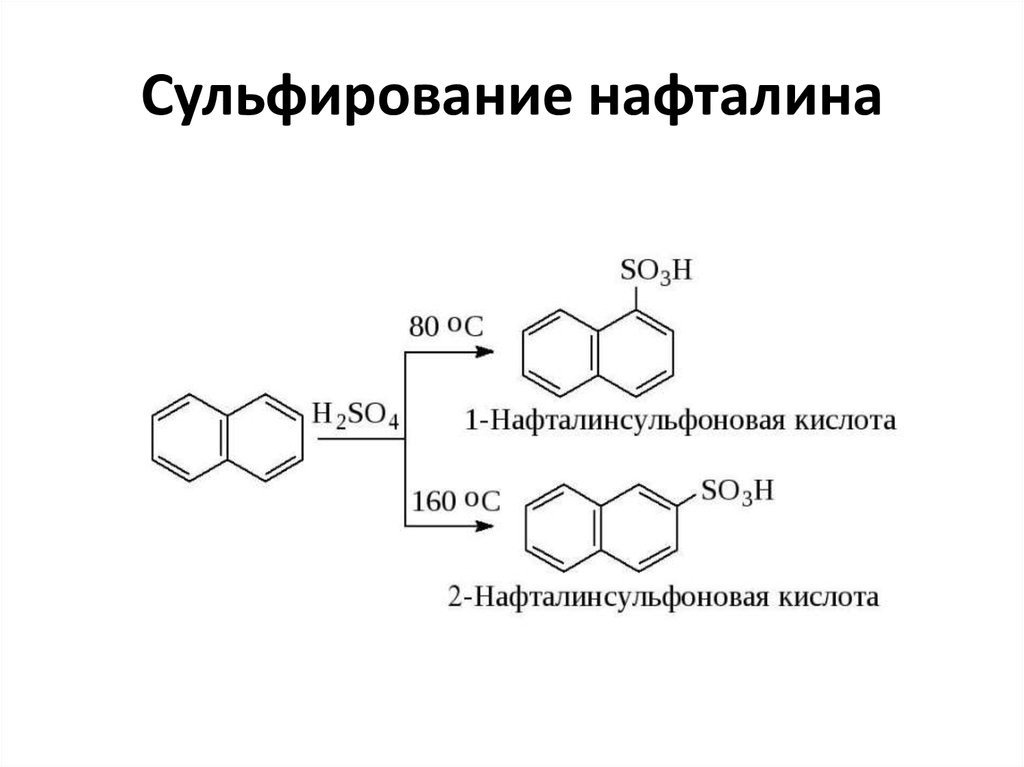
56. Сульфирование нафталина
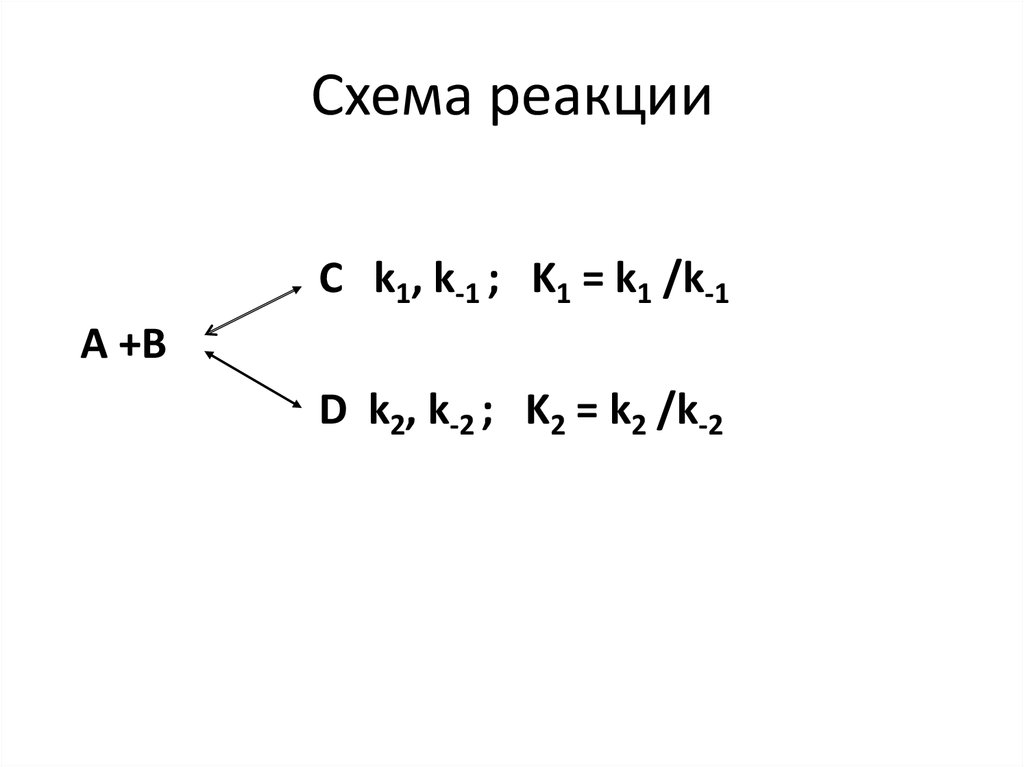
57. Схема реакции
С k1, k-1 ; K1 = k1 /k-1А +В
D k2, k-2 ; K2 = k2 /k-2













































 chemistry
chemistry








