Similar presentations:
Курс лекций по энзимиологии
1. Курс лекций по энзимиологии
• Лектор• Шумянцева Виктория Васильевна,
д.б.н. профессор кафедры биохимии
МБФ РНИМУ им. Н.И. Пироова,
• Зав. лабораторией биоэлектрохимии
ИБМХ им. В. Н. Ореховича (кор. Б, ком.
354)
2. Основные вопросы по 1-й лекции
• 1. Структурная биохимия. Первичная, вторичная,третичная структура белков. Связи,
стабилизирующие эти структуры. Примеры. Методы
разрушения ковалентных, ионных, гидрофобных
связей.
• 2. Классификация ферментов по простетическим
группам, по типу катализируемых реакций.
• 3. Практическое использование химической
модификации белков.
• 4. Белок-белковые взаимодействия. Медицинские
аспекты.
• 5. Посттрансляционные модификации белков
3. Лекция 2 Химическая кинетика
• Химическая кинетика - один из важнейших разделов химии,задача которого - объяснение качественных и количественных
изменений химического или биохимического процесса,
происходящего во времени. Эту задачу подразделяют на две.
• 1. Выявление механизма реакции - установление элементарных
стадий и последовательности их протекания (качественные
изменения).
• 2. Количественное описание химической реакции установление строгих отношений, которые могли бы
предсказывать изменения количеств исходных реагентов и
продуктов по мере протекания реакции.
• При обсуждении механизмов реакции классифицируют по числу
молекул, участвующих в каждом элементарном акте
взаимодействия.
4. Классификация химических реакций
5. Молекулярность химических реакций
• Мономолекулярными называют реакции, в которыхэлементарный акт представляет собой химическое
превращение одной молекулы.
• A=B+C
• Бимолекулярные - реакции, элементарный акт в которых
осуществляется при одновременном столкновении двух
молекул.
• A+B=C или 2A=C
• В тримолекулярных реакциях элементарный акт
осуществляется при одновременном столкновении трех
молекул.
• 2A+B=C A+B+C=D
• Столкновение более чем трех молекул одновременно
практически невероятно, поэтому реакций большей
молекулярности на практике не обнаружено.
6. Порядок реакции
• Порядок реакции. В кинетике различают реакциипервого, второго , третьего или даже дробного
порядка. Порядок реакции - это число, равное сумме
показателей степени концентрации реагирующих
веществ в уравнении скорости.
• A=B+C
• v =k [A], это скорость реакции первого порядка.
• A+B=C, v=k[A][B], сумма показателей 2, реакция
суммарно второго порядка, но первого порядка по А,
и первого по В.
• или 2A=C v=k[A]2 , это скорость реакции второго
порядка.
7. Порядок реакции
• v =k [A]2 [B] [C] 3 , это реакция шестого порядка, нопервого по В, второго по А, третьего по С.
• Если в уравнении скорости отсутствует
концентрация, т.е. v=k, то оно относится к реакции
нулевого порядка. Реакции нулевого порядка
протекают с постоянной скоростью и не зависят от
концентрации реагирующих веществ. Например, в
каталитической реакции, в которой концентрация
реагента (субстрата) настолько превышает
концентрацию катализатора (фермента), что
катализатор (фермент) все время полностью
насыщен реагентом, реакция будет протекать с
максимальной скоростью, и на нее не будет влиять
увеличение концентрации реагента.
8. Cкорость реакции.
• Основным понятием в химической кинетике являетсяскорость реакции.
• Скорость химической реакции определяется
количеством вещества, прореагировавшего в
единицу времени в единице объема.
• Размерность скорости химической реакции моль/л с
или моль/л мин (М/с, М/мин).
• Скорость химической реакции в начальный момент
времени , когда существенные изменения
концентраций реагирующих веществ не успели
произойти, называется начальной скоростью и
обозначается v0
• Скорость химической реакции в любой другой
момент времени называется текущей скоростью v.
9. Закон действующих масс Гулдберга и Вааге.
• В основе кинетики лежит закон действующихмасс Гулдберга и Вааге.
• Закон действующих масс был
сформулирован в 1867 г. Гулдбергом и Вааге,
и независимо от них в 1865 г. русским ученым
Н.И. Бекетовым.
• (1861 г. Теория строения органических
соединений А.М. Бутлерова,
• 1869 г. Периодический закон и
Периодическая таблица химических
элементов Д.И. Менделеева)
10. Закон действующих масс Гулдберга и Вааге.
• Скорость химической реакции припостоянной температуре прямо
пропорциональна произведению
концентраций реагирующих веществ в
степени их стехиометрических
коэффициентов.
• A=B+C
• v =-dA/dt =k [A], k - коэффициент
пропорциональности (константа скорости),
[A]- молярная концентрация вещества А (М,
моль/л)
11. Выражения для скорости реакции
• Для реакции нулевого порядка v =-dA/dt =k,(размерность k М/с)
• Для мономолекулярной реакции A=B+C
• v =-dA/dt =k [A], размерность k время-1, ( с -1 )
• k - коэффициент пропорциональности (константа
скорости),
• [A]- молярная концентрация вещества А
• В случае бимолекулярной реакции A+B=C, v=k[A][B]
• 2A=C, v=k[A]2 , размерность k М -1 с -1
• в случае тримолекулярной реакции 2A+B=C
• v= k[A]2[B]
• A+B+C=D , v= k[A][B][C]
• В общем виде mA+nB=C, v= k[A]m[B]n
12. Закон действующих масс Гулдберга и Вааге.
A=P
V=k[A], k –константа скорости
mA+nB=pC+qD
V=k[A]m[B]n
Влияние концентраций реагирующих веществ может быть
объяснено тем, что химические взаимодействия являются
результатом столкновений частиц. Увеличение числа частиц в
заданном объеме приводит к более частым столкновениям, т.е.
к увеличению скорости реакции.
• Зависимость скорости химической реакции от концентрации
реагирующих веществ справедлива для газов и реакций,
протекающих в растворе. Для реакций с участием твердых
веществ взаимодействие происходит не во всем объеме, а
лишь на поверхности, от размера которой зависит скорость
реакции. Поэтому реакции в гетерогенных системах
значительно сложнее.
13. Константа скорости k
Константа скорости k характеризует
1) химическую природу реагирующих веществ,
2) их способность вступать в реакцию.
Пример:Na+H2O=1/2H2 + NaOH (реакция идет бурно,
со взрывом)
• 3Fe +4 H2O(пар) =Fe3O4 +4H2 (реакция идет при
нагревании)
• Физический смысл константы скорости - это скорость
реакции при концентрации реагирующих веществ,
равной единице, [A]=1моль/л (1М). v=k
14. Способы выражения концентрации
1. Молярная концентрация.
Количество молей в 1 л раствора
моль/л или М
ммоль/л, мМ (10-3)
мкмоль/л, мкМ (10-6)
нмоль/л, нМ (10-9 )
рмоль/л, рМ (10-12 )
фмоль /л фМ (10-15 )
15.
аттомоль/л, аМ (10-18 )
зептомоль/л, зМ (10-21 )
йоктомоль/л (yocto), (10-24 )
1 йоктомоль составляет 0,6 молекулы
16.
Молярная концентрация.Количество молей в 1 л раствора
моль/л или М
ммоль/л, мМ (10-3)
мкмоль/л, мкМ (10-6)
нмоль/л, нМ (10-9 )
рмоль/л, рМ (10-12 )
фмоль /л фМ (10-15 )
аттомоль/л, аМ (10-18 )
зептомоль/л, зМ (10-21 )
йоктомоль/л (yocto), (10-24 )
1 йоктомоль составляет 0,6 молекулы
17.
• 2. Массовая доля (Процентнаяконцентрация).
• Масса (г) вещества в 100 г раствора.
• m(в-ва)/m (р-ра) × 100%
18. Экспериментальный расчет
• Расчет количества вещества набиочипе, электроде, подложке
микроскопа.
• Например, на биочип нанесли 2 мкл 100
мМ раствора белка. Сколько молей
белка на биочипе? ( =m/M; x= объем
молярность)
• Обратите внимание на размерность!
19.
• Количество молей = объем *молярность
• = 2 * 10-6 л * 100 10-3 моль/л = 2 *10-7
моль
20. Порядок реакции
• Порядок реакции. В кинетике различают реакциипервого, второго , третьего или даже дробного
порядка. Порядок реакции - это число, равное сумме
показателей степени концентрации реагирующих
веществ в уравнении скорости.
• A=B+C
• v =k [A], это скорость реакции первого порядка.
• A+B=C, v=k[A][B], сумма показателей 2, реакция
суммарно второго порядка, но первого порядка по А,
и первого по В.
• или 2A=C v=k[A]2 , это скорость реакции второго
порядка.
21. Порядок реакции
• v =k [A]2 [B] [C] 3 , это реакция шестого порядка, нопервого по В, второго по А, третьего по С.
• Если в уравнении скорости отсутствует
концентрация, т.е. v=k, то оно относится к реакции
нулевого порядка. Реакции нулевого порядка
протекают с постоянной скоростью и не зависят от
концентрации реагирующих веществ. Например, в
каталитической реакции, в которой концентрация
реагента (субстрата) настолько превышает
концентрацию катализатора (фермента), что
катализатор (фермент) все время полностью
насыщен реагентом, реакция будет протекать с
максимальной скоростью, и на нее не будет влиять
увеличение концентрации реагента.
22. Зависимость скорости реакции нулевого порядка от концентрации
V=k6.5
6.0
скорость
5.5
5.0
4.5
4.0
3.5
1.0
1.5
2.0
2.5
3.0
концентрация реагента
3.5
4.0
23. Зависимость скорости реакции первого порядка от концентрации
v =k [A],5
скорость
4
3
2
1
0
0
1
2
3
4
концентрация реагента
5
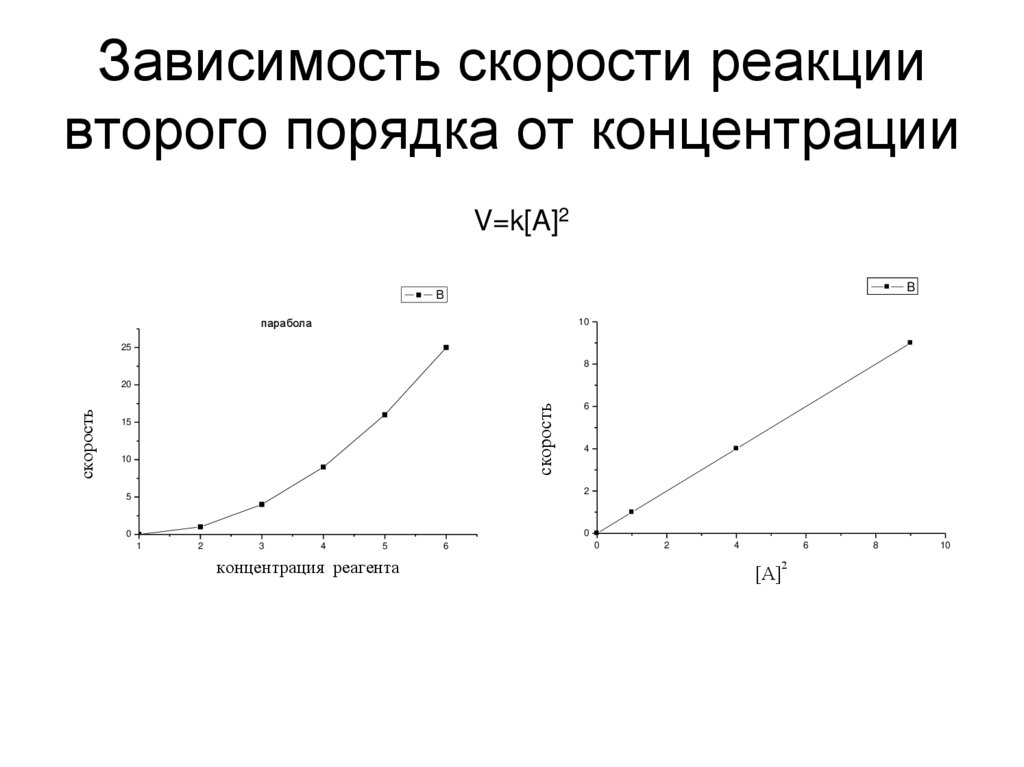
24. Зависимость скорости реакции второго порядка от концентрации
V=k[A]2B
B
парабола
10
25
8
скорость
скорость
20
15
10
6
4
2
5
0
0
1
2
3
4
5
концентрация реагента
6
0
2
4
6
[А]
2
8
10
25. Начальная скорость ферментативной реакции
• Начальная скорость – это скорость впервые моменты инкубации, пока еще
сохраняется прямо пропорциональная
зависимость между нарастанием
продукта и временем инкубации, пока
превращению подверглось не более 1015 % субстрата.
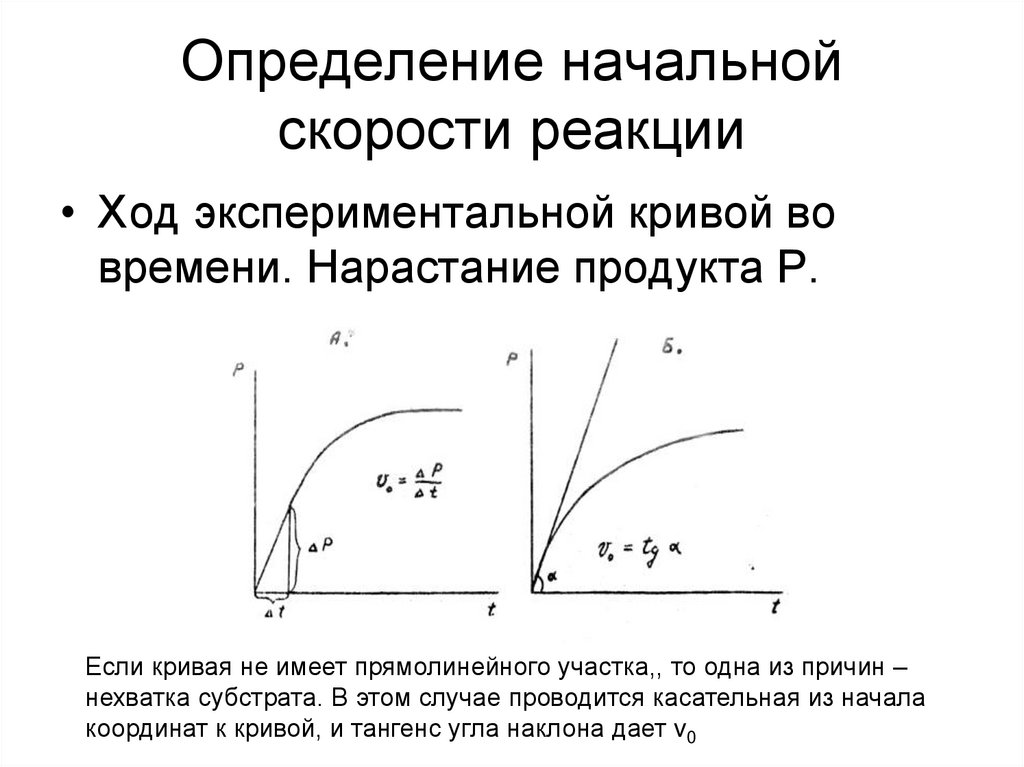
26. Определение начальной скорости реакции
• Ход экспериментальной кривой вовремени. Нарастание продукта Р.
Если кривая не имеет прямолинейного участка,, то одна из причин –
нехватка субстрата. В этом случае проводится касательная из начала
координат к кривой, и тангенс угла наклона дает v0
27. Каталитические реакции
• Если катализатор находится в однойфазе с реакционной смесью, то процесс
называется гомогенным, если в разных
фазах – гетерогенным.
• Катализатор – вещество, не входящее в
стехиометрическое уравнение реакции,
ускоряющее химическую реакцию, но
остающееся неизменным после
реакции.
28.
• Ферменты, растворенные вреакционной смеси, считаются
гомогенными катализаторами.
• Однако, часто ферменты ведут себя как
гетерогенные катализаторы, так как изза большого размера их белковых
молекул они образуют коллоидные, а
не истинные растворы (размеры белков
лежат в нанометровом диапазоне).
29.
• Истинные растворы -размеры чстичменее 1 нм
• Коллоидные растворы (растворы
белков 1-100 нм (нанорастворы)
30. Каталитические реакции
• Катализатор – это вещество не входящее встехиометрическое уравнение реакции,
может образовывать с исходными
веществами переходные комплексы с
меньшими свободными энтальпиями
активации, чем при непосредственном
взаимодействии исходных веществ. Если
образующиеся переходные комплексы
распадаются с образованием продуктов и
полной регенерацией катализатора, то
реакция является каталитической.
31. Активные центры ферментов как биологических катализаторов
• В основе катализа лежитпредставление о том, что
каталитический цикл осуществляется
совокупностью атомов, которые
составляют активный центр . Для
ферментов под активным центром
понимают совокупность фрагментов
аминокислот, осуществляющих
связывание (сорбцию) субстрата, его
химическую активацию и превращение.
32. Активные центры ферментов
• Активный центр фермента имеетсложную конфигурацию, он включает
как полярные (гидрофильные ), так и
неполярные (гидрофобные ) группы.
• Представление об активном центре
сформировалось в результате анализа
данных по ингибированию реакций и
химической модификации белковой
молекулы.
33. Активные центры ферментов
• Активный центр ферментаосуществляет две функции:
• 1. сорбцию субстрата
(комплексообразование субстрата с
ферментом)
• 2. химическое превращение субстрата
• Условно в активном центре можно
выделить сорбционный и
каталитический участки.
34. Природа ферментативного катализа
S→S*P
На первой стадии исходная молекула претерпевает
определенные конформационные и электронные
изменения, которые служат предпосылкой ее
последующего преобразования в конечный продукт
E+S ES →E + P
35. Энергия активации.
• В таком возбужденном состоянии S*(егоназывают переходным) молекула существует
очень недолго (10 -14 -10 -13 с). Возникновение
переходного состояния обусловлено
поступлением энергии извне.
• Суммарная реакция должна сопровождаться
уменьшение свободной энергии – иначе она
не произошла бы. Положительное изменение
свободной энергии при превращении S-S*
называют энергией активации.
36.
• Взаимодействие субстрата и ферментаописывается моделью «ключ-замок»
• или моделью индуцированного
соответствия, когда активный центр
фермента достаточно гибок и может
изменять свою конформацию при
связывании субстрата.
37. Идентификация групп, входящих в активные центры ферментов
• 1.Идентификация групп, входящих в активныецентры ферментов, проводится с помощью
химической модификации (см. лекцию 1)
• 2. Новые возможности идентификации групп,
входящих в активные центры ферментов, появились
с развитием техники сайт-специфического
мутагенеза (генетическая инженерия ферментов).
Для ферментов, экспрессию генов которых можно
проводить с помощью генно-инженерных
конструкций типа плазмид, возможна замена
отдельных аминокислот на уровне ДНК (на уровне
кодонов) с последующей экспрессией и изучением
каталитических свойств получаемых белков.
• 3. Методы с использованием биосенсорных
технологий и биоинформационные методы
38. Сорбционный и каталитический участки.
• Сорбционный подцентр, ответственныйза связывание, фиксацию и ориентацию
субстратов, определяет специфичность
действия ферментов
• Каталитический подцентр,
осуществляющий химическое
превращение молекул субстрата и
использующий для этих целей
различные механизмы катализа.
39. Типы катализа
• 1. Катализ сближением.(Внутримолекулярные реакции и
ферментативные реакции).
2. Ковалентный катализ.
2.1.Нуклеофильный катализ.
2.2. Электрофильный катализ.
.
40.
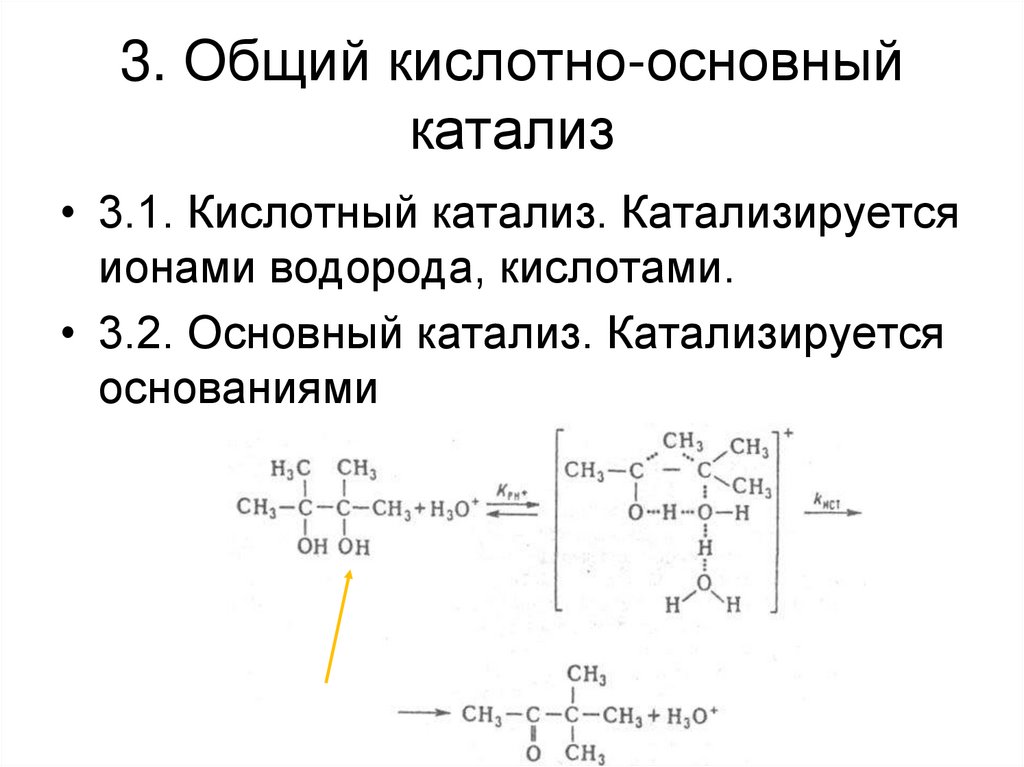
• 3. Общий кислотно-основный катализ• 3.1. Кислотный катализ. Катализируется
ионами водорода, кислотами.
• 3.2. Основный катализ. Катализируется
основаниями.
41. Типы катализа (по механизму реакции). 1. Катализ сближением. Примеры: внутримолекулярные реакции и ферментативные реакции
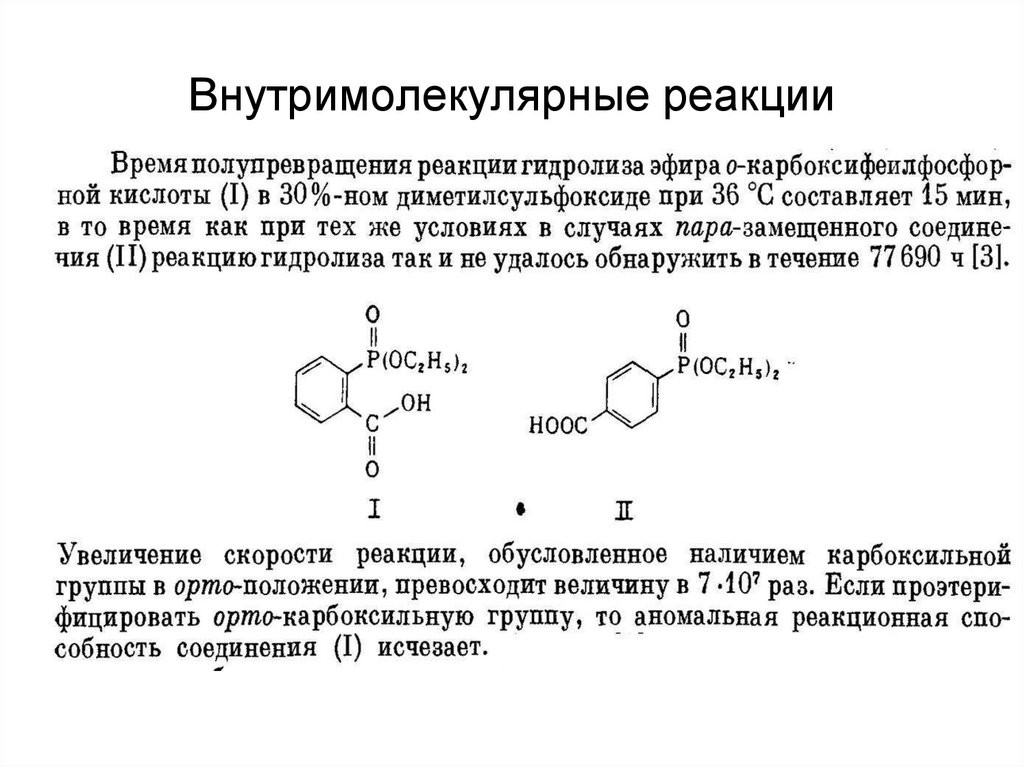
42. Внутримолекулярные реакции
43. 1. Катализ сближением
• Для ферментов катализ сближениемприводит к локальному увеличению
локальной концентрации реагирующих
молекул на активном центре фермента.
• На активном центре фермента
происходит сближение реагирующих
молекул за счет слабых сил
связывания.
44. 2. Ковалентный катализ.
• Некоторые ферменты химическиреагируют с субстратами с
образованием ковалентных ферментсубстратных промежуточных
соединений (ацилфермент в случае
сериновых протеиназ).
45. Ковалентные фермент-субстратные промежуточные соединения
Ковалентные ферментсубстратные промежуточныесоединения
46. 2.1. Нуклеофильный катализ
• 1. К нуклеофильным группам ферментов,которые участвуют в ковалентном катализе
относятся:
• -OH (серин, тирозин)
• -SH (цистеин)
• -COOH (аспарагиновая кислота)
• NH2- (лизин)
• Имидазол (гистидин)
• Все нуклеофильные группы, как правило,
имеют свободную пару электронов.
47. Нуклеофильный катализ
48. 2.2. Электрофильный катализ (основная роль – стабилизация образующихся отрицательных зарядов)
• Примеры электрофильныхкатализаторов
• 1. ионы металлов.
• 2. пиридоксальфосфат (пиридиновое
кольцо оттягивает на себя электроны,
эффективно стабилизируя
отрицательный заряд.
• 3. тиаминпирофосфат
49. Пиридоксаль фосфат конденсируется с аминокислотами, образуя основание Шиффа. Пиридиновое кольцо оттягивает на себя электроны,
Пиридоксаль фосфат конденсируется с аминокислотами, образуя. Пиридиновое кольцо оттягивает на себя
электроны, эффективно стабилизируя отрицательный заряд.
основание Шиффа
50. Пиридоксаль фосфат
51. 3. Общий кислотно-основный катализ
• 3.1. Кислотный катализ. Катализируетсяионами водорода, кислотами.
• 3.2. Основный катализ. Катализируется
основаниями
52. Классификация химических реакций
53. Классификация реакций (по стадиям).
• Последовательные многостадийныецепи реакций (гликолиз).
• А→Б →В →Г….Р
• В такой цепи скорость образования
конечного продукта определяется
скоростью самой медленной стадии
(узкое место)
54. Классификация реакций (по стадиям)
• Разветвленные реакции собразованием различных конечных
продуктов. Пример: превращение
ацетил –КоА:
• ацетил –КоА идет в цикл Кребса, на
синтез жирных кислот, на другие
синтетические процессы.
• Замкнутые циклы (цикл Кребса или
орнитиновый цикл)
55. Классификация реакций
• Ферментативная реакция• E+S ES →E + P
• Необратимые (односторонние для
ферментативных реакций) (АТФ-азная
реакция) E+S ES →E + P
• Обратимые (двухсторонние для
ферментативных реакций)
(переаминирование) E+S ES E + P
56. Классификация реакций
• Ферментативные реакции можноклассифицировать по числу участников.
• 1. односубстратные (ацетилхолинэстераза)
• 2. двухсубстратные (креатинкиназа,
миокиназа, переаминирование, цитохром
Р450)
• Иногда в ходе реакции участвует один
субстрат и один кофермент.
• Такие реакции описываются как
двухсубстратные (лактатдегидрогеназа)




















































 chemistry
chemistry








