Similar presentations:
Распределение молекул в системе по энергиям при разных температурах
1. Распределение молекул в системе по энергиям при разных температурах (Т2 > Т1)
Распределение молекул в системе по энергиям при разныхтемпературах (Т2 > Т1)
N a N e Ea / RT
распределение Максвелла-Больцмана:
N – общее число частиц, Na – число активных частиц,
N a - доля активных частиц
N
с ↑T растет доля активных молекул
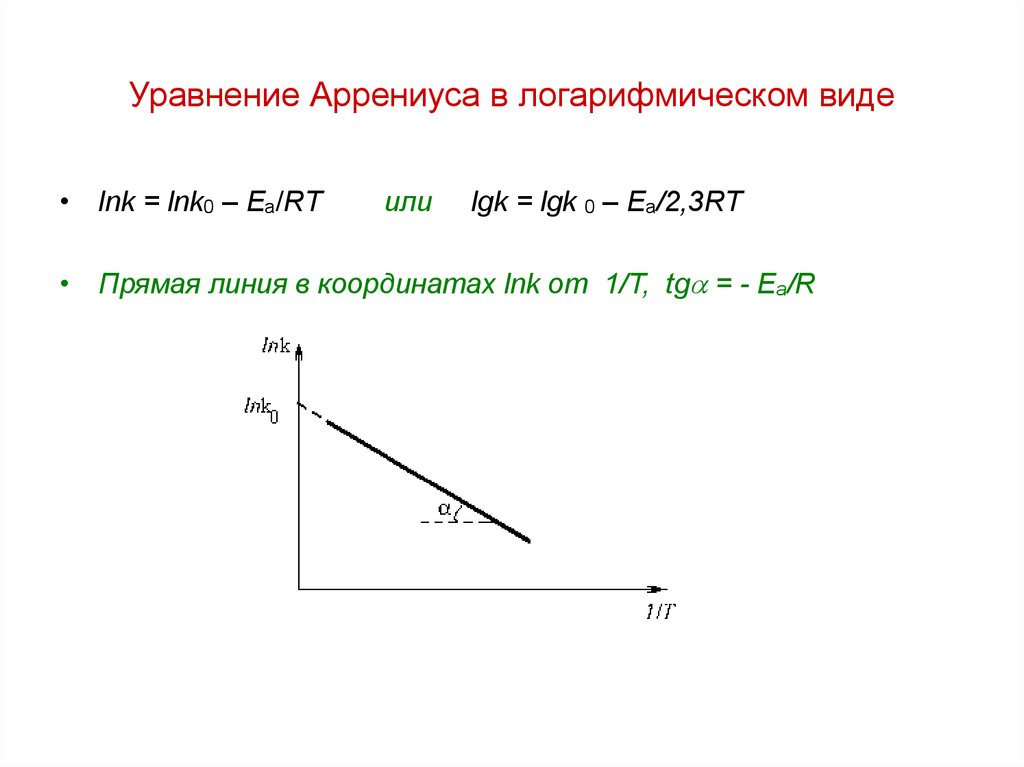
2. Уравнение Аррениуса в логарифмическом виде
• lnk = lnk0 – Еа/RTили
lgk = lgk 0 – Еа/2,3RT
• Прямая линия в координатах lnk от 1/Т, tg = - Еа/R
3. Приведем уравнение Аррениуса для двух температур (Т1 и Т2): lnk1 = lnk0 – Еа/RT1 lgk1 = lgk0 – Eа/2,3RT1 lnk2 = lnk0 – Еа/RT2
lgk2 = lgk0 – Eа/2,3RT2Вычитая из второго уравнения первое, получим:
Ea 1 1
ln( k2 / k1)
R T1 T2
Ea 1 1
lg( k2 / k1)
2,3R T1 T2
Если концентрации веществ постоянны, то:
Ea 1 1
2
lg
1 2,3R T1 T2
2 Ea 1 1
ln
1 R T1 T2
Энергию активации можно рассчитать по формуле:
Ea
R(T2T1) k2 R(T2T1) 2
ln
ln
T2 T1
k1 T T
2 1
1
4. Уравнение Аррениуса в дифференциальной форме:
Ead ln k
.
2
dT
RT
Ea /(RT2) > 0
• k возрастает с ↑Т
5. Связь энергии активации с тепловым эффектом реакции
Обратимые химические реакции протекают в прямом иобратном направлении А+В ↔ АВ
• для прямой реакции:
Ea
k k0 e
• для обратной реакции:
k k0 e
d ln k Ea
и
2
dT
RT
RT
Ea
RT
d ln k Ea
и
dT
RT 2
• Вычитая из первого уравнения второе, получим:
d ln
k
k Ea Ea ,
dT
RT 2 RT 2
k
k
K
6.
Заменим
k
K
(Константа равновесия)
k
Ea Ea
d ln K
.
2
dT
RT
Получим
Запишем изобару Вант-Гоффа
Следовательно
d ln K
H
r 2
dT
RT
Ea Ea r H
связь термодинамических и кинетических параметров:
Разность между энергиями активации прямой и обратной
реакции равна её тепловому эффекту ∆rH
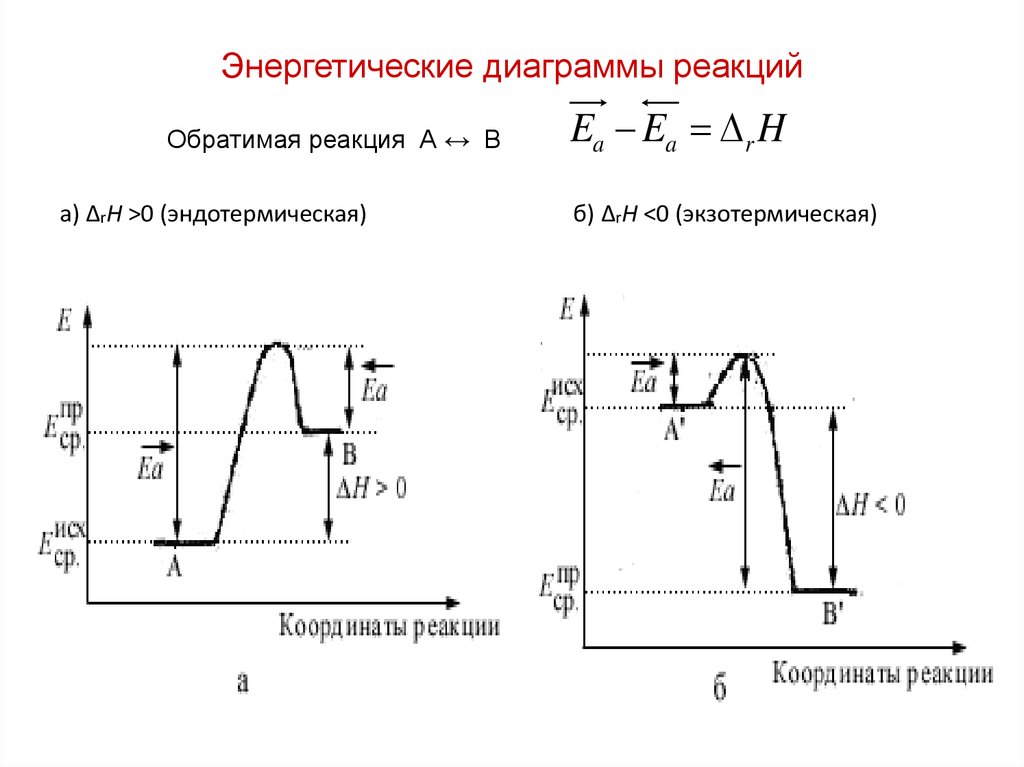
7. Энергетические диаграммы реакций
Обратимая реакция А ↔ Ва) ΔrН >0 (эндотермическая)
Ea Ea r H
б) ΔrН <0 (экзотермическая)
8. Катализ
Явление изменения скорости реакции под воздействиемкатализаторов называется катализом
Положительный катализ – процесс, ускоряющий реакцию
Отрицательный катализ – процесс, замедляющий реакцию
Гомогенный катализ – катализатор и все реагенты находятся в
одной фазе
H2O2 HI H2O + 1/2O2
(H+, OH- активные kt)
Гетерогенный катализ – реакция идет на поверхности
катализатора, образующего самостоятельную фазу
Pt-kt
H2O2
H2O + 1/2O2
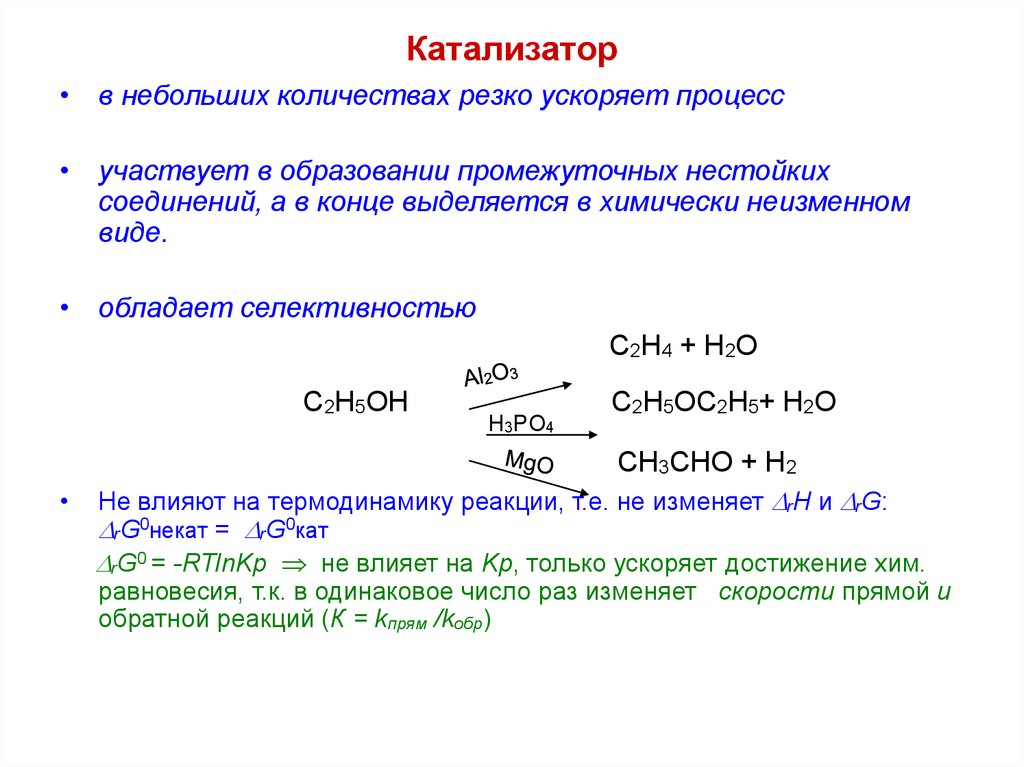
9. Катализатор
• в небольших количествах резко ускоряет процесс• участвует в образовании промежуточных нестойких
соединений, а в конце выделяется в химически неизменном
виде.
• обладает селективностью
С 2Н 4 + Н 2 О
С2Н5ОН
H3PO4
С2Н5ОС2Н5+ Н2О
СН3СНО + Н2
Не влияют на термодинамику реакции, т.е. не изменяет rН и rG:
rG0некат = rG0кат
rG0 = -RTlnKp не влияет на Kp, только ускоряет достижение хим.
равновесия, т.к. в одинаковое число раз изменяет скорости прямой и
обратной реакций (К = kпрям /kобр)
10. Катализатор
• уменьшает полную энергию активации процесса, Еа > Еа,к1
ABK*
Ea,K
Ea
Энергия
AB*
A+B
Hнач
2
AB
Hкон
Ход реакции
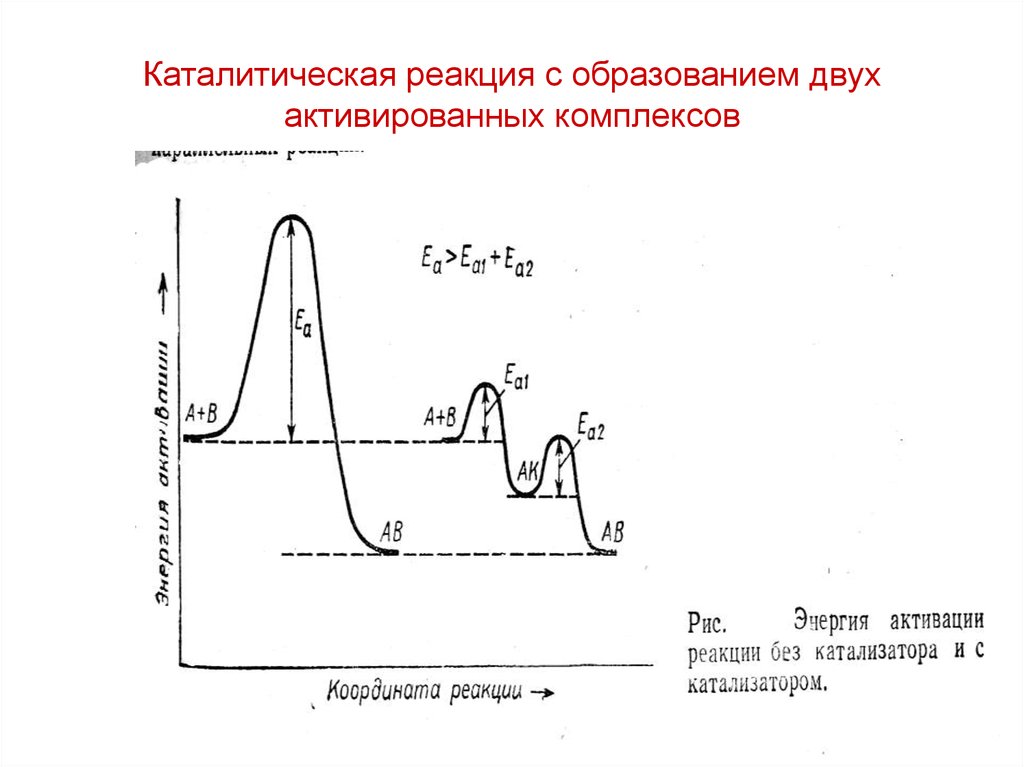
11. Каталитическая реакция с образованием двух активированных комплексов
12. Механизм гомогенного катализа: катализатор образует с реагентами промежуточное соединение, разложение которого является
лимитирующей стадией процесса.г 2СО
•Газофазный
2СО + О2
2
H O
HI
•Жидкофазный
H2O2 -----→
H2O + 1/2O2
2
кислотно-основный катализ (kt Н+ и ОН-)
гидролиз эфиров: R CООR + Н2О R СООН + R ОН
Н
Кислотный катализ широко применяется в органической химии.
Гомогенный катализ характеризуется
высокими скоростями реакций (скорость пропорциональна Сkt ),
дешевизной и доступностью катализаторов.
kt: Н2О; Си2+; Рd 2+;Fe 2+; кислоты; растворители и др.
Но трудно выделить из гомогенной смеси продукты реакции.
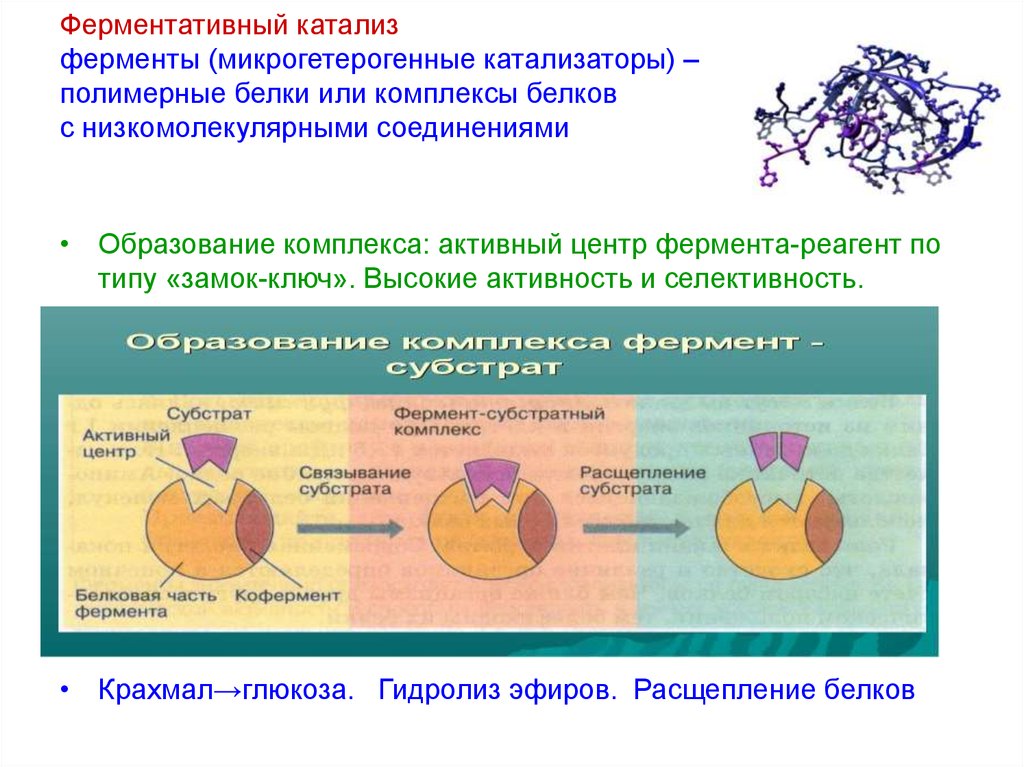
13. Ферментативный катализ ферменты (микрогетерогенные катализаторы) – полимерные белки или комплексы белков с низкомолекулярными
соединениями• Образование комплекса: активный центр фермента-реагент по
типу «замок-ключ». Высокие активность и селективность.
• Крахмал→глюкоза. Гидролиз эфиров. Расщепление белков
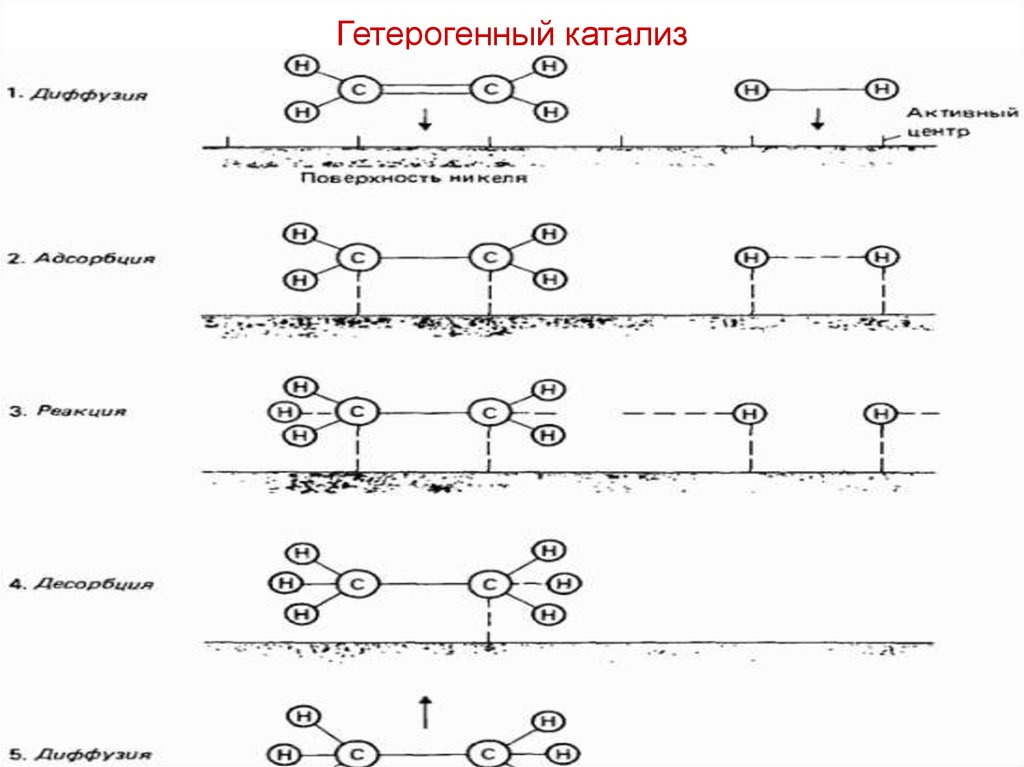
14. Гетерогенный катализ
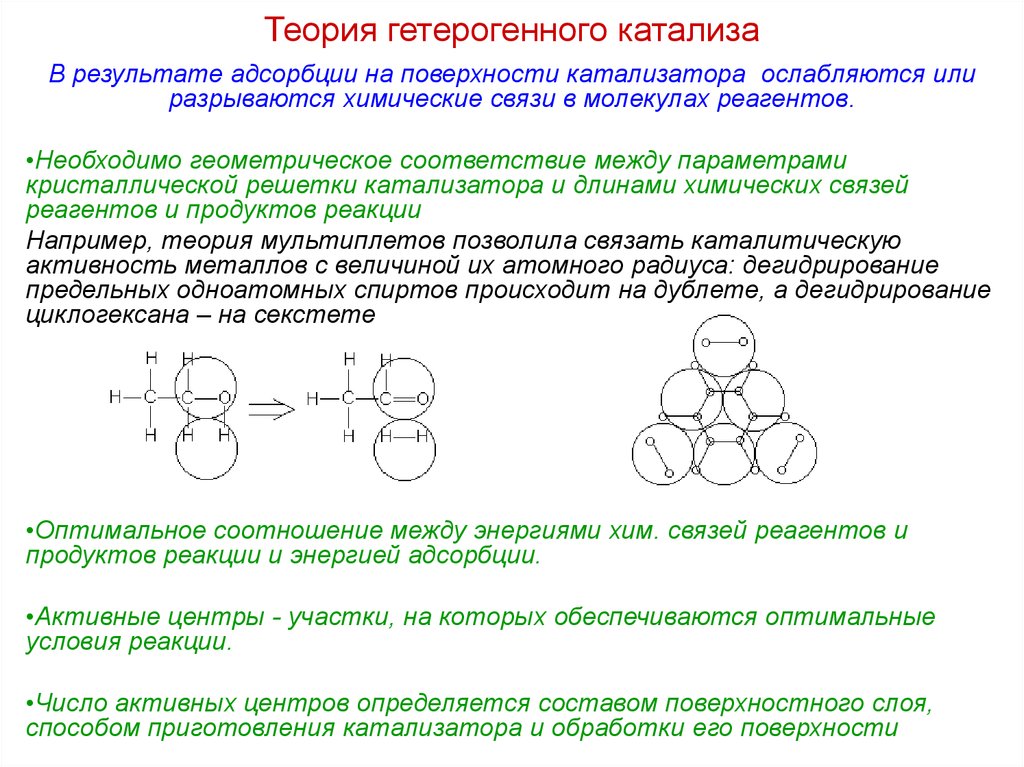
15. Теория гетерогенного катализа
В результате адсорбции на поверхности катализатора ослабляются илиразрываются химические связи в молекулах реагентов.
•Необходимо геометрическое соответствие между параметрами
кристаллической решетки катализатора и длинами химических связей
реагентов и продуктов реакции
Например, теория мультиплетов позволила связать каталитическую
активность металлов с величиной их атомного радиуса: дегидрирование
предельных одноатомных спиртов происходит на дублете, а дегидрирование
циклогексана – на секстете
•Оптимальное соотношение между энергиями хим. связей реагентов и
продуктов реакции и энергией адсорбции.
•Активные центры - участки, на которых обеспечиваются оптимальные
условия реакции.
•Число активных центров определяется составом поверхностного слоя,
способом приготовления катализатора и обработки его поверхности
16. Особенности гетерогенного катализа:
• Действие kt зависит от способа получения kt:акт
Cu(NO3)2 to
Cu + 2NO2 + O2
Cu-kt
неакт. Cu(NO3) 2 электролиз Cu + O2 +HNO3
• Действие kt зависит от присутствия активаторов (промоторов)
K2O, Al2O3 – для Fe-kt :
N2 + 3H2 → 2NH3
К2SO4 – для V2O5-kt :
2SO2 + O2 → 2SO3
Се для Ni - kt :
СО + Н2 → СН4 + Н2О
• каталитические яды уменьшают активность kt
H2S, O2 – для Fe-kt :
N2 + 3H2 → 2NH3
HgCl2 , AsH3 – для Pt-kt :
H2O2 → H2O + 1/2O2
(Необходимость очистки катализатора)
Скорость реакции зависит от величины удельной поверхности kt
17. Гетерогенные катализаторы
• К наиболее распространенным промышленным катализаторамотносятся Рt, Pd, Ph, Fе, Ni, СuО, RuO2, V2О5, NiО, Fe2O3, ZnО,
SiО2, Cr2О3, Al2О3, AlCl3, Аg2О,WO3, алюмосиликаты, цеолиты,
комплексы и кластеры металлов.
• Обычно применяют тонкоизмельченные порошки, пористые
структуры с высокоразвитой поверхностью, в том числе
пористые носители с нанесенным тонким слоем катализатора,
кластерного соединения или безлигандных ультрадисперсных
металлических частиц (наночастиц).
Расширение каталитических процессов и улучшение
катализаторов обеспечивает экономию энергии и сырья.
В дальнейшем применение катализаторов поможет также в
создании экологически чистых малоотходных технологий.
Большое значение имеет решение задачи увеличения срока
службы катализаторов, которые с течением времени могут
изменять химический и фазовый состав и дисперсность.










 chemistry
chemistry








