Similar presentations:
Определение кислот и оснований. Определение Бренстеда
1.
ОПРЕДЕЛЕНИЕ КИСЛОТ И ОСНОВАНИЙОпределение Бренстеда: ( протонная теория)
кислота является донором протона, основание – акцептором протона.
AH + B
-
-
A + HB
где: НВ/В- ; АН/А- – пары сопряженных кислот и оснований.
Определение Льюиса: ( электронная теория)
кислота является акцептором электронной пары, основание – донор
электронной пары .
Условия проявления кислотно-основных свойств?
спирт – кислота:
-
ROH + OH
спирт – основание: ROH + CH COOH
3
кислота – основание:
HCl + CH3COOH
-
RO + H2O
+
RO H2 + CH3COO
CH3COOH2+ + Cl-
-
2.
Кислоты Бренстеда:Основания Бренстеда:
HCl + B
BH + Cl
HO + H
H2O
H2O + B
BH + OH
H2O + H
H3O
R3N + H
R3N H
O
O
+ B
H2C
+ BH
NH2
NH
COOCH3
COOCH3
+ B
HC
COOCH3
C6H5OH + B
RCOO + H
+ BH
COOCH3
O
+ H
OH
C6H5O + BH
Кислоты Льюиса:
Протон: H
Нейтральные в-ва:
RCOOH
AlCl3 ; FeCl3 ; BF3
Катионы металлов: Li ; Ag ; Hg
Прочие электрофилы:
SO3 ; R ; NO2
Основания Льюиса:
Анионы: HO ; RO ; NH2
Молекулы с неподеленной
парой электронов:
NH3 ; R3N ; H2O ;
O
3.
Концепция жестких и мягких кислот и оснований (ЖМКО)Жесткие кислоты:
H+, Li+, Na+, K+, Mg2+ , Cu2+ , Fe3+ , Th4+ , Ti4+
BF3, AlCl3, SbF5
Жесткие основания: F-, HO-, C2H5O-, NO3-, PO43-, NH2-, NH3, R3N
Мягкие кислоты:
Cu+, Hg2+ , Pd2+ , Pt2+ , Tl+ , Cd2+
( * - орбиталь) СО, NO
Мягкие основания:
HS-, I-, Br-, CH3COS-, R-, S2O32-, SCNR2S, PR3, P(OR)3, CO
Алкены, алкины, ароматика и др. непредельные УВ
Ряды относительной мягкости и жесткости
Основания (В):
CH3Hg + BH
CH3HgB + H
I- > Br- > Cl- > S2- > RS- > CN- > H2O > C5H5N > AcO- > F- > NH3 > HOКислоты (М+):
I + M OH
M I + OH
Hg2+ > Ag+ > CH3Hg+ > Cd2+ > Zn2+ > Ni2+ > Fe2+ > Cu2+ > Cr3+ > Zr4+ > H+
4.
Кислотность и основность Бренстдедовских кислот и основанийКонстанта кислотности
AH + SH
A + SH2
K
AH
A
=
[A ][SH2 ]
рKA = -lgKA
[AH]
Константа основности
A + SH
K
AH + S
AB =
[AH ][S ]
рKВ = -lgKВ
[A ]
Константа автопротолиза растворителя
KW = 10-14 , рKW = 14
Для водных растворов рKW = рKААН + рKВА- = 14
Кислота
CF3COOH
C6H5SO3H
CH3COOH
NH4+
C6H5OH
HCN
H2O
CH3OH
рKA
0,23
0,7
4,76
9,23
9,87
10,14
15,7
16,0
Основание
CF3COO
C6H5SO3
рKВ
13,77
13,3
-
-
CH3COO
9,24
-
NH3
-
4,77
C6H5O
4,13
-
CN
-
3,86
HO
-
-1,7
CH3O
-2,0
-
5.
Расчет константы протолитического равновесияK
AH + B
K =
[BH][A ]
[AH ][B ]
=
[A ][SH2 ]
[BH]
[AH]
[B ][SH2 ]
Пример:
CH3COO- + C6H5COOН
КА 105:
A + HB
6,6
К
=
AH
K
A
BH
K
A
=
BK
B
AK
B
CH3COOH + C6H5COO1,75
К = КАБК /КАУК = 6,6 10-5/(1,75 10-5)= 3,77
6.
Функция кислотности Н0Исходные положения
Светопоглощение пропорционально концентрации
вещества (закон Бугера-Ламберта-Бера):
В – индикатор-основание
ВН+ – протонированный индикатор
K
В присутствии кислоты:
Iкон = I0exp(- lC)
0
A
B + H
BH
K A0 – константой кислотности протонированной формы индикатора, BH
По светопоглощению определяют отношение концентраций: I = [BH+]/[B]
Вывод уравнения для определения кислотности
K
0
A
aH aB
a BH
a H [ B ] B
[ BH ] BH
aH B 1
BH
h
0
I
I
, где
h0
a B
H
BH
– кислотность
h0 = K0A I
K
0
A
определяют в разбавленных растворах, для которых i = 1:
Н0 = -lgh0
K A0
H 0 lg h0 pK A0 lg I
[ H ][ B]
lim
[ Сi ] 0 [ BH ]
7.
Построение шкалы Н01.
2.
3.
Определяют КА0 для самого сильного основания-индикатора в ряду в сильно разбавленном
растворе кислоты, когда i = 1.
Проводят измерения Н0 по уравнению H 0 lg h0 pK A0 lg I в пределах концентраций,
позволяющих получать достоверные значения I.
В области перекрывания определяют КА0 для следующего в ряду индикатора (например, пнитроанилин и о-нитроанилин):
I o K o0 a H B,o BH ,n
I n K n0 a
BH ,o H
lg I o lg I n pK o0 pK n0 lg
B ,n
B ,o
BH ,n
BH ,o B ,n
pKo0 lg I o lg I n pK n0
4. Продолжают измерения по п.п. 2-3 с каждым последующим индикатором.
Функция кислотности для оснований Н_ (функция Стюарта)
BH + HO- B- + H2O
или
BH B- + H+
KABH = [B-]aH+ B-/([BH] BH)
h_ = aH+ B-/ BH
H_ = -lgh_
Общий принцип измерений различных функций кислотности НХ
H X pK A0 lg I
8.
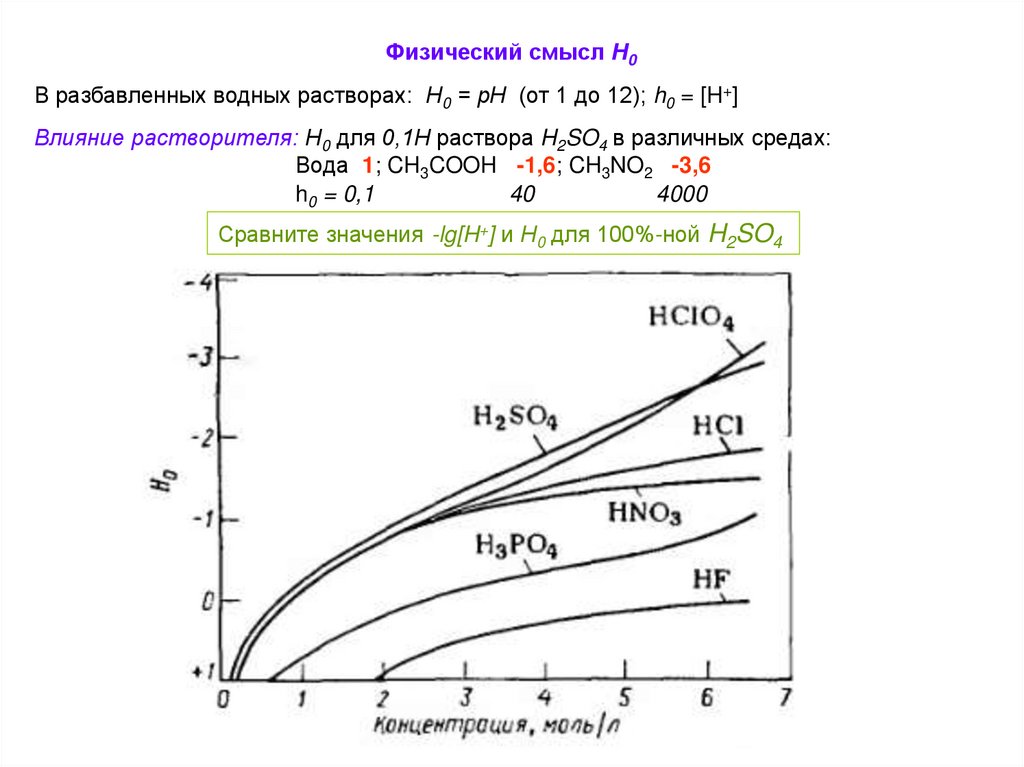
Физический смысл Н0В разбавленных водных растворах: Н0 = рН (от 1 до 12); h0 = [H+]
Влияние растворителя: Н0 для 0,1Н раствора H2SO4 в различных средах:
Вода 1; CH3COOH -1,6; CH3NO2 -3,6
h0 = 0,1
40
4000
Сравните значения -lg[H+] и Н0 для 100%-ной H2SO4
9.
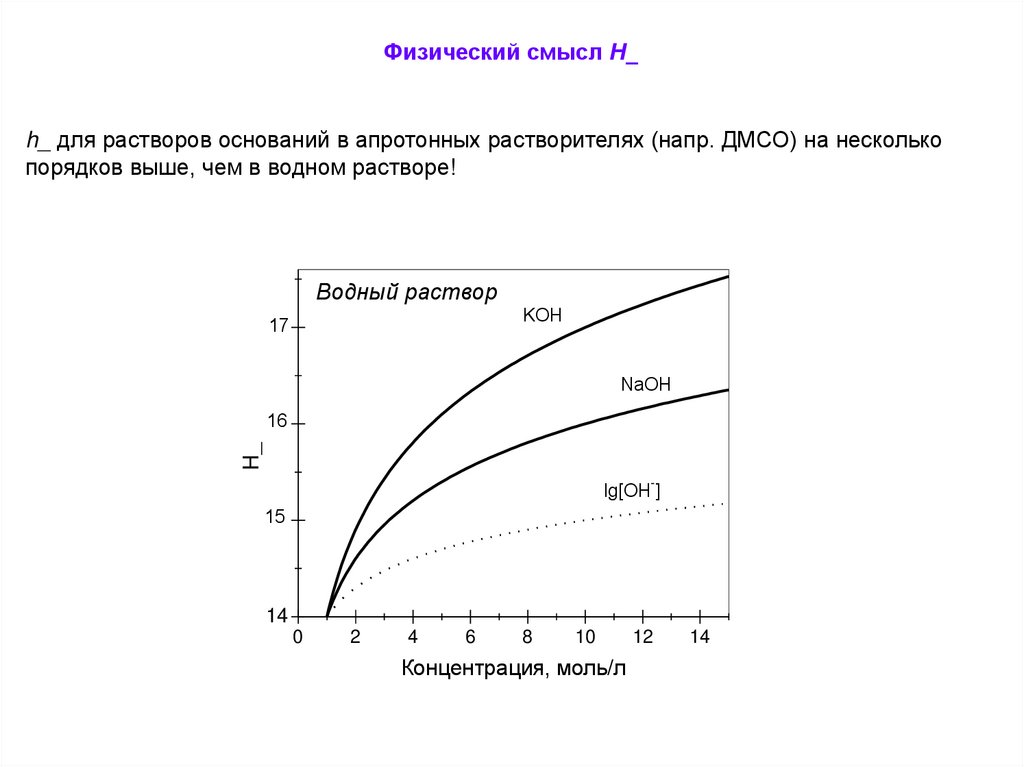
Физический смысл Н_h_ для растворов оснований в апротонных растворителях (напр. ДМСО) на несколько
порядков выше, чем в водном растворе!
Водный раствор
KOH
17
NaOH
H_
16
-
lg[OH ]
15
14
0
2
4
6
8
10
Концентрация, моль/л
12
14
10.
СуперкислотыН0 -12
Простые протонные кислоты:
Кислота
100%-я H2SO4
HClO4
HSO3Cl
CF3SO3H
HSO3F
Н0
-12
-13
-13.8
-14.1
-15
Комплексные кислоты
(протонная + кислота Льюиса):
Кислота
Н0
Олеум
-14,5
HCl-AlCl3
-15…-16
HF-BF3
-15…-16
HSO3F-SbF5 (magic acid)
до -26,5
HF-(SbF5)n
-11…< -30
Причина суперкислотности:
I) Снижение теплоты сольватации протона. Например, в воде 261 ккал/моль, а в
концентрированной H2SO4 239 ккал/моль.
II) Увеличение активности протона в результате: 1) электронного влияния
заместителей; 2) понижения основности сопряженного основания за счет
увеличения объема последнего.
h0
a B
H
BH
Gb(A-) = -RTlnKb(A- )
Уравнение Борна (изменение
энергии сольватации иона):
11.
СупероснованияН_ > (18,5 – 20)
Основания в апротонных средах
Н_ для растворов оснований в апротонных растворителях (напр. ДМСО) на несколько
единиц выше, чем в водном растворе.
Комплексы катионов с макроциклическими соединениями:
Увеличение активности основания в результате понижения электрофильности
(кислотности) комплексного катиона за счет увеличения объема последнего.
Гетерогенные суперосновные катализаторы:
Na/MgO H_ > 35;
Na-NaOH/Al2O3 H_ > 37
12.
НУКЛЕОФИЛЬНЫЙ КАТАЛИЗНуклеофилы – вещества (анионы или молекулы), которые предоставляют свою пару
электронов для образования новой связи.
Галоген-анионы: I-, Br-, Cl-, F-;
Оксианионы: RO-, ArO-, HCO3-, HO-, RCOO-;
Другие анионы: CN-, HOO-;
Нейтральные молекулы: аммиак, амины, пиридин, имидазол, фосфины.
Реакции присоединения:
Общий механизм: HY – реагент-кислота; Y- - катализатор (сопряженное с HY основание)
HY
Y X Z
Y + X=Z
Y X Z H +Y
Примеры:
H3C
C O + CN
H3C
H3C
HCN
O
C
H3C
CN
H3C
OH
+ CN
C
H3C
CN
Активирование за счет водородной связи:
Y
YH
O
YH O
Y
Y
+ OH
Y
13.
Реакции замещения:Общий механизм:
Реакция
RZ + Nu RNu + Z
Пример:
RZ + Y RY + Z
RNu + Y RY + Nu
RCl + I- RI + ClRI + 2H2O ROH + H3O+ + I-
Вопрос: В чем разница между нуклеофилом и
основанием с точки зрения механизма катализа?
Факторы, влияющие на активность нуклеофильных катализаторов
К1
RZ + Nu RNu(+Z)
k2
RNu(+Y) Р + Nu
Лимитирование 1-й стадией: r = k1CNuCRZ – k-1CRNu = k1(CNuCRZ – CRNu/К1)
Лимитирование 2-й стадией: r = k2CRNuCY
при быстром равновесии CRNu = К1CNuCRZ , тогда:
r = k2К1CNuCRZCY
Соизмеримые скорости стадий:
14.
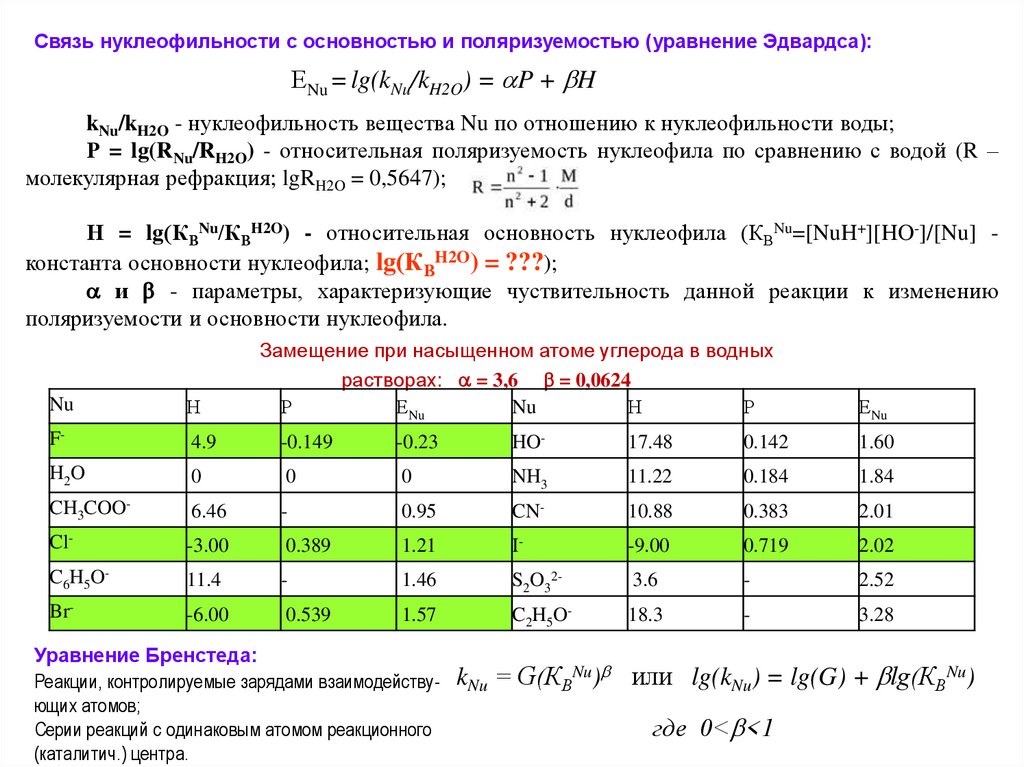
Связь нуклеофильности с основностью и поляризуемостью (уравнение Эдвардса):ЕNu = lg(kNu/kH2O) = P + H
kNu/kH2O - нуклеофильность вещества Nu по отношению к нуклеофильности воды;
Р = lg(RNu/RH2O) - относительная поляризуемость нуклеофила по сравнению с водой (R –
молекулярная рефракция; lgRH2O = 0,5647);
Н = lg(КВNu/КВH2O) - относительная основность нуклеофила (КВNu=[NuH+][HO-]/[Nu] константа основности нуклеофила; lg(КВH2O) = ???);
и - параметры, характеризующие чуствительность данной реакции к изменению
поляризуемости и основности нуклеофила.
Замещение при насыщенном атоме углерода в водных
растворах: = 3,6 = 0,0624
Р
ЕNu
Nu
Н
Р
ЕNu
Nu
Н
F-
4.9
-0.149
-0.23
HO-
17.48
0.142
1.60
H2O
0
0
0
NH3
11.22
0.184
1.84
CH3COO-
6.46
-
0.95
CN-
10.88
0.383
2.01
Cl-
-3.00
0.389
1.21
I-
-9.00
0.719
2.02
C6H5O-
11.4
-
1.46
S2O32-
3.6
-
2.52
Br-
-6.00
0.539
1.57
C2H5O-
18.3
-
3.28
Уравнение Бренстеда:
Реакции, контролируемые зарядами взаимодействующих атомов;
Серии реакций с одинаковым атомом реакционного
(каталитич.) центра.
kNu = G(КВNu) или lg(kNu) = lg(G) + lg(КВNu)
где 0< <1
15.
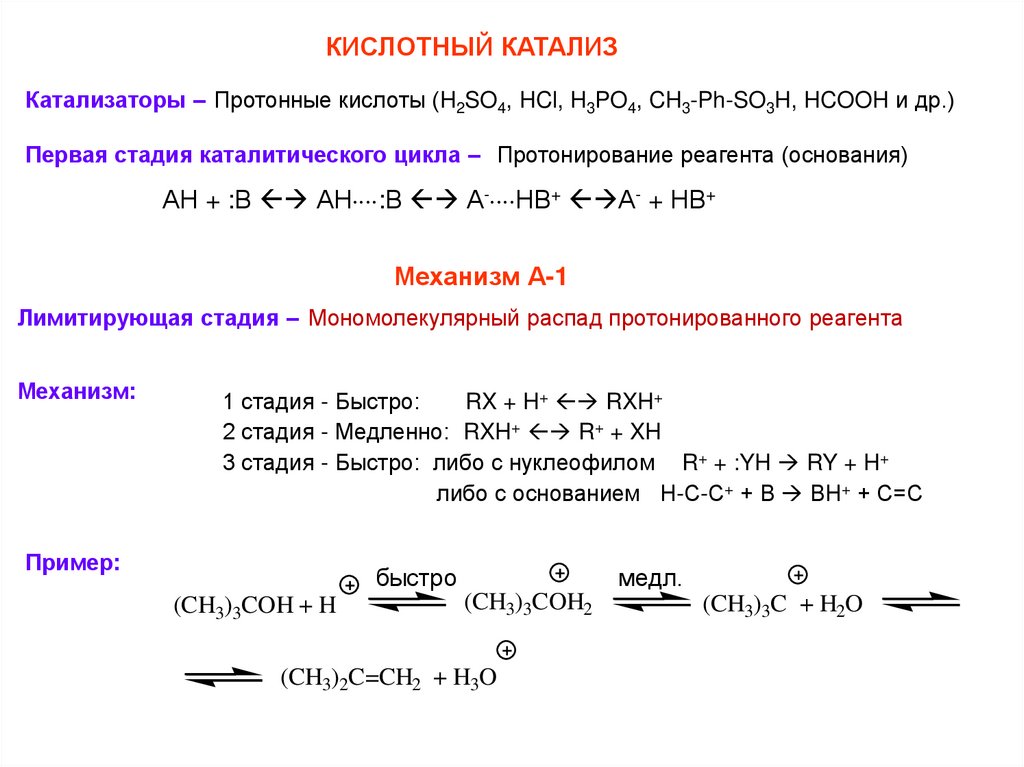
КИСЛОТНЫЙ КАТАЛИЗКатализаторы – Протонные кислоты (H2SO4, HCl, H3PO4, CH3-Ph-SO3H, HCOOH и др.)
Первая стадия каталитического цикла – Протонирование реагента (основания)
АН + :В АН :В А- НВ+ А- + НВ+
Механизм А-1
Лимитирующая стадия – Мономолекулярный распад протонированного реагента
Механизм:
1 стадия - Быстро:
RX + H+ RXH+
2 стадия - Медленно: RXH+ R+ + XH
3 стадия - Быстро: либо с нуклеофилом R+ + :YH RY + H+
либо с основанием Н-С-С+ + В ВН+ + С=С
Пример:
быстро
(CH3)3COH + H
медл.
(CH3)3COH2
(CH3)2C=CH2 + H3O
(CH3)3C + H2O
16.
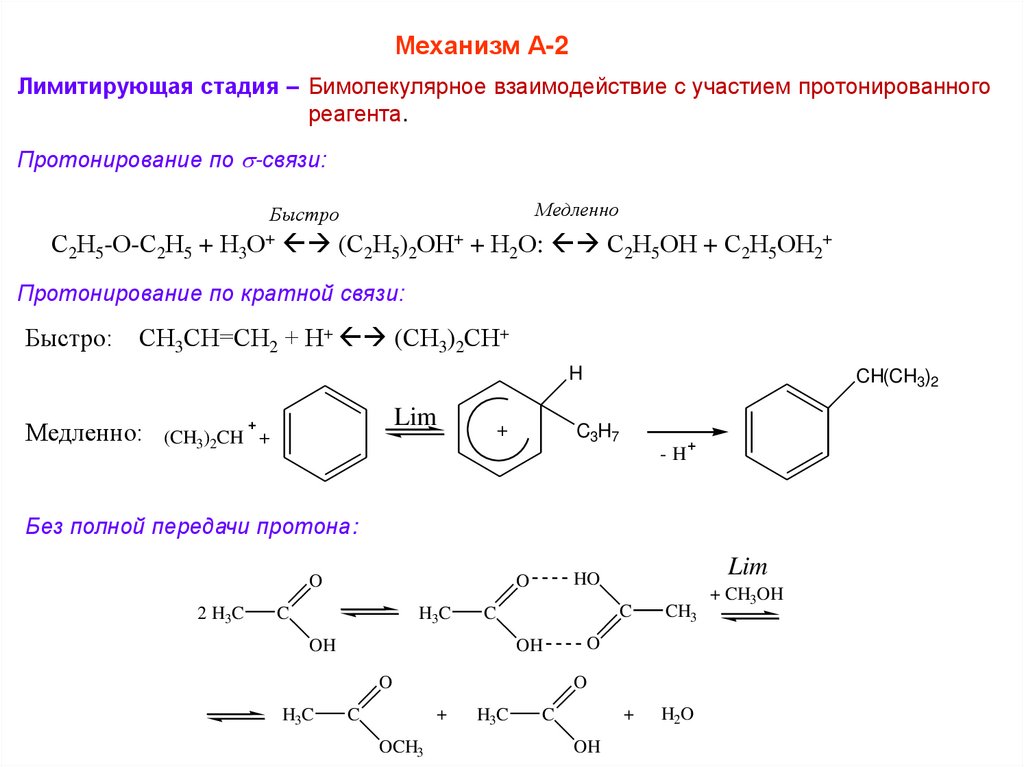
Механизм А-2Лимитирующая стадия – Бимолекулярное взаимодействие с участием протонированного
реагента.
Протонирование по -связи:
Медленно
Быстро
С2Н5-О-С2Н5 + Н3О+ (С2Н5)2ОН+ + Н2О: С2Н5ОН + С2Н5ОН2+
Протонирование по кратной связи:
Быстро:
СН3СН=СН2 + Н+ (СН3)2СН+
H
Медленно:
Lim
+
(CH3)2CH +
CH(CH3)2
C3H7
-H
Без полной передачи протона:
O
2 H3C
C
H3C
C
OH
OH
O
H3C
OCH3
C
CH3
+
H2O
O
O
+
C
Lim
HO
O
H3C
C
OH
+ CH3OH
17.
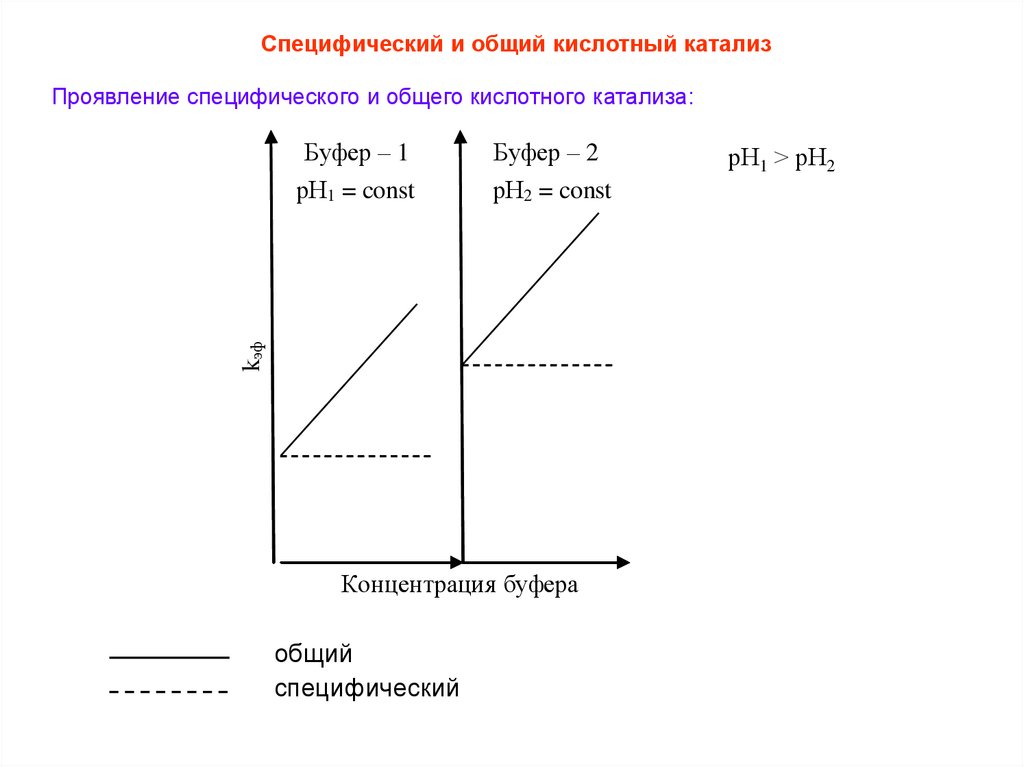
Специфический и общий кислотный катализПроявление специфического и общего кислотного катализа:
Буфер – 2
рН2 = const
kэф
Буфер – 1
рН1 = const
Концентрация буфера
общий
специфический
рН1 > рН2
18.
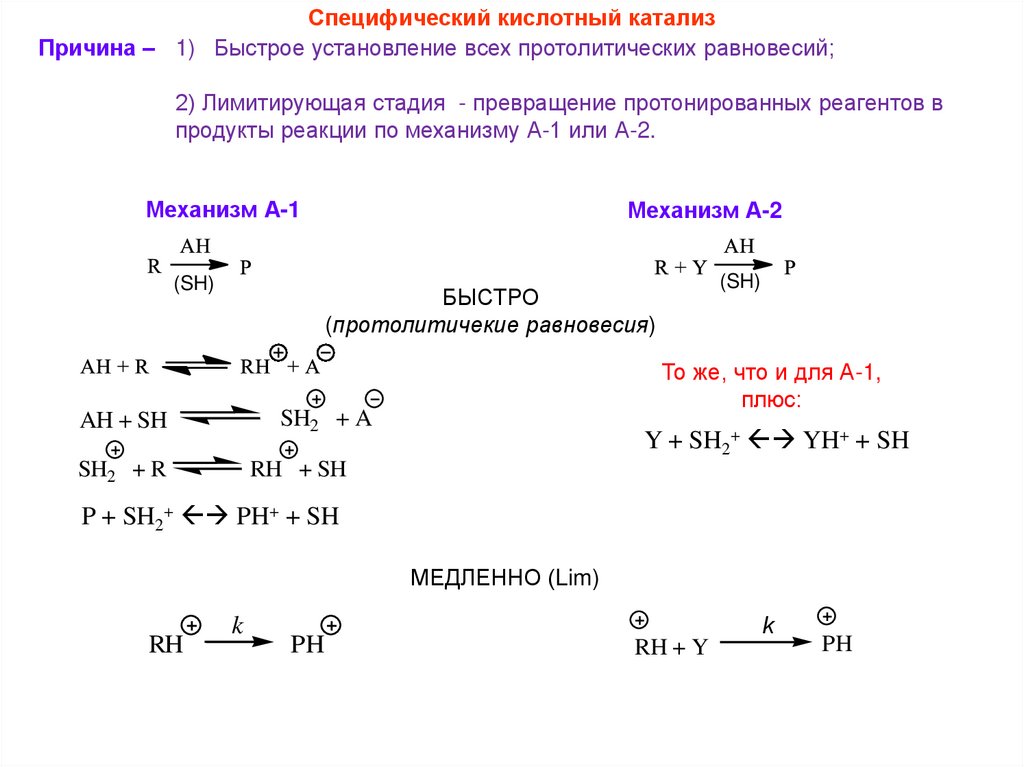
Специфический кислотный катализПричина – 1) Быстрое установление всех протолитических равновесий;
2) Лимитирующая стадия - превращение протонированных реагентов в
продукты реакции по механизму А-1 или А-2.
Механизм А-1
(SH)
Механизм А-2
(SH)
БЫСТРО
(протолитичекие равновесия)
То же, что и для А-1,
плюс:
SH2 + A
AH + SH
SH2 + R
Y + SH2+ YH+ + SH
RH + SH
P + SH2+ PH+ + SH
МЕДЛЕННО (Lim)
RH
k
PH
k
RH + Y
PH
19.
Механизм А-1Скорость реакции:
r = k[RH+]
(2.41)
Баланс по реагенту R:
CR = [R] + [RH+]
(2.42)
Из уравнения кислотности:
[RH ]
h
[R ]
K RH
(2.38)
Lim
k
RH
PH
A
Из уравнений (2.38) и (2.42):
[RH ]
Скорость реакции: r k[ RH ]
k 'эф
Зависимость kЭФ от h:
RH
KA h
или
RH
KA h
при
(2.43)
K ARH h
kh
kh
при K RH
A
CR h
h
RH
K A h
CR kЭФCR
1
k ЭФ
1
k
(2.44)
RH
KA
k
1
h
kЭФ = k = const
lg k ЭФ lg
k
RH
KA
(2.47)
H
(2.48)
20.
Зависимость kЭФ от h:при K RH
A
при
h
RH
K A h
- pH, - H0, - H-
kЭФ = k = const
lg k ЭФ lg
k
K ARH
(2.47)
H
(2.48)
21.
Механизм А-2Скорость реакции (lim):
r k[ RH ][Y ]
(2.51)
Баланс по реагентам:
CR = [R] + [RH+]
CY = [Y] + [YH+]
Из уравнения кислотности и балансов (2.52):
YH
C
K
CR h
[RH ]
[Y] Y A
K ARH h
K YH
h
A
Зависимость kЭФ от h:
kЭФ = max при:
(2.50)
YH
KA
kh
r
C R CY k ЭФ C R CY
RH
YH
( K A h ) ( K A h)
Скорость реакции:
(2.52)
(2.52)
k
при
h K Ai
lg k ЭФ lg
H
(2. 54)
при
h K Ai
lg kЭФ lg( kK AYH ) H
(2.55)
hmax
YH
RH
KA KA
RH
KA
22.
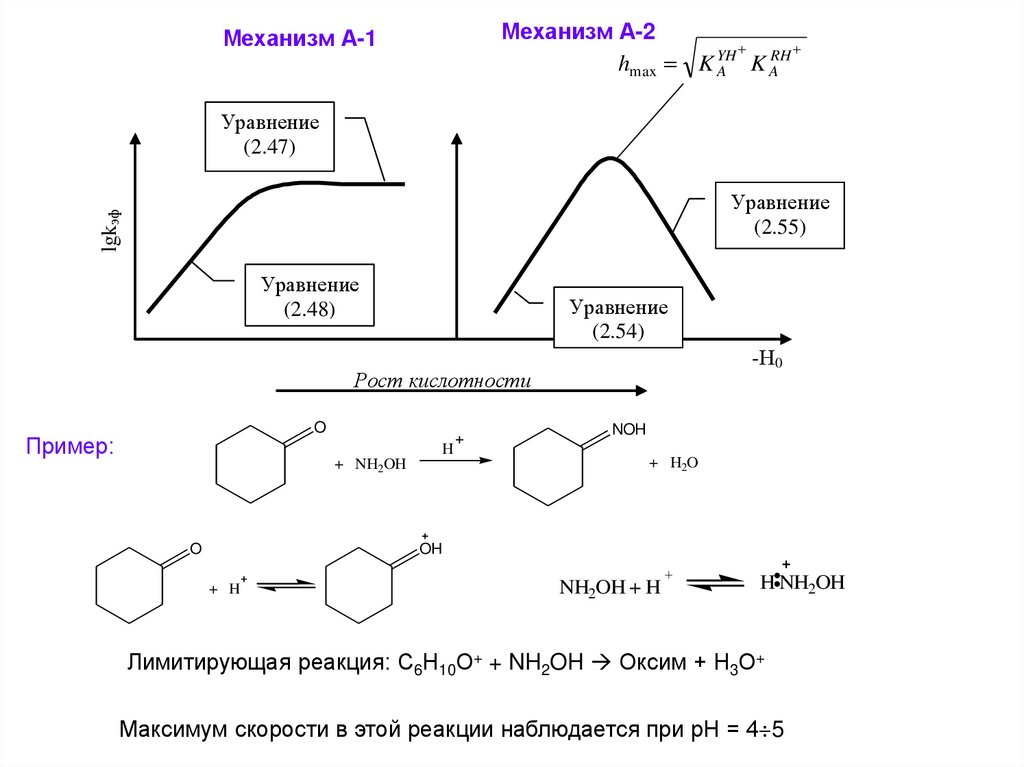
Механизм А-2RH
hmax K YH
K
A
A
Механизм А-1
Уравнение
(2.47)
lgkэф
Уравнение
(2.55)
Уравнение
(2.48)
Уравнение
(2.54)
-Н0
Рост кислотности
O
Пример:
NOH
H
+ NH2OH
O
+ H2O
OH
+ H
NH2OH + H
H NH2OH
Лимитирующая реакция: С6Н10О+ + NH2OH Оксим + Н3О+
Максимум скорости в этой реакции наблюдается при рН = 4 5
23.
(2.51) с подстановкой (2.50) для [RH+]Т.е. kЭФ =
24.
Полученное уравнение использовали для обработки найденной зависимостиkЭФ от h.
Минимизацией нелинейным МНК функции:
определены константы:
Сравнение расчетных и экспериментальных kЭФ приведено на графике на
следующем слайде:
25.
26.
Общий кислотный катализПричина – 1) Лимитирующая стадия - протонирование реагента;
2) Далее – быстрое превращение протонированных реагентов в продукты
реакции.
Суммарная реакция:
Медленно:
k1
R + AH
RH + A
k -1
Быстро:
RH
(+Y)
k2
PH
+A
P + AH
Далее – вывод кинетического уравнения аналогичный нуклеофильному
катализу (схема 2) (см. «ТХП 3_2023» слайд 5 и далее):
Принцип стационарности
Баланс по катализатору
Общее кинетическое уравнение:
27.
При условии:Кинетическое уравнение:
r = k1CRCAH
- для каждой из форм катализатора в
реакционной среде
В общем виде:
Пример:
быстрые превращения
28.
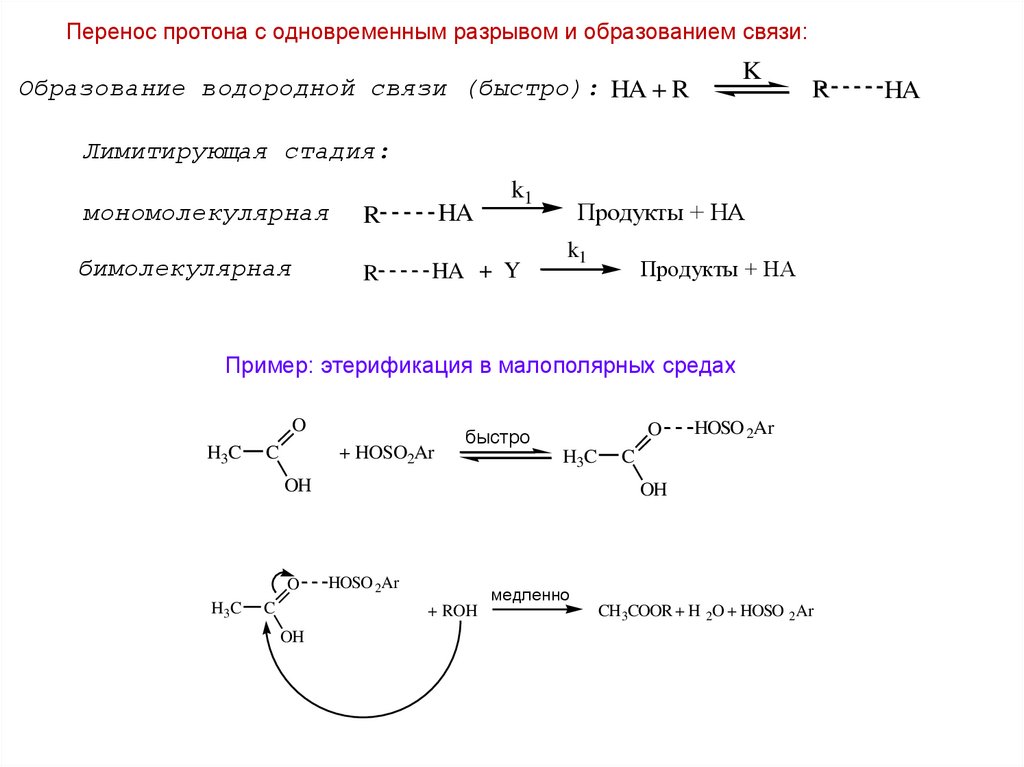
Перенос протона с одновременным разрывом и образованием связи:K
Образование водородной связи (быстро): HA + R
R
Лимитирующая стадия:
мономолекулярная
бимолекулярная
HA
R
R
k1
HA + Y
Продукты + НА
k1
Продукты + НА
Пример: этерификация в малополярных средах
O
H3C
C
+ HOSO2Ar
O
быстро
H3C
OH
O
H3C
C
C
OH
HOSO 2Ar
медленно
+ ROH
OH
HOSO 2Ar
CH 3COOR + H 2O + HOSO 2Ar
HA
29.
OH3C
C
HOSO 2Ar
медленно
+ ROH
CH 3COOR + H 2O + HOSO 2Ar
OH
Для бимолекулярной лимитирующей стадии:
С учетом материального баланса по формам реагента и
катализатора:
СR ≈ [R]
СK = [АН]+[R…HA]
K = [R…HA]/([АН]СR)
получаем:
(Дробно-линейный порядок по R)
При KCR>>1:
(0-й порядок по R)
30.
Проявление общего катализа:Скорость реакции зависит от концентрации катализатора (даже при постоянной
кислотности среды (h0)), а константа скорости от природы (кислотности) кислотыкатализатора.
ki = GA(KiA)
(GA ; ) = const - эмпирические коэффициенты уравнения Бренстеда
0< <1
31.
Например, в реакции этерификацииКатализ ArO2SOH:
O
H3C
C
+ HOSO2Ar
O
быстро
H3C
OH
HOSO 2Ar
C
OH
r1
Катализ уксусной кислотой:
r2
Катализ спиртом:
r3
Суммарная скорость реакции:
r = r1 + r2 + r3 = (k1 СArO2SOH + k2 СCH3COOH + k3 СROH ) СROH
ki = GA(KiA)
32.
ЭЛЕКТРОФИЛЬНЫЙ КАТАЛИЗЭлектрофилы – вещества (катионы или молекулы), которые предоставляют свою
вакантную орбиталь для образования новой связи.
Галогениды металлов: ZnCl2, AlCl3, FeCl3, TiCl4, SnCl4, BF3;
Ионы металлов: Li+, Ag+, Hg+;
Молекулы и ионы: SO3, P2O5, R+, NO2+
Механизм активации реагента:
Полный разрыв
связи:
C
Сильная поляризация
связи:
Примеры:
Cl2 + FeCl3
Cl
Cl FeCl3
X
X
X
C
+E
RCl + AlCl3
C
X
X E
+ E
+X E
X XE
C
Cl
H
R Cl AlCl3
X E
C
C
+ FeCl4
Cl
C
C
Cl + FeCl3
R
R
+
C
+ AlCl4
+ AlCl3 + HCl
Вывод кинетического уравнения аналогичен нуклеофильному катализу – с учетом
стационарности по концентрации промежуточного комплекса и баланса по формам
катализатора.
Количественная интерпретация каталитической активности – по теории ЖМКО
33.
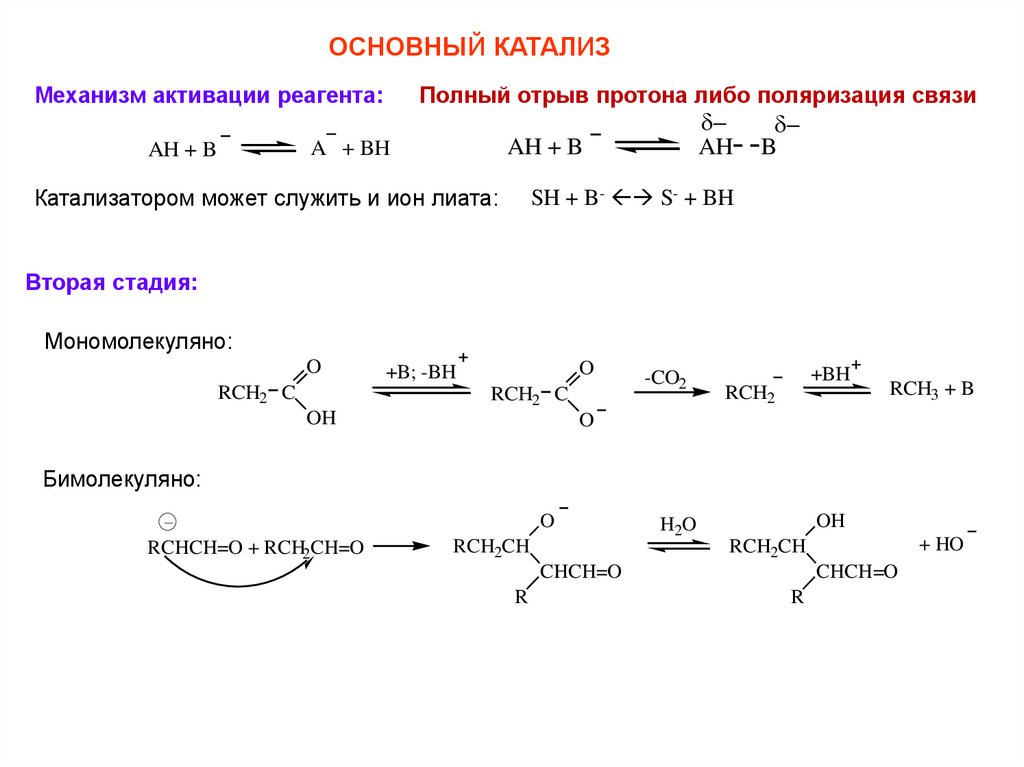
ОСНОВНЫЙ КАТАЛИЗМеханизм активации реагента:
A + BH
AH + B
Полный отрыв протона либо поляризация связи
AH + B
AH B
Катализатором может служить и ион лиата:
SH + B- S- + BH
Вторая стадия:
Мономолекуляно:
O
RCH2 C
O
+B; -BH
RCH2 C
OH
-CO2
+BH
RCH2
RCH3 + B
O
Бимолекуляно:
O
RCHCH=O + RCH2CH=O
RCH2CH
H2O
OH
CHCH=O
R
+ HO
RCH2CH
CHCH=O
R
34.
Специфический основный катализПричина – 1) Быстрый отрыв протона;
2) Лимитирующая стадия - превращение депротонированных реагентов в
продукты реакции по моно- или би-молекулярному механизму.
Мономолекулярный
r
kK ARH
K ARH
Бимолекулярный
h
C RH
kK ARH
h_
r
C RH CYH
RH
YH
( K A h _) ( K A h _)
Для каких реагентов характерен? Примеры?
35.
Общий основный катализПричина – 1) Лимитирующая стадия - отрыв протона;
2) Далее быстрая стадия стадия превращения депротонированных
реагентов в продукты реакции.
r k i [ Bi ] [ RH ]
i
ki = GB(KiB)
Пример: енолизация кетона в водном растворе при катализе НОr = (k1 [OH-]+ k2 [H2O]+ Σki [Bi] ) Скетон
где Bi – енол; енолят-анион; прочие возможные основания
ki = GB(KiB)
KОН-B = 101,7
KН2ОB = …

























 chemistry
chemistry








