Similar presentations:
Катализ кислотами и основаниями. Лекция 3
1.
ЛЕКЦИЯ 3. Катализ кислотами и основаниямиКатализ кислотами имеет самые глубокие
исторические корни.
Впервые на примере реакции Кирхгофа
дано объяснение ускорения реакции
кислотой исходя из химических
принципов (1812 г.).
H 2 SO4
Крахмал
Сахар
Катализ в нефтепереработке
1
2.
ЛЕКЦИЯ 3. КлассификацияГомогенные
минеральные
кислоты, щелочи,
органические
кислоты и основания,
галогениды металлов
и неметаллов,
гетерополикислоты и
суперкислоты в
растворах
Гетерогенные
алюмосиликаты,
цеолиты, минеральные
кислоты и основания
на носителях, оксиды
металлов,
ионообменные смолы,
твердые
гетерополикислоты и
суперкислоты
Катализ в нефтепереработке
2
3.
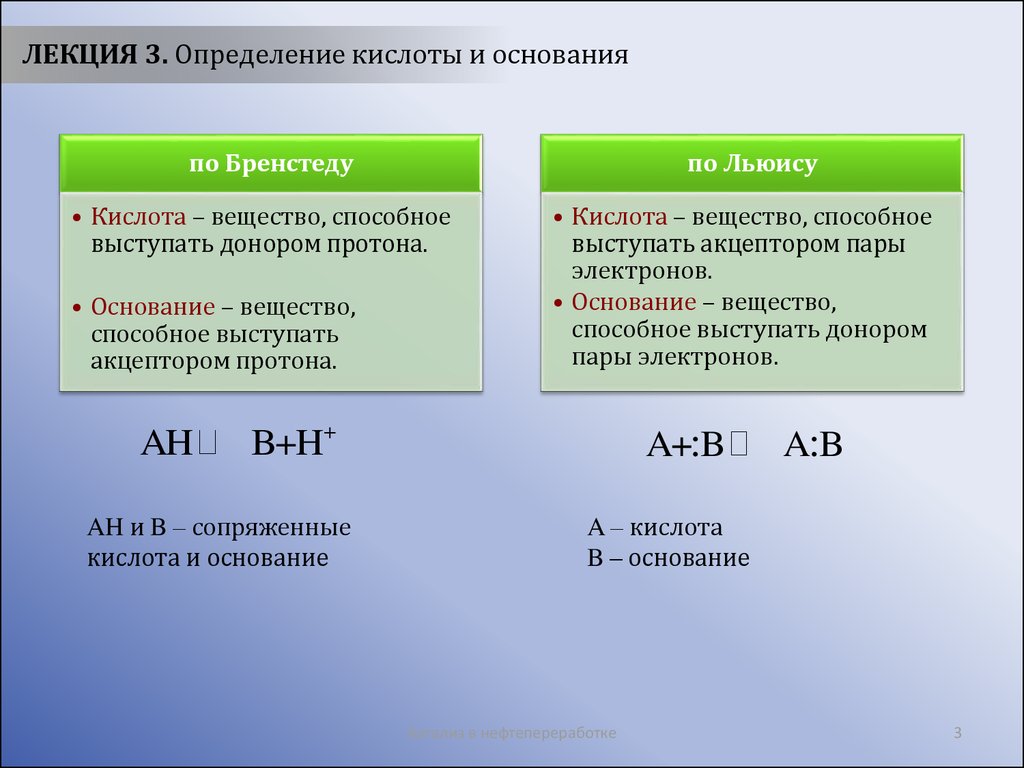
ЛЕКЦИЯ 3. Определение кислоты и основанияпо Бренстеду
по Льюису
• Кислота – вещество, способное
выступать донором протона.
• Основание – вещество,
способное выступать
акцептором протона.
AH
• Кислота – вещество, способное
выступать акцептором пары
электронов.
• Основание – вещество,
способное выступать донором
пары электронов.
B+H+
AH и B – сопряженные
кислота и основание
A+:B
A:B
A – кислота
B – основание
Катализ в нефтепереработке
3
4.
ЛЕКЦИЯ 3. Определение кислотностиа) Сила протонной кислоты:
H A-
Ka
AH
б) Кислотность разбавленных протонных кислот:
pH lg a
lg H
H
в) Кислотность концентрированных растворов кислот:
f
H 0 lg aH+ B
f BH+
pK BH lg BH B
Шкала кислотности
Кислоты
Основания
Суперкислоты
-12
Обычные кислоты
Обычные основания
7
Супероснования
26
NB: При гомогенном катализе активным центром в большинстве
случаев является протон.
Катализ в нефтепереработке
4
5.
ЛЕКЦИЯ 3. Свойства протонаСверхмалый размер и масса;
Способность образовывать водородные связи.
Следствия:
1. Возможен перенос по туннельному механизму;
2. Аномально высокая подвижность (до 10-4 см2/с),
обеспечивающая скорость присоединения до 1011
л/моль·сек);
3. Отсутствие стерических затруднений для переноса.
Катализ в нефтепереработке
5
6.
ЛЕКЦИЯ 3. Принципы действиияУравнение Бренстеда (эмпирическое правило):
– для общего кислотного катализа
k a a K a
0 1
– для общего основного катализа
k b b K b
0 1
Реальная зависимость:
α=0
лимитирующий фактор – диффузия
lg ka
|AH·····S|
α =0,5
Общий катализ
|A···H···S|
k k0 kai Ai H kb j B j H
i
α =0,9
α =1
j
|A·····HS|
Специфический
k
k
k
H
O
k
OH
0
H
3
OH
катализ
AH + H2O → A – + H3O+
H3O+ + S → P (медл.)
lg Ka
NB: есть случаи, когда α < 0 и α > 1.
Катализ в нефтепереработке
6
7.
ЛЕКЦИЯ 3. Механизм катализаротонирование реагента приводит к появлению
П
положительного заряда и сильной поляризации соседних
связей, что делает возможным или облегчает последующее
превращение.
Механизм А1: непосредственный распад протонированной
молекулы (α > 0,8 ).
CH 3 C O C CH 3 H
O
H
CH 3 C O C CH 3
O
O
CH 3 C O CH 3COOH
O
Механизм А2: последующее взаимодействие пртонированной
молекулы (α < 0,8 )..
C2 H 5OC2 H 5 H 3O
H
H O CH 2CH 3 H 2O
H
C2 H 5 O C H 2 CH 3 H 2O
H
C2 H 5OH H O CH 2CH 3 ,
H 3O C2 H 5OH .
Катализ в нефтепереработке
7
8.
ЛЕКЦИЯ 3. Механизм катализаСогласованный механизм
B HX Y Z HA
W
BH X ZH A
k HA B
Туннельный механизм
KH
KD
8
Сильная температурная зависимость K H
Катализ в нефтепереработке
KD
8
9.
ЛЕКЦИЯ 3. Ключевые стадииπ - комплекс
H
+H
карбениевый ион
+
H
+H
Реакции карбениевого иона:
-
C
+X
C
+
C C C
C
+ H–R
C H + R
C
C X
C
+
C
3.
+ O
R
H
C O
C
+
C
2.
Катализ в нефтепереработке
C
1.
C
3.
R
H
+
C
C
1.
2.
9
10.
ЛЕКЦИЯ 3. Катализ кислотами и основаниями ЛьюисаКислоты: Al(III); AlCl3; AlBr3; AlF3; ZnCl2; BF3 и т.п.
Основания: F–; J–; R2O; R2S; R3N и т.п.
Шкалы силы кислот и оснований Льюиса
Качественная — Концепция жестких и мягких кислот и оснований
(КЖМКО).
Количественная — не существует единой шкалы силы апротонных
кислот и оснований, аналогичной рКа, что ограничивает возможность
предвидения
каталитического
действия.
Существует
метод
количественной оценки по величине Кравн процесса:
RMe X
RMe+ + X .
Катализ в нефтепереработке
10
11.
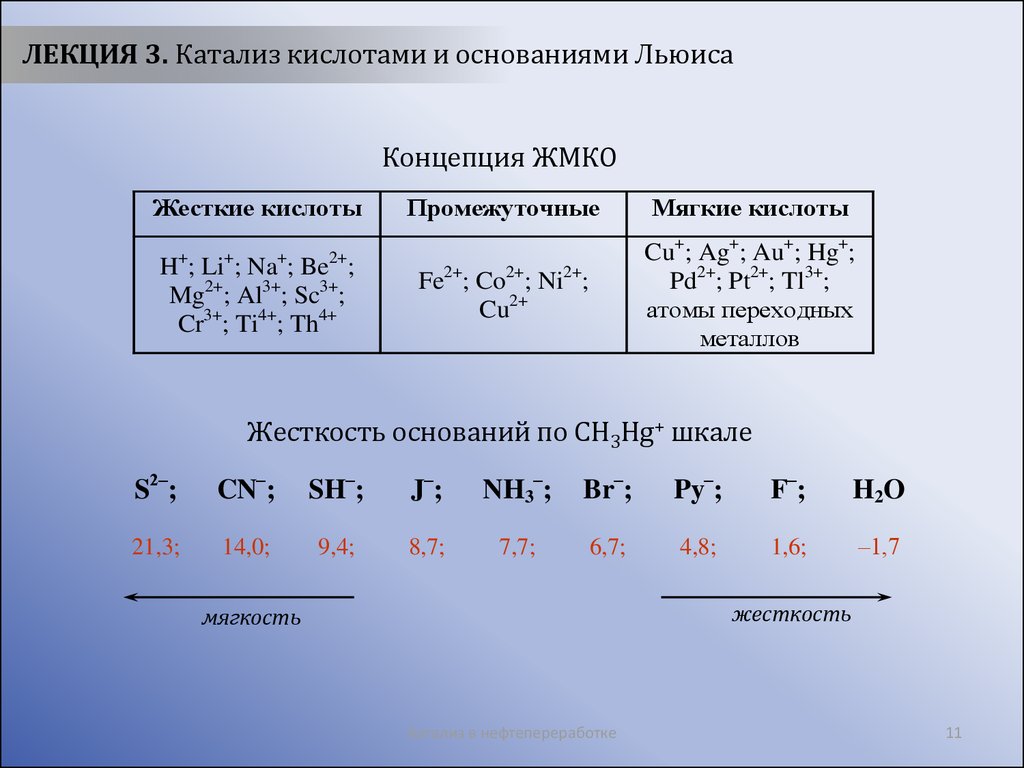
ЛЕКЦИЯ 3. Катализ кислотами и основаниями ЛьюисаКонцепция ЖМКО
Жесткие кислоты
+
+
+
2+
H ; Li ; Na ; Be ;
Mg2+; Al3+; Sc3+;
Cr3+; Ti4+; Th4+
Промежуточные
Мягкие кислоты
Fe2+; Co2+; Ni2+;
Cu2+
Cu+; Ag+; Au+; Hg+;
Pd2+; Pt2+; Tl3+;
атомы переходных
металлов
Жесткость оснований по CH3Hg+ шкале
S2–;
CN–;
SH–;
J–;
NH3–;
Br–;
Py–;
F–;
H2O
21,3;
14,0;
9,4;
8,7;
7,7;
6,7;
4,8;
1,6;
–1,7
жесткость
мягкость
Катализ в нефтепереработке
11
12.
ЛЕКЦИЯ 3. Катализ кислотами и основаниями ЛьюисаСвязь между активностью и силой льюисовских кислот и
оснований.
Имеются примеры соотношений типа Бренстеда между каталитической
активностью и силой кислоты или основания, но они имеют менее общий
характер, т.к. нет единой шкалы апротонных кислот и оснований;
Для узких групп реакций найдены корреляции:
Me
(CH 3 )3 CX H 2O
(CH 3 )3 COH HX ;
lg k A lg kM X , 0,8.
n
Полное соответствие с концепцией ЖМКО
для R–F
Zr4+; Sc3+
для R–Cl
Tl3+; Pd2+
для R–Br
Ag+
|(CH3)3Cd+····Xd–····M+|
Катализ в нефтепереработке
12
13.
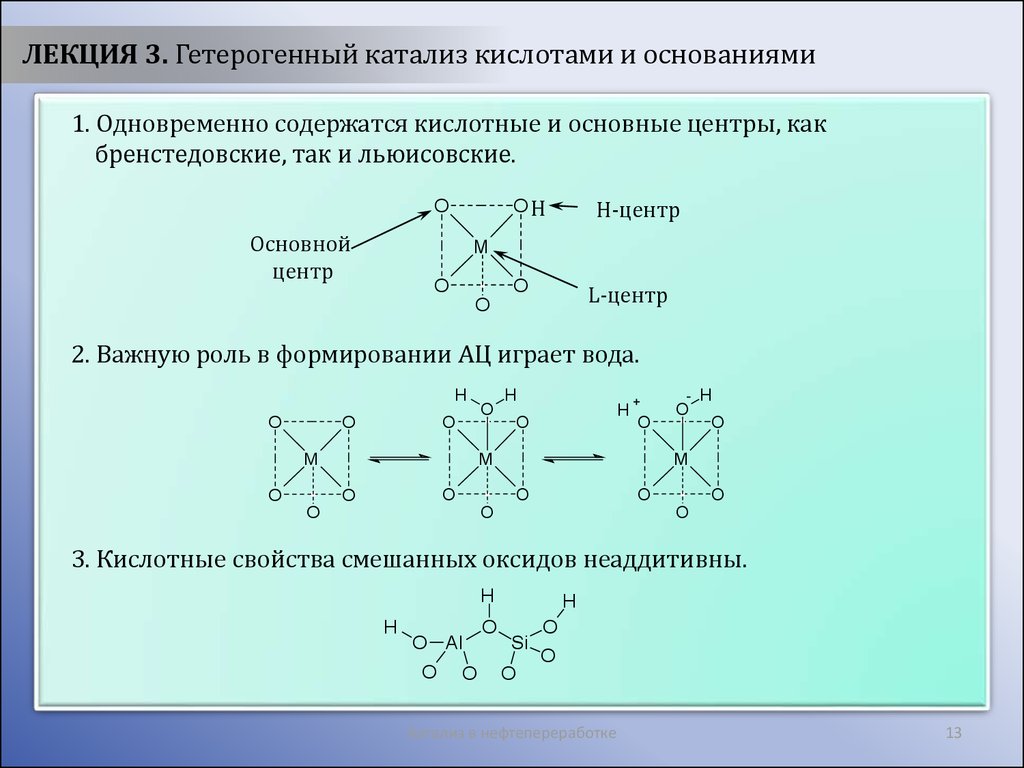
ЛЕКЦИЯ 3. Гетерогенный катализ кислотами и основаниями1. Одновременно содержатся кислотные и основные центры, как
бренстедовские, так и льюисовские.
OH
O
Основной
центр
H-центр
M
O
O
L-центр
O
2. Важную роль в формировании АЦ играет вода.
H
O
O
O
H
H
O
+
O
M
M
O
O
O
O
O
O
H
O
M
O
O
-
O
O
O
3. Кислотные свойства смешанных оксидов неаддитивны.
H
H
O Al
O
O
O
H
Si
O
O
O
Катализ в нефтепереработке
13
14.
ЛЕКЦИЯ 3. Гетерогенный катализ кислотами и основаниями4. Большие возможности изменения кислотно-основных свойств путем
модифицирования.
пример:
Al – Si – O
введение Cl – или F – в координационную сферу Al;
деалюминирование — увеличивают силу кислотных центров;
обработка раствором NH4Cl с последующим прокаливанием —
увеличивают число Н-центров;
повышением температуры термообработки увеличивают
соотношение количеств L-/H-центров;
специальное “отравление” центров для регулирования их силы
(катионный обмен, адсорбция пиридина и т.п.).
Катализ в нефтепереработке
14
15.
ЛЕКЦИЯ 3. Гетерогенный катализ кислотами и основаниями5. При определении количества и силы центров индикаторным методом
надо учитывать возможность существенного влияния стерического
эффекта
6. При катализе гораздо чаще встречается согласованный механизм,
поэтому говорят о бифункциональном катализе (например, “H–/–O”
катализ; “H–/–L” катализ и т.п.)
7. Зависимость скорости реакции от силы центров выражена менее
четко, чем в случае гомогенного катализа:
набор центров
в жестких условиях сильные центры быстро отравляются
большой вклад бифункционального катализа
Катализ в нефтепереработке
15
16.
ЛЕКЦИЯ 3. Закономерности гетерогенного КО катализаМинимальная сила протонных центров, необходимая для
некоторых реакций
Катализ в нефтепереработке
16
17.
к реагентамЛЕКЦИЯ 3. Молекулярно ситовой эффект
к переходному
состоянию
по продуктам
+
Катализ в нефтепереработке
17














 chemistry
chemistry








