Similar presentations:
Оксидтер
1.
Еуразия технологиялық университетҚабылдаған: Амирханова А
Орындаған: Өтеш А.
Мыңтұрғанова Ұ.
2016 жыл
2.
Жоспар:1. Оксидтер
2. Оксидтердің жіктелуі
3. Оксидтердің қолданылуы
4. Оксидтердің алынуы
5. Оттектің физикалық қасиеті
6. Оксидтің түстері
7. Оттегінің маңызы
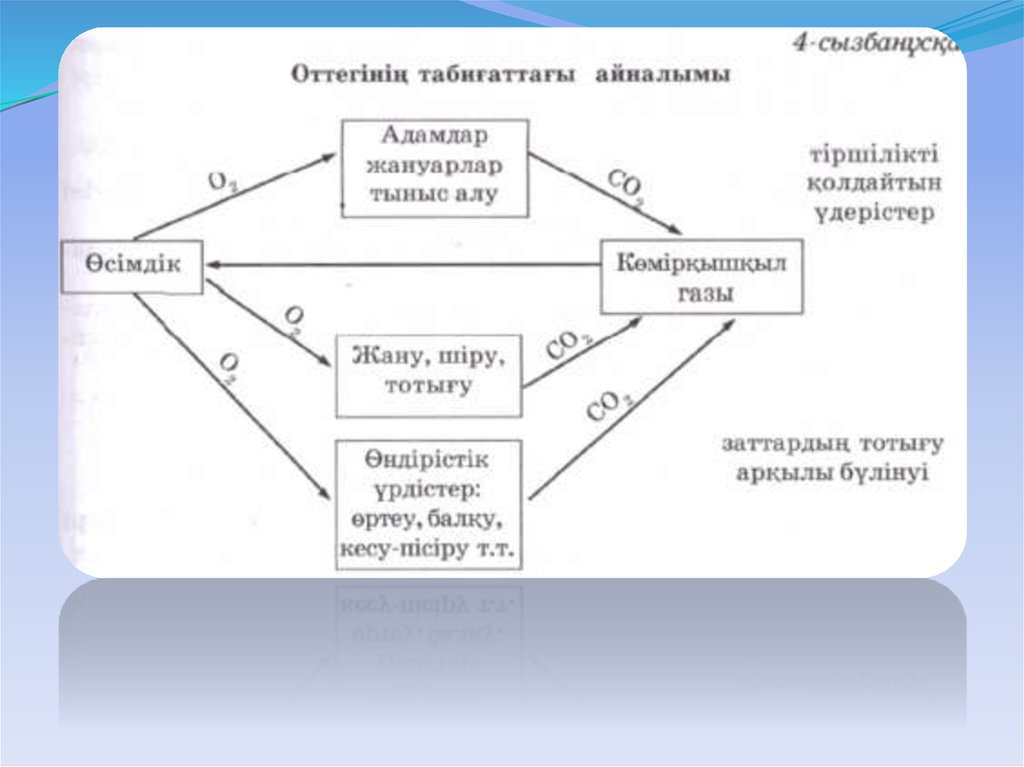
8. Оттегінің табиғаттағы айналымы
3.
Күрделі қосылыстардың үлкен бір тобы (класы) - оксидтер.Оксидтер үшке бөлінеді: қышқылдық, негіздік, екідайлы
(амфотерлі).
Қышқылдық оксидтерге - қышқылдар, негіздік оксидтерге - негіздер
сәйкес
келеді.
Р2О5→Н3РО4;
SО3→H2SО4;
Na2О→NaОH;
СаО→Са(ОН)2. Ал екідайлы оксидтерге кышқылдар да, негіздер де
сәйкес келеді, мысалы, H2ZnО2← ZnO→Zn(OH)2
4.
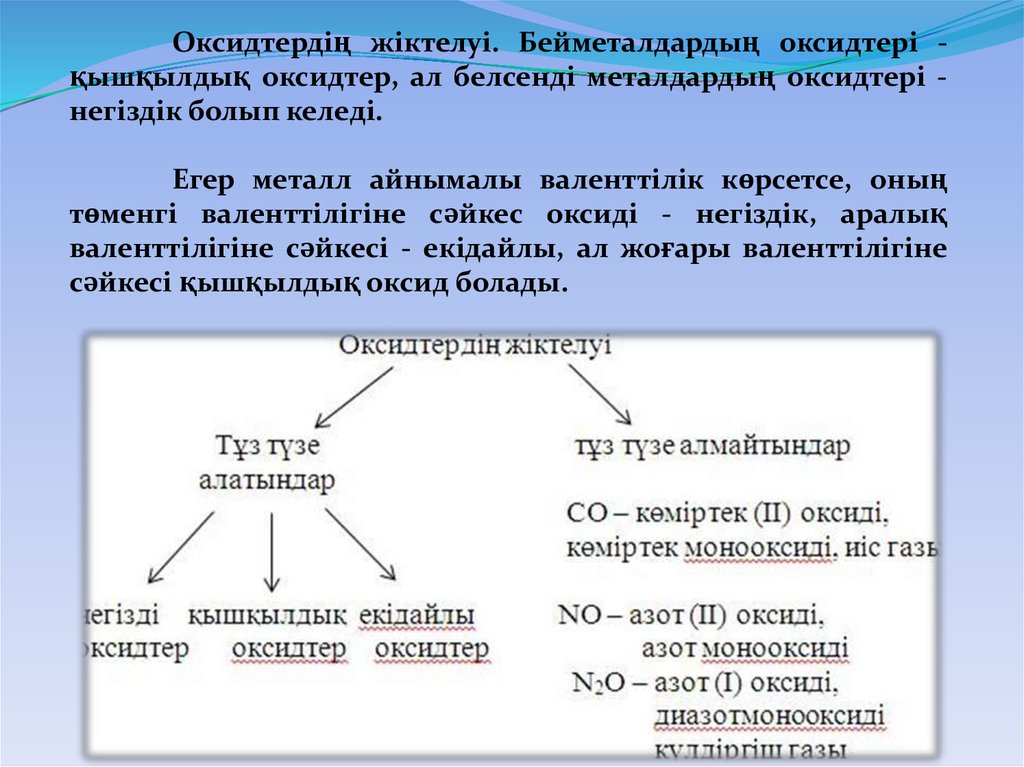
Оксидтердің жіктелуі. Бейметалдардың оксидтері қышқылдық оксидтер, ал белсенді металдардың оксидтері негіздік болып келеді.Егер металл айнымалы валенттілік көрсетсе, оның
төменгі валенттілігіне сәйкес оксиді - негіздік, аралық
валенттілігіне сәйкесі - екідайлы, ал жоғары валенттілігіне
сәйкесі қышқылдық оксид болады.
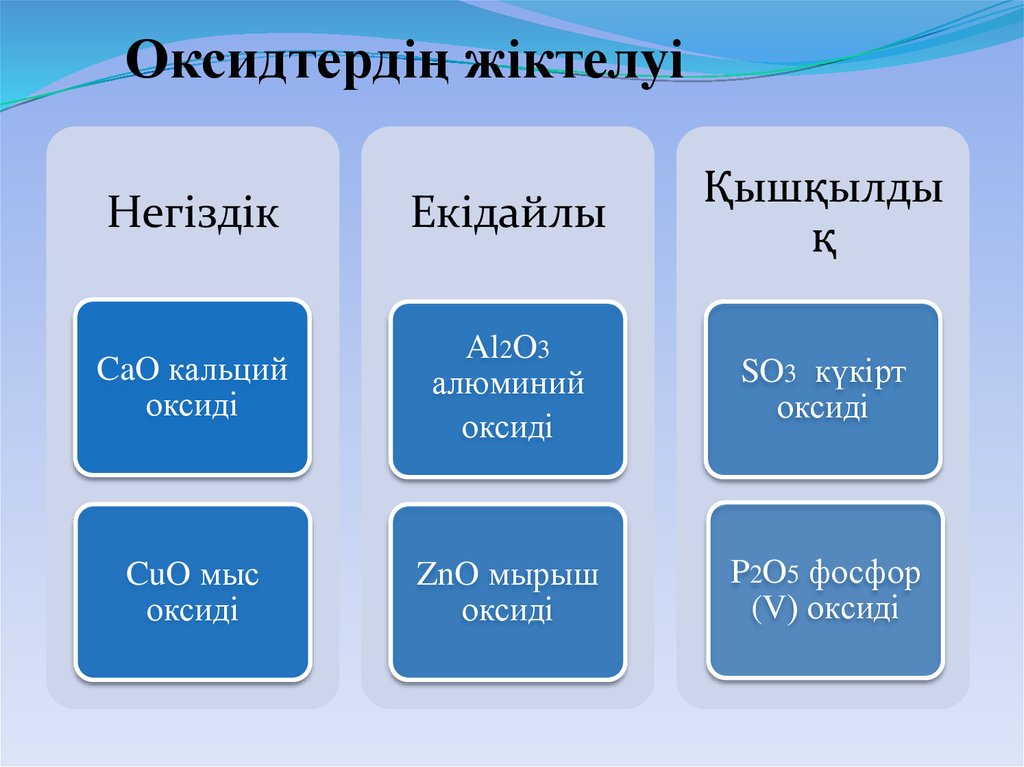
5. Оксидтердің жіктелуі
НегіздікЕкідайлы
Қышқылды
қ
CaO кальций
оксиді
Al2O3
алюминий
оксиді
SO3 күкірт
оксиді
CuO мыс
оксиді
ZnO мырыш
оксиді
P2O5 фосфор
(V) оксиді
6.
Оксидтердің қолданылуыН2O
7.
Fe2O3Гематит
8.
SiO2хрусталь,
кварц
9.
СаOСөндірілмеген әк
10.
Оксидтердің алынуы1.Жай заттардың оттекпен тікелей әрекеттесуі арқылы:
C + O2 = CO2
2Cu + O2 = 2CuO
2Ca + O2 = 2CaO
2.Оксидтерді әрі қарай тотықтыру арқылы:
4FeO + O2 = 2Fe2O3
2CO + O2 = 2CO2
3.Суда ерімейтін негіздерді қыздыру арқылы:
Cu(OH)2 = CuO + H2O
2Fe(OH)3= Fe2O3 + 3H2O
4.Тұздарды қыздырып айыру арқылы:
CaCO3 = CaO + CO2
CaSO4 = CaO + SO3
11.
мысалы,CuO, CaO, Fe2O3, P2O5 - қатты заттар;
CO2, SO2, NO2 - газдар;
H2O, N2O3(t<0) - сұйық.
12.
Оксидтердің түстері де әртүрлі: Ғе2О3 - қызыл-қоңыр, CuO кара, Сr2O3 - жасыл, ZnO, MgO - ақ,
МnO2 - кою қоңыр, SnO - кою көк
түсті, т.б.
Иістері де әр алуан түрлі
болып келеді. SО2, SО3, NО2, Р2О5 тұншықтырғыш иісті. CO, NO, СО2 иіссіз.












 chemistry
chemistry








