Similar presentations:
Лекция № 7. Конкурентные реакции у насыщенного атома
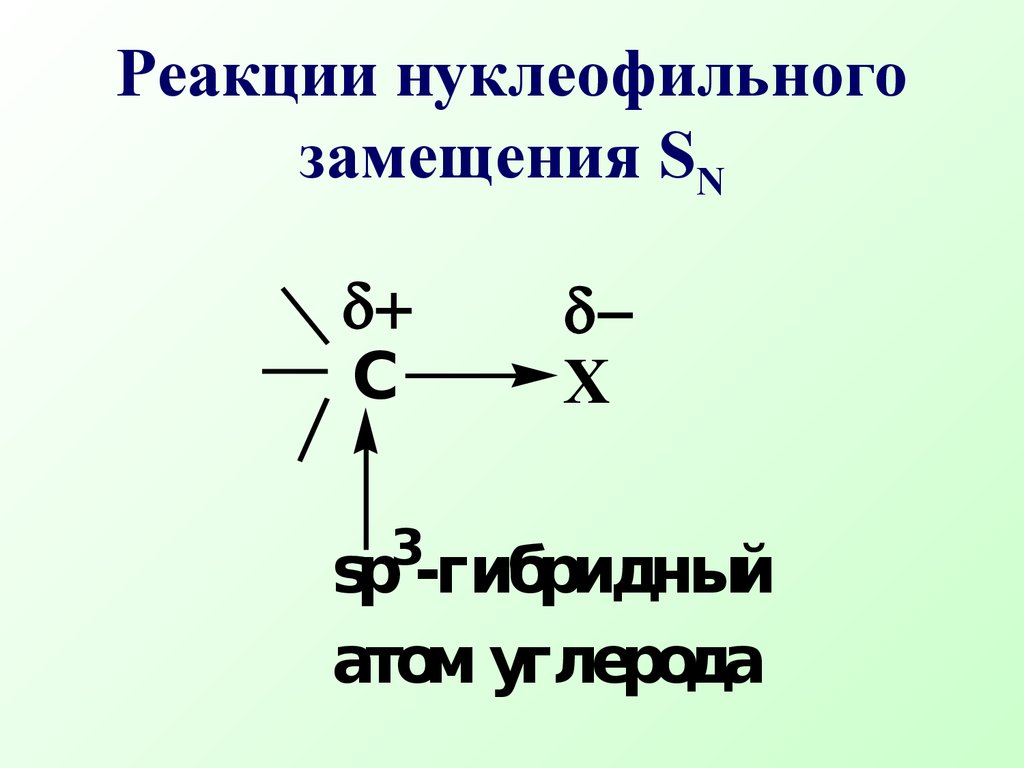
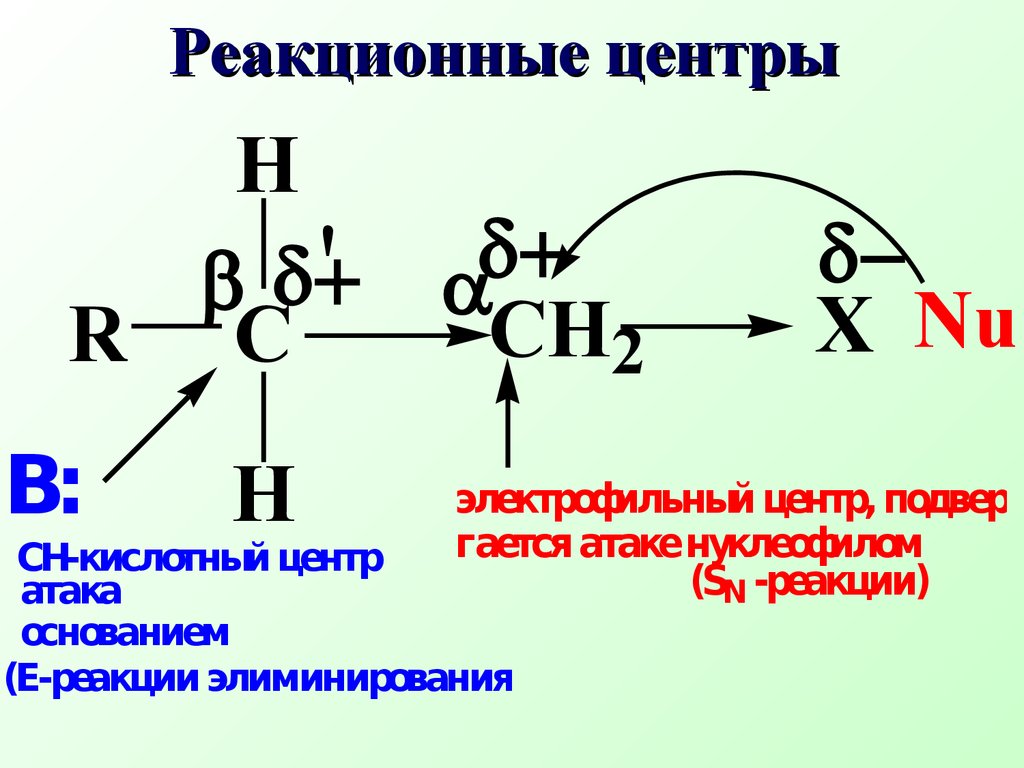
Лекция № 7 Конкурентные реакции у насыщенного атома углерода План 7.1.Реакции нуклеофиль- ного замещения (SN) 7.2.Реакции элиминиро- вания (Е) К конкурентным реакциям у насыщенного атома углерода относятся реакции нуклеофильного замещенияи элиминирования 7.1.Реакции нуклеофильного замещения (SN) Нуклеофильное замещение у насыщенного атома углерода представляет собой одну из наиболее важных в синтетическом плане органических реакций и широко используется для синтеза биологически активных веществ По типу реакцийSN иЕ протекают многие биологические реакции (алкилирование, дегидратация) Конкурентные реакцииSN иЕ протекают в одной молекуле, но на разных реакционных центрах Нуклеофильное замещение при насыщенном атоме углерода характерно для алкилгалогенидов, спиртов, тиолов, аминовsp3- гибридный атом углеродаCX Реакции нуклеофильного замещения SN Введение в насыщенный углеводородный скелет молекулы электро но акцепторной группировки Х приводит к перераспределению электронной плотности в молекуле и появлению новых р еак ционных центровCCH2XNuRHВ:' атака основанием(Е- реакции элиминирования) СН- кислотный центр электрофильный центр, подвер- гается атаке нуклеофилом(SN- реакции) Реакционные центры В таких соединениях атом углерода связан σ-связью с электроакцепторным атомом (Нal,О,N,S ) и вследствие большей электроотрицательности гетероатома связь С - Х поляризована.
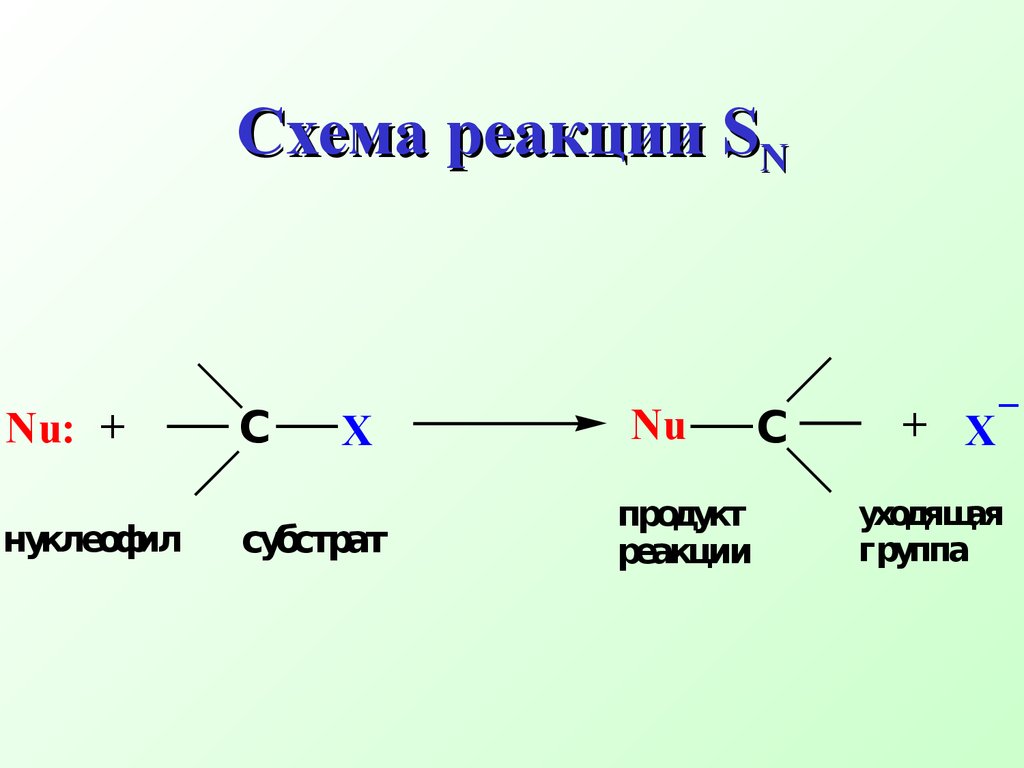
Атом углерода становится электронодефицитным (электрофильным) и может подвергаться атаке нуклеофилом Схема реакцииSNNu:Nu+СXX_ нуклеофил субстрат продукт реакции уходящая группа Реакция возможна, т.е.
протекает вправо, когда уходящая группа(Х-) более стабильна, чем нуклеофил, т.е.
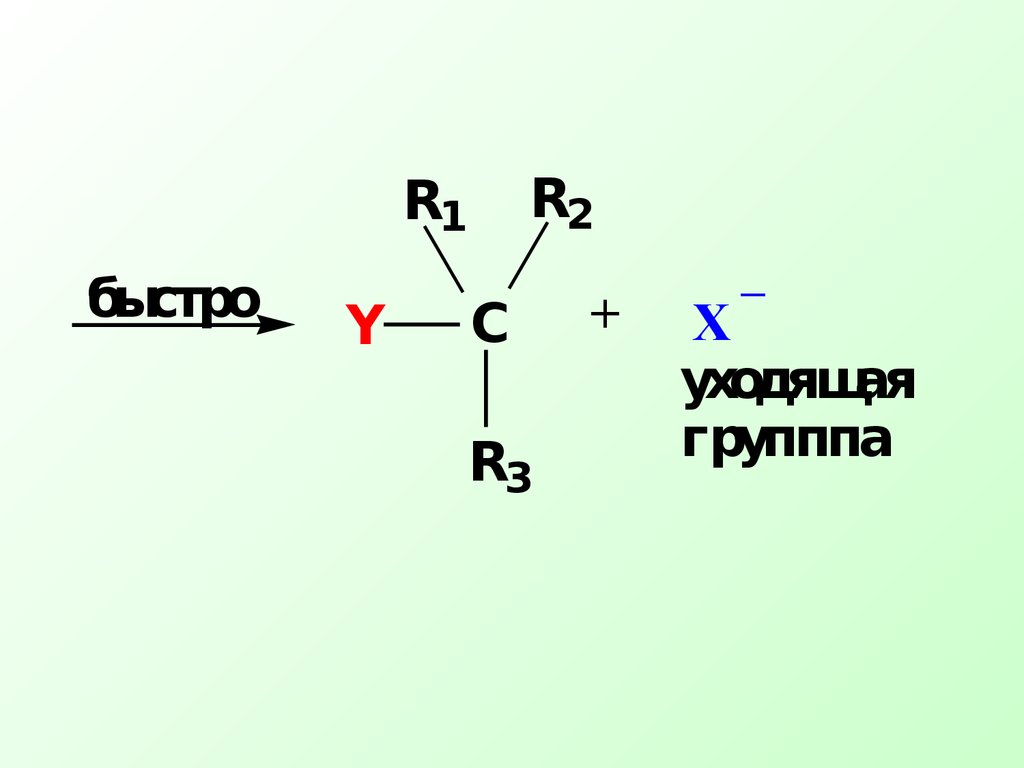
имеет меньшую энергию по сравнению с атакующим нуклеофилом+СXR1R1R2R2R3R3Y_ .
.
.
Переходный комплекс медленно − δ−Yδ+ Механизм реакцииSN_Y быстро уходящая групппаСR1R2R3+XН уклеофильная частицаY- атакует атом углерода с наиболее выгодной стороны (противоположной уходящей группе « атака с тыла »).
Разрыв старой связи С—Х и образование новой С—Y происходит синхронно, т.е.
образуется переходное состояние (в этой стадии принимают участие две молекулы – реагент и субстрат) Реакция бимолекулярная, скорость реакции зависит от концентрации обоих реагентов.
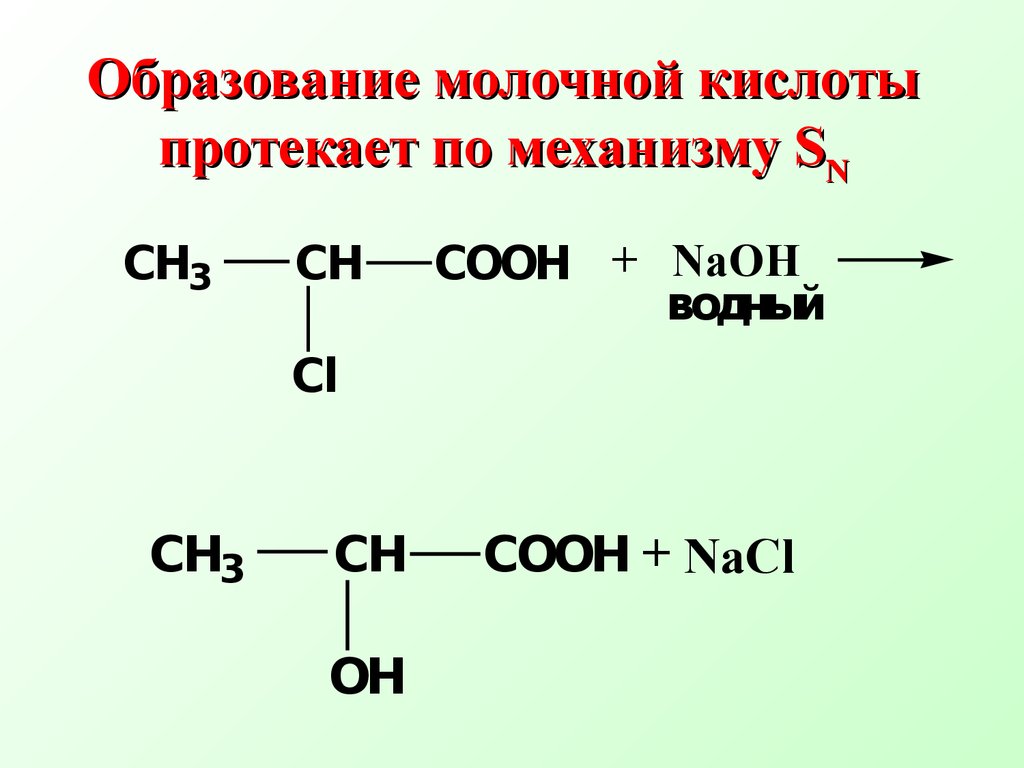
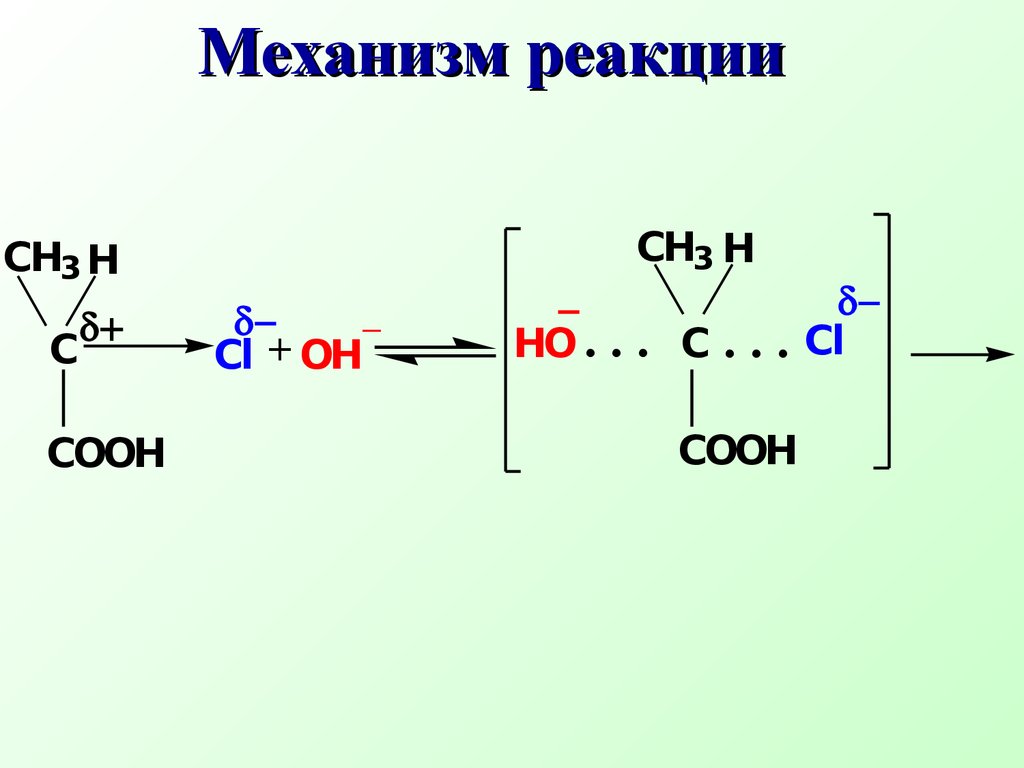
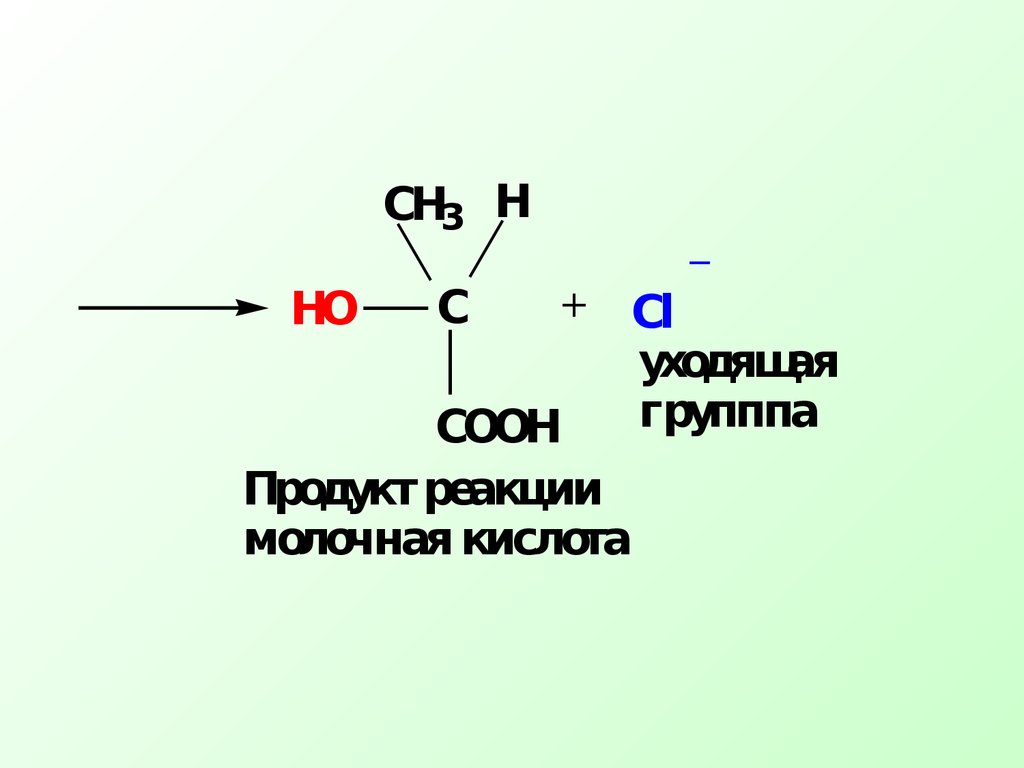
Переходное состояние соответствует максимуму на энергетической кривойО бразование молочной кислоты протека ет по механизмуSN СН3 СНСООН+ NaOH водныйСl СН3 СНСООН+ NaCl ОН Механизм реакции+С_ .
.
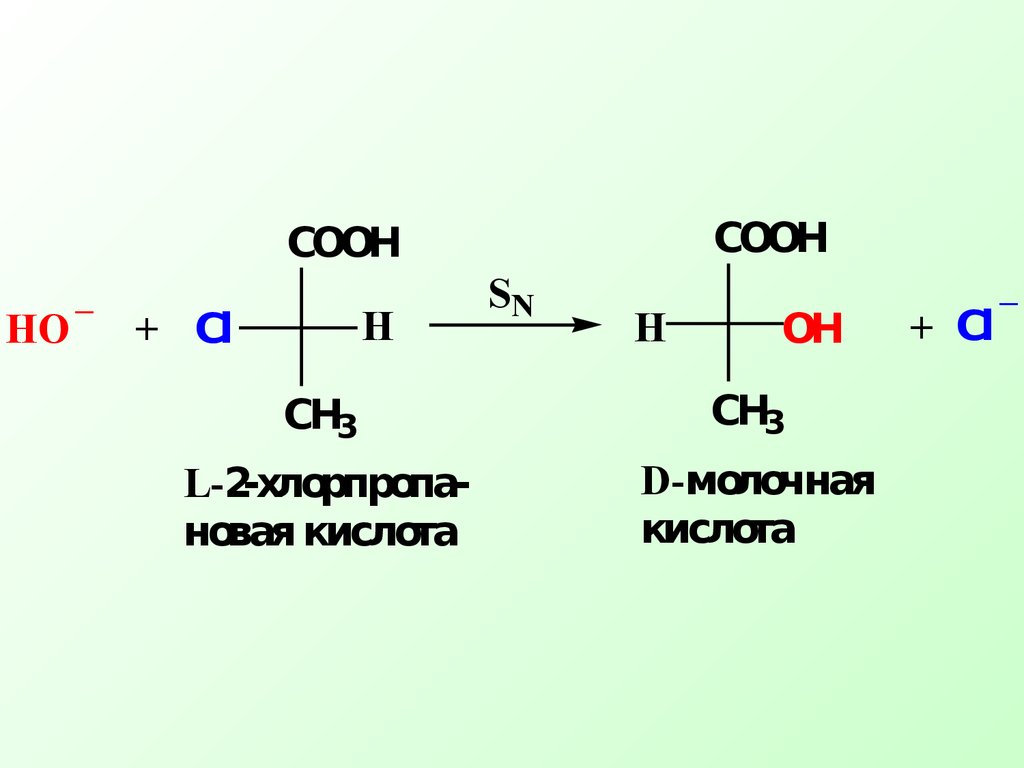
.− δ−δ+ СН3 СООН СН3 НОСlНСl ОН_ уходящая групппаС+ СООНСlН СН3 НО Продукт реакции молочная кислота Протекание реакции нуклеофильного замещения приводит к «обращению» конфигурации атома углерода (т.е.
происходит изменение положения заместителей в пространстве)+_HO СН3 СООН+Сl ОНHSN СН3 СООНHСl_L-2- хлорпропа- новая кислотаD- молочная кислота Нуклеофильное замещение в спиртах, тиолах и аминах протекает аналогично, но эти соединения содержат довольно трудноуходящие группы (ОН—,SH—,NН2— ) и данные реакции протекают, как правило, в условиях кислотного катализа, при этом трудноуходящая группа превращается в легкоуходящую ХНδ+СOH δ−H2O Спиртыδ+СHаl δ− Cl , Br , I Галогенпроиз- водные---δ+СX δ− Связь Субстраты Уходящие группы Потенциальные субстратыв SN реакциях .δ+СOR δ− R - OH Простые эфирыδ+СSH δ−H2S Тиолыδ+СNH2 δ−NH3 АминыCH3 - CH2 OH + HCl CH3 - CH2 - ClH2SO4- H2OCH3 - CH2 OH + H+ CH3 - CH2 - O δ+δ−H- H2O+CH3 - CH2CH3 - CH2 - Cl+Cl-+ В живых организмах хорошо уходящие группы – стабильные фосфат, дифосфат и трифосфат ионы , в которых отрицательный заряд делокализуется на многих атомах кислорода В сложной структуре биологически активных молекул всегда возникает вопрос, какой атом углерода субстрата будет атакован нуклеофилом.
В первую очередь будет атакован тот атом углерода, который связан с лучшей уходящей группой Многие реакции, происходящие в клетках растений и животных осуществляются по типу нуклеофильного замещения.
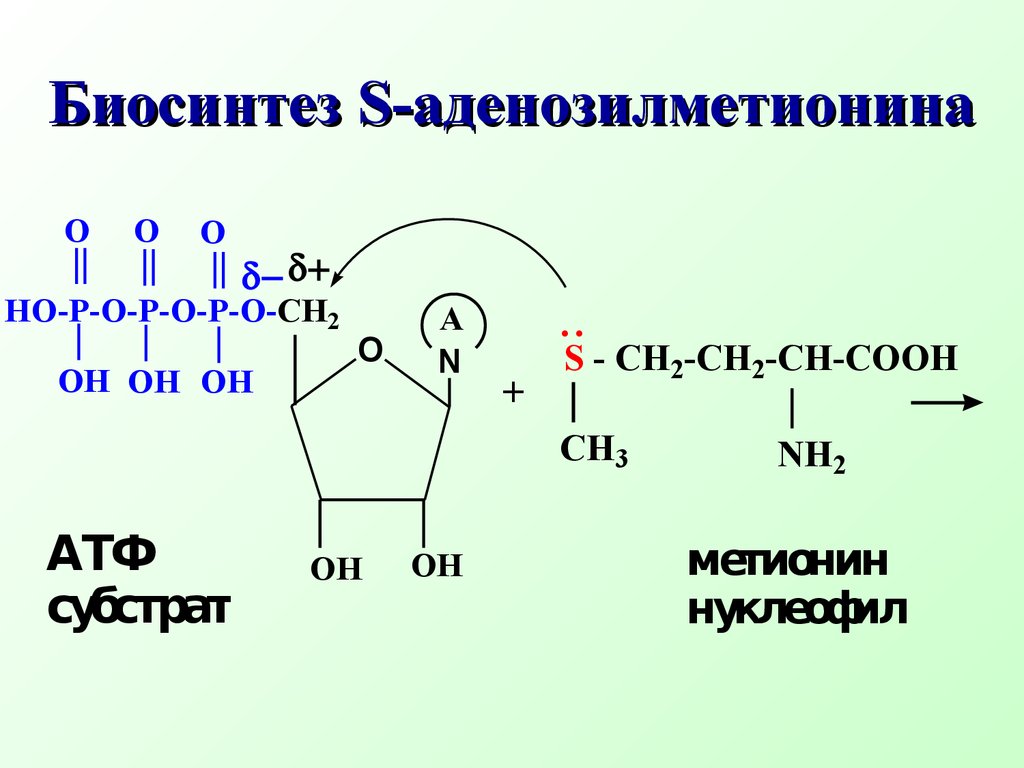
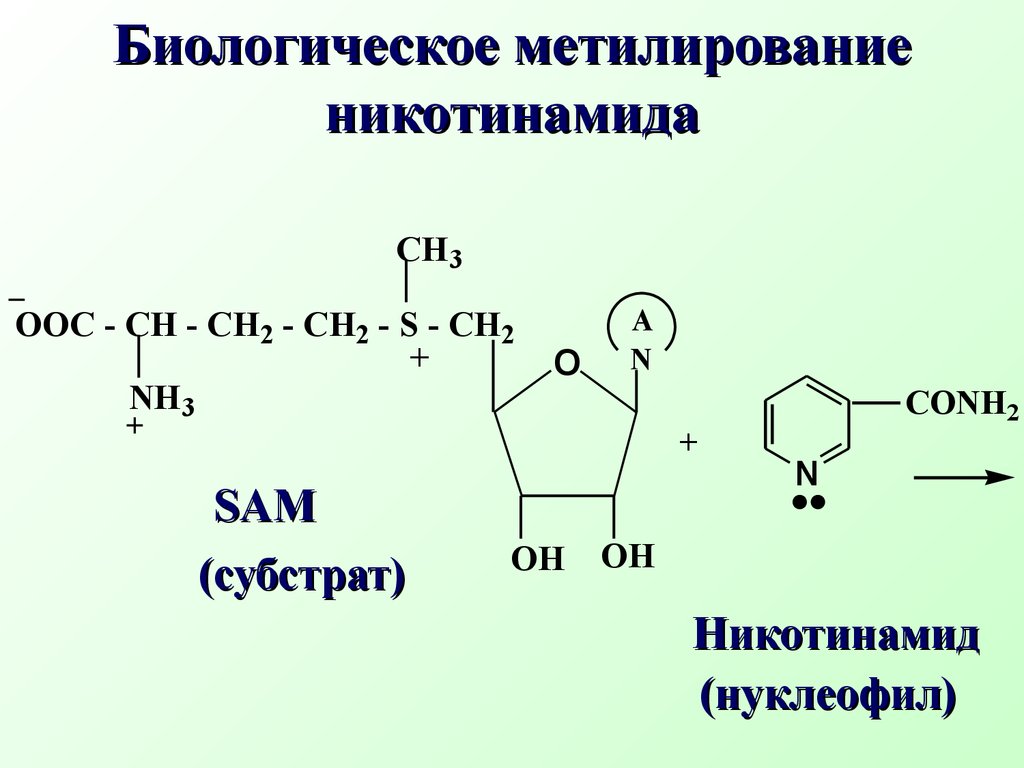
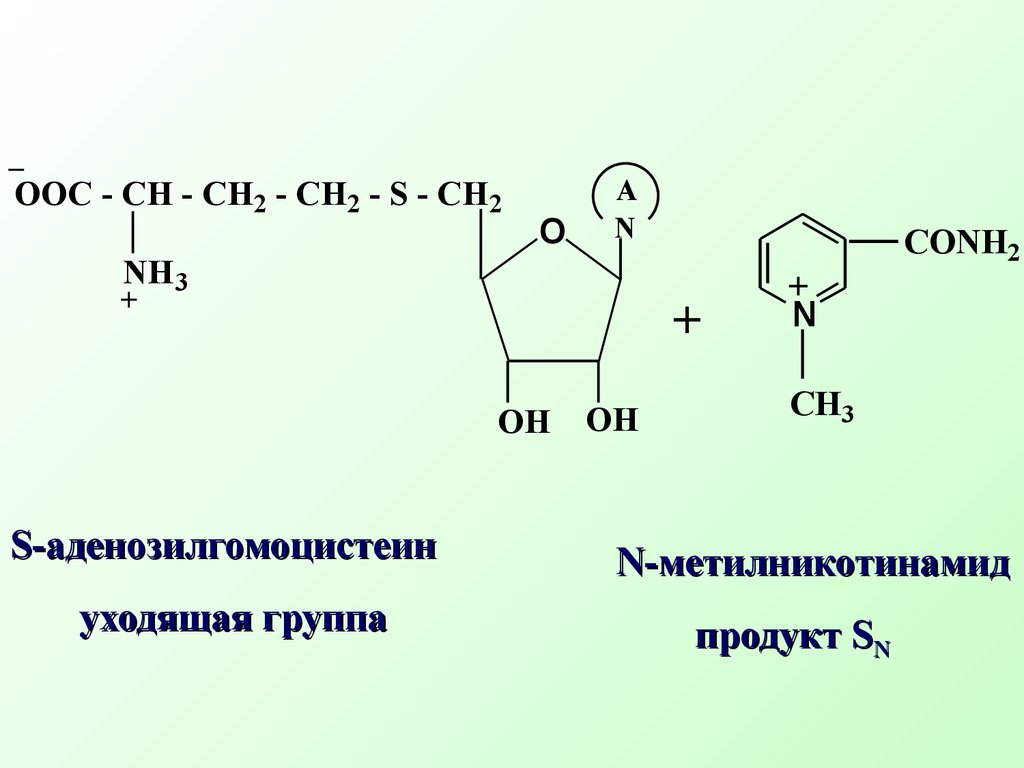
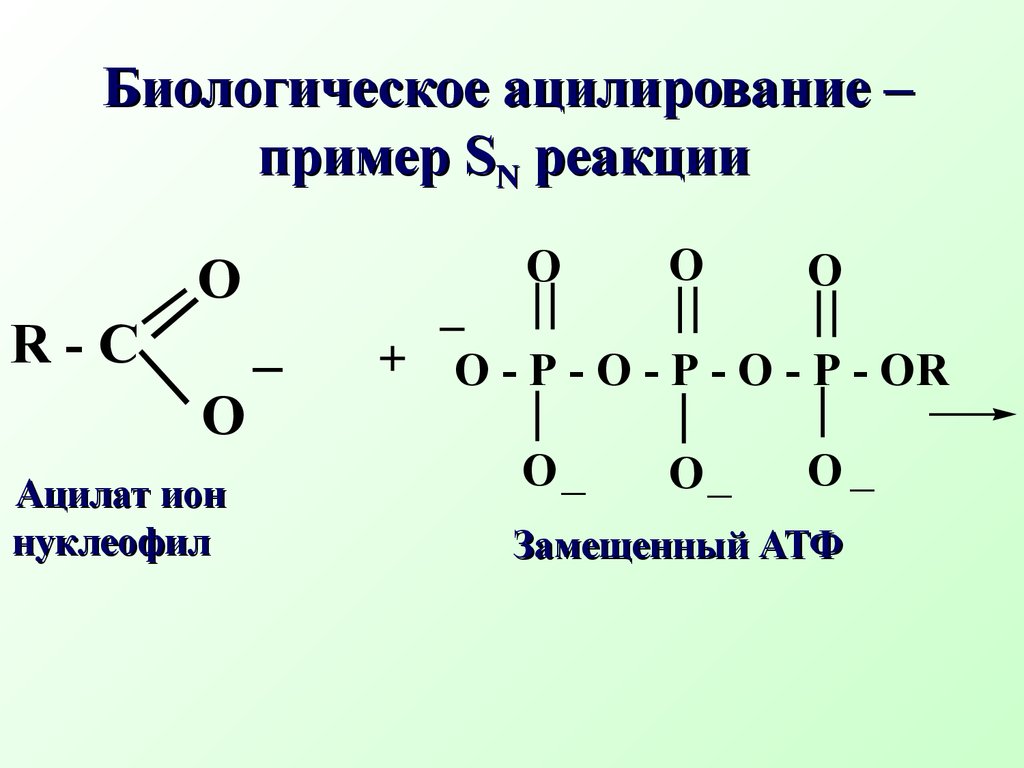
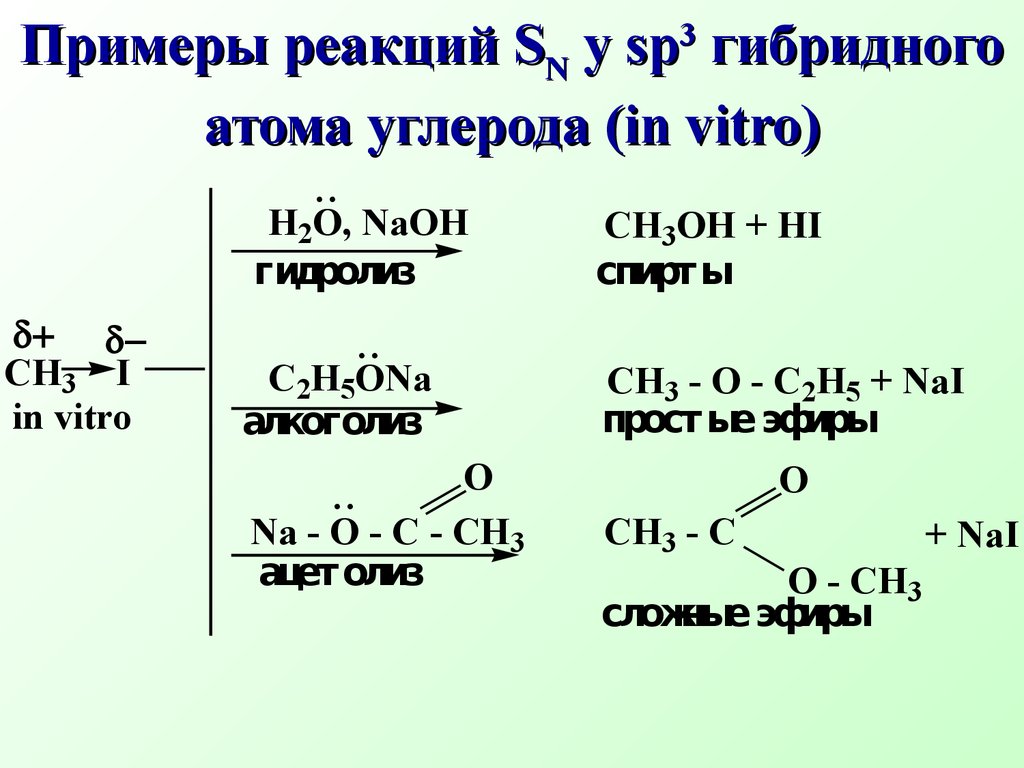
Например, биосинтезS- аденозилметионина(SAM) из аминокислоты метионина (нуклеофил) и АТФ (субстрат) БиосинтезS -аденозилметионинаδ+ δ−OOOOH OHOHONOH HO-P-O-P-O-P-O-CH2A+S - CH2-CH2 -CH-COOH..NH2CH3 АТФ субстрат метионин нуклеофил+ HO - P - O - P - O - P - OOOH OHOH-OOHNH2 HOOC - CH - CH2 - CH2 - S - CH2+CH3ANS- аденозилметионин( SAM) (Продукт реакции SN Трифосфат ион Уходящая группаSAM является донором метильной группы и отвечает за биологические реакции метилирования (метилирует природные азотистые нуклеофилы: коламин, норадреналин, никотинамид, участвует в биосинтезе антибиотика тетрациклина, витамина В12N CONH2+SAM Никотинамид Биологическое метилирование никотинамида (субстрат) (нуклеофил)OOHNH3 OOC - CH - CH2 - CH2 - S - CH2+CH3AN CONH2CH3+S- аденозилгомоцистеин уходящая группаOOHNH3 OOC - CH - CH2 - CH2 - S - CH2ANN- метилникотинамид продуктSN R - CO O - P - O - P - O - P - ORO_ Биологическое ацилирование – примерSN реакции Ацилат ион нуклеофил Замещенный АТФ R - CO O - P - ORO_P2O74- Замещенный ацилфосфат Дифосфат ион уходящая группа Ацилфосфаты играют важную рольin vivo в качестве переносчиков ацильных группH2 O, NaOHCH3 OH + HIC2H5ONaCH3 - O - C2H5 + NaI Na - O - C - CH3CH3 - C O - CH3 + NaICH3 I in vitroδ+ δ−O гидролизспирты алкоголиз простые эфиры ацетолиз сложные эфиры..O Примеры реакцийSN уsр3 гибридного атома углерода (in vitro)2NH3CH3 - NH2 + NH4IH2SCH3 - SH + HI R - SHCH3 - S - R + HI аммонолиз амины тиолы тиоспирты..и аминыCH3 I in vitro 7.2.
Реакции элиминирования (Е) Реакция элиминирования заключается в отщеплении двух атомов или групп, входящих в состав одной молекулы.
Различают α-, β-и γ- элиминирование α-элиминирование – отщепление двух атомов или групп атомов происходит от одного и того же атома углерода β-элиминирование – отщепление двух атомов или групп атомов происходит от соседних атомов углерода.
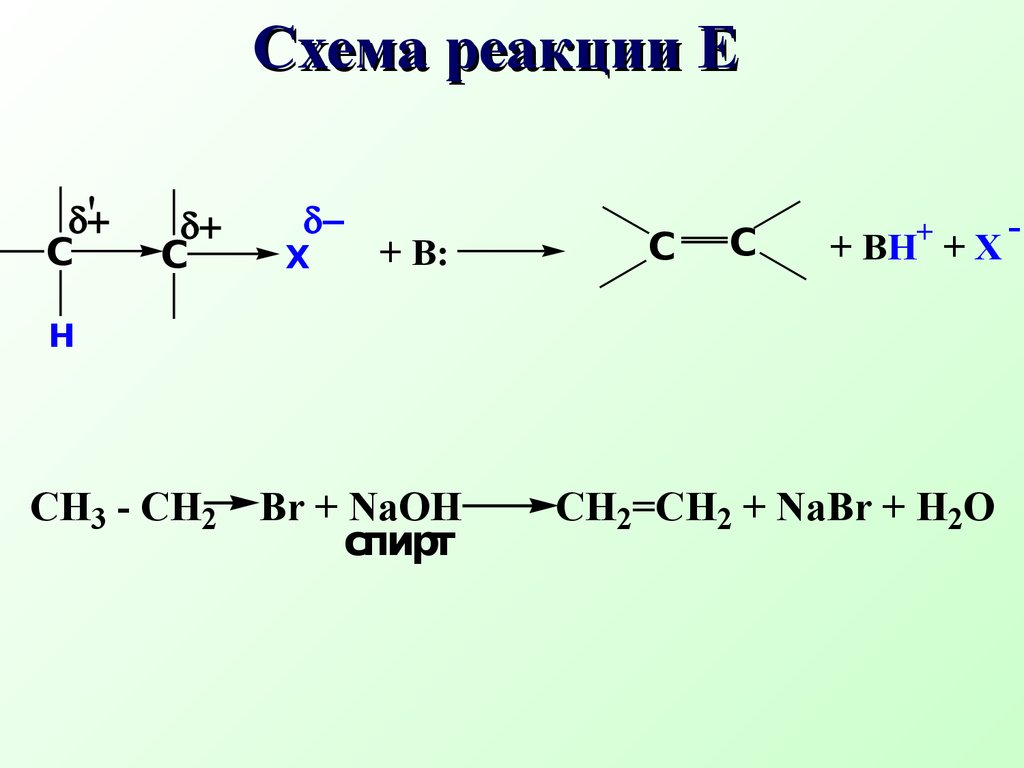
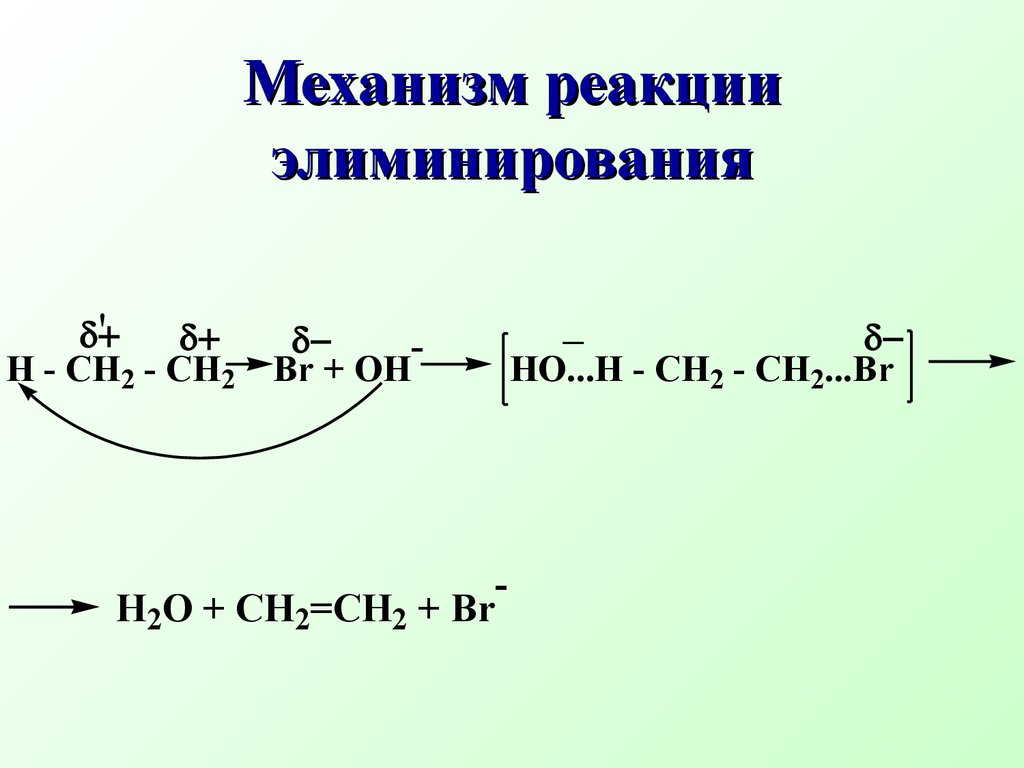
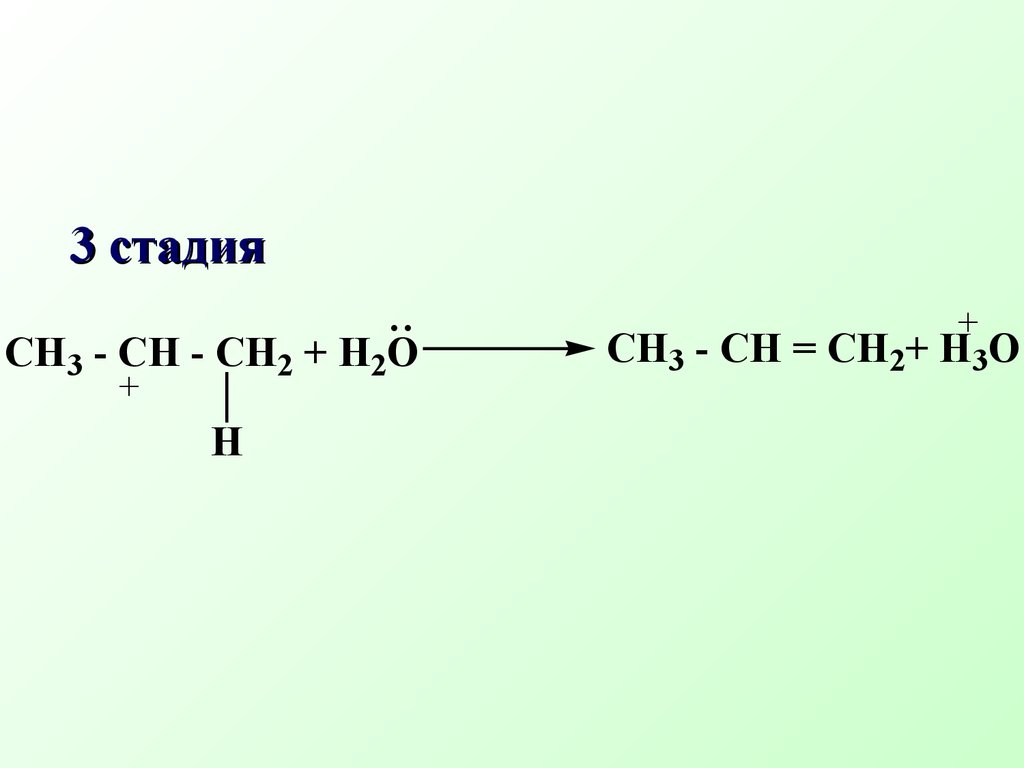
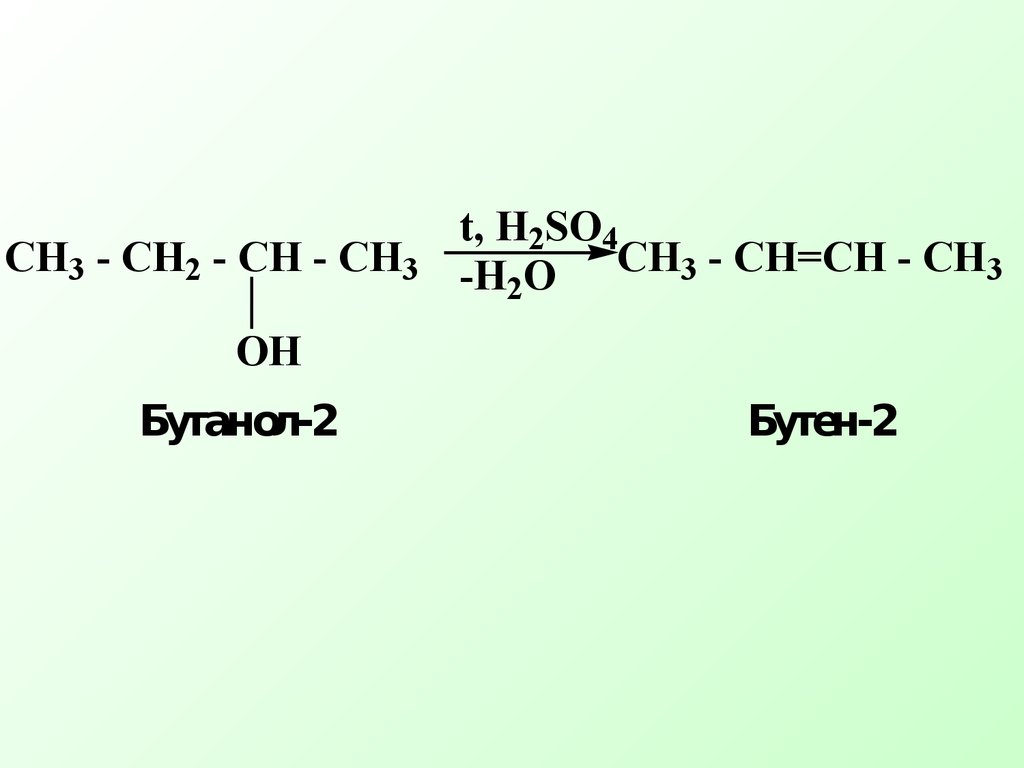
β-элиминирование наиболее распространенный тип элиминирования, протекающий в живых организмах и приводящий к образованию кратн ой связиCH3 - CH2 Br + NaOH CH2=CH2 + NaBr + H2O спирт Схема реакции Еδ+СX δ−Сδ+СH- + B:+ BH+ +X'H2 O + CH2=CH2 + Br- Механизм реакции элиминирования H - CH2 - CH2 Br + OH- HO...H - CH2 - CH2 ...Brδ+ δ−' δ−CH3 - CH - CH3 CH2 =CH - CH3 + H2OOHto,H2SO4 Одной из реакций элиминирования, имеющих биологическое значение – является реакция дегидратации (отщепление воды)CH3 - CH - CH3OH+ H2SO4 быстроCH3 - CH - CH3OH+ + HSO4- Механизм реакции 1 стадияCH3 - CH - CH3 CH3 - CH - CH3 + H2OH+ медленно 2 стадияCH3 - CH - CH2 + H2O..+H CH3 - CH = CH2+ H3O+ 3 стадия Правило Зайцева: в реакциях дегидратации и дегидрогалогенирования водород отщепляется от наименее гидрогенизированного атома углеродаCH3 - CH2 - CH - CH3 CH3 - CH=CH - CH3 t, H2SO4-H2OOH Бутанол-2 Бутен-2 Дегидратация характерна для соединений живой природы, содержащих гидроксильную группу и СН-кислотный центр Классический пример – дегидратация яблочной кислоты.
Реакция специфична.
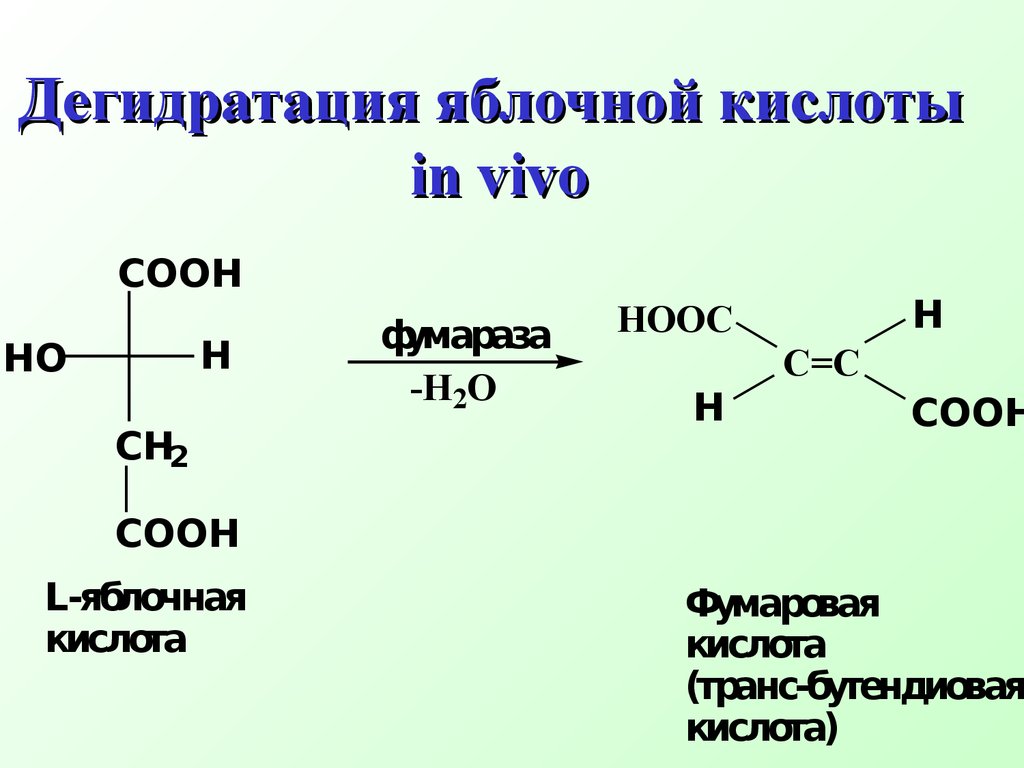
Фермент фумараза способен катализировать реакцию дегидратации только од ного оптическ ого изомера яблочной кислоты –L -яблочную кислоту Дегидратация яблочной кислоты in vivo COOHCH2HOH COOH фумараза-H2OC=C HOOC COOHHL- яблочная кислота Фумаровая кислота( транс- бутендиовая кислота)
Атом углерода становится электронодефицитным (электрофильным) и может подвергаться атаке нуклеофилом Схема реакцииSNNu:Nu+СXX_ нуклеофил субстрат продукт реакции уходящая группа Реакция возможна, т.е.
протекает вправо, когда уходящая группа(Х-) более стабильна, чем нуклеофил, т.е.
имеет меньшую энергию по сравнению с атакующим нуклеофилом+СXR1R1R2R2R3R3Y_ .
.
.
Переходный комплекс медленно − δ−Yδ+ Механизм реакцииSN_Y быстро уходящая групппаСR1R2R3+XН уклеофильная частицаY- атакует атом углерода с наиболее выгодной стороны (противоположной уходящей группе « атака с тыла »).
Разрыв старой связи С—Х и образование новой С—Y происходит синхронно, т.е.
образуется переходное состояние (в этой стадии принимают участие две молекулы – реагент и субстрат) Реакция бимолекулярная, скорость реакции зависит от концентрации обоих реагентов.
Переходное состояние соответствует максимуму на энергетической кривойО бразование молочной кислоты протека ет по механизмуSN СН3 СНСООН+ NaOH водныйСl СН3 СНСООН+ NaCl ОН Механизм реакции+С_ .
.
.− δ−δ+ СН3 СООН СН3 НОСlНСl ОН_ уходящая групппаС+ СООНСlН СН3 НО Продукт реакции молочная кислота Протекание реакции нуклеофильного замещения приводит к «обращению» конфигурации атома углерода (т.е.
происходит изменение положения заместителей в пространстве)+_HO СН3 СООН+Сl ОНHSN СН3 СООНHСl_L-2- хлорпропа- новая кислотаD- молочная кислота Нуклеофильное замещение в спиртах, тиолах и аминах протекает аналогично, но эти соединения содержат довольно трудноуходящие группы (ОН—,SH—,NН2— ) и данные реакции протекают, как правило, в условиях кислотного катализа, при этом трудноуходящая группа превращается в легкоуходящую ХНδ+СOH δ−H2O Спиртыδ+СHаl δ− Cl , Br , I Галогенпроиз- водные---δ+СX δ− Связь Субстраты Уходящие группы Потенциальные субстратыв SN реакциях .δ+СOR δ− R - OH Простые эфирыδ+СSH δ−H2S Тиолыδ+СNH2 δ−NH3 АминыCH3 - CH2 OH + HCl CH3 - CH2 - ClH2SO4- H2OCH3 - CH2 OH + H+ CH3 - CH2 - O δ+δ−H- H2O+CH3 - CH2CH3 - CH2 - Cl+Cl-+ В живых организмах хорошо уходящие группы – стабильные фосфат, дифосфат и трифосфат ионы , в которых отрицательный заряд делокализуется на многих атомах кислорода В сложной структуре биологически активных молекул всегда возникает вопрос, какой атом углерода субстрата будет атакован нуклеофилом.
В первую очередь будет атакован тот атом углерода, который связан с лучшей уходящей группой Многие реакции, происходящие в клетках растений и животных осуществляются по типу нуклеофильного замещения.
Например, биосинтезS- аденозилметионина(SAM) из аминокислоты метионина (нуклеофил) и АТФ (субстрат) БиосинтезS -аденозилметионинаδ+ δ−OOOOH OHOHONOH HO-P-O-P-O-P-O-CH2A+S - CH2-CH2 -CH-COOH..NH2CH3 АТФ субстрат метионин нуклеофил+ HO - P - O - P - O - P - OOOH OHOH-OOHNH2 HOOC - CH - CH2 - CH2 - S - CH2+CH3ANS- аденозилметионин( SAM) (Продукт реакции SN Трифосфат ион Уходящая группаSAM является донором метильной группы и отвечает за биологические реакции метилирования (метилирует природные азотистые нуклеофилы: коламин, норадреналин, никотинамид, участвует в биосинтезе антибиотика тетрациклина, витамина В12N CONH2+SAM Никотинамид Биологическое метилирование никотинамида (субстрат) (нуклеофил)OOHNH3 OOC - CH - CH2 - CH2 - S - CH2+CH3AN CONH2CH3+S- аденозилгомоцистеин уходящая группаOOHNH3 OOC - CH - CH2 - CH2 - S - CH2ANN- метилникотинамид продуктSN R - CO O - P - O - P - O - P - ORO_ Биологическое ацилирование – примерSN реакции Ацилат ион нуклеофил Замещенный АТФ R - CO O - P - ORO_P2O74- Замещенный ацилфосфат Дифосфат ион уходящая группа Ацилфосфаты играют важную рольin vivo в качестве переносчиков ацильных группH2 O, NaOHCH3 OH + HIC2H5ONaCH3 - O - C2H5 + NaI Na - O - C - CH3CH3 - C O - CH3 + NaICH3 I in vitroδ+ δ−O гидролизспирты алкоголиз простые эфиры ацетолиз сложные эфиры..O Примеры реакцийSN уsр3 гибридного атома углерода (in vitro)2NH3CH3 - NH2 + NH4IH2SCH3 - SH + HI R - SHCH3 - S - R + HI аммонолиз амины тиолы тиоспирты..и аминыCH3 I in vitro 7.2.
Реакции элиминирования (Е) Реакция элиминирования заключается в отщеплении двух атомов или групп, входящих в состав одной молекулы.
Различают α-, β-и γ- элиминирование α-элиминирование – отщепление двух атомов или групп атомов происходит от одного и того же атома углерода β-элиминирование – отщепление двух атомов или групп атомов происходит от соседних атомов углерода.
β-элиминирование наиболее распространенный тип элиминирования, протекающий в живых организмах и приводящий к образованию кратн ой связиCH3 - CH2 Br + NaOH CH2=CH2 + NaBr + H2O спирт Схема реакции Еδ+СX δ−Сδ+СH- + B:+ BH+ +X'H2 O + CH2=CH2 + Br- Механизм реакции элиминирования H - CH2 - CH2 Br + OH- HO...H - CH2 - CH2 ...Brδ+ δ−' δ−CH3 - CH - CH3 CH2 =CH - CH3 + H2OOHto,H2SO4 Одной из реакций элиминирования, имеющих биологическое значение – является реакция дегидратации (отщепление воды)CH3 - CH - CH3OH+ H2SO4 быстроCH3 - CH - CH3OH+ + HSO4- Механизм реакции 1 стадияCH3 - CH - CH3 CH3 - CH - CH3 + H2OH+ медленно 2 стадияCH3 - CH - CH2 + H2O..+H CH3 - CH = CH2+ H3O+ 3 стадия Правило Зайцева: в реакциях дегидратации и дегидрогалогенирования водород отщепляется от наименее гидрогенизированного атома углеродаCH3 - CH2 - CH - CH3 CH3 - CH=CH - CH3 t, H2SO4-H2OOH Бутанол-2 Бутен-2 Дегидратация характерна для соединений живой природы, содержащих гидроксильную группу и СН-кислотный центр Классический пример – дегидратация яблочной кислоты.
Реакция специфична.
Фермент фумараза способен катализировать реакцию дегидратации только од ного оптическ ого изомера яблочной кислоты –L -яблочную кислоту Дегидратация яблочной кислоты in vivo COOHCH2HOH COOH фумараза-H2OC=C HOOC COOHHL- яблочная кислота Фумаровая кислота( транс- бутендиовая кислота)





































 chemistry
chemistry








