Similar presentations:
Процессы сульфирования в промышленности
1. Кафедра химической технологии лекарственных веществ (ХТЛВ)
• Зав.кафедрой Лалаев Борис Юрьевич, к.хим.н., доцент• Курс «Основы химической технологии»
• Лектор Иозеп Анатолий Альбертович, профессор
кафедры ХТЛВ, д.фарм.наук,
профессор.
1
2. Учебные материалы
• 1. Полный курс лекций и презентация• 2. Вопросы – программы - МК (9), КР (2) и
экзаменационные
• 3. Технологическая карта
• 4. Календарные планы
• 5.Другие материалы (МУПЗ, МУСР)
• Учебник:
А.А. Иозеп, Б.В. Пассет, В.Я. Самаренко,
О.Б.Щенникова
Химическая технология лекарственных веществ.
Основные процессы химического синтеза
биологически активных веществ.– СПб.: Изд.
«Лань», 2016
2
3. ПРОЦЕССЫ СУЛЬФирования В ПРОМЫШЛЕННОСТИ
ПРОЦЕССЫ СУЛЬФИРОВАНИЯ ВПРОМЫШЛЕННОСТИ
• Существуют разные способы введения сульфогрупп в
молекулу
органического
соединения,
но
в
промышленности наиболее широко применяют
метод сульфирования - прямое замещение атома водорода
на сульфогруппу.
• Различают С-, N- и О-сульфирование в зависимости от
того, у какого элемента замещается атом водорода. ОСульфирование называют также сульфатированием.
• Сульфогруппы находятся в молекуле многих ценных
лекарственных веществ (сульфаниламиды, таурин,
хонтроитинсульфат, гепарин и др.). Кроме того,
сульфосоединения
являются
промежуточными
продуктами в синтезе лекарственных веществ и
витаминов.
• Другие понятия: субстрат, реагент, промежуточный и
целевой продукт
3
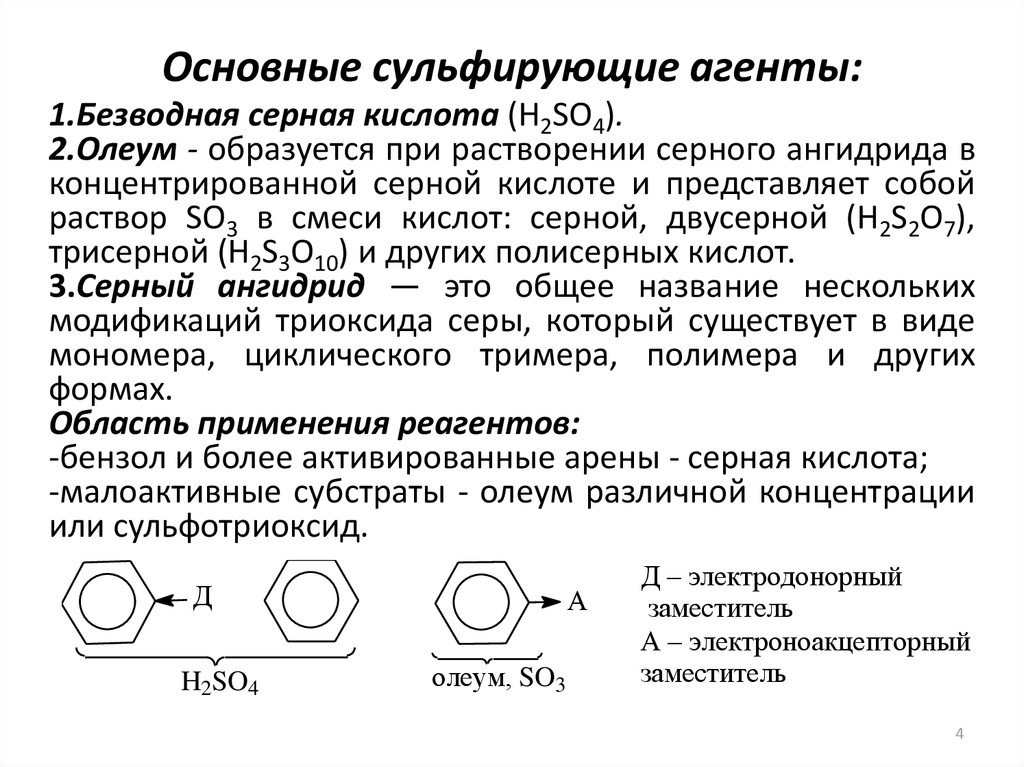
4. Основные сульфирующие агенты:
1.Безводная серная кислота (H2SO4).2.Олеум - образуется при растворении серного ангидрида в
концентрированной серной кислоте и представляет собой
раствор SO3 в смеси кислот: серной, двусерной (H2S2O7),
трисерной (H2S3O10) и других полисерных кислот.
3.Серный ангидрид — это общее название нескольких
модификаций триоксида серы, который существует в виде
мономера, циклического тримера, полимера и других
формах.
Область применения реагентов:
-бензол и более активированные арены - серная кислота;
-малоактивные субстраты - олеум различной концентрации
или сульфотриоксид.
Д
H2SO4
А
олеум, SO3
Д – электродонорный
заместитель
А – электроноакцепторный
заместитель
4
5. Основные методы сульфирования:
1.Сульфирование концентрированной серной кислотойArH + H2SO4 = ArSO3H + H2O
2.Сульфирование серным ангидридом
ArH + SO3 = ArSO3H
3.Сульфирование олеумом
ArH SO3/H2SO4
ArSO3H
4.Сульфирование растворами серного ангидрида в
инертных растворителях
ArH
SO3/ДХЭ
ArSO3H
4.Сульфирование растворами серного ангидрида в
инертных растворителях
L SO3
ArH
ArSO3H
5
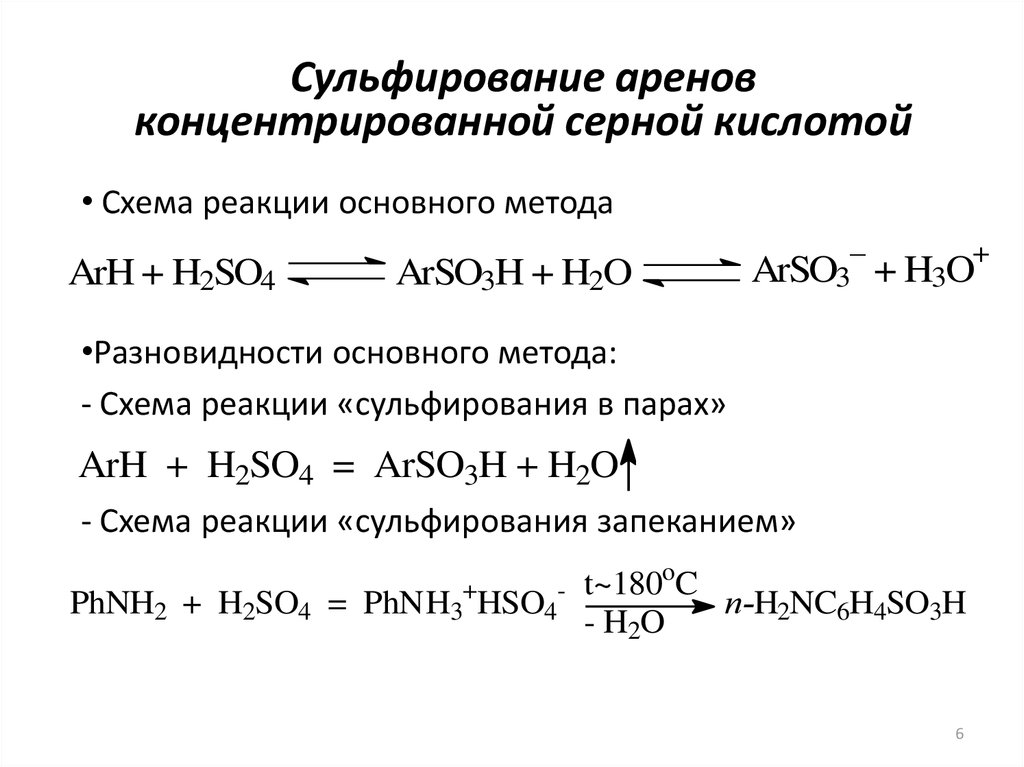
6. Сульфирование аренов концентрированной серной кислотой
• Схема реакции основного методаArH + H2SO4
ArSO3H + H2O
–
+
ArSO3 + H3O
•Разновидности основного метода:
- Схема реакции «сульфирования в парах»
ArH + H2SO4 = ArSO3H + H2O
- Схема реакции «сульфирования запеканием»
PhNH2 + H2SO4 = PhNH3+HSO4-
t~180oC
п-H2NC6H4SO3H
- H2O
6
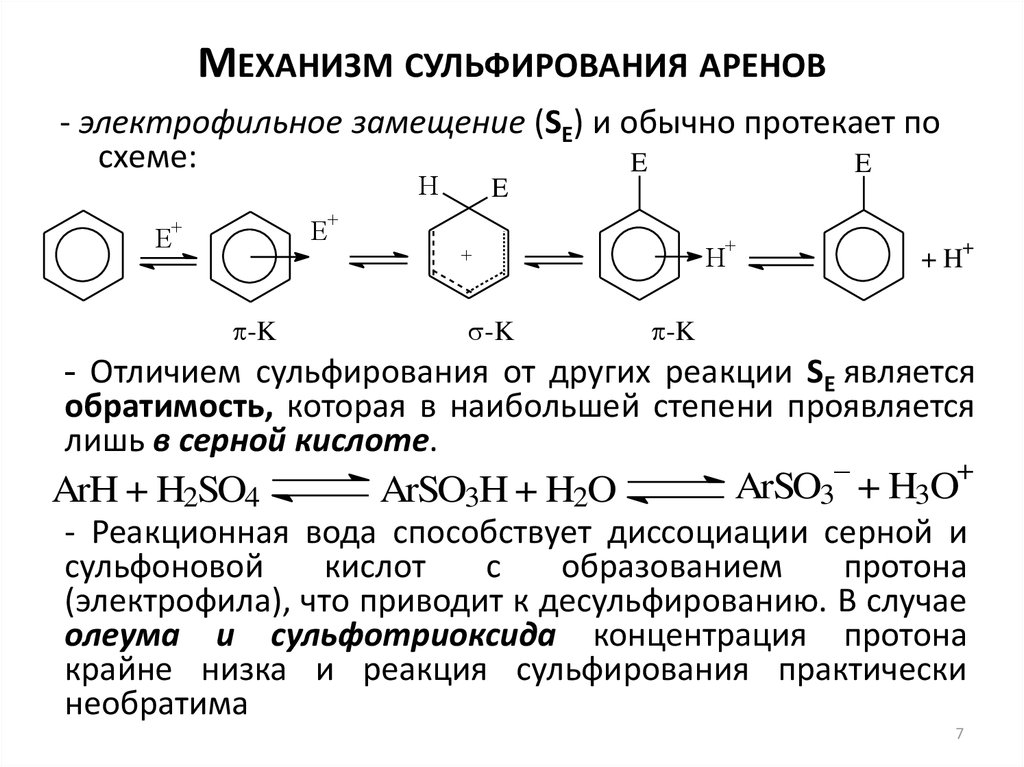
7. Механизм сульфирования аренов
МЕХАНИЗМ СУЛЬФИРОВАНИЯ АРЕНОВ- электрофильное замещение (SE) и обычно протекает по
схеме:
E
E
H
E
+
E
+
E
-K
+
-K
+
H
+
+H
-K
- Отличием сульфирования от других реакции SE является
обратимость, которая в наибольшей степени проявляется
лишь в серной кислоте.
ArH + H2SO4
ArSO3H + H2O
–
+
ArSO3 + H3O
- Реакционная вода способствует диссоциации серной и
сульфоновой
кислот
с
образованием
протона
(электрофила), что приводит к десульфированию. В случае
олеума и сульфотриоксида концентрация протона
крайне низка и реакция сульфирования практически
необратима
7
8. Сульфирующие частицы (Е+)
EH
E
E
+
E
+
E
-K
+
H
+
-K
+
+H
-K
- Н3SO4+ < SO3, S2O6, S3O9 < НSO3+ - в порядке возрастания
активности;
-которые имеются в серном ангидриде или образуются
в олеуме и при диссоциации кислоты:
H2SO4
H2SO4
– HSO4–
+
H3SO4
+
– H3O
SO3
H2SO4
– HSO4–
+
HSO3
- Сама H2SO4 не является электрофилом и не способна
сульфировать органические соединения.
Молекулы
органического
соединения
могут
одновременно
взаимодействовать
с
разными
электрофильными частицами, и реакция может
протекать по нескольким схемам.
8
9. Скорость и направление реакции
• в большой степени определяется, устойчивостью комплекса т. е. строением субстрата (кинетическийфактор), однако сульфирование процесс обратимый,
поэтому направление реакции может зависеть и от
устойчивости продуктов реакции (термодинамический
фактор)
• Электронодонорные (Д) заместители в арене
стабилизируют -комплекс и облегчают прохождение
реакции, а электроноакцепторные (А) — затрудняют.
ускорение реакции
NO2 < SO3H < COOH < Cl < H < CH3 < OCH3 < OH
Если принять скорость реакции бензола за единицу, то
относительная скорость реакции фенола в тех же условиях
будет примерно на 8 порядков больше, а нитробензола —
меньше.
9
10. Тепловой эффект
•сульфирования аренов серной кислотой, рассчитанный позакону Гесса, ~ 73 кДж/моль (является суммой
экзотермического процесса взаимодействия SO3 с
субстратом и эндотермического — диссоциации H2SO4 с
образованием SO3).
• В реальном процессе ~150 кДж/моль, за счет теплоты
разбавления серной кислоты реакционной водой.
•сульфирования серным ангидридом (олеумом) составляет
около 200 кДж/моль (нет затрат на образование SO3).
10
11. Особенности сульфирования серной кислотой. Реакционная вода
ОСОБЕННОСТИ СУЛЬФИРОВАНИЯ СЕРНОЙ КИСЛОТОЙ.РЕАКЦИОННАЯ ВОДА
1.Сульфирование серной кислотой, обычно, протекает
как гомогенная реакция.
2. Кислота диссоциирует по 2 схемам: с образованием
протона и сульфирующих частиц:
+
H3SO4
–
+ HSO4
H2SO4
H2SO4
H2O
–
+
HSO4 + H3O
-Чем больше концентрация кислоты (меньше воды),
тем
больше
образуется
электрофильных
(сульфирующих) частиц, и тем быстрее идет реакция.
- Реакционная вода - образуется в результате реакций:
ArH + H2SO4
ArSO3H + H2O
- и способствует кислотной диссоциации кислот
(равновесие
смещается
вправо).
Концентрация
электрофильных частиц, которая даже в 100 %-ной кислоте
менее 1%, уменьшается, и скорость реакции резко
11
снижается.
12. - «-Сульфирования» (с)
- « -Сульфирования» ( с)- минимальную концентрацию серной кислоты
(выраженную в % SO3), при которой она еще способна
сульфировать соединение.
•За
величину
« -сульфирования»
принимают
концентрацию серной кислоты, при которой скорость
образования продукта составляет менее 1 % за час.
•Эта величина полезна при определении концентрации и
массы реагента, необходимых для сульфирования
данного субстрата.
•Минимальное количество серной кислоты или олеума,
необходимое для моносульфирования 1 моль соединения,
может быть вычислено по формуле:
где С — начальная
концентрация сульфирующего
агента в % SO3
12
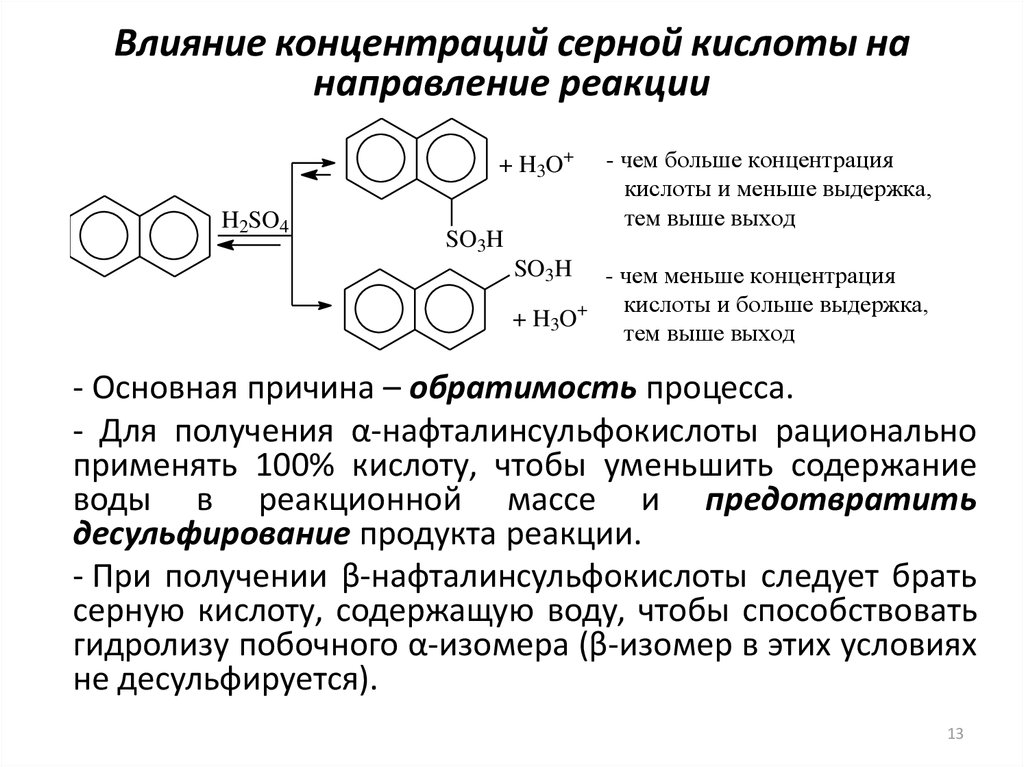
13. Влияние концентраций серной кислоты на направление реакции
+ H3O+H2SO4
SO3H
SO3H
+ H3O+
- чем больше концентрация
кислоты и меньше выдержка,
тем выше выход
- чем меньше концентрация
кислоты и больше выдержка,
тем выше выход
- Основная причина – обратимость процесса.
- Для получения α-нафталинсульфокислоты рационально
применять 100% кислоту, чтобы уменьшить содержание
воды в реакционной массе и предотвратить
десульфирование продукта реакции.
- При получении β-нафталинсульфокислоты следует брать
серную кислоту, содержащую воду, чтобы способствовать
гидролизу побочного α-изомера (β-изомер в этих условиях
не десульфируется).
13
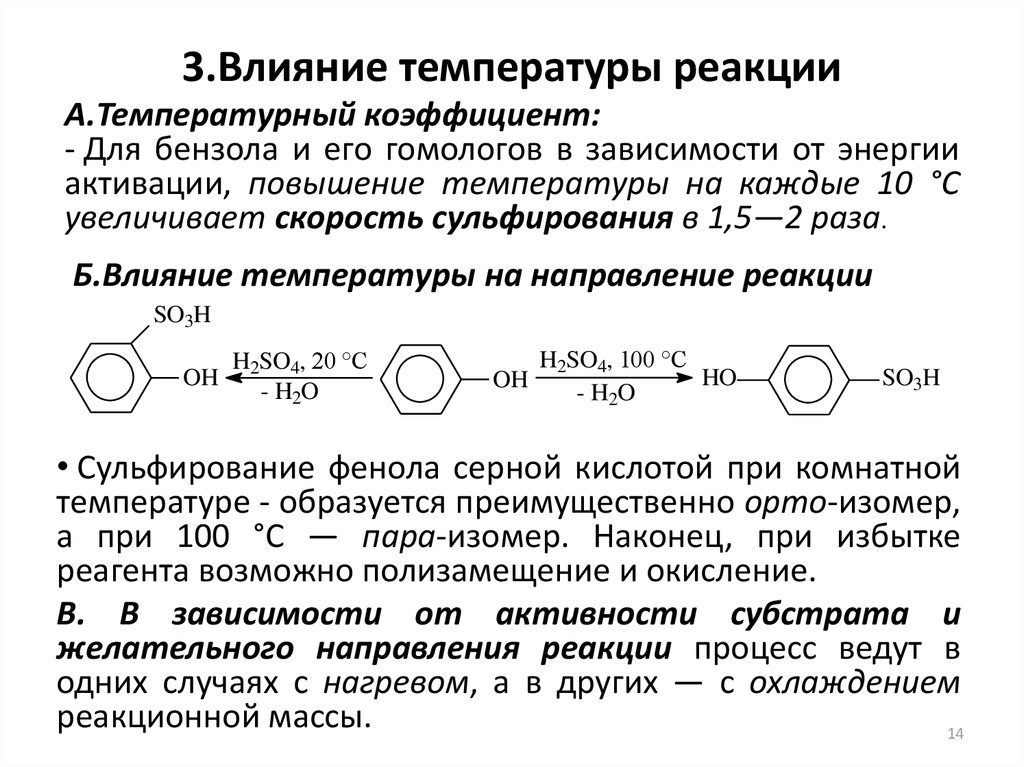
14. 3.Влияние температуры реакции
А.Температурный коэффициент:- Для бензола и его гомологов в зависимости от энергии
активации, повышение температуры на каждые 10 °С
увеличивает скорость сульфирования в 1,5—2 раза.
Б.Влияние температуры на направление реакции
SO3H
OH
H2SO4, 20 °С
- H2O
H2SO4, 100 °С
HO
OH
- H2O
SO3H
• Cульфирование фенола серной кислотой при комнатной
температуре - образуется преимущественно орто-изомер,
а при 100 °С — пара-изомер. Наконец, при избытке
реагента возможно полизамещение и окисление.
В. В зависимости от активности субстрата и
желательного направления реакции процесс ведут в
одних случаях с нагревом, а в других — с охлаждением
реакционной массы.
14
15. Основные недостатки сульфирования H2SO4 :
1.Малая концентрация электрофильных частиц;2.Быстрое снижение скорости реакции (вследствие
разбавления кислоты реакционной водой);
3.Отсутствие возможности сульфирования малоактивных
субстратов;
4.Окислительные и агрессивные свойства реакционной
среды;
5.Технологические и экологические трудности на стадии
выделения продукта (избыток реагента требует больших
количеств
нейтрализующих
средств,
усложняет
технологию и образует большое количество отходов).
•Некоторые недостатки можно устранить удалением
образующейся воды из реакционной массы и другими
методами («Сульфирование в парах» «Сульфирование
запеканием»).
15
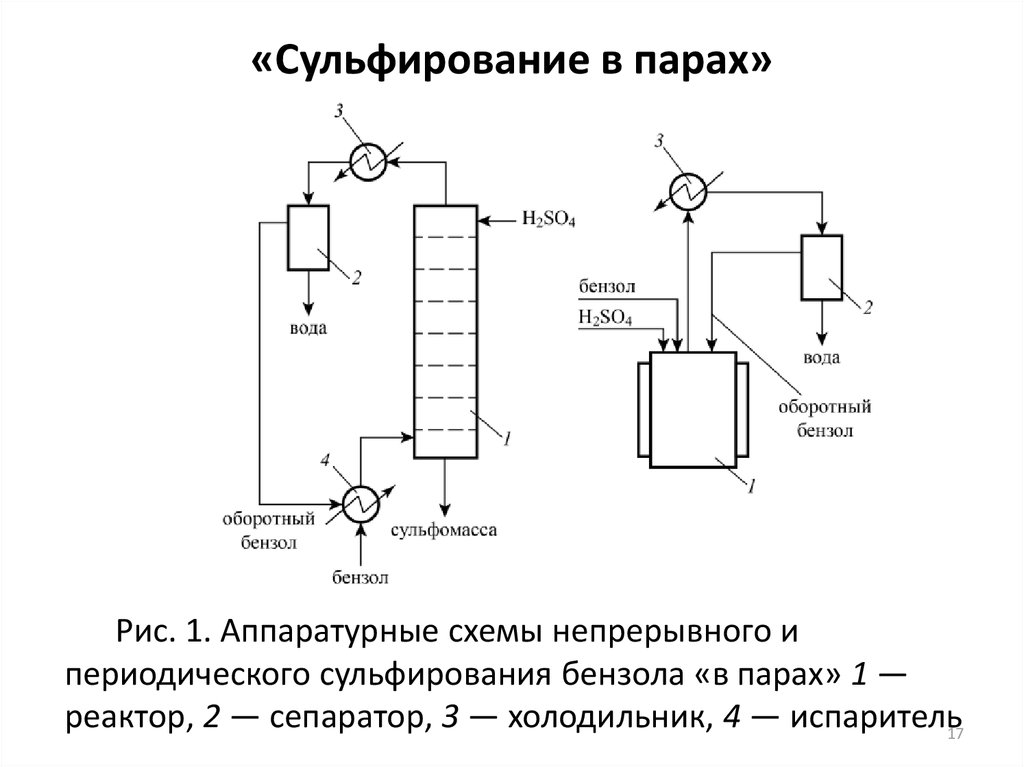
16. «Сульфирование в парах»
- предполагает азеотропную отгонку воды изреакционной массы, либо с избытком летучего субстрата
(бензолом, толуолом и др.), либо (в случае высококипящих
углеводородов) со специально введенным в реакционную
массу инертным азеотропным агентом (хлороформом,
лигроином и др.).
При сульфировании бензола «в парах»:
+ а)снижается расход серной кислоты в 1,8 раза по
сравнению с обычным сульфированием;
б)сохраняется концентрация сульфирующих частиц в
течение всего процесса;
- а)снижается скорость сульфирования (вследствие
уменьшения концентрации H2SO4 в реакционной массе);
б)процесс идет при более высокой температуре,
необходимой для эффективного удаления воды.
16
17. «Сульфирование в парах»
Рис. 1. Аппаратурные схемы непрерывного ипериодического сульфирования бензола «в парах» 1 —
реактор, 2 — сепаратор, 3 — холодильник, 4 — испаритель17
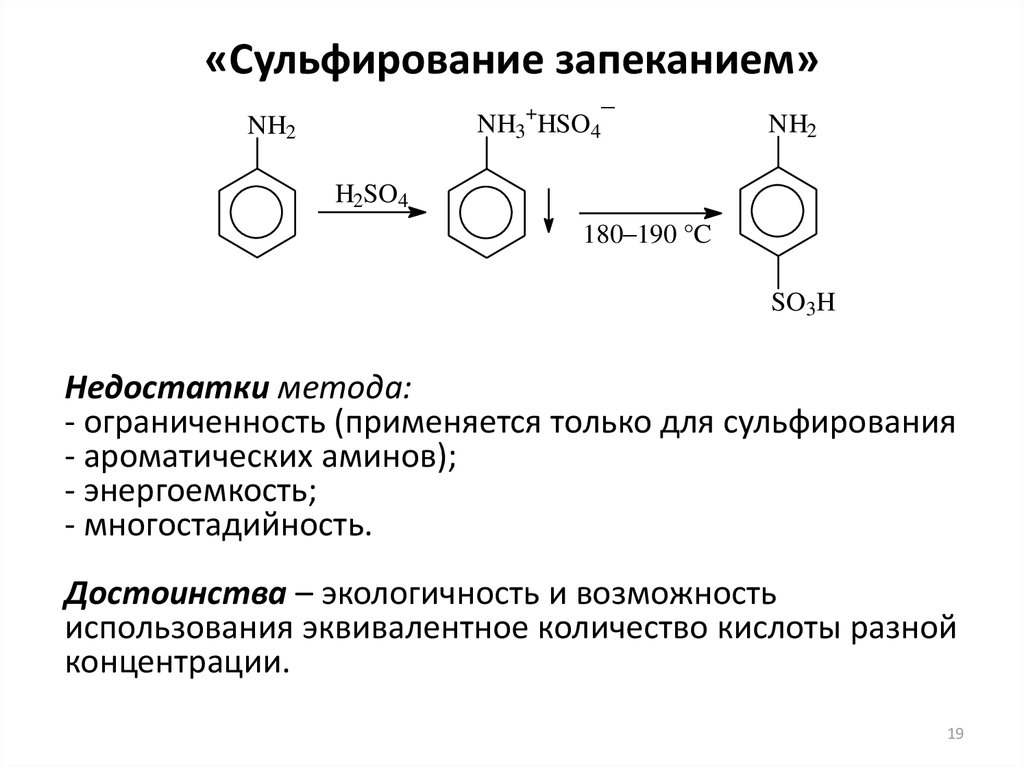
18. «Сульфирование запеканием»
• Применяют для сульфирования ароматических аминов.• Сначала из амина и разбавленной серной кислоты
получают соль, которую выделяют и нагревают до 180—
190 °С («запекают»). При этом образуется п- или оаминосульфокислоты. Раньше «запекание» соли
осуществляли в специальных печах.
• В настоящее время сульфат амина нагревают в среде
полихлорбензолов:
Первоначально
азеотропно
отгоняют воду. Затем реакционную массу выдерживают
при 180 °С и отгоняют растворитель. Далее добавляют
раствор NaOH и отгоняют с острым паром остатки
полихлоридов и ароматического амина. Соль продукта
остается в аппарате.
18
19. «Сульфирование запеканием»
–+
NH3 HSO4
NH2
NH2
H2SO4
180–190 °C
SO3H
Недостатки метода:
- ограниченность (применяется только для сульфирования
- ароматических аминов);
- энергоемкость;
- многостадийность.
Достоинства – экологичность и возможность
использования эквивалентное количество кислоты разной
концентрации.
19
20. Способы выделения аренсульфокислот. Химизм
Сульфокислоты обычно хорошо растворяются всульфомассе, поэтому их чаще всего выделяют в виде
солей после нейтрализации реакционной массы.
Нейтрализующими агентами обычно являются:
сода, сульфит натрия, мел, известь и щелочь.
Химизм процесса нейтрализации сульфомассы:
2ArSO3H + Na2CO3 (Na2SO3) 2ArSO3Na + CO2 (SO2) + H2O
H2SO4 + Na2CO3 (Na2SO3) Na2SO4 + CO2 (SO2) + H2O
2ArSO3H + Ca(OH)2 (CaCO3) (ArSO3)2Ca + CO2 + (2)H2O
H2SO4 + Ca(OH)2 (CaCO3) CaSO4 + (CO2) + (2)H2O
20
21. Технология выделения аренсульфокислот
•Образующиеся соли могут находиться в одной фазе (врастворе или в осадке), поэтому при выборе
нейтрализующего агента следует это учитывать.
•При
разделении
натриевых
солей
требуются
многочисленные их переосаждения, упаривания и
фильтрации растворов, что связано с энергетическими и
временными затратами, с коррозией оборудования.
•Недостаток нейтрализации солями сернистой и угольной
кислот - выделение газов. Возможен выброс реакционной
массы.
•Нейтрализация
сульфитом
выгодна
только
в
производствах,
где
комбинируются
процессы
сульфирования и щелочного плавления продуктов
сульфирования.
Отходы
производств
взаимно
используются (токсичность, экология):
ArSO3Na + 2NaOH = ArONa + Na2SO3 + H2O
2ArSO3H + Na2SO3 = 2ArSO3Na + SO2↑ + H2O
2NaOH + SO2 = Na2SO3 + H2O
21
22. Технология выделения аренсульфокислот
- Мел и известь - дешевое сырье, а кальциевые солисульфокислот, как правило, растворимы в воде, что
позволяет избавиться от неорганических солей.
При нейтрализации сульфомассы известью не образуется
углекислый газ, но мел дешевле, и при его использовании
образуется легко фильтрующейся осадок. Раствор,
полученный после фильтрации осадка, упаривают и
осаждают аренсульфонат кальция.
Перевод кальциевой соли в натриевую осуществляют по
схеме:
(RSO3)2Сa + Na2CO3 = 2RSO3Na + СаСО3↓ (!)
- Свободные сульфокислоты выделяют с помощью
ионообменных смол, либо хлороводорода.
- Таким образом, стадия выделения продукта
сульфирования часто оказывается технологически более
сложной и дорогой, чем стадия сульфирования
(спокойная, хорошо управляемая реакция, коррозия
оборудования незначительная).
22
23. Сульфирование олеумом и серным ангидридом
СУЛЬФИРОВАНИЕ ОЛЕУМОМ И СЕРНЫМ АНГИДРИДОМ- Методы отличаются универсальностью и большой
активностью, которая сохраняется до конца процесса.
Это объясняется высокой концентрацией электрофильных
частиц (SO3 и HSO3+), и отсутствием реакционной воды:
ArH + SO3
ArSO3H
Недостатки: возможны побочные реакции (окисление,
образование дисульфокислот, сульфонов и др.), поэтому
их чаще всего используют в случае малоактивных аренов,
устойчивых к окислителям;
- Серный ангидрид в отсутствие жидкого разбавителя
использовать технологически сложно.
- При сульфировании анилинов олеумом сульфогруппа
направляется в м-положение:
N(CH3)2
H2SO4/SO3
+
–
NH (CH3)2HSO4
+
–
NH (CH3)2HSO4
SO3
12 ч, 65 °C
SO3H
23
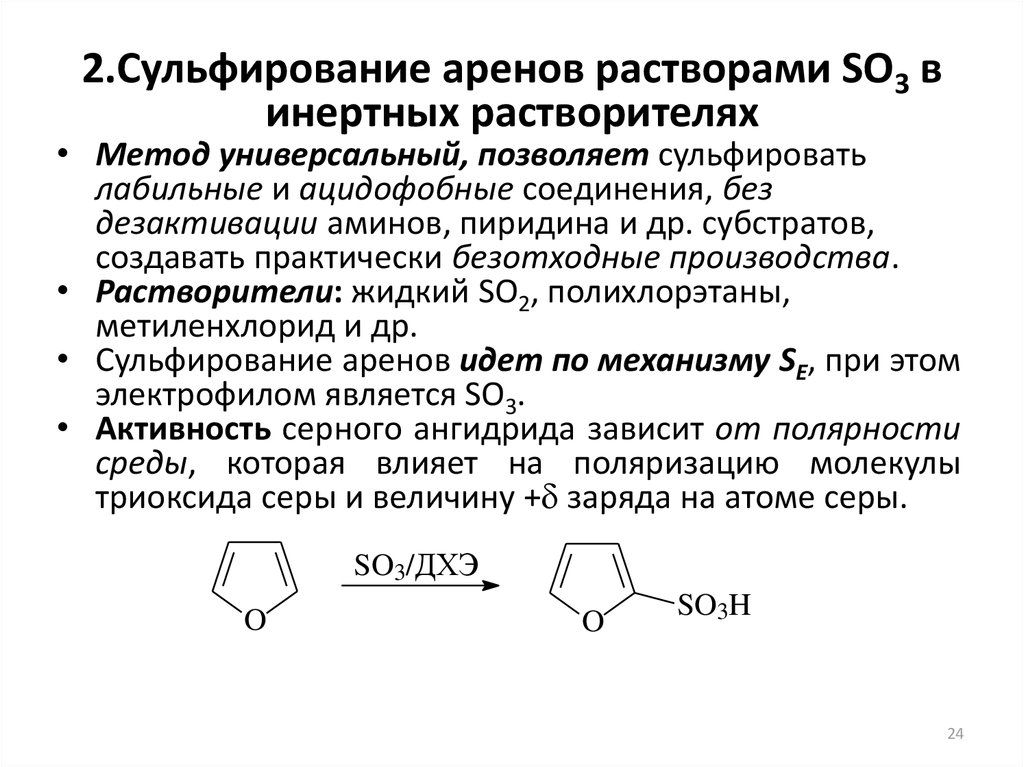
24. 2.Сульфирование аренов растворами SO3 в инертных растворителях
• Метод универсальный, позволяет сульфироватьлабильные и ацидофобные соединения, без
дезактивации аминов, пиридина и др. субстратов,
создавать практически безотходные производства.
• Растворители: жидкий SO2, полихлорэтаны,
метиленхлорид и др.
• Сульфирование аренов идет по механизму SE, при этом
электрофилом является SO3.
• Активность серного ангидрида зависит от полярности
среды, которая влияет на поляризацию молекулы
триоксида серы и величину + заряда на атоме серы.
SO3/ДХЭ
O
O
SO3H
24
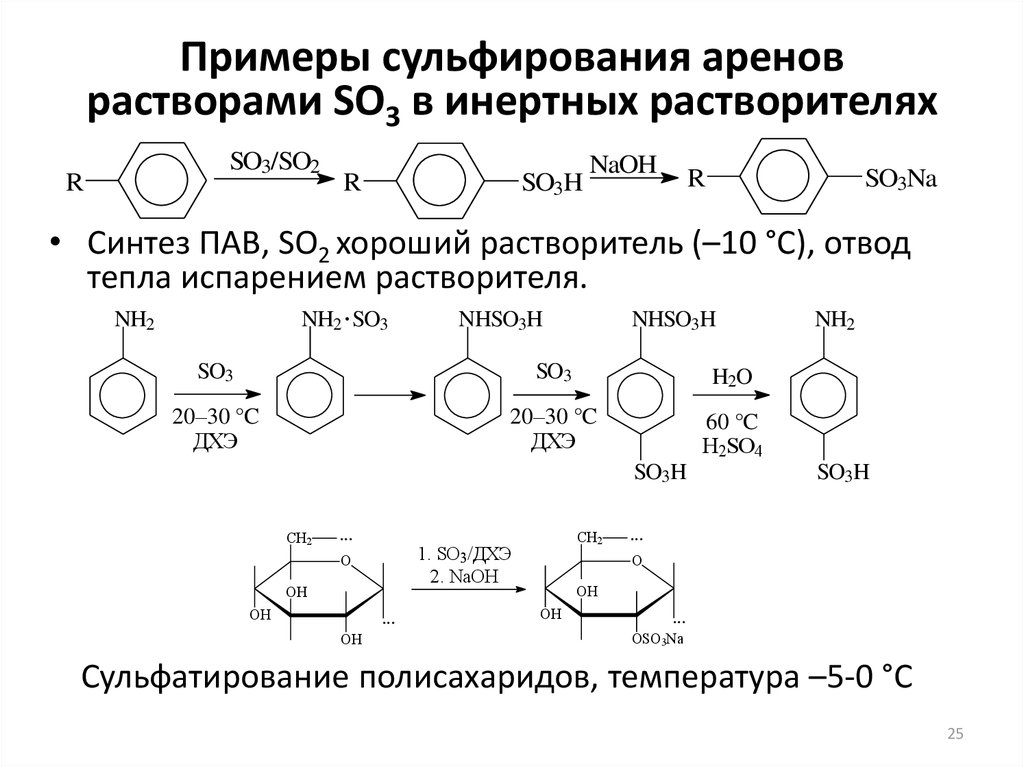
25. Примеры сульфирования аренов растворами SO3 в инертных растворителях
SO3/SO2R
R
SO3H
NaOH
R
SO3Na
• Синтез ПАВ, SO2 хороший растворитель (–10 °С), отвод
тепла испарением растворителя.
NH2 SO3
NH2
NHSO3H
NHSO3H
SO3
SO3
H2O
20–30 °C
ДХЭ
20–30 °C
ДХЭ
60 °C
H2SO4
SO3H
CH2
...
1. SO3/ДХЭ
2. NaOH
O
OH
OH
...
OH
CH2
NH2
SO3H
...
O
OH
OH
...
OSO3Na
Сульфатирование полисахаридов, температура –5-0 °С
25
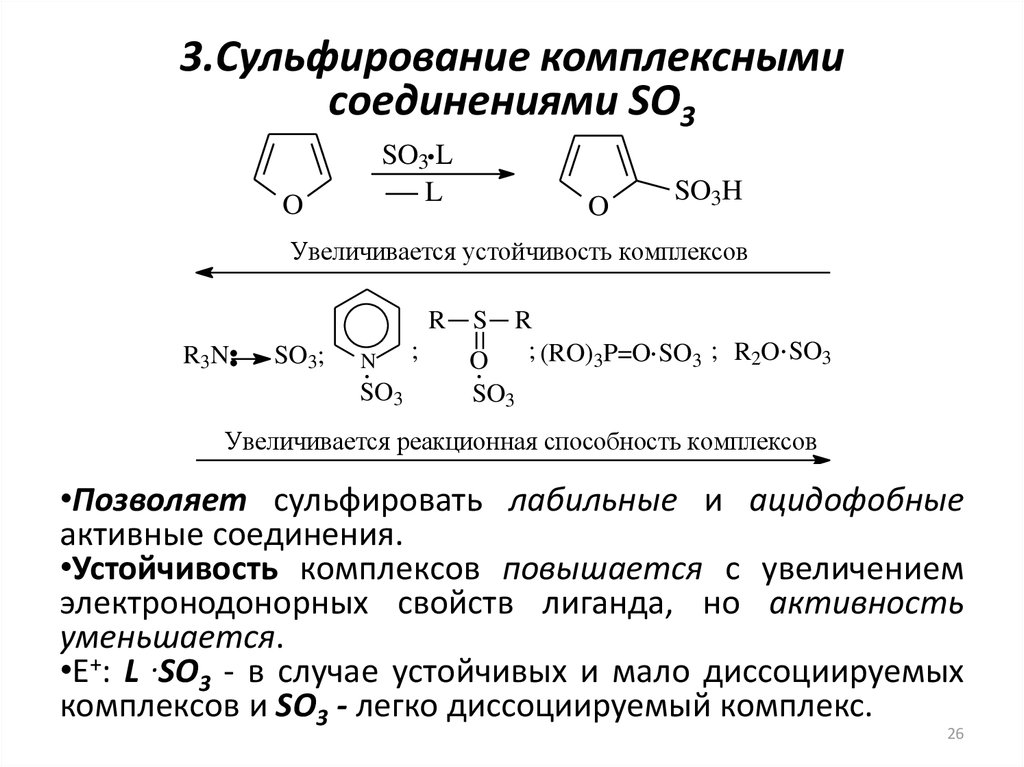
26. 3.Сульфирование комплексными соединениями SO3
SO3 LL
O
O
SO3H
Увеличивается устойчивость комплексов
R
R3N
SO3;
N
SO3
;
S
R
; (RO)3P=O SO3 ; R2O SO3
O
SO3
Увеличивается реакционная способность комплексов
•Позволяет сульфировать лабильные и ацидофобные
активные соединения.
•Устойчивость комплексов повышается с увеличением
электронодонорных свойств лиганда, но активность
уменьшается.
•Е+: L .SO3 - в случае устойчивых и мало диссоциируемых
комплексов и SO3 - легко диссоциируемый комплекс.
26
















 chemistry
chemistry








