Similar presentations:
Теория нитрования
1. Вопросы теории нитрования
2. Лекция 1
3. Принципиальная схема цеха по получению нитросоединений
Подготовкакомпонентов
Прием и
хранение
сырья
Реакционный
узел
Регенерация
кислот
Очистка
продукта
Регенерация
растворителей
Обезвреживание
отходов
Изготовление
готовых
форм
Хранение и
отправка
продукции
4.
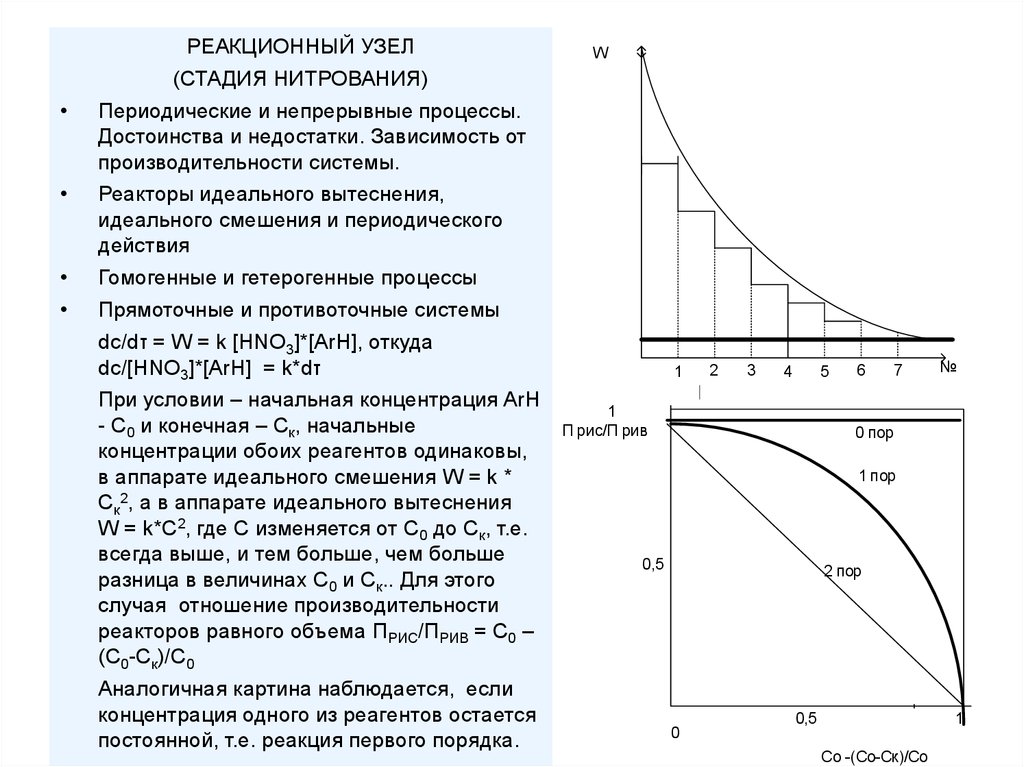
РЕАКЦИОННЫЙ УЗЕЛ(СТАДИЯ НИТРОВАНИЯ)
W
Периодические и непрерывные процессы.
Достоинства и недостатки. Зависимость от
производительности системы.
Реакторы идеального вытеснения,
идеального смешения и периодического
действия
Гомогенные и гетерогенные процессы
Прямоточные и противоточные системы
dc/dτ = W = k [HNO3]*[ArH], откуда
dc/[HNO3]*[ArH] = k*dτ
При условии – начальная концентрация ArH
- С0 и конечная – Ск, начальные
концентрации обоих реагентов одинаковы,
в аппарате идеального смешения W = k *
Cк2, а в аппарате идеального вытеснения
W = k*C2, где С изменяется от С0 до Ск, т.е.
всегда выше, и тем больше, чем больше
разница в величинах С0 и Ск.. Для этого
случая отношение производительности
реакторов равного объема ПРИС/ПРИВ = С0 –
(С0-Ск)/С0
Аналогичная картина наблюдается, если
концентрация одного из реагентов остается
постоянной, т.е. реакция первого порядка.
1
2
3
4
5
1
П рис/П рив
6
7
№
0 пор
1 пор
0,5
2 пор
0,5
1
0
Со -(Со-Ск)/Со
5.
1. Тип реакции нитрованияЭлектрофильное замещение
Радикальный механизм
Ион-радикальный механизм
Нуклеофильное замещение
Щелочное нитрование
Косвенные методы введения
нитрогруппы (окисление
аминогруппы и пр.)
NO2
+
R Cl
.
+
+
NO2+
AgNO2
N2O4
R NO2
+
H+
+
AgCl
NO2
2. Тип реакционного центра.
С-нитрование (необратимое в
R OH
R ONO2
R NH2
R N NO2
H
ароматических соединениях)
N-нитрование (обратимо)
O-нитрование (обратимо)
+
.
NO2
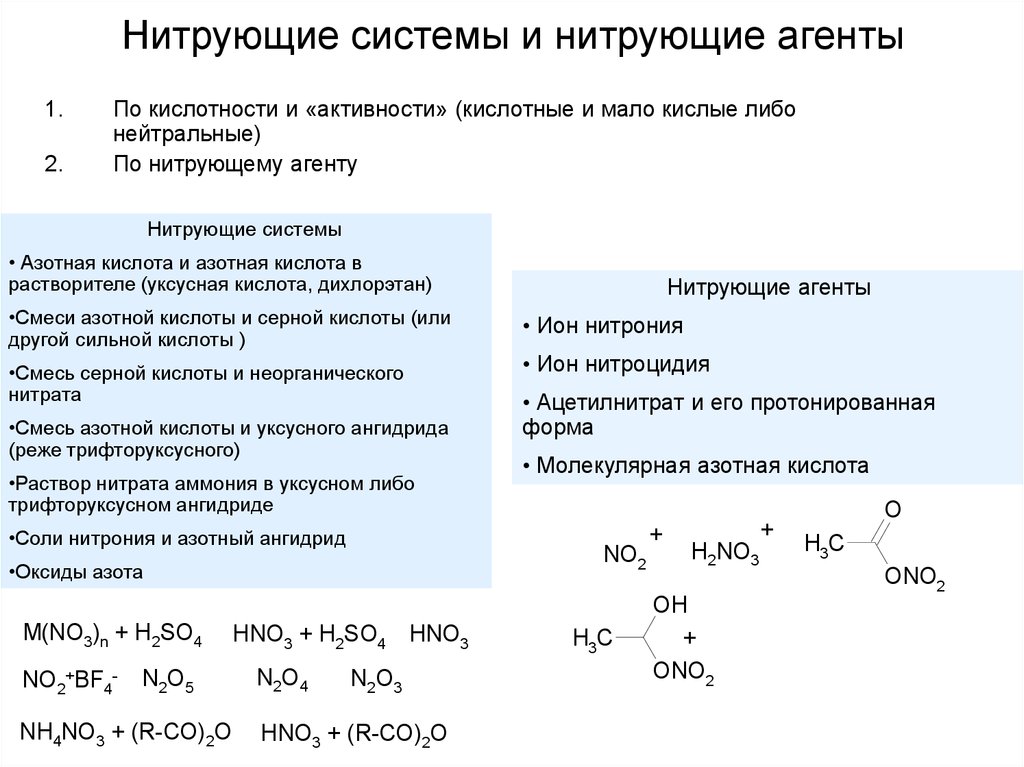
6. Нитрующие системы и нитрующие агенты
1.2.
По кислотности и «активности» (кислотные и мало кислые либо
нейтральные)
По нитрующему агенту
Нитрующие системы
• Азотная кислота и азотная кислота в
растворителе (уксусная кислота, дихлорэтан)
•Смеси азотной кислоты и серной кислоты (или
другой сильной кислоты )
•Смесь серной кислоты и неорганического
нитрата
•Смесь азотной кислоты и уксусного ангидрида
(реже трифторуксусного)
•Раствор нитрата аммония в уксусном либо
трифторуксусном ангидриде
•Соли нитрония и азотный ангидрид
NO2+BF4-
N2O5
NH4NO3 + (R-CO)2O
HNO3 + H2SO4 HNO3
N2O4
• Ион нитрония
• Ион нитроцидия
• Ацетилнитрат и его протонированная
форма
• Молекулярная азотная кислота
NO2
•Оксиды азота
M(NO3)n + H2SO4
Нитрующие агенты
N2O3
HNO3 + (R-CO)2O
H3C
+
+
H2NO3
OH
+
ONO2
O
H3C
ONO2
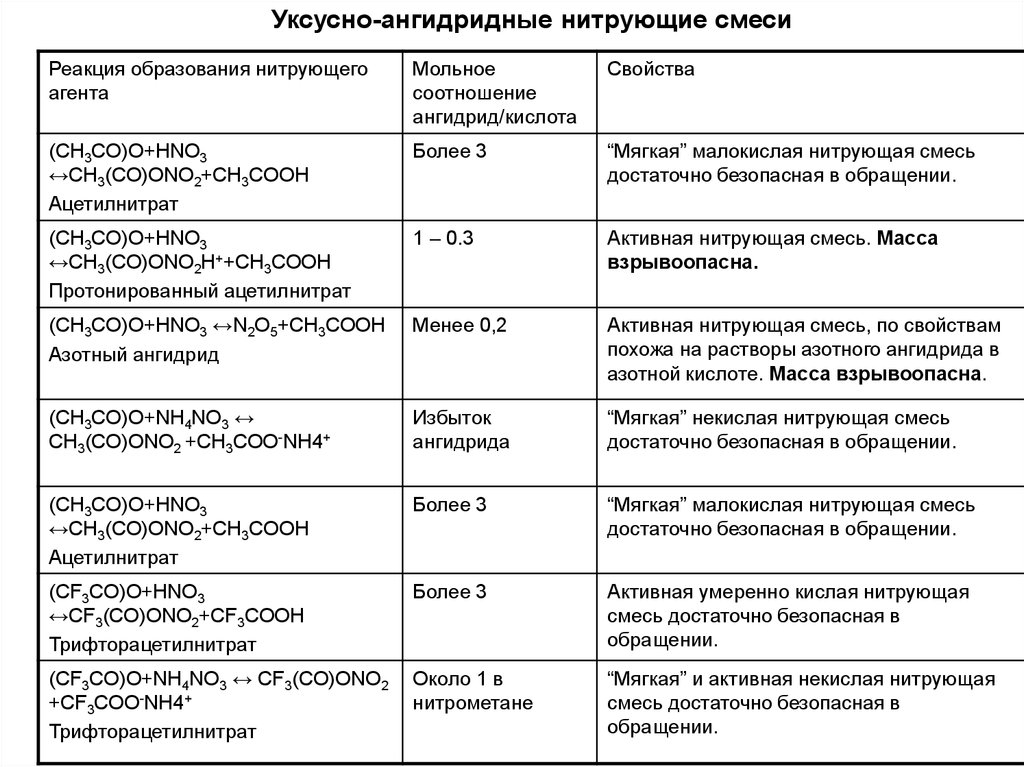
7.
Уксусно-ангидридные нитрующие смесиРеакция образования нитрующего
агента
Мольное
соотношение
ангидрид/кислота
Свойства
(CH3CO)O+HNO3
↔CH3(CO)ONO2+CH3COOH
Ацетилнитрат
Более 3
“Мягкая” малокислая нитрующая смесь
достаточно безопасная в обращении.
(CH3CO)O+HNO3
↔CH3(CO)ONO2H++CH3COOH
Протонированный ацетилнитрат
1 – 0.3
Активная нитрующая смесь. Масса
взрывоопасна.
(CH3CO)O+HNO3 ↔N2O5+CH3COOH
Азотный ангидрид
Менее 0,2
Активная нитрующая смесь, по свойствам
похожа на растворы азотного ангидрида в
азотной кислоте. Масса взрывоопасна.
(CH3CO)O+NH4NO3 ↔
CH3(CO)ONO2 +CH3COO-NH4+
Избыток
ангидрида
“Мягкая” некислая нитрующая смесь
достаточно безопасная в обращении.
(CH3CO)O+HNO3
↔CH3(CO)ONO2+CH3COOH
Ацетилнитрат
Более 3
“Мягкая” малокислая нитрующая смесь
достаточно безопасная в обращении.
(CF3CO)O+HNO3
↔CF3(CO)ONO2+CF3COOH
Трифторацетилнитрат
Более 3
Активная умеренно кислая нитрующая
смесь достаточно безопасная в
обращении.
(CF3CO)O+NH4NO3 ↔ CF3(CO)ONO2
+CF3COO-NH4+
Трифторацетилнитрат
Около 1 в
нитрометане
“Мягкая” и активная некислая нитрующая
смесь достаточно безопасная в
обращении.
8.
Нитрующая активность уксусно-ангидридных смесей на примере циклических мочевин100
80
NO2
N
O
ТНПДМ
выход,%
O2N
N
O
N
O2N
N
NO2
O2N
60
ТНГУ
40
TNPDU
NO2
N
N
N
20
ТНГУ
O
O
N
0
NO2
0
2
4
6
8
10
HNO3 /Ac 2O,моль/моль
H
H
N
N
O
+
NO2
NO2
H
N
N
O
O
O
N
N
N
N
H
H
H
NO2
NO2
H
N
N
+
NO
2
O
O
N
H
NO2
NO2
N
N
O
(CH3CO)2O
+
HNO3
CH3CONO2
+
HNO3
[ CH3CONO2H ]
N
N
NO2
NO2
NO2
HNO3
+
2 HNO3
+
[ CH3CONO2H ]
NO3
N2O5
O
N
+
CH3COOH
CH3COOH
NO2
+
NO3
NO2
+
+
CH3COONO2
+
NO3
(I)
(II)
N2O5
(III)
-
+ 2 NO3 +
H3O
+
(IV)
9. Нитрующие смеси на кислотной основе
Азотная кислота и азотный олеумN2O5 ↔ NO2+ + NO33HNO3 ↔ H3O+ + NO2+ NO3-
Среднекислые активные нитрующие смеси.
Нитрование соединений разлагающихся в
сильнокислой среде. Многие
гетероциклические соединения, синтез
гексогена
Серно-азотные смеси (возможно
использование хлорной кислоты)
HNO3+ 2 Н2SO4 ↔ H3O+ + NO2+ + 2HSO4HNO3+ 2 Н2S2O7 ↔ H3O+ + NO2+ +
2HS2O7-
Высоко-кислотные активные нитрующие смеси.
Нитрование соединений устойчивых в
сильнокислой среде (ароматические и
некоторые гетероциклические)
Нитраты металлов в серной кислоте
NaNO3 + H2SO4 ↔ Na+ + HSO4- + HNO3
HNO3+ 2 Н2SO4 ↔ H3O+ + NO2+ + 2HSO4H2SO4 +H2O ↔H3O+ + HSO4-
Система отличается пониженной кислотностью
и отсутствием оксидов азота. Нитрование
легкоокисляющихся соединений.
HNO3+ P2O5↔ N2O5 + 2HPO3
N2O5 ↔ NO2+ + NO3Азотный ангидрид в полифосфорных
кислотах
Активные нитрующие смеси с низкой
кислотностью. Нитрование соединений
разлагающихся в сильнокислой среде. Многие
гетероциклические соединения.
10. Механизм нитрования
Механизм реакции – совокупность элементарных процессов
Методы изучения: изучение кинетики процессов, физико-химическине (спектральные) и
расчетные методы установления структуры промежуточных соединений и переходных
состояний.
Скорость и порядок химической реакции.
Порядок реакции – сумма стехиометрических коэффициентов в уравнении реакции
n*A + m*B = k* C, W=k*[A]n*[B]m, порядок = n+m
Необратимая реакция первого порядка А →B ; W=d[A]/dt=k*[A] ; [A]=[A0]*e-k*t
Необратимая реакция второго порядка А+B →C ; W=d[A]/dt=k*[A]*[B], в случае [B]»[A],
[B]≈[B0]=const и W=k*[B0]*[A]=k`*[A] где k`=k*[B0]
Молекулярнось реакции – число частиц одновременно участвующих в элементарном акте
взаимодействия.
Механизм ароматического нитрования
Ранее предполагалось присоединение – отщепление азотной кислоты.
O2N
+
HNO3
H
NO2
OH
H
-H2O
11.
В настоящее время общепринятым является механизм электофильного нитрования сучастием иона нитрония NO2+ (А.И. Титов, К. Ингольд …) по которому Нитрование
ароматических соединений проходит через образование π- и σ-комплексов по схеме:
+ NO2+
+
NO2
H
O2N
+
NO2
энергия
1
2
Е
-H+
б
Е
а
Реагенты
В зависимости
от заместителя, лимитирующей стадией могут быть
различные стадии процесса. В настоящее время считается, что для
активированных соединений более медленной стадией является образование
p-комплекса, а для дезактивированных – образование s-комплекса.
В серно-азотных нитрующих смесях с концентрацией серной кислоты выше
70% реакция протекает по уравнению второго порядка:
k1
k2
HNO3 ↔ NO2+ , ArH + NO2+ ↔ продукт
d [ HNO3 ] d [ ArH ] k1 k 2 [ HNO3 ] [ Ar ]
dt
dt
k 1 k r [ Ar ]
Учитывая, что в условиях проведения реакцииk1 k 2
d [ ArH ]
k 2 [ HNO3 ] [ ArH ]
dt
d [ ArH ]
k 2 [ NO2 ] [ ArH ]
dt
Продукты
12. Образование иона нитрония
В безводной кислоте2HNO3 ↔ H2NO3+ + NO3- ↔
↔ H2O + NO2+ + NO3HNO3 + H2O ↔ H3O+ + NO3Σ 3HNO3 ↔ H3O+ + NO2+ + NO3По данным криоскопии
в 95-100% кислоте образуется гидрат
2 HNO3 * H2O
в 95-100% кислоте образуется гидрат
HNO3 * H2O
В более разбавленной кислоте
увеличивается доля реакции
HNO3 + H2O ↔ H3O+ + NO3До 60% азотной кислоты нитрующий
агент – ион нитрония.
В этих растворах в отличии от серной
кислоты существует вода в
молекулярной форме и велика доля
молекулярной азотной кислоты.
HNO3
, моль/л
HNO3%
HNO3 св
моль/л
H2O
своб.
, моль/л
NO2+ моль/л
100
NO3моль/л
0.3
95
22.8
18.7
0
0.0122
0.06
90
21.3
12.3
0
5.09E-04
0.19
85
19.8
8.25
0.82
8.26E-06
0.43
80
18.5
3.94
1.18
2.67E-07
0.74
75
17.1
1.88
1
1.19E-08
1.11
71
9.27E-10
64
2.17E-11
60
4.70E-12
2
0
-2
log [C], моль/л
• В азотной кислоте
-4
-6
log[HNO3 своб], моль/л
-8
log[H2O своб.], моль/л
log[NO2+] моль/л
-10
log[NO3-], моль/л
-12
-14
60
70
80
Азотная кислота %
90
100
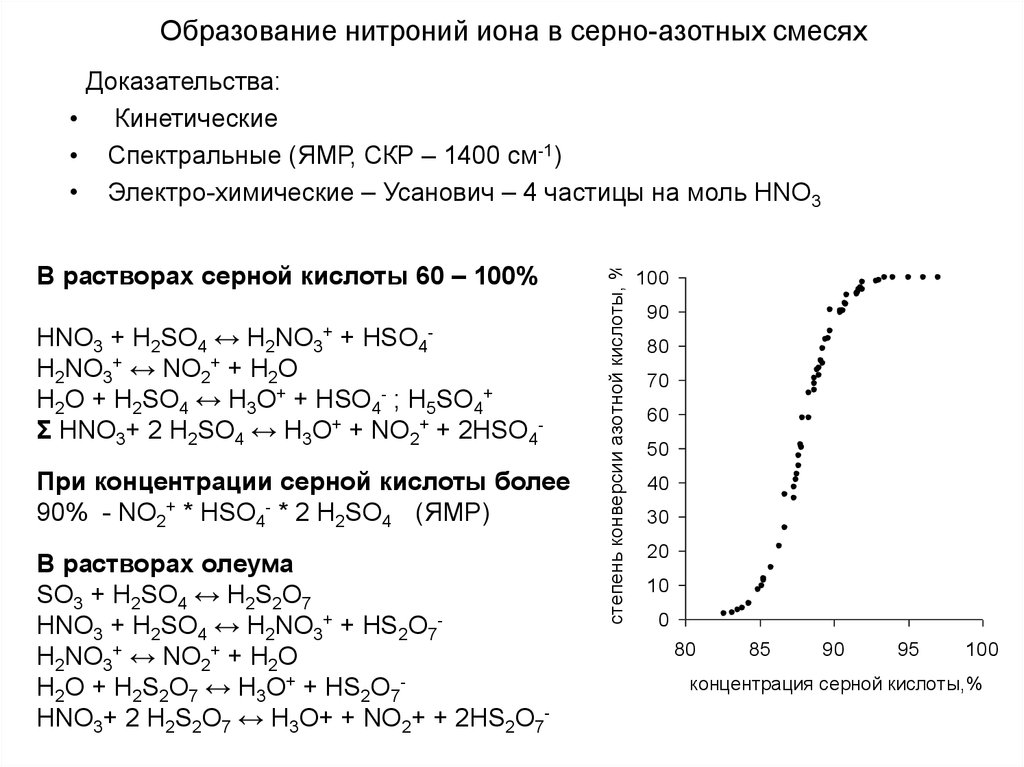
13. Образование нитроний иона в серно-азотных смесях
В растворах серной кислоты 60 – 100%HNO3 + Н2SO4 ↔ H2NO3 + HSO4
H2NO3+ ↔ NO2+ + H2O
H2O + H2SO4 ↔ H3O+ + HSO4- ; H5SO4+
Σ HNO3+ 2 Н2SO4 ↔ H3O+ + NO2+ + 2HSO4+
-
При концентрации серной кислоты более
90% - NO2+ * HSO4- * 2 H2SO4 (ЯМР)
В растворах олеума
SO3 + H2SO4 ↔ H2S2O7
HNO3 + Н2SO4 ↔ H2NO3+ + HS2O7H2NO3+ ↔ NO2+ + H2O
H2O + H2S2O7 ↔ H3O+ + HS2O7HNO3+ 2 Н2S2O7 ↔ H3O+ + NO2+ + 2HS2O7-
степень конверсии азотной кислоты, %
Доказательства:
• Кинетические
• Спектральные (ЯМР, СКР – 1400 см-1)
• Электро-химические – Усанович – 4 частицы на моль HNO3
100
90
80
70
60
50
40
30
20
10
0
80
85
90
95
100
концентрация серной кислоты,%
14. Лекция 2
15.
ДЗависимость т.. пл. азотной кислоты от концентрации
А - -42,3°С, 33%; Б - -42°С, 70%;
Е
А
С - -66,2°С, 90%; Д -18,5°С, 54%; Е -41,2°С,
Б
Е
С
40
20
40
60
80
100
20
Г
Б
Зависимость т. пл. серной кислоты
в зависимости от концентрации
А - <-40°C, 30-75%; Б - +8°С, 83%; В - -33,8°С,
0
Ж
Д
-20
92,5%; Г – +10°С, 100%, Д – 12,2°С,
103,6%; Е - +35°С, 109%; Ж - +0,8°С; 114%
В
-40
А
-60
-60
70
80
90
100
100
104
108
112
114
16.
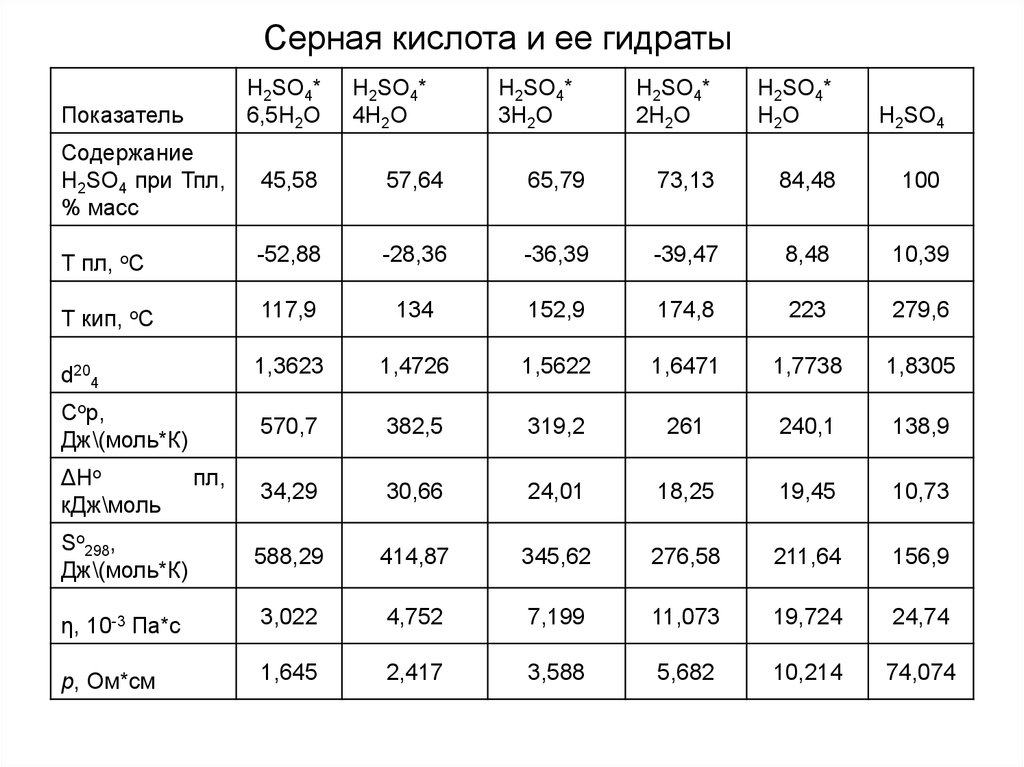
Серная кислота и ее гидратыH2SO4*
6,5H2O
Показатель
H2SO4*
4H2O
H2SO4*
3H2O
H2SO4*
2H2O
H2SO4*
H2O
H2SO4
Содержание
H2SO4 при Тпл,
% масс
45,58
57,64
65,79
73,13
84,48
100
Т пл, oС
-52,88
-28,36
-36,39
-39,47
8,48
10,39
Т кип, oС
117,9
134
152,9
174,8
223
279,6
d204
1,3623
1,4726
1,5622
1,6471
1,7738
1,8305
Сop,
Дж\(моль*К)
570,7
382,5
319,2
261
240,1
138,9
34,29
30,66
24,01
18,25
19,45
10,73
So298,
Дж\(моль*К)
588,29
414,87
345,62
276,58
211,64
156,9
η, 10-3 Па*с
3,022
4,752
7,199
11,073
19,724
24,74
p, Ом*см
1,645
2,417
3,588
5,682
10,214
74,074
ΔHo
кДж\моль
пл,
17.
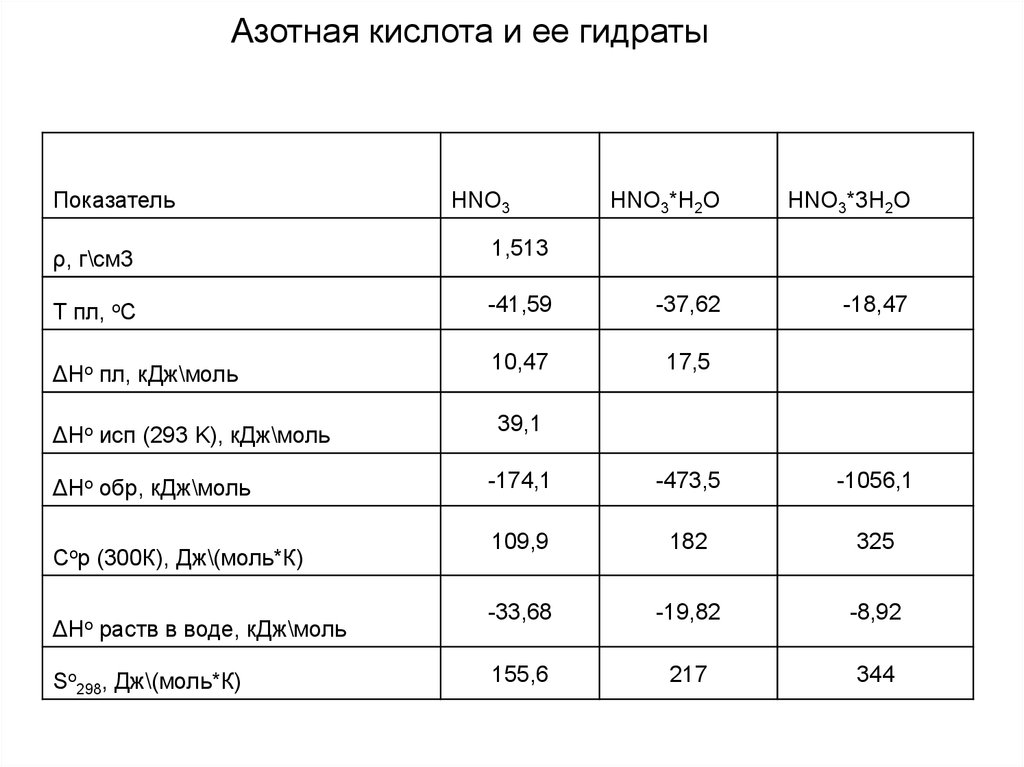
Азотная кислота и ее гидратыПоказатель
HNO3
HNO3*H2O
HNO3*3H2O
-18,47
ρ, г\см3
1,513
Т пл, oС
-41,59
-37,62
ΔHo пл, кДж\моль
10,47
17,5
ΔHo исп (293 K), кДж\моль
39,1
ΔHo обр, кДж\моль
Сop (300К), Дж\(моль*К)
ΔHo раств в воде, кДж\моль
So298, Дж\(моль*К)
-174,1
-473,5
-1056,1
109,9
182
325
-33,68
-19,82
-8,92
155,6
217
344
18. Ионно-молекулярный состав серной кислоты
Концентроция компонента, моль/лИонно-молекулярный состав серной кислоты
H3O+
45
Состав изучен методам СКР
С привлечением факторного
анализа
Н5O2+
40
(SO4)2-
35
HSO4-
30
H2SO4
25
(H3O * H2SO4)+
20
15
H2SO4 aq ↔ HSO4- + H+ aq
HSO4- aq ↔ SO42- + H+ aq
10
5
0
0
5
10
15
серная кислота, моль/л
20
H2SO4 + 2H2O ↔ H3O+ * H2O * HSO4H3O+ * H2O * HSO4- + H2O ↔ H+ aq + HSO4- aq
HSO4- aq + H2O ↔ H+ aq + SO22- aq
19. Функции кислотности
Теория Бренстеда – Лоури.
Согласно теории Бренстеда – Лоури кислота рассматривается как вещество, поставляющее
протон, а основание – как вещество, способное присоединять протон.
А ↔ В + Н+
кислота основание
Кислота и отвечающее ей основание образуют сопряженную пару.
Ключевым в теории Бренстеда – Лоури является представление о том, что кислота
взаимодействует при переносе протона с другой сопряженной парой (двойное
протолитическое равновесие):
А1 + В2 ↔ А2 + В1
Можно представить, что двойное протолитическое равновесие является результатом двух
сопряженных равновесий:
НА ↔ Н+ + АВ + Н+ ↔ ВН+
Это уравнение можно считать адекватным процессам, проходящим в газовой фазе
В растворах сначала кислота АН и основание В образуют комплекс АН…В за счет
водородной связи, такой процесс называется “незавершенным” кислотно-основным
равновесием. Далее происходит передача протона от кислоты к основанию. Эта вторая
стадия протолитического процесса называется “завершенным” кислотно-основным
взаимодействием. При этом, образовавшиеся ионы могут находиться в растворе либо в
свободном виде, либо в виде ионных пар.
ВН+А- ↔ ВН+ А- ↔ ВН+ + АРазличают - тесные ионные пары, сольватно – разделенные ионные пары и свободные
ионы.
Более полным отражением кислотно – основного процесса является следующая схема:
а
б
в
+
АН + В ↔ АН…В ↔ А …ВН ↔ А- + ВН+
здесь а – незавершенное кислотно-основное равновесие, б – завершенное и в –
диссоциация на свободные ионы.
20. Физический смысл и меры основности в газовой фазе
Основностью в газовой фазе называют свободную энергию ( ΔG ) равновесия
В + Н+ ↔ ВН+ . Как известно Δ G= Δ Но -Т Δ S. Измерения энтропии равновесия
в газовой фазе показали, что это величина обычно не превышает 9 – 12
Дж/(моль* К). Таким образом изменение энтальпии равновесия (Δ Но) считается
равным Δ Gо.
Изменение энтальпии равновесия переноса протона в газовой фазе, взятое с
обратным знаком, называется сродством к протону и обозначается РА ( Proton
Affinity). Численное значение РА определяется из соотношения:
РА = - Δ НО = Δ НО(Н+) + Δ НО(В) - Δ НО(ВН+)
Где Δ НО(Н+) – энтальпия образования иона Н+; Δ НО(В) и Δ НО(ВН+) – энтальпия
образования основания (В) и его протонированной формы (ВН+)
соответственно.
Ионы в газовой фазе не стабильны. Раз образовавшись, они быстро гибнут в
результате рекомбинации с ионами противоположного знака В жидкой среде
ионы стабилизируются за счет сольватации, энергия которой может превысить
энергию образования иона из молекулы. В этом случае можно ожидать
инверсии основности при сопоставлении данных в газовой фазе и в растворе
21.
Протонирование слабых органических оснований в
водных растворах кислот.
Протонирование многих слабых органических оснований происходит в
достаточно концентрированной серной кислоте, хлорной и фторсульфоновой
кислотах. Очень слабые основания протонируются в олеуме или в так
называемых суперкислотах (смеси HSO3F – SbF5, HF - SbF5 и другие подобные
системы). Для описания процессов протонирования в этих системах,
необходимо учитывать влияние процессов сольватации основания и его
протонированной формы. Также важно учитывать роль сольватирования
“переносимого” протона.
Под сольватацией понимают взаимодействие частиц растворенного вещества и
растворителя.
G O Еисп Еион дип Едисп Еотт Е 'ион дип Ев.с. Ео
где Еисп-теплота испарения молекул воды; Еион-дип , Едисп и Еотт – энергии
электростатического (кулоновского), дисперсионного взаимодействий и энергии
отталкивания между ионом и молекулами воды при образовании гидратного
комплекса; Е’ион-дип - энергия взаимодействия иона с диполями воды вне
первичного сольватного комплекса; Ев.с – энергия образования водородной
связи между молекулами воды, находящимися в растворе, когда комплекс
(например, ВН+ * nН2О) из газовой фазы переходит в раствор; Ео –
характеризует неэлектрический вклад в общую энергию сольватации.
22.
В зависимости от концентрации минеральной кислоты, характер специфической
сольватации непрерывно меняется. Избыточные протоны, имеющиеся в водных
растворах минеральных кислот, не закреплены за определенными молекулами
воды с которыми они образуют ионы Н3О+, а постоянно перемещаются от одной
молекулы к другой, что обуславливает чрезвычайно низкое время жизни (10-13с)
индивидуального иона Н3О+ (протонный газ). Это время значительно меньше,
чем средняя продолжительность жизни гидрата В…Н2О. На этом основании
возникло представление о “протонном газе” в водных растворах кислот.
с увеличением концентрации кислоты все более заметным становится процесс
частичной дегидратации комплексов (В…Н+.nН2О)
В*bН2О + Н+*хН2О ↔ В…Н+*nН2О + (b+x – n)Н2О
В…Н+*nН2О ↔ В…Н+*(n-1)Н2О + Н2О
В…Н+*(n-1)Н2О ↔ В…Н+*(n-2)Н2О + Н2О
В…Н+.Н2О ↔ ВН+ + Н2О
Суммарно
В…Н+*nН2О ↔ В…Н+*mН2О + (n-m)Н2О
Таким образом основание (В) в процессе протонирования получает протон не из
среды, как это предусмотрено схемой Бренстеда, а путем последовательной
дегидратации комплексов основания с гидратированным протоном.
23.
Гаммет и Дейруп: серия органических соединений, обладающие максимально сходной молекулярной
структурой, так называемых кислотно-основных индикаторов.
Протонирование всех членов ряда сопровождалось идентичным характером делокализации
положительного заряда в ионе ВН+. Ииндикаторы были выбраны -замещенные анилины. Для nнитроанилин – в воде величина рК ВН+ :
К In1H
H f In1 CIn1
f In1 H CIn1 H
где КIn H+ - константа основности ; fIn , f In H+ - коэффициенты активности; CIn и C In H+ - концентрация
индикатора и его протонированной. Значение константы основности n-нитроанилина (pK In H+ =1,0)
может быть определено с помощью шкалы рН по уравнению:
pK BH pH lg
CBH
CB
0,505
где m - ионная сила раствора.
Допущение: отношение fIn /f In H+ в уравнение не зависит от строения индикатора и единственным
показателем кислотности среды является величина h0=αH+* f In/f In H+. Величина Н0=-lg h0. получила
название "функция кислотности Гаммета". Затем измеряли значения ионизационных отношений
I=[BH+]/[B] для n-нитроанилина и о-нитроанилина в растворах серной кислоты одной и той же
концентрации. При этой в соответствии с постулатом Гаммета f Iо * f Ip H+ / fIp* f Io H+ =1, где fIo и f Io H+
- кэффициент активности о-нитроанилина и его протонированной формы.
Н0 = pK I H+ - lg I.
Распространив "методику перекрывания" вплоть до концентрированной серной кислоты, авторы
вычислили значения функции кислотности Н0 для интервала 5-100 масс. % H2SO4. Стандартным
состоянием для шкалы Н0 является бесконечно разбавленный водный раствор. Учитывая это, шкалу
Н0 формально можно рассматривать как продолжение шкалы рН в область концентрированных
растворов кислот.
24.
21.E+11
H3O+
1.E+10
Н5O2+
1.E+09
0
0
кислотность h o
5
10
15
Активность
воды
1.E+07
-2
1.E+06
1.E+05
Значение
Концентроция компонента, моль/л
1.E+08
1.E+04
1.E+03
1.E+02
-4
-6
1.E+01
log акт воды
1.E+00
1.E-01
0
5
10
15
20
-8
Ho
1.E-02
-10
1.E-03
1.E-04
1.E-05
-12
1.E-06
Серная кислота, моль/л
серная кислота, моль/л
20
25.
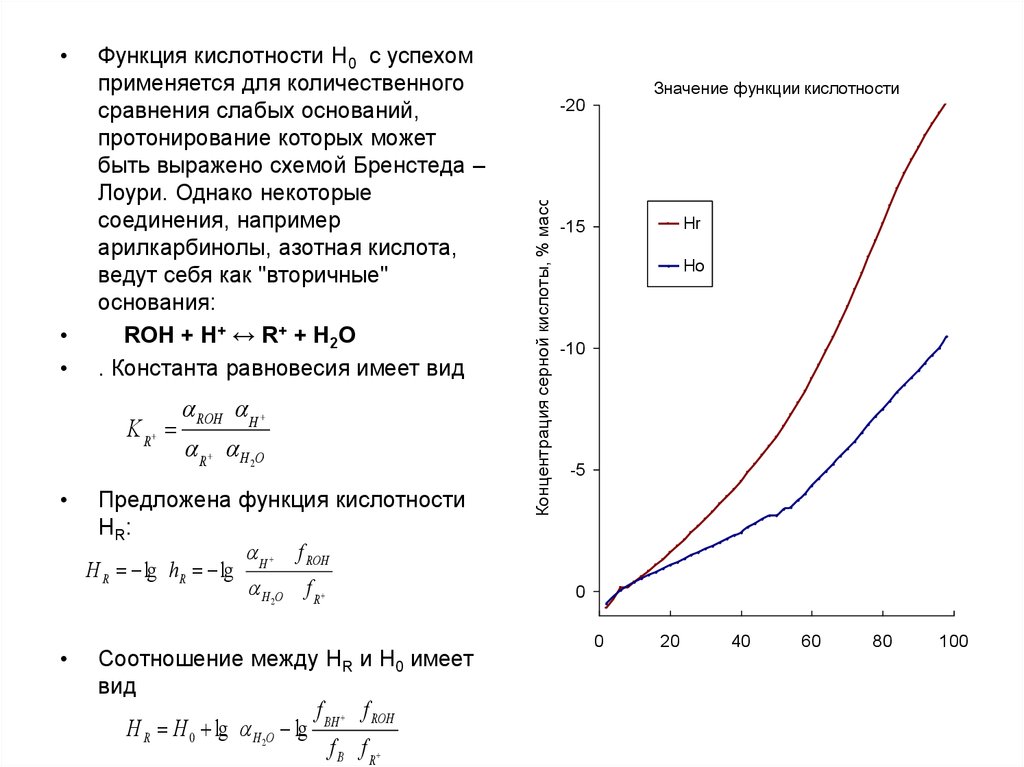
Функция кислотности Н0 с успехом
применяется для количественного
сравнения слабых оснований,
протонирование которых может
быть выражено схемой Бренстеда –
Лоури. Однако некоторые
соединения, например
арилкарбинолы, азотная кислота,
ведут себя как "вторичные"
основания:
ROH + H+ ↔ R+ + H2O
. Константа равновесия имеет вид
K R
ROH H
R H 2O
Предложена функция кислотности
HR:
f ROH
H R lg hR lg H
H 2O f R
Соотношение между НR и Н0 имеет
вид
H R H 0 lg H 2O lg
f BH f ROH
f B f R
Значение функции кислотности
-20
Концентрация серной кислоты, % масс.
Hr
-15
Ho
-10
-5
0
0
20
40
60
80
100
26.
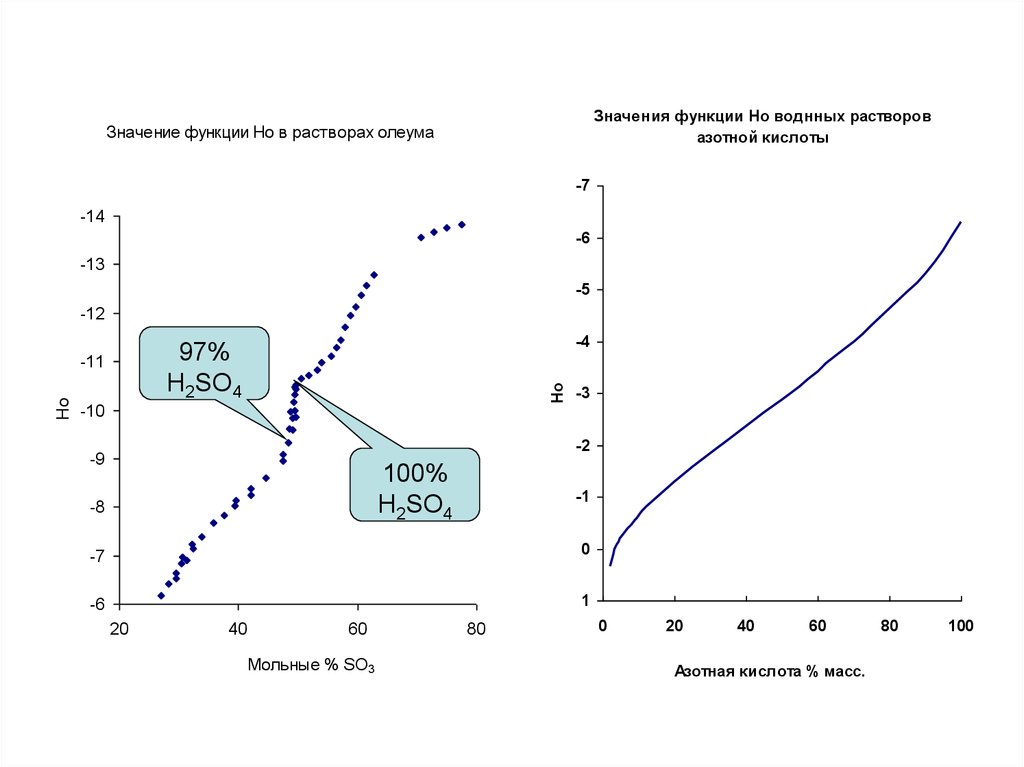
Значения функции Но воднных растворовазотной кислоты
Значение функции Ho в растворах олеума
-7
-14
-6
-13
-5
-12
-10
Ho
Ho
-4
97%
H2SO4
-11
-3
-2
-9
100%
H2SO4
-8
-1
-7
0
-6
1
20
40
60
Мольные % SO3
80
0
20
40
60
Азотная кислота % масс.
80
100
27.
Кроме функций Нo и Hr существуют функции построенные на других
рядах индикаторов: амидах (Ha), индолах и пр.
Марциано с соавторами была предложена универсальная функция Mc
построенная на индикаторах различной природы.
Экспериментальное определение функций кислотности построено на
определение ионизационного отношения I спектральными методами.
Метод Эйтса – МакКлеланда - Нх = m*Н0
Lg I = - mH0 + pK BH+
dHx/dH0
H2SO4
HClO4
HNO3
HCl
dHR/dH0
dHI/dH0
dH0'''/dH0
dHA/dH0
2,0
1,3
1,3
0,6
2,1
1,5
1,35
0,6
2,3
1,3
-
2,0
1,3
0,8
28.
Образование иона нитрония в растворах азотной кислоты в водной серной кислоте.2.5
2
1.5
NO2 aw
K;
HNO3 H
1
NO2
H
K
HNO3
aw
log I
0.5
0
-19.5
-19
-18.5
-18
-17.5
-17
-16.5
-16
-15.5
-0.5
log( I ) pK ( Hr log( aw ))
-1
y = -1.27x - 22.40
R2 = 0.99
2.5
-1.5
2
-2
-2.5
y = 0.86x - 18.02
R2 = 0.99
1.5
Hr
1
lg
HNO3 H
NO2 a w
lg
0.5
log(I)
HNO3+ 2 Н2SO4 ↔ H3O+ + NO2+ + 2HSO4где Hr и Mc функции кислотности
Log(I)=[NO2+]/[HNO3]
aw – активность воды
0
18
19
20
21
-0.5
-1
-1.5
16 0,98M C
NO 2
22,4 1,27 H r
HNO3
-2
-2.5
-(Hr+log(aводы))
22
23
24
29.
Распределение азотной кислоты между дихлорэтаном иводной серной кислотой
Содержание иона нитрония смеси безводных серной и
азотной кислот
100
10
9
[NO2+]
7
1
70
75
80
85
90
95
6
5
4
3
100
2
1
0
0,1
0
Серная кислота % масс
0.2
0.4
0.6
Мольная доля серной кислоты
Кислотность смеси безводных серной и азотной
кислот
-6
0
0.2
0.4
0.6
0.8
-7
-8
Но
Коэфф. распр.
8
10
-9
-10
-11
-12
Мольная доля серной кислоты
1
0.8
1
30.
• Лекция 331.
32.
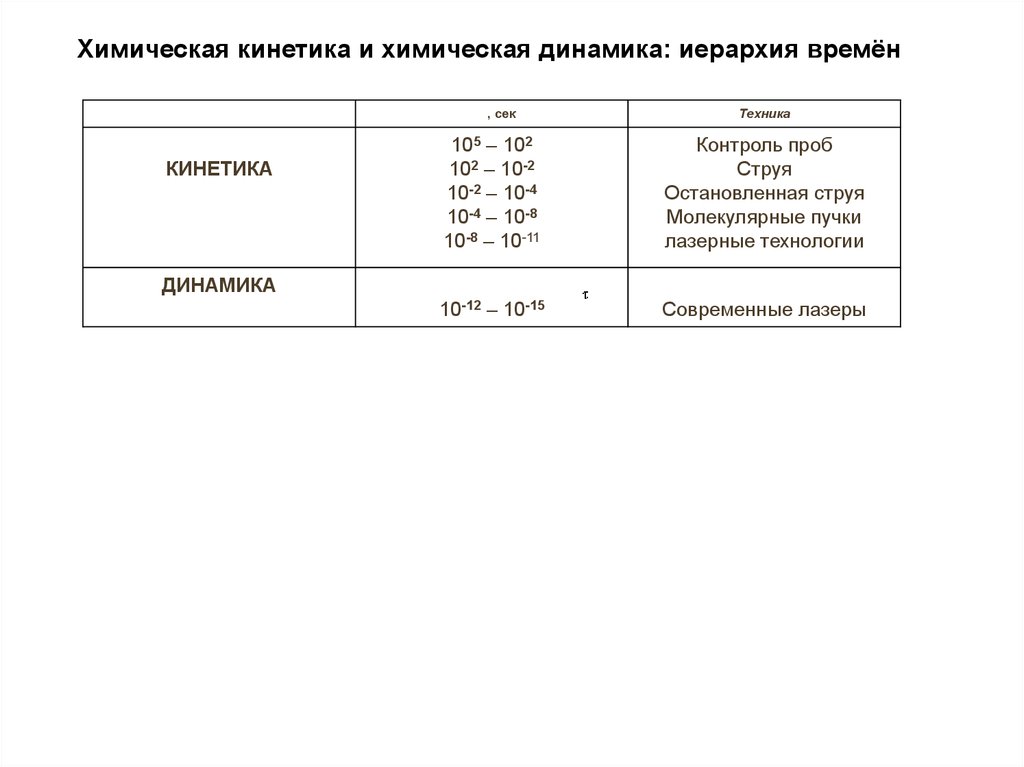
Химическая кинетика и химическая динамика: иерархия времён, сек
КИНЕТИКА
Техника
105 – 102
102 – 10-2
10-2 – 10-4
10-4 – 10-8
10-8 – 10-11
Контроль проб
Струя
Остановленная струя
Молекулярные пучки
лазерные технологии
10-12 – 10-15
Современные лазеры
ДИНАМИКА
33.
0.00250
0.003
0.0035
зависимость Еакт от конц аз. кислоты
80
-1
-2
70
-3
100%средняя
ln(k)
77,90% по НТО
Разложение по средним
-4
Mezitilene
Еакт
89.2 % по НТО
p-Xylene
60
Toluene
Смесь №1
Benzene
Смесь №2
Смесь №3
Разложение в смеси №3
-5
50
-6
40
-7
40
50
60
70
% азотной к-ты
-8
1/T, 1/K
Смесь №1
Смесь №2
Смесь №3
54,53% HNO3, 20,31% H2SO4, 25,16% H2O
3,6% HNO3, 67,47% H2SO4, 28,93% H2O
3,2% HNO3, 89,05% H2SO4, 7,75% H2O
80
34.
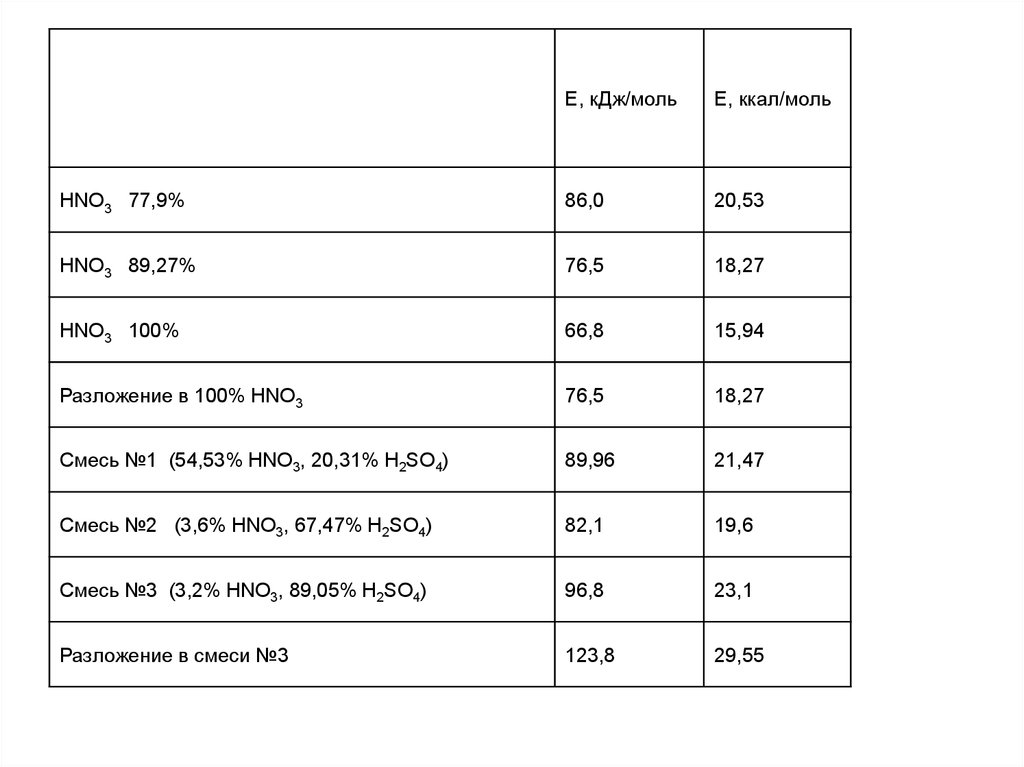
Е, кДж/мольЕ, ккал/моль
HNO3 77,9%
86,0
20,53
HNO3 89,27%
76,5
18,27
HNO3 100%
66,8
15,94
Разложение в 100% HNO3
76,5
18,27
Смесь №1 (54,53% HNO3, 20,31% H2SO4)
89,96
21,47
Смесь №2 (3,6% HNO3, 67,47% H2SO4)
82,1
19,6
Смесь №3 (3,2% HNO3, 89,05% H2SO4)
96,8
23,1
Разложение в смеси №3
123,8
29,55
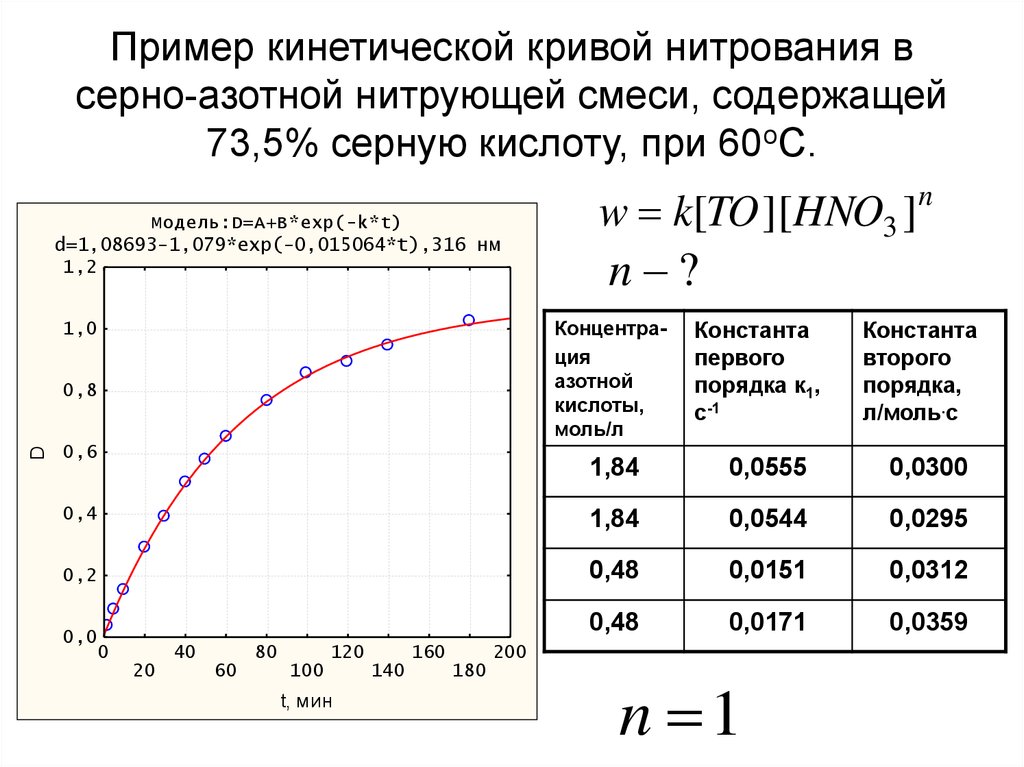
35. Пример кинетической кривой нитрования в серно-азотной нитрующей смеси, содержащей 73,5% серную кислоту, при 60оС.
Модель:D=A+B*exp(-k*t)d=1,08693-1,079*exp(-0,015064*t),316 нм
1,2
n ?
Концентрация
азотной
кислоты,
моль/л
1,0
0,8
D
w k[TO ][HNO3 ]n
0,6
Константа
первого
порядка к1,
c-1
Константа
второго
порядка,
л/моль.с
1,84
0,0555
0,0300
0,4
1,84
0,0544
0,0295
0,2
0,48
0,0151
0,0312
0,48
0,0171
0,0359
0,0
0
40
20
80
60
120
100
t, мин
160
140
200
180
n 1
36.
OH2N
O
N
H
O
+NO2+ k1
H2N
NH2
O
N
H
NO2
+H+ k-2
NO2
O
N
H
NH
NO2
Нитрование биурета и
нитробиурета в 85%H2SO4.
Нитрование биурета и
нитробиурета в 94%H2SO4
100
100
90
80
70
60
50
40
30
20
10
0
90
степень превращения, %
Степень превращения ,%
HN
NH
+H+ k-1
O
+NO2+ k2
80
70
60
50
40
30
20
10
0
0
0,5
1
1,5
2
2,5
Концентрация HNO3, моль/л
НБ, моль/л
ДНБ из НБ
ДНБ, моль/л
НБ из НБ
Сумма
Сумма из НБ
3
0
0,5
1
1,5
2
2,5
концентрация HNO3 моль/л
НБ, моль/л
Сумма
НБ из НБ
ДНБ, моль/л
ДНБ из НБ
Сумма из НБ
3
37. 7.6.Схема нитрования биурета
OH2N
O
N
H
H2N
NH2
+H+
[ NO2 ] I HNO3
[ HNO3 ]
O
O
N
H
k-1
[ НБ ] [ Н ]
К1
[ Б ] [ NO2 ]
I HNO3
O
+NO2+ k1
+NO2+ k2
HN
NH
NO2
+H+ k-2
[ ДНБ ] [ Н ]
К2
[ НБ ] [ NO2 ]
( I HNO3 1)
[ NO2 ]
- степень ионизации HNO3
[ HNO3 ]
Lg I = -1.27∙ HR – pKa HNO3
HR- функция кислотности
H0- функция кислотности
O
NO2
N
H
NH
NO2
38. Примеры обработки кинетических данных по уравнению для последовательных реакций
Модель:C=(k1*Co/(k2-k1))*(exp(-k1*T)-exp(-k2*T))c=((,018647)*(,020383)/((,875e-3)-(,018647)))*(exp(-(,018647)*t)-exp(-(,875e-3)
*t))
0.020
Примеры обработки
кинетических данных по
уравнению для
последовательных
реакций
20
0.018
0.016
0.014
C
0.012
0.010
0.008
0.006
k c
c 1 0 exp( k1 t ) exp( k 2 t )
k 2 k1
0.004
80 %
0.002
0.000
0
50
100
150
200
250
300
350
400
T
Модель:C=(k1*0,02210/(k2-k1))*(exp(-k1*T)-exp(-k2*T))
c=((,002486)*0,02210/((,010559)-(,002486)))*(exp(-(,002486)*t)-exp(-(,010559)*t
))
Модель:C=(k1*0,02117/(k2-k1))*(exp(-k1*T)-exp(-k2*T))
c=((,013881)*0,02117/((,004006)-(,013881)))*(exp(-(,013881)*t)-exp(-(,004006)*t
))
0.014
0.0040
0.012
0.0035
0.0030
0.010
0.0025
C
C
0.008
0.0020
0.006
0.0015
0.004
0.0010
85 %
0.002
93 %
0.0005
0.0000
0.000
0
50
100
150
T
200
250
300
0
50
100
150
200
T
250
300
350
400
39.
6Толуол в серноазотной смеси
4
2
log(k)
Бензол в серноазотной смеси
0
Бензол в азотной
кислоте
-2
Толуол в азотной
кислоте
-4
-6
0
2
4
6
Ho
8
10
40.
Зависимость константы скорости нитрования бензойной кислотыот концентрации серной кислоты
70
75
80
85
90
95
100
Зависимость константы скорости нитрования бензойной
кислоты от -Но
105
110
6
2
8
10
12
14
2
1
log (k эффективной)
0
-1
-2
0
-1
-2
-3
-3
-4
-4
Концентрация серной кислоты % масс
-Но
Log константы по нтронию БК
По нитронию 2-фторбензойная кислота
3
2.5
2
2
1.5
1
0.5
log(k)
NO2+)
1
log(k
log ( k эффективной)
1
0
-0.5 75
80
85
90
95
100
0
6
7
8
9
10
-1
105
-2
-1
-1.5
-3
-2
-4
-2.5
Ho
% серной кислоты
11
12
13
14
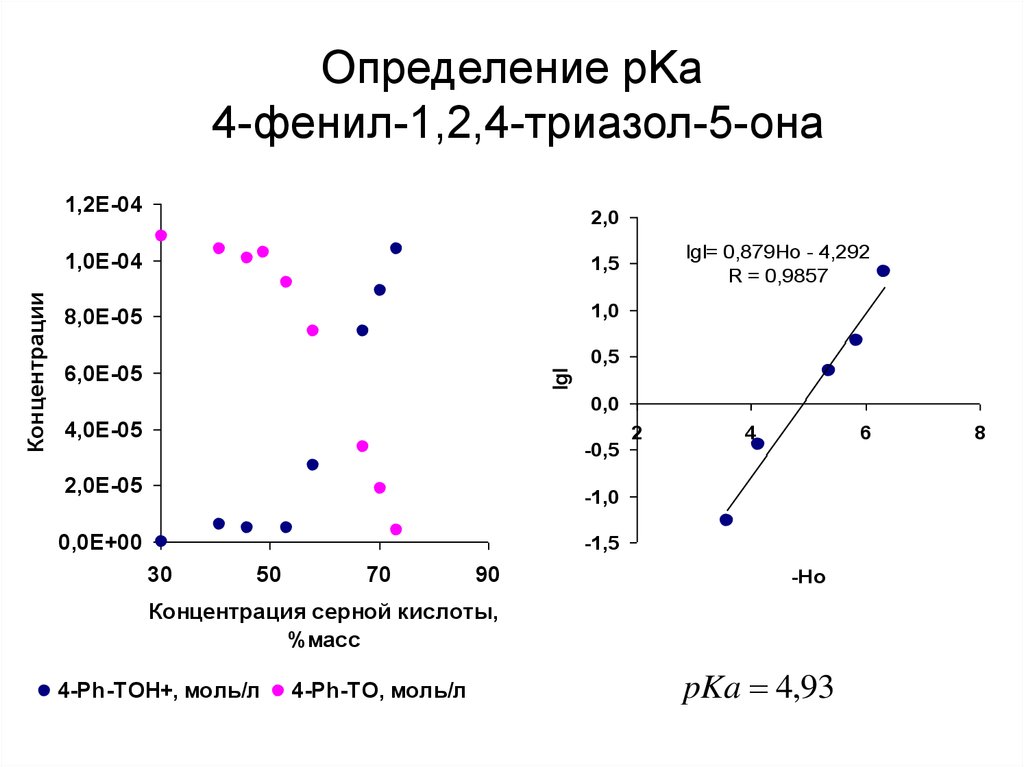
41. Определение pKa 4-фенил-1,2,4-триазол-5-она
2,01,0E-04
1,5
8,0E-05
1,0
lgI= 0,879Ho - 4,292
R = 0,9857
0,5
6,0E-05
lgI
Концентрации
1,2E-04
0,0
4,0E-05
-0,5
2,0E-05
2
4
6
-1,0
0,0E+00
-1,5
30
50
70
90
-Ho
Концентрация серной кислоты,
%масс
4-Ph-ТОН+, моль/л
4-Ph-ТО, моль/л
pKa 4,93
8
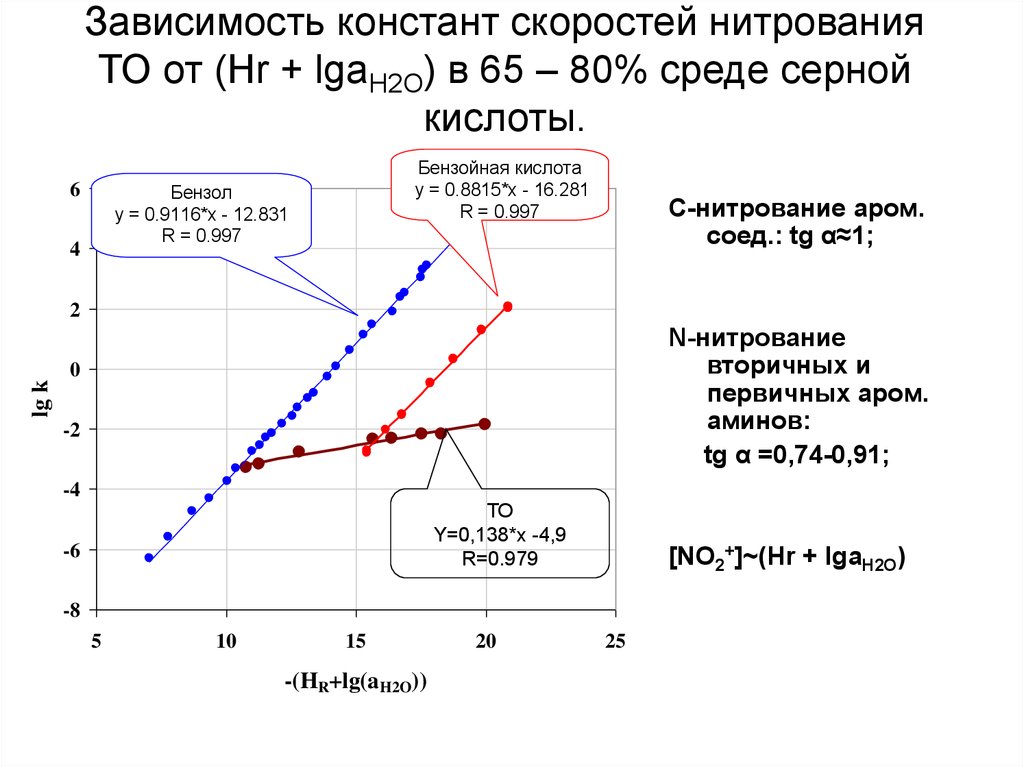
42. Зависимость констант скоростей нитрования ТО от (Hr + lgaH2O) в 65 – 80% среде серной кислоты.
6Бензойная кислота
y = 0.8815*x - 16.281
R = 0.997
Бензол
y = 0.9116*x - 12.831
R = 0.997
4
C-нитрование аром.
соед.: tg α≈1;
lg k
2
N-нитрование
вторичных и
первичных аром.
aминов:
tg α =0,74-0,91;
0
-2
-4
ТО
Y=0,138*x -4,9
R=0.979
-6
[NO2+]~(Hr + lgaH2O)
-8
5
10
15
-(HR+lg(aH2O))
20
25
43.
Константа скорости нитрования ДНТ1
0.03
0.9
0.025
y = -0.092x + 1.0401
R2 = 0.9884
y = -0.0831x + 0.9864
R2 = 0.9825
0.8
y = -0.0803x + 1.0042
R2 = 0.9702
0.7
"коэффициент активности" нитрония
К2
0.02
0.015
0.01
0.6
0.5
отношение рхлорнитробензол
0.4
отношение Нитробензол
отношение
Метилфенилсульфон
0.3
y = -0.0959x + 1.1227
R2 = 0.9786
отношение ДНТ
0.005
0.2
0.1
0
85
90
95
Серная %
100
0
0
1
2
3
4
5
6
растояние от максимума, %
7
8
9
10
44.
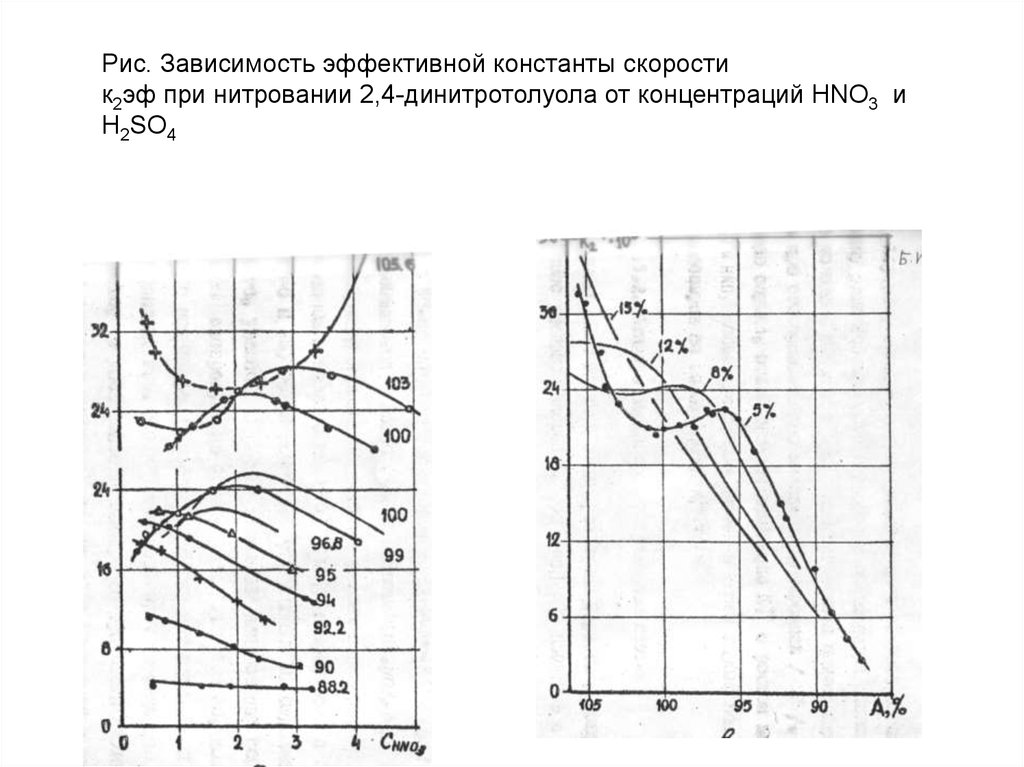
Рис. Зависимость эффективной константы скоростик2эф при нитровании 2,4-динитротолуола от концентраций HNO3 и
H2SO4
45.
24A
A*
Содержание о-НБК
20
16
B
B*
12
8
C
4
70
80
90
100
Концентрация серной кислоты %, масс.
110
46.
ТЕПЛОВЫЕ ЭФФЕКТЫ ПРИ НИТРОВАНИИТепловой баланс.
Q приход = Q1 + Q2 + Q3
Приход
Q1 -Теплосодержание приходящих компонентов
Q2 - Теплота химических реакций
Q3 - Теплота разбавления кислот
Qрасход = Q4 + Q5 + Q6
Расход
Q4 – теплосодержание продуктов реакции
Q5 - теплопотери в окружающую среду
Q6 - теплота отведенная теплоносителем
Тепловой эффект введения одной нитрогруппы в ароматическое ядро 18 – 25 ккал/моль
Тепловой эффект разбавления кислот по Плановскому
Теплота исчерпывающего разбавления для исходной кислоты отработанной кислоты.
Для азотной кислоты
312 h
QN = 111 - ---------------98,5 + N
Для серной кислоты
324 h
QS = 183 - -----------49 + S
Для серно-азотных кислотных смесей
a
QSN = -------- ккал/кг,
1 – bx
где h – содержание воды в смеси, %
N - содержание азотной кислоты,%
S - содержание серной кислоты,%
a = QN; b = 1 –(a/QS), x = S/(S+N)
47.
• Суммарный тепловой эффектнитрования при получении
• мононитротолуола ~ 123 кДж/мол (29
ккал/моль)
• динитротолуола ~ 139 кДж/моль (33
ккал/моль)
• тринитротолуола ~ 105 кДж/моль (25
ккал/моль)
48.
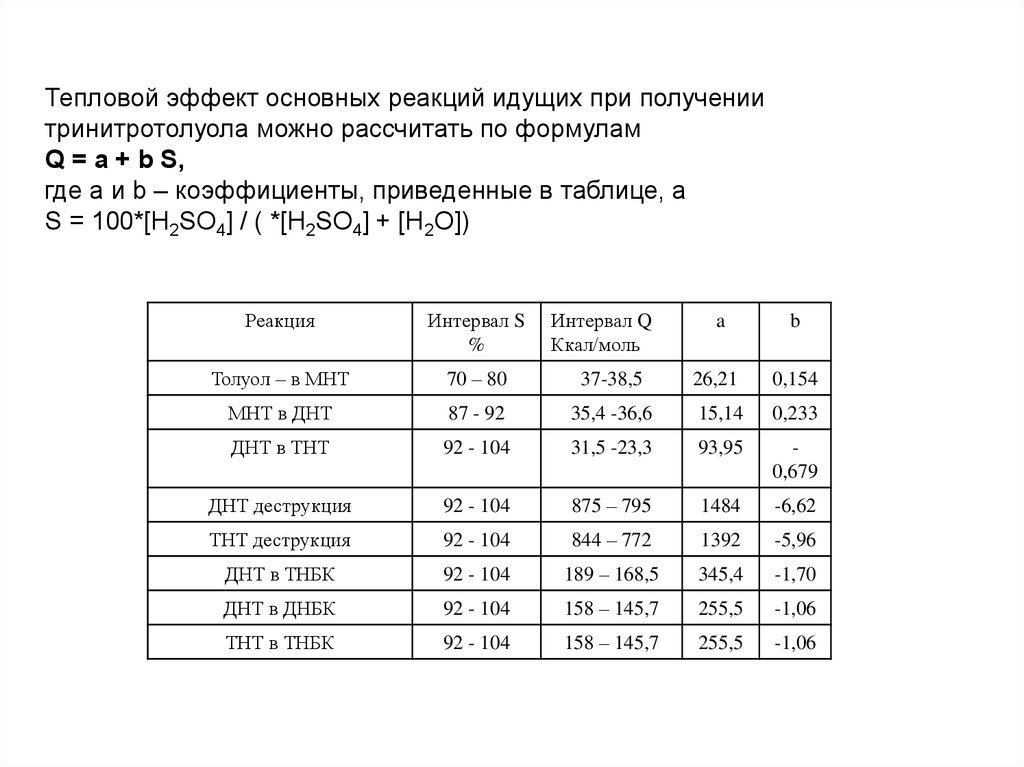
Тепловой эффект основных реакций идущих при получениитринитротолуола можно рассчитать по формулам
Q = a + b S,
где а и b – коэффициенты, приведенные в таблице, а
S = 100*[H2SO4] / ( *[H2SO4] + [H2O])
Реакция
Интервал S
%
Толуол – в МНТ
70 – 80
МНТ в ДНТ
Интервал Q
Ккал/моль
a
b
37-38,5
26,21
0,154
87 - 92
35,4 -36,6
15,14
0,233
ДНТ в ТНТ
92 - 104
31,5 -23,3
93,95
0,679
ДНТ деструкция
92 - 104
875 – 795
1484
-6,62
ТНТ деструкция
92 - 104
844 – 772
1392
-5,96
ДНТ в ТНБК
92 - 104
189 – 168,5
345,4
-1,70
ДНТ в ДНБК
92 - 104
158 – 145,7
255,5
-1,06
ТНТ в ТНБК
92 - 104
158 – 145,7
255,5
-1,06
49.
rD = β∑* (C2/γ –C1),где β∑ -общее сопротивление диффузии
Если скорость химической реакции значительно ниже, чем скорость диффузии, то
скорость процесса
W = kмин *C 1.мин*C 2.мин = к мин*С1.мин*С2.орг/γ
Если реакция протекает одновременно в 2 фазах, и скорость в обеих фазах ниже
скорости диффузии
W = kмин *C 1.мин*C 2.мин*Vмин + корг*С1.орг*Сорг * Vорг
=кмин*С1.мин*С2.орг/γорг* Vмин+ корг *С 1. мин *С2.орг/γмин*Vорг
С2
Скорость химической реакции выше скорости диффузии
β2*(С2 –С2.0) = β1*(С1.0 – 0)*δ1/Х = βА*(СА – 0)*δ1/(δ1-Х)
С2.0 = γ*С1.0; Х/δ1 = (С2 –βА*СА/β2)/(С2 + γ*βА*СА/β1)
С2.0
rD = (C2/γ +βA*CA/β1)/(1/β1 + 1/γβ2)
С1.0
СА
δ2
δ1-х
0
rD = β∑* (C2/γ + βА*СА/ β1)
50. Кинетика гетерогенных процессов
Процессы диффузии
β2*(С2 – С2.0) = β1*(С1.0 – С1)
С2.0 = С1.0* γ
β2*(С2 –С1.0* γ) = β1*(С1.0-С1)
С1.0 = (β1*с1 + β2*с2)/(β1 + β2* γ)
rD = β2*(C2-C2.0) = β2*(C2 –γ*C1.0) = β2*(C2 – γ*(β1*с1
+ β2*с2)/(β1 + β* γ)
Если разделить числитель и знаменатель на β1*β2*γ,
получим
rD = (C2/γ –C1) / ( 1/ β1 + 1/(β2*γ).
Обозначим, ( 1/ β1 + 1/(β2*γ) = 1/ β∑, тогда .
С2
С2.0
С1.0
δ2
С1
δ1
D –коэффициент диффузии
rD =D *dc/dx мол/м2*с –скорость диффузии
rD = -(D/δ)*ΔC = - β* ΔC –
β – коэффициент массопередачи
rD = β∑* (C2/γ –C1), где β∑ -общее сопротивление
диффузии
Если скорость химической реакции значительно ниже,
чем скорость диффузии, то
скорость процесса
W = kмин *C1.мин*C2.мин = к
мин*С1.мин*С2.орг/γ
Если реакция протекает одновременно в 2 фазах, но скорость в обеих фазах ниже
скорости диффузии
W = kмин *C1.мин*C2.мин*Vмин + корг*С1.орг*Сорг * Vорг
=кмин*С1.мин*С2.орг/γорг* Vмин+ корг*С1. мин*С2.орг/γмин*Vорг
51. Влияние азотистой кислоты
В водных растворах H2SO4 и HClO4 (с концентрацией менее 50%) HNO2 присутствуетпреимущественно в молекулярной форме, хотя имеется и N2O3. В кислотах с концентрацией 6065% присутствует в основном NO+ , что доказано методом Раман-спектроскопии. В избытке азотной
кислоты HNO2 существует преимущественно как N2O4, который почти полностью ионизирован по
уравнению
N2O4
NO+ + NO3-,
В системах, содержащих органический растворитель и азотную кислоту, N2O4 ионизирован
слабо.
Представления о нитровании высокоактивных ArH разбавленной азотной кислотой
или серно-азотными кислотными смесями с высоким содержанием воды были
наиболее
четко
сформулированы
А.И.
Титовым.
Нитрование
высокореакционноспособных ArH в таких нитрующих системах протекает только в
присутствии азотистой кислоты и электрофильный агент - нитрозоний-ион.
Реакция протекает даже в среде 3% HNO3. Изучение этих процессов в более
концентрированных водных растворах HNO3, проведенное
Ингольдом с
сотрудниками, показало одновременное протекание двух реакций: нитрование NO2+ по
нулевому порядку и каталитический процесс, скорость которого может быть описана
уравнением
W = k2 . [ArH] . [HNO2]
52.
Изучение кинетики каталитического процесса строго доказало первоначальное
нитрозирование с последующим быстрым окислением С-нитрозосоединения и
регенерацией HNO2.
медленно
быстро
ArH + HNO2→ ArNO + H2O
ArNO + HNO3 → ArNO2 + HNO2
Активный нитрозирующий агент - NO+ образуется из HNO2 через H2NO2+ либо при
ионизации N2O4 или N2O3. Следует отметить, что окисление не идет в отсутствие
азотистой кислоты. Если реакцию быстро прервать, то можно зафиксировать образование
п-нитрозофенола. Соотношение о- : п-изомеров (9 : 91) при катализируемой реакции в
водной среде остается таким же, как при получении нитрозофенолов в отсутствие HNO3.
Ингольд назвал нитрование через нитрозирование «специальным» нитрованием. Оно
характерно для замещенных фенолов и анилинов, но для менее активных соединений
строго не доказано.
53.
Последующие исследования показали, что прикаталитическом
действии низших оксидов азота не всегда происходит нитрозирование. Этот
явление
наблюдали при нитровании таких соединений, как N,Nдиметиланилин, 1,2,3-триметоксинитробензол, нафталин. Добавление
HNO2 в следовых количествах к смеси этих веществ и серно-азотной
кислотной смеси приводило к резкому росту скорости нитрования. При
использовании одной HNO2 нитрозосоединения не образуются.
Возможный механизм нитрования – окисление начального [ArH*NO+]- комплекса в [ArH*NO2+]- - комплекс , который затем изомеризуется в комплекс. Этот механизм объясняет наблюдаемую селективность при
каталитическом нитровании низшими оксидами азота N(III), весьма похожую
на наблюдаемую в случае истинного N(V) нитрования. Возможно, что этот
механизм имеет общий характер и применим для нитрования в среде N2O4.
Предположение о нитровании, протекающем через [ArH*NO+] - -комплекс
может быть использовано для интерпретации образования комплекса с
переносом заряда в схеме Кочи с последующим переносом электрона,
ведущим к катион-радикалу и комплексу последнего с NO2 - [ArH+ NO2 ].
54.
В 70-80-е годы образование относительно стабильных катион-радикалов (КР)
спектральными методами или в форме солей было обнаружено при
электрофильном замещении у ряда активированных ароматических и
гетероциклических соединений (анилинов, фенолов, пиррола). Для
малоактивированного толуола предположительное время жизни составляет
всего 3,3*10-7 с. Косвенным доказательством образования КР при нитровании
ArH является получение диарилов. С высоким выходом нитросоединения
были получены из КР на примере нафталина. Превращение КР в
нитросоединения происходит под действием NO2 или NO2-
ArH . + + NO2 ־
ArH . + + NO2
2 ArH + 3 NO2
Рекомбинация КР с NO2 может протекать и в газовой фазе. Для димерного
КР бензола константа скорости такой рекомбинации равна 2,4*10-11
см3/моль•с.
→
→
→
ArH + NO2
ArNO2 + H+
2 ArNO2 + H2O + NO
При газофазном нитровании ионом нитрония первичным продуктом реакции
является КР, который рекомбинирует с NO2, давая -комплекс.
Для высокоактивных соединений первичный акт образования катион-радикала при
взаимодействии с нитроний - ионом сопровождается вторичным превращением в комплекс (в клетке растворителя, без выхода из нее). Для таких соединений характерно
нитрование, катализируемое оксидами азота.
55.
По ион-радикальному механизму с переносом электрона протекает реакция стетранитрометаном. Ее применяют для нитрования высокореакционноспособных
соединений (фенолов и др) в присутствии оснований. Передача электрона происходит
внутри комплекса с переносом заряда (от ArH к С(NO2)4) и сопровождается
отщеплением от возникающего анион-радикала C(NO2)4-. радикала NO2., последний
рекомбинирует в клетке с катион-радикалом ArH+.. Еще в 1962 г в РХТУ им. Д.И.
Менделеева было показано, что при реакции тетранитрометана с диметиланилином с
выходом, близким к количественному, образуется 4-нитродиметиланилин.
Реакция с участием катион-радикалов протекает и в серной кислоте (выше 82%
H2SO4), где нитрование анилина идет только через анилиний-ион. В 98% H2SO4
соотношение о-:м-:п-изомеров равно 1,5:62:38, в 82% H2SO4 5:36:59. В 98% H2SO4
диметиланилин дает смесь м- : о- = 78 : 22, в 82% H2SO4 образуется 50% 4нитропроизводного, 2% 3-нитрозамещенного и 26% тетраметилбензидина. Константа
скорости каталитической реакции нитрования на порядок больше, чем
некаталитической.







































 chemistry
chemistry








