Similar presentations:
Бионеорганическая химия. Жидкие среды организма. (Лекция 2)
1. Бионеорганическая химия
Лекция №2Жидкие среды организма
2014
2.
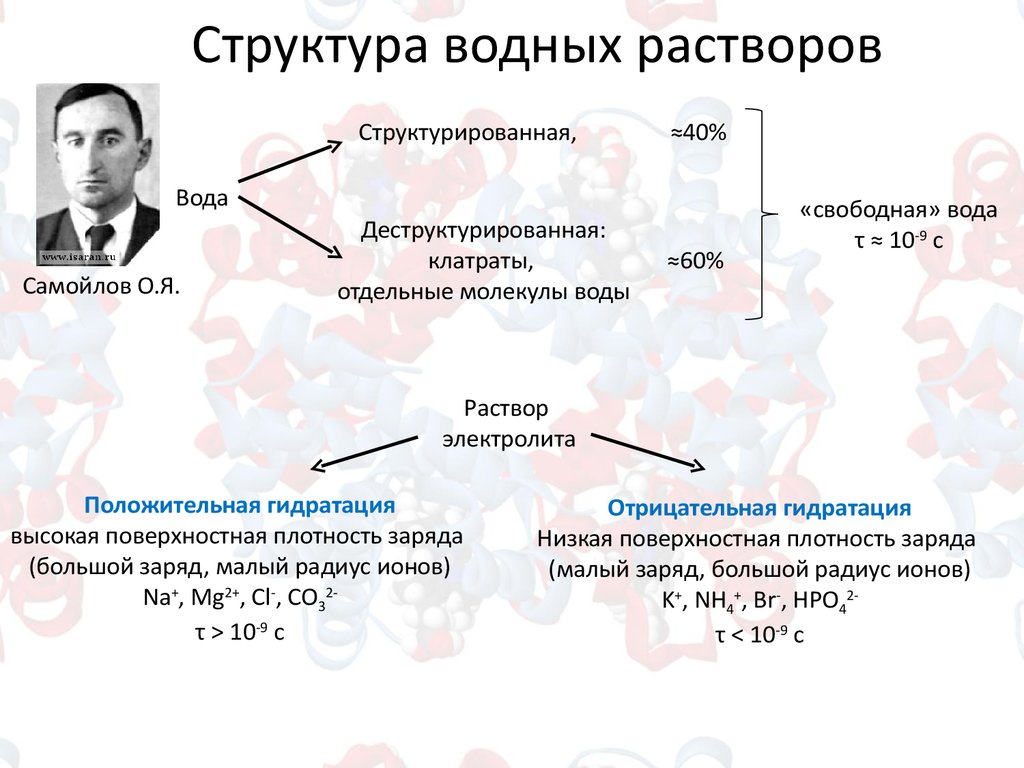
Структура водных растворовСтруктурированная,
≈40%
Вода
Самойлов О.Я.
Деструктурированная:
клатраты,
отдельные молекулы воды
≈60%
«свободная» вода
τ ≈ 10-9 c
Раствор
электролита
Положительная гидратация
высокая поверхностная плотность заряда
(большой заряд, малый радиус ионов)
Na+, Mg2+, Cl-, CO32τ > 10-9 c
Отрицательная гидратация
Низкая поверхностная плотность заряда
(малый заряд, большой радиус ионов)
K+, NH4+, Br-, HPO42τ < 10-9 c
3.
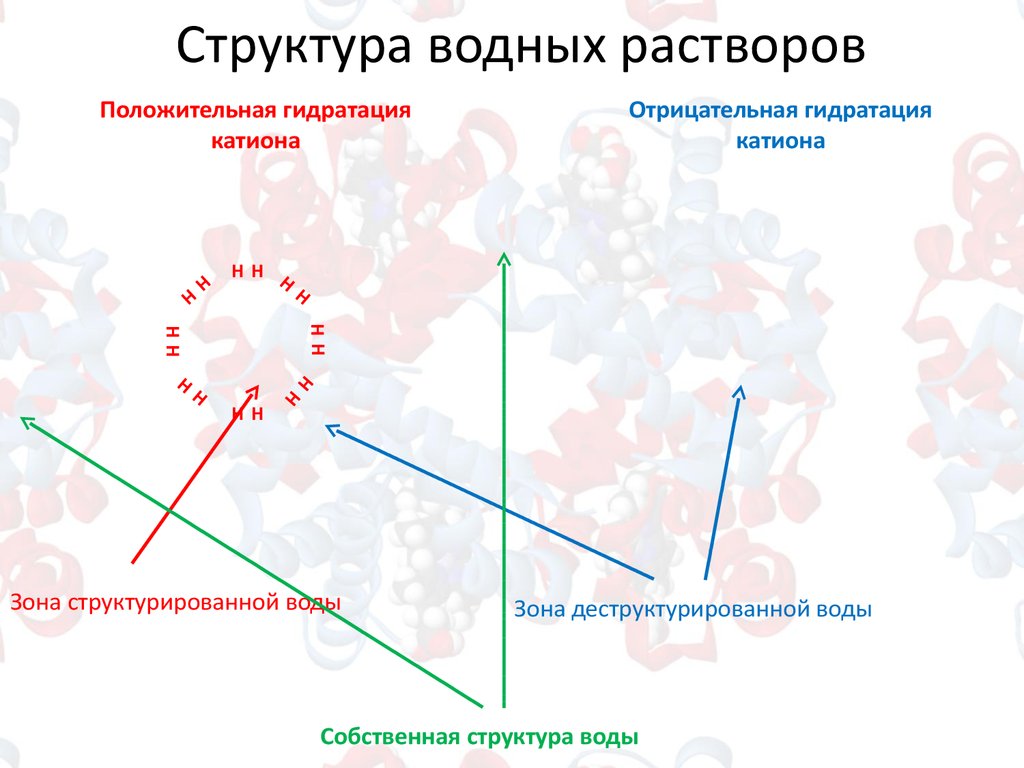
Структура водных растворовПоложительная гидратация
катиона
НН Н
Н
Н
Н
Н
НН Н
Н
НН
Н
Отрицательная гидратация
катиона
НН
Зона структурированной воды
Зона деструктурированной воды
Собственная структура воды
4.
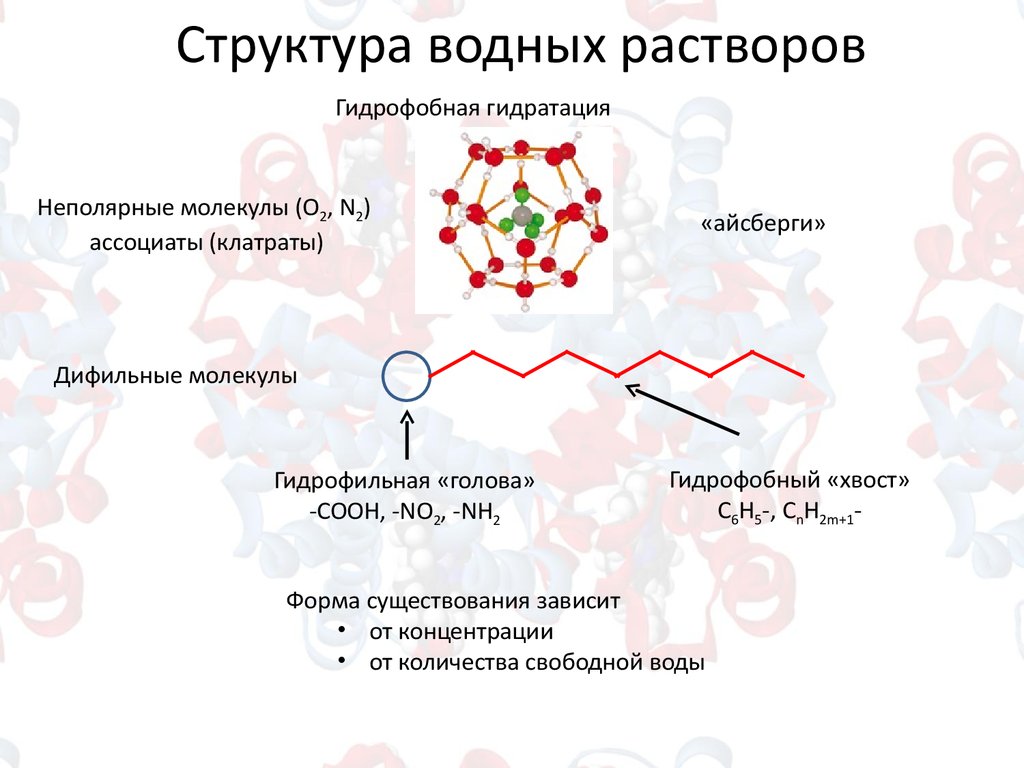
Структура водных растворовГидрофобная гидратация
Неполярные молекулы (О2, N2)
ассоциаты (клатраты)
«айсберги»
Дифильные молекулы
Гидрофильная «голова»
-COOH, -NO2, -NH2
Гидрофобный «хвост»
С6Н5-, СnH2m+1-
Форма существования зависит
• от концентрации
• от количества свободной воды
5.
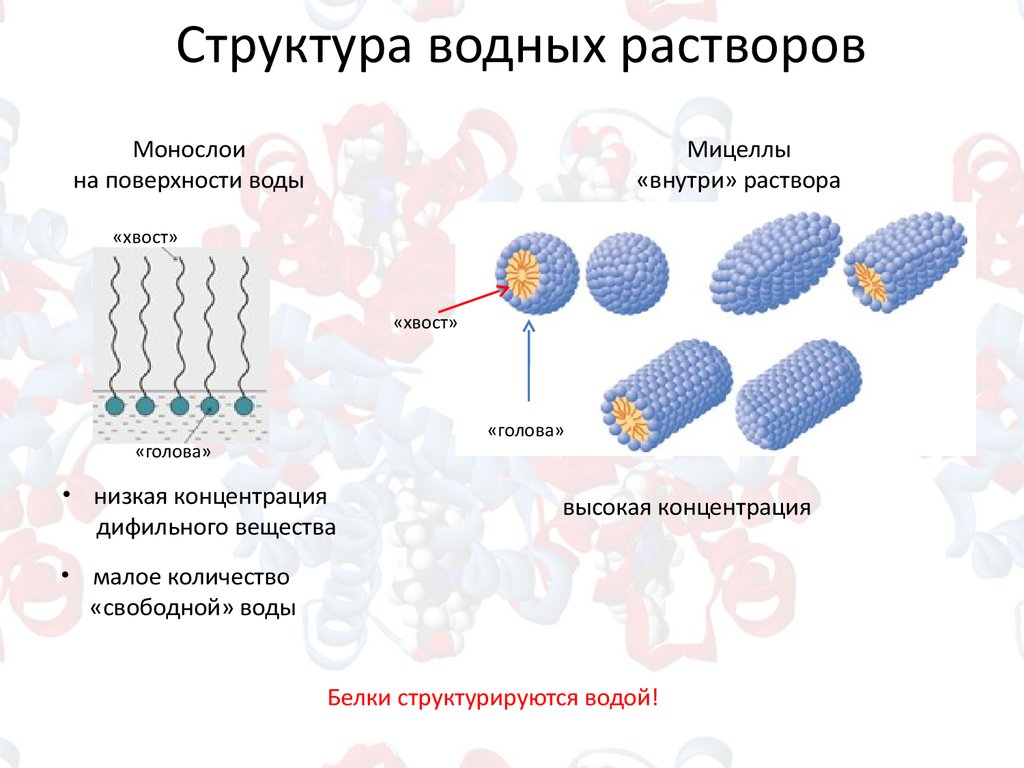
Структура водных растворовМонослои
на поверхности воды
Мицеллы
«внутри» раствора
«хвост»
«хвост»
«голова»
«голова»
• низкая концентрация
дифильного вещества
высокая концентрация
• малое количество
«свободной» воды
Белки структурируются водой!
6.
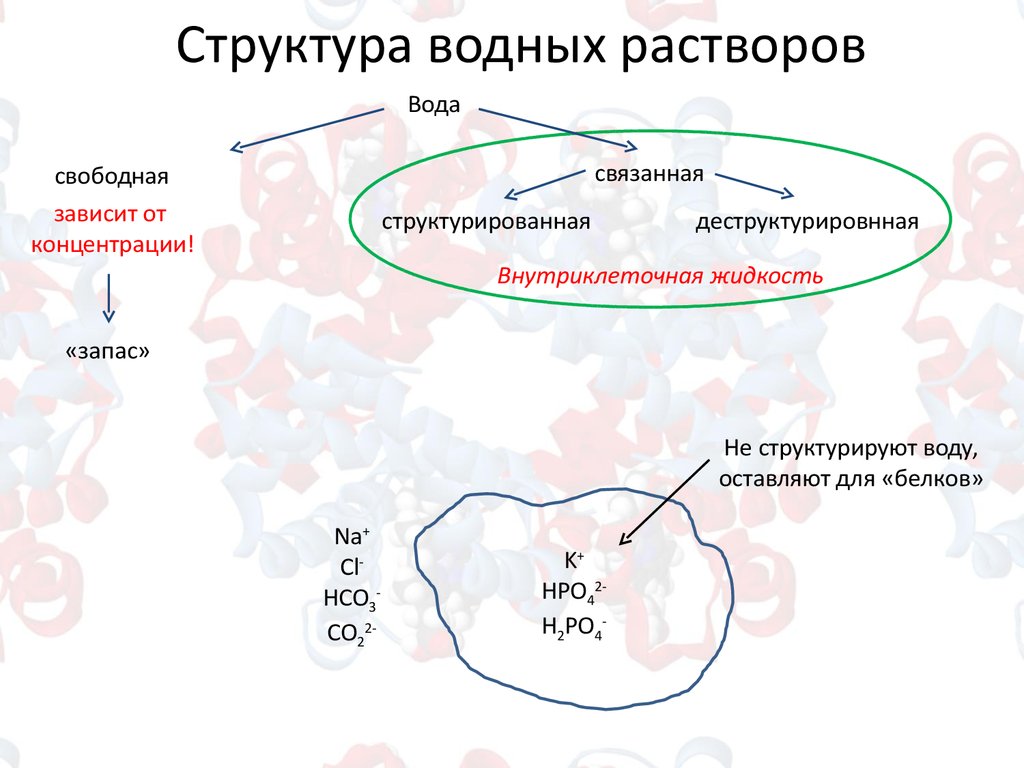
Структура водных растворовВода
связанная
свободная
зависит от
концентрации!
структурированная
деструктурировнная
Внутриклеточная жидкость
«запас»
Не структурируют воду,
оставляют для «белков»
Na+
ClHCO3CO22-
K+
HPO42H2PO4-
7.
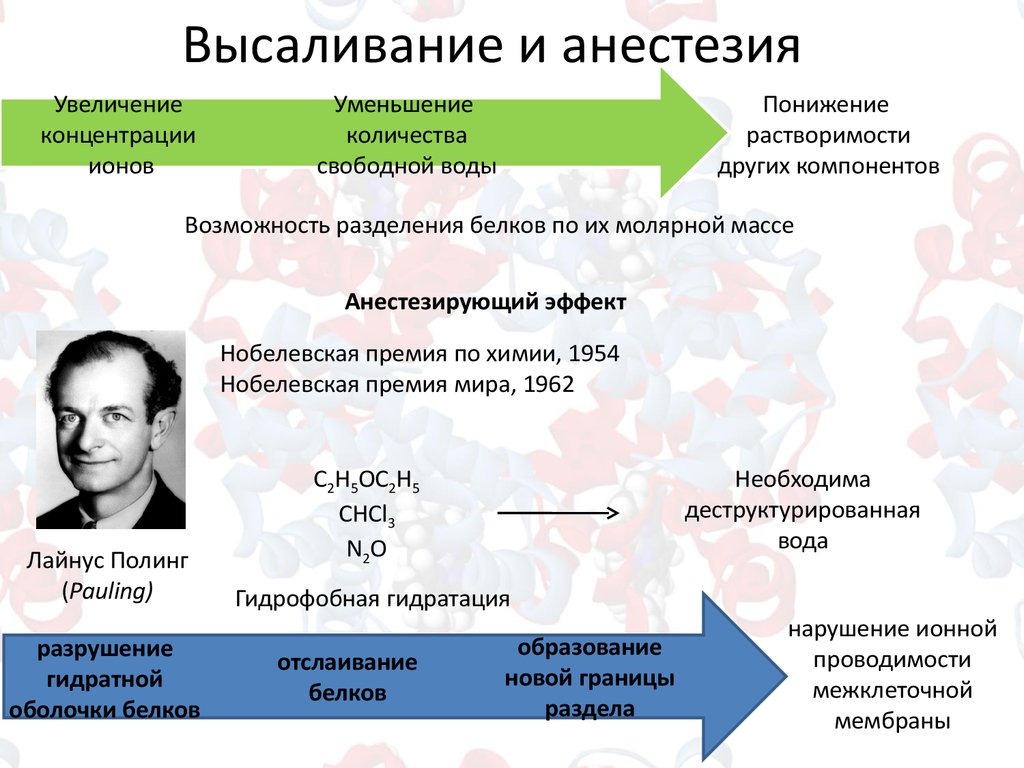
Высаливание и анестезияУвеличение
концентрации
ионов
Уменьшение
количества
свободной воды
Понижение
растворимости
других компонентов
Возможность разделения белков по их молярной массе
Анестезирующий эффект
Нобелевская премия по химии, 1954
Нобелевская премия мира, 1962
Лайнус Полинг
(Pauling)
разрушение
гидратной
оболочки белков
C2H5OC2H5
CHCl3
N2O
Необходима
деструктурированная
вода
Гидрофобная гидратация
отслаивание
белков
образование
новой границы
раздела
нарушение ионной
проводимости
межклеточной
мембраны
8.
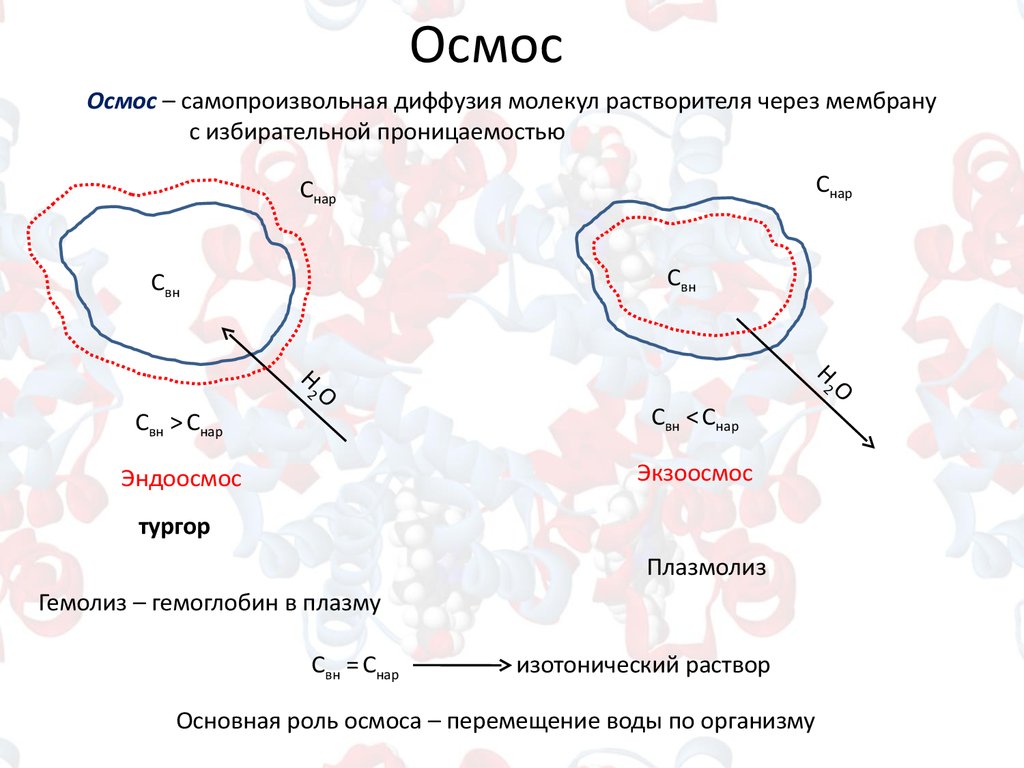
ОсмосОсмос – самопроизвольная диффузия молекул растворителя через мембрану
с избирательной проницаемостью
Снар
Снар
Свн
Свн
Н
2
О
Н
2
Свн > Снар
Свн < Снар
Эндоосмос
Экзоосмос
тургор
Плазмолиз
Гемолиз – гемоглобин в плазму
Свн = Снар
изотонический раствор
Основная роль осмоса – перемещение воды по организму
О
9.
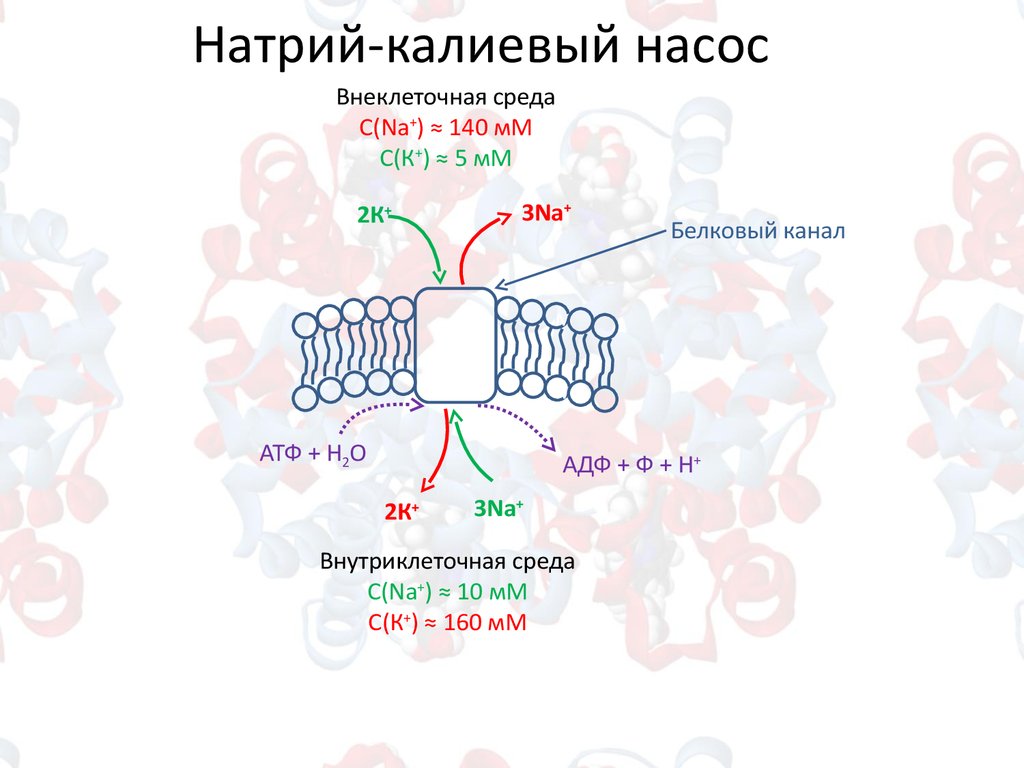
Натрий-калиевый насосВнеклеточная среда
С(Na+) ≈ 140 мM
С(К+) ≈ 5 мM
2К+
3Na+
Белковый канал
м
м
АТФ + Н2О
АДФ + Ф + Н+
2К+
3Na+
Внутриклеточная среда
С(Na+) ≈ 10 мM
С(К+) ≈ 160 мM
10.
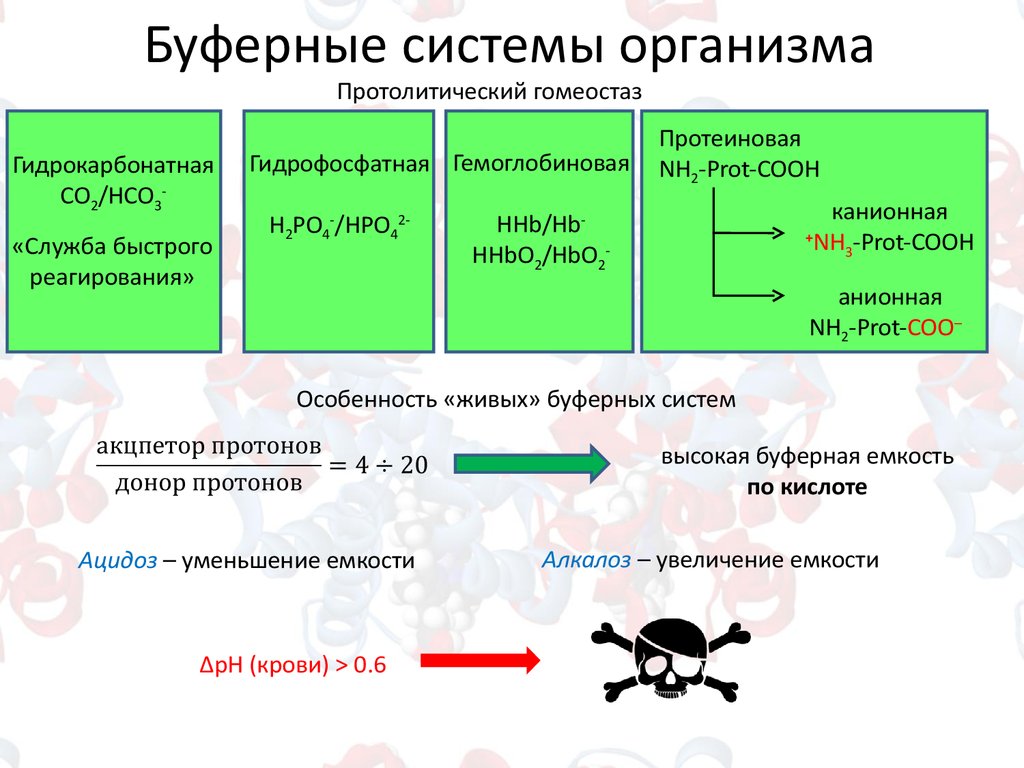
Буферные системы организмаПротолитический гомеостаз
Гидрокарбонатная
СO2/HCO3«Служба быстрого
реагирования»
Гидрофосфатная Гемоглобиновая
H2PO4-/HPO42-
Протеиновая
NH2-Prot-COOH
канионная
+
NH3-Prot-COOН
HHb/HbHHbO2/HbO2-
анионная
NH2-Prot-COO─
Особенность «живых» буферных систем
высокая буферная емкость
по кислоте
Ацидоз – уменьшение емкости
ΔрН (крови) > 0.6
Алкалоз – увеличение емкости
11.
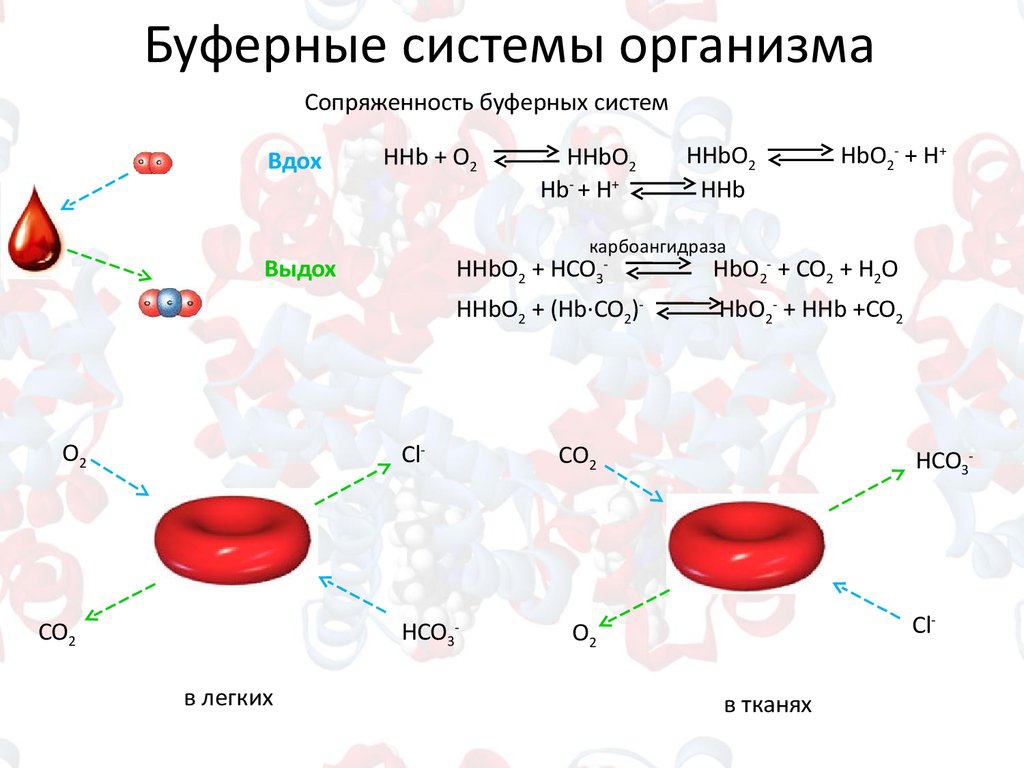
Буферные системы организмаСопряженность буферных систем
Вдох
HHb + O2
HbO2- + CO2 + H2O
HHbO2 + (Hb∙CO2)-
HbO2- + HHb +CO2
HCO3в легких
HbO2- + H+
HHbO2 + HCO3-
Cl-
CO2
HHbO2
HHb
карбоангидраза
Выдох
O2
HHbO2
Hb- + H+
CO2
HCO3-
Cl-
O2
в тканях
12.
Гетерогенные системы организма[Ca2+] = 1,1∙10-3 M
[HPO42-] = 2,9∙10-4 M
Плазма крови
Ca2+ + HPO42-
КS (CaHPO4) = 2,7∙10-7
ИП = 3,2∙10-7
Размер кристаллов - 10-9÷10-7 м
5Ca + 3HPO + 4OH
2+
24
CaHPO4
коллоидное состояние
pH = 8,3
-
поверхность коллагена
Ca3(PO4)2
КS (Ca3(PO4)2) = 2∙10-29
Ca5(PO4)3OH + H2O
гидроксиапатит
КS (Ca5(PO4)3OH) = 1,6∙10-58
Ca5(PO4)3F – зубная эмаль
резерв ионов кальция и фосфатов в организме
13.
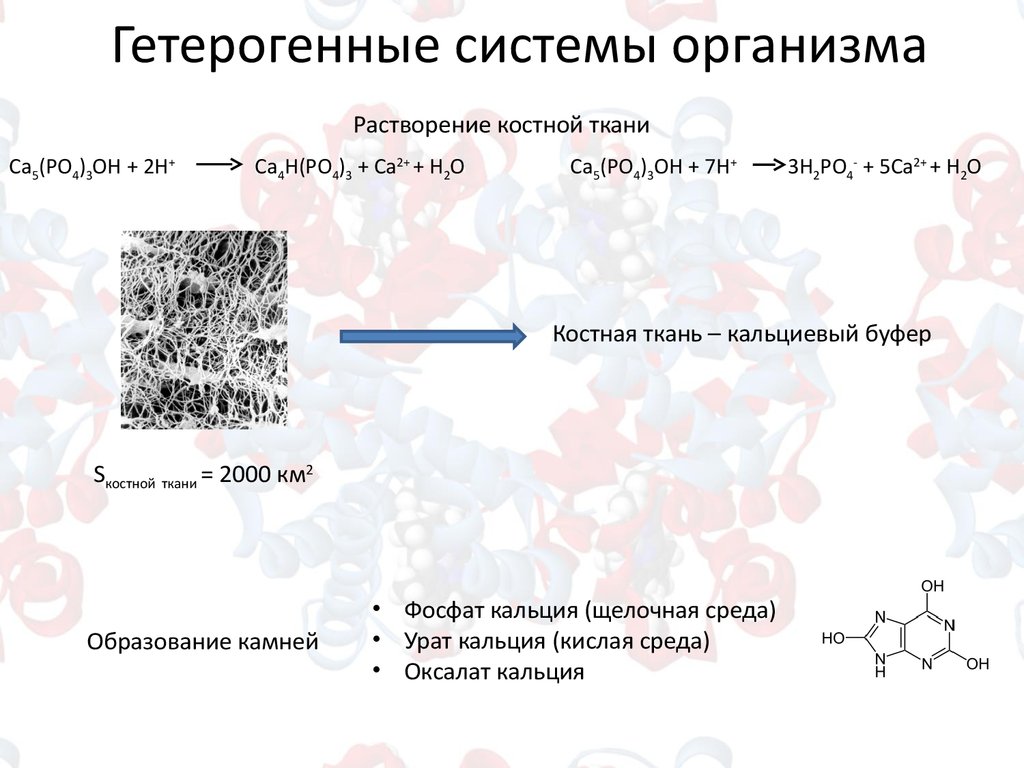
Гетерогенные системы организмаРастворение костной ткани
Ca5(PO4)3OH + 2H+
Ca4Н(PO4)3 + Са2+ + H2O
Ca5(PO4)3OH + 7H+
3Н2PO4- + 5Са2+ + H2O
Костная ткань – кальциевый буфер
Sкостной ткани = 2000 км2
Образование камней
• Фосфат кальция (щелочная среда)
• Урат кальция (кислая среда)
• Оксалат кальция


 biology
biology chemistry
chemistry








