Similar presentations:
Жидкие вещества
1.
Жидкиевещества
11 класс
базовый уровень
26.12.18
Трухина О.Е
1
2.
Жидкое агрегатноесостояние
характеризуется:
₪расстояние между молекулами сравнимо с
размерами молекул;
₪жидкости, в отличие от газов, обладают
большей вязкостью и меньшей
текучестью;
₪ имеют собственный объем, но не имеют
формы, поэтому принимают форму сосуда,
в который их налили;
₪плохо сжимаемы;
₪обладают поверхностным натяжением
26.12.18
жидкие вещества
2
3.
Вода – необычноевещество
Вода – эликсир жизни
вода – самое
распространенное
химическое вещество
водой покрыто
71% поверхности
нашей планеты
Н2О
единственное вещество,
которое в природе
встречается в трех
агрегатных состояниях
26.12.18
мозг человека на
80% состоит из
воды
кровь человека
содержит 83%
воды
без воды человек
живет не более 3-х
суток
жидкие вещества
3
4.
Вода - растворитель1S1
1S2 2S2
2p4
Тпл=00С
H
Ткип=1000СО
э/о(О)=3,5
ρ=1г/мл
э/о(Н)=2,1
1.вода хорошо растворяет ионные и многие
–
–
–
–
δ
δ+
δ+
δ
δ+
δ+
δ соединения;
δ
полярные
H O
H O
H Oи другие
H Oаномальные
2.важны
свойства
воды:
δ+
δ+
δ+
δ+
H
H
H натяжение;
₪высокое H
поверхностное
₪низкая вязкость;
☼
₪высокие Тпл и Ткип и более высокая
плотность
в
H
H
O
O
H
O
O H
жидком состоянии,
чем в твердом;
₪для воды характерно наличие ассоциатов – групп
H
26.12.18
жидкие вещества H
6
H
H
молекул, соединенных «Н»–связями
5.
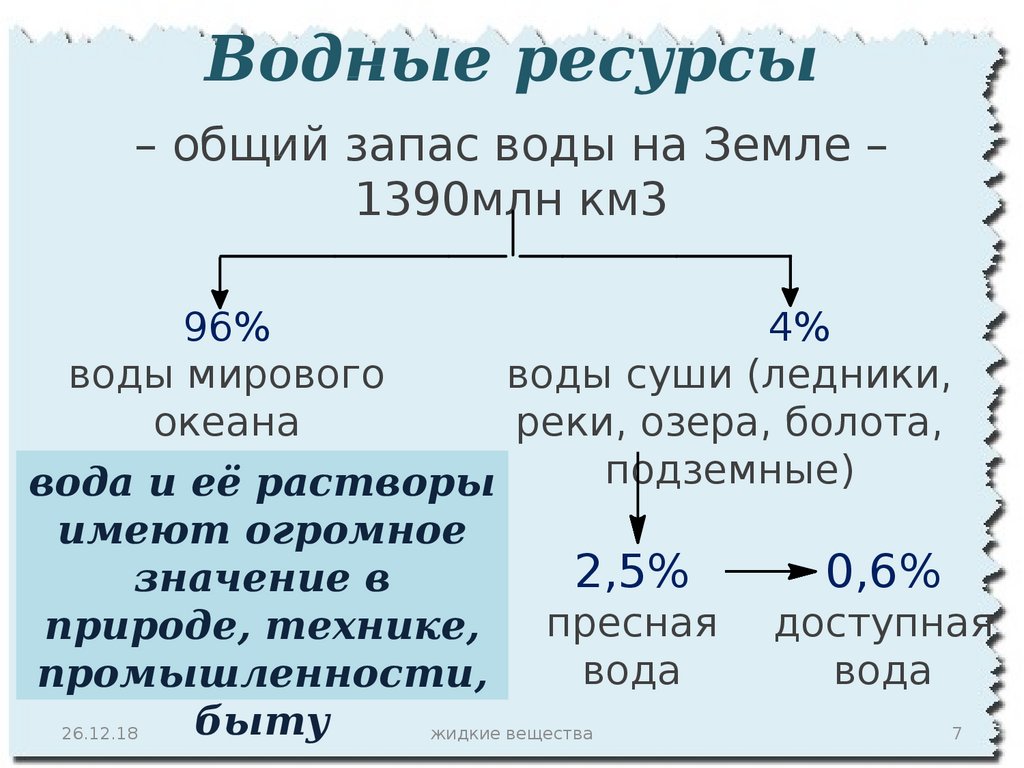
Водные ресурсы– общий запас воды на Земле –
1390млн км3
96%
4%
воды мирового
воды суши (ледники,
океана
реки, озера, болота,
подземные)
вода и её растворы
имеют огромное
2,5%
0,6%
значение в
пресная доступная
природе, технике,
вода
вода
промышленности,
быту
26.12.18
жидкие вещества
7
6.
Характеристики воды₪отслоившиеся
₪
частицы
при через
этом
начинают
население
Как
известно,
из-за
кожа
жесткости
воды
страдает
поры,
через
если
в систему
отопления
залить
жесткую
жесткость
воды
водышит
многом
определяет
«болтаться»
них
жето
выводятся
всей
шлаки,
системе
а кальций,
водоснабжения,
мочекаменными
болезнями,
артритами
и как
пригодность
воды
для
использования
воду,
подпо
воздействием
высокой
попадая
содержащийся
в краны,
в жесткой
приборы
воде
автоматики,
в избытке,
склерозами
(отложения
кальция
вс
промышленных,
так и всолей
бытовых
целях;
температуры
образуется
накипь,
которая
большей
соединяется
вероятностью
с этими
выделениями
выводя
их из
и строя.
суставных
сумках
и
сосудах
головного
мозга
возникновением
накипи
мы
«благодарны»
представляет изслой
себя
сильнейший
накипи
уменьшение
Особенно
закупоривает
страдают
поры.
от
При
зарастания
этом заболеваемости
под
кожей
устройства
соответственно);
увеличение
теплопередачи
именно
жесткой
воде;
теплоизолятор.
с
образуются
мелкими образом
отверстиями
кристаллы
кальция
– душевые
– на
тасетки,
самая
странным
совпадает
с увеличением
1,5 мм
15
%,
разбрызгивающие
накипь, которая
появляется
головки
стиральных
в чайниках.
иЭто
жесткости
потребляемой
3 мм питьевой
наводы;
25 %
₪посудомоечных
машин.
проявляется
в сухости
кожи
посленаумывания
и
в жесткой воде
мыло
мылиться,
при
10 не
мм
50 %стирке
принятия
душа. Кожа
в результате
белья
повышается
расход
моющих средств;
₪
шелушиться,крупы и
в жесткой воденачинает
плохо развариваются
₪высушивается,
по статистике, 90 % всех поломок
появляются
морщины, перхоть,
мясо,
плохо заваривается
чай и волосы
кофе.
водонагревателей, чайников,
секутся.
26.12.18
жидкие вещества
кипятильников также
происходит из-за
8
7.
Жесткость воды₪совокупность свойств воды,
обусловленных содержанием
растворенных солей кальция и магния
природная вода
₪самая жесткая –
морская
(содержание солей
до 35г/л);
26.12.18
₪самая мягкая –
талая, дождевая,
дистиллированная
жидкие вещества
9
8.
Общаяжесткость
Жесткость
воды
водыпостоянная
временная
обусловлена содержанием
Ca(HCO3)2
Mg(HCO3)2
устраняется
кипячением
CaCl2, CaSO4,
Ca(NO3)2
MgCl2,
MgSO4,
устраняется
Mg(NO3)2
добавлением соды
• Ca(HCO3)2 →
• CaCl2 + 2NaHCO3 →
CaCO3↓ + CO2↑
CaCO3↓ + 2NaCl +
+H2O
H2O
• Mg(HCO3)2 →
• Mg(NO3)2+2NaHCO3
26.12.18
жидкие вещества
10
Mg(OH)2↓ + 2CO2↑
→
9.
Как удалить накипь?₪накипь – это
1.CaCO3
2.MgCO3 + 2H+ → Ca2+ + CO2↑ + H2O
3.Mg(OH)2
+ 2H+ → Mg2+ + CO2↑ + H2O
+ 2H+ → Mg2+ + 2H2O
₪какая вода пригодна для питьевых
нужд?
26.12.18
жидкие вещества
11
10.
– физико–химическийпроцесс, при котором происходит измельчение
вещества.
физический –
химический - молекулы
разрушается
растворенного вещества
кристаллическая
реагируют с молекулами
решетка и
растворителя:
происходит:
Растворение
равномерное
распределение
диффузия
частиц растворенного
вещества по всему объему
перемешивание
растворителя
выделение или
поглощение тепла
изменение цвета
или объема р-ра
☼
Раствор - гомогенная система, состоящая из
растворителя, частиц растворенного вещества
(одного или нескольких) и продуктов их
26.12.18
жидкие вещества
взаимодействия.
☼
12
11.
Химические процессыпри растворении
1.в процессе растворения некоторые вещества
H
изменяют цвет.
N
H
H-OH
H
N H OH
H
H
H
1.в процессе растворения может поглощаться и
выделяться энергия.
1.уменьшение объема раствора по сравнению с
суммой объема исходных компонентов.
δ+ δ– δ+ δ– δ+ δ–
HC2H5OH
H O
O
H 500мл
O
δ+ δ–
H O
+ R
Hδ+
500мл Н2О
Hδ+
δ–O
26.12.18
R
H
O
H
O
R
H
O
930 мл раствора + Q
H
жидкие вещества
R
H
H
☼
13
12.
Растворитель• это тот компонент, который в
растворе находится в том же
агрегатном состоянии, что и до
растворения;
• растворителем является то
вещество, содержание которого
в растворе больше;
• если один из
компонентов р-ра
является вода, ее чаще
всего и считают
26.12.18
жидкие вещества
70%
14
13.
Классификациярастворов
1.по характеру
взятого
растворителя
водные
растворы большинства
солей, щелочей и
кислот готовятся
главным образом
водные
растворы в
органических
растворителях
(Br2(вода) в CCl4)
неводные
26.12.18
жидкие вещества
15
14.
растворы по агрегатномусостоянию:
газ в газе,
1. газообраз
ные
н-р: кислород в азоте,
воздух,
природный газ
в жидкости - газ, жидкость,
жидкие
твердое вещество; н-р:
соляная кислота и нашатырный спирт; водка;
растворы солей, щелочей, сахара
твердые
26.12.18
сплавы металлов,
амальгамы, растворы газов в
металле,
н-р водород в платине 16
жидкие вещества
15.
1.растворы в зависимости отсостояния растворенного
вещества
молекулярные
сахар С12Н22О11
спирт С2Н5ОН
глюкоза С6Н12О6
ионномолекулярные
уксусная кислота
СH3COOH
СH3COOH ⇄ H+ +CH3COO–
ионные
поваренная соль NaCl,
NaНCO3
NaClсода
→ Na+
+Cl–
NaHCO3 → Na+ + H+ + CO32–
26.12.18
жидкие вещества
17
16.
1.растворы по наличию илиотсутствию ЭД
р-ры
электролитов
растворы KNО3, HCl,
КОН, Ва(ОН)2 ,
глицина
р-ры
неэлектролитов
растворы сахарозы,
глюкозы, мочевины
26.12.18
жидкие вещества
– растворы
диссоциирующих на
ионы солей, кислот,
оснований,
амфолитов
– растворы
веществ,
практически не
диссоциирующих в
воде
18
17.
Концентрацияраствора
– величина, характеризующая
количественный состав раствора
Способы выражения
концентрации:
₪массовая доля;
₪молярность и д.р.
26.12.18
жидкие вещества
19
18.
Массовая доля– отношение массы растворённого
вещества к массе раствора;
– измеряется в долях единицы или в
процентах:
ω= •100%
m(р-ра) = m(р. в-ва ) = m(р-ра)
эта формула указывает массу безводного
вещества, содержащегося в 100 г р-ра
(например, раствор с ω(NaCl)=20%
содержит 20 г NaCl и 80 г воды)
26.12.18
жидкие вещества
20
19.
Массовая доляраствор состоит из растворенного
вещества и растворителя
m(р-ра) = m(р. в-ва) + m(Н2O);
ω=
•100%
массу раствора можно выразить через объем
раствора (V) и его плотность (ρ):
m(р-ра) = V(р-ра)•ρ(р-ра).
откуда
ω=
•100% ; ⟹
m(р. в-ва ) = V• ρ
ω(р.в.)
26.12.18
жидкие вещества
21
20.
Массовая долядля приготовления р-ра с определенной
массовой долей р.в-ва смешиванием двух
растворов большей и меньшей концентрации
или разбавлением концентрированного
раствора водой используют правило
смешения в виде:
массовая доля
р. в-ва
ω1
p-p 1
масса
ω2
p-p 2
m1
m2
ω3
p-p 3
m1 +m2
ω1• m1 + ω2• m2 = ω3 • (m1 +m2)
26.12.18
жидкие вещества
22
21.
Решите задачи1.Определите массовую долю (%) соли в растворе,
полученном при растворении 50 г соли в 200 г
воды.
2.Какую массу раствора с массовой долей уксусной
кислоты 40%, или 0,4 надо прибавить к 500 г воды
для получения раствора с массовой долей уксусной
кислоты 15%, или 0,15?
3.Смешали 300 г раствора с массовой долей хлорида
натрия 20% и 500 г раствора с массовой долей —
40%. Вычислите массовую долю хлорида натрия в
полученном растворе.
4.Смешали 10 мл раствора с массовой долей азотной
кислоты 10% (р = 1,056 г/мл) и 100 мл раствора с
массовой долей — 30% (р = 1,184 г/мл). Вычислите
массовую долю азотной кислоты в полученном ☼
23
растворе.
22.
Молярность(молярная объёмная
– количество р.в-ва (число молей) в единице
концентрация)
объёма раствора
См
=
– измеряется в [моль/л]
– обозначение молярной концентрации CM,
которое принято обозначать М (0,1M NaOH)
Решите задачи:
1.В воде растворили KOH m=11,2г, объем раствора
довели до 200мл. Определить См.
2.В растворе объемом 500мл содержится хлорид
магния массой 9,5г. Определите молярную
концентрацию растворенного вещества.
26.12.18
жидкие вещества
24
23.
Домашнее задание₪§9
₪ упр.1-11
₪ ТПО
26.12.18
жидкие вещества
25






















 chemistry
chemistry








