Similar presentations:
Буферные системы организма. Механизм буферного действия, буферная ёмкость (лекция 5.2)
1. Буферные системы организма. Механизм буферного действия, буферная ёмкость.
2.
ПЛАН1. Буферные системы и растворы. Типы
буферных систем.
2. Механизм буферного действия.
3. Расчет рН буферных растворов.
4. Буферная емкость.
5. Буферные системы организма.
3.
Буферныерастворы
растворы,
сохраняющие
неизменными значения рН при разбавлении или добавлении
небольшого количества сильной кислоты или щелочи.
Кислотные - слабая кислота и ее соли, образованной
сильным основанием.
Ацетатный буфер
Фосфатный буфер - смесь двух солей многоосновной
кислоты
4.
Оснóвные - слабое основание и его соли, образованнойсильной кислотой.
Аммиачный буфер
Амфолитные - смеси двух солей или из соли слабой
кислоты и слабого основания, например: CH3COONH4
CH3COO- - акцептор протона, NH4+ - донор протона.
Белковый буфер
(NH3+)m-Prot-(CH3COO-)n
а) слабая «белок-кислота» + соль этой слабой кислоты;
б) слабое «белок - основание» + соль этого слабого
основания.
5.
Буферное действие кислотного (ацетатного) буфера:CH3COOH ⇄ H+ + CH3COO-;
СH3COONa ⇄ Na+ + CH3COO-.
При добавлении сильной кислоты - H+ взаимодействуют с
CH3COO- соли, образуя слабую кислоту
CH3COO- + H+ ⇄ CH3COOH
Сильная кислота заменяется эквивалентным количеством
слабой, диссоциация которой в присутствии CH3COOподавлена.
При добавлении щелочи - CH3COO- взаимодействуют с H+
уксусной кислоты, связывая их в молекулы воды:
CH3COOH + ОН- ⇄ CH3COO- + Н2О.
Щелочь заменяется эквивалентным количеством соли,
почти не изменяющей величину рН раствора.
6.
Буферное действие основного (аммиачного) буфера:NH4OH ⇄ NH4++ OH-
NH4Cl ⇄ NH4+ + ClПри добавлении сильной кислоты - связывание OHоснования с H+ кислоты, с образованием молекул воды.
Кислота заменяется эквивалентным количеством соли:
NH4OH + H+ ⇄ NH4+ + Н2О
При добавлении щелочи - взаимодействие с солью, и
образование слабого основания:
NH4++ Cl- + OH- ⇄ NH4OH + ClПри разбавлении или концентрировании изменяется
концентрация обоих компонентов, а их соотношение не
изменяется - рН не изменяется.
7.
В основе расчета рН буферных систем - ЗДМ для кислотноосновного равновесия.Для буферных систем кислотного типа:
Уравнение Гендерсона – Гассельбаха:
рК = -lgК
8.
Для буферных систем основного типа:[основание]
рН 14 рК lg
соль
рК = -lgК
[основание]
рН 14 lg К lg
соль
рН буферных растворов зависит:
от отрицательного десятичного логарифма константы
диссоциации слабой кислоты или основания,
от отношения концентраций компонентов кислотноосновной пары.
9.
Буферная емкостью (β) - величина, измеряемая числом моль илиммоль эквивалента кислоты или щелочи, которое нужно добавить к
1 л буферного раствора, чтобы изменить его рН на единицу.
Чем выше исходные концентрации компонентов буфера, тем
выше ее буферная емкость.
Чем ближе соотношение концентраций компонентов буфера к
единице, тем выше буферная емкость.
Vкисл. или щел. - объемы добавленной кислоты или щелочи, л.;
С кисл. или щел. - молярные концентрации эквивалентов кислоты
или щелочи, моль/л.;
Vбуф. р-ра - объем буферного раствора, л.;
ΔрН – значение рН буферного раствора до и после добавления
кислоты или щелочи, (рН0 – рН) – разность по модулю.
10.
Белковый буфер - система из протеина (Pt) и его соли,образованной сильным основанием.
Pt – COOH ⇄ H+ + Pt – COOPt – COONa ⇄ Na+ + Pt – COO При увеличении [H+]:
NH2 – Pt – COO- + Na+ + H+ + Cl- ⇄ NH2 – Pt – COOH + Na+ + Cl При взаимодействии со щелочами в реакцию вступает белок кислота :
NH2 – Pt – COO- + Н+ + Na+ + OH-⇄NH2 – Pt – COO- + Na+ + H2O
Белки обладают свойством амфотерности
При добавлении сильной кислоты:
NH3+ – Pt – COO- + H+ + Cl- ⇄ NH3+ – Pt – COOH + Cl При добавлении щелочи образуется слабоосновная соль белка:
NH3+ – Pt – COO- + Na+ + OH- ⇄ HONH3 – Pt – COO- + Na+
11.
Водородкарбонатный буфер - сопряженная кислотноосновная пара:H2CO3 - донор протонов (H+)
HCO33- (сопряженное основание) - акцептор.
НСО3-/Н2СО3
СО2 (р) + Н2О ⇄ H2CO3
где [CO2] - концентрация растворенного CO2.
Если в кровь поступает кислота и увеличивается Н+
Н+ + НСО3- - Н2СО3 - СО2– + Н2О
При поступлении в кровь оснований
ОН- + Н2СО3 - НСО3- + Н2О
12.
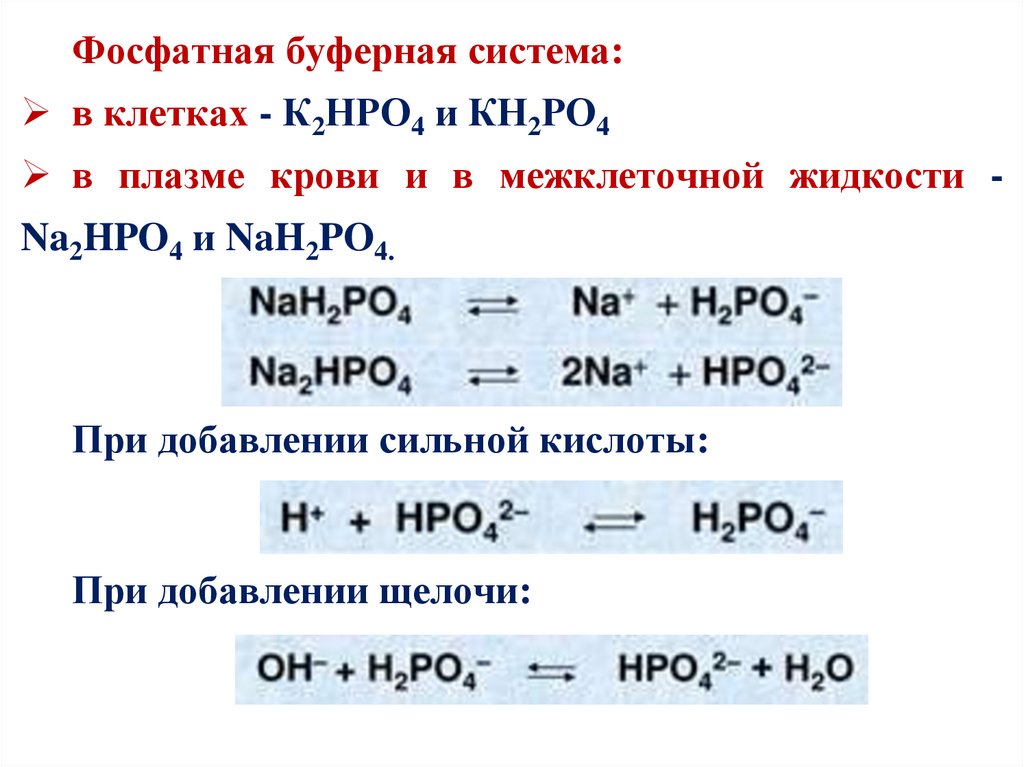
Фосфатная буферная система:в клетках - К2НРО4 и КН2РО4
в плазме крови и в межклеточной жидкости Na2HPO4 и NaH2PO4.
При добавлении сильной кислоты:
При добавлении щелочи:
13.
СоставБуферная система
гемоглобиновая оксигемоглобиновая
донор протона
ННb
ННbO2
акцептор протона
Hb‾
HbO2‾
Механизм буферного действия
при добавлении кислот:
H+ + Hb‾ ↔ HHb
pKa (HHb) = 8,20
H+ + HbO2‾ ↔ HHbO2 ↔ HHb + O2
pKa (HHbO2) = 6,95
при добавлении основания:
OH‾ + HHbO2 ↔ HbO2 ‾ + H2O
OH ‾ + HHb ↔ Hb ‾ + H2O












 chemistry
chemistry








