Similar presentations:
Протолитические равновесия. Буферные системы
1.
Протолитическиеравновесия.
БУФЕРНЫЕ СИСТЕМЫ
План лекции
1.
2.
3.
4.
5.
Теория кислот и оснований
Водородный показатель. Шкала
рН
Классификация буферных систем
Уравнение рН буферной системы
Ацидоз и алкалоз
Лектор: зав.кафедрой общей и биологической химии
д.б.н., профессор Эльбекьян К.С.
2.
Что есть теория ?Это опыт накопленный
предыдущими поколениями.
Что есть практика?
Опыт, который мы
приобретаем сами
3.
В истории развитии любойнауки наступает момент,
когда накопленный
фактический материал
нуждается в некой
систематизации и
обобщении.
Именно на этих этапах
рождаются теории,
общие модели,
позволяющие
объяснить уже
установленные факты и
предвидеть новые
события.
4.
Теории кислот и основанийВ настоящее время в химии разработано и
используются несколько теорий кислот и
оснований.
Наиболее распространенными являются:
1.теория Аррениуса. Теория
электролитической диссоциации.
2. теория Бренстеда–Лоури. Протонная
теория кислот и оснований
3. теория Льюиса. Электронная теория
кислот и оснований.
5.
Развитие теоретических представлений о строениирастворов началось с теории электролитической
диссоциации Аррениуса.
Новизна теории Аррениуса
была в том, что он
предположил распад
(диссоциацию) электролитов
в растворах в отсутствие
каких-либо внешних сил.
За разработку теории
электролитической
диссоциации Аррениусу в
1903 году была присуждена
Нобелевская премия
Сванте-Август Аррениус
19.02.1859 - 1927
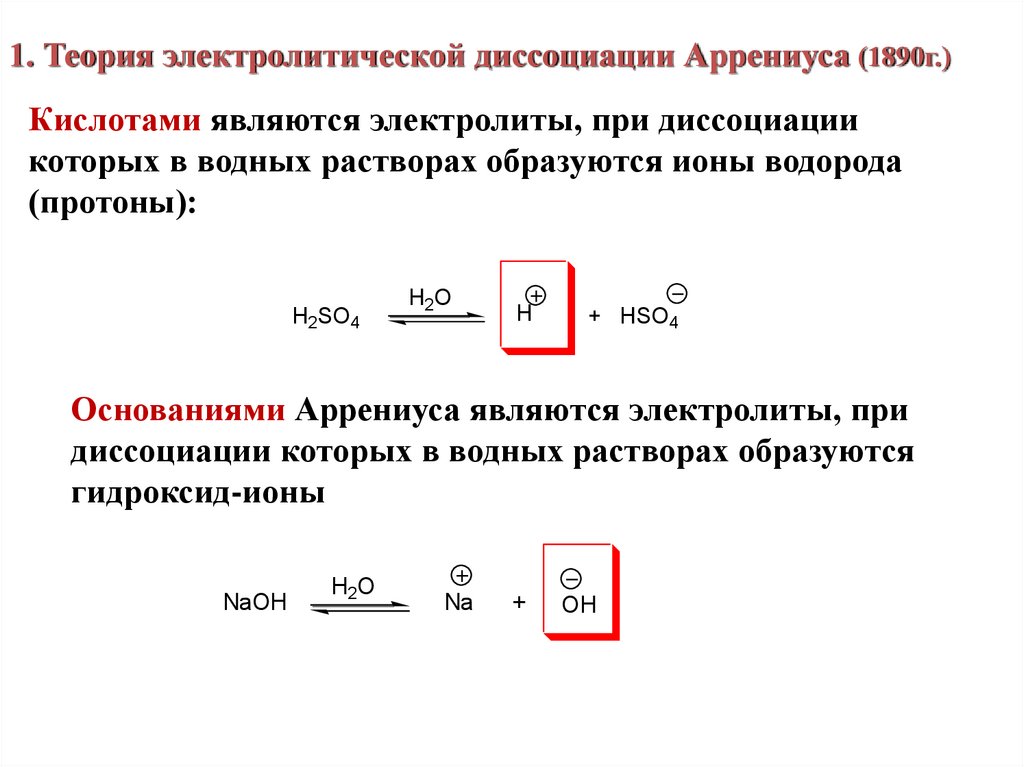
6.
1. Теория электролитической диссоциации Аррениуса (1890г.)Кислотами являются электролиты, при диссоциации
которых в водных растворах образуются ионы водорода
(протоны):
H2SO4
H2O
H
+ HSO4
Основаниями Аррениуса являются электролиты, при
диссоциации которых в водных растворах образуются
гидроксид-ионы
NaOH
H2O
Na
+
OH
7.
Ограничения теории АррениусаТеория Аррениуса часто критиковалась
учёными его времени. В числе
противников был и великий русский
учёный Дмитрий Иванович Менделеев,
создатель физико-химической теории
растворов.
Менделеев резко критиковал не только саму
идею Аррениуса о диссоциации, но и чисто
«физический» подход к пониманию природы
растворов, не учитывающий химических
взаимодействий между растворённым
веществом и растворителем (гидратации в
случае воды, или сольватации в общем случае)
Д. И. Менделеев говорил о химическом взаимодействии между
растворенным веществом и растворителем, за счет которого
образуются «жидкие непрочные соединения в состоянии
диссоциации»
8.
9.
10.
ВЫВОД!!!!!Несмотря на свои достоинства теория
Бренстеда, как и теория Аррениуса, не
применима к веществам, проявляющим
функцию кислоты веществ, не содержащих
водорода, например галогенидам бора,
алюминия, кремния и олова.
Поэтому более общей является теория
кислот и оснований Льюиса.
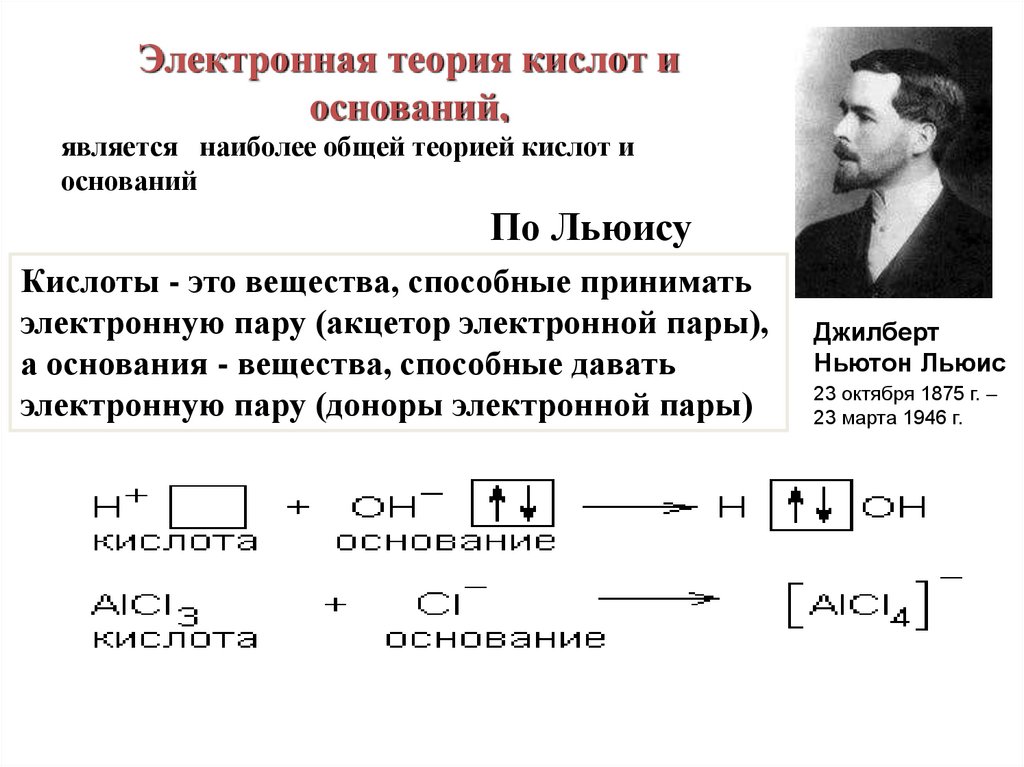
11.
Электронная теория кислот иоснований,
является или
наиболее
общейЛьиса
теорией кислот
Теория
(1926)и
оснований
По Льюису
Кислоты - это вещества, способные принимать
электронную пару (акцетор электронной пары),
а основания - вещества, способные давать
электронную пару (доноры электронной пары)
Джилберт
Ньютон Льюис
23 октября 1875 г. –
23 марта 1946 г.
12.
• К кислотам Льюиса относятся не толькопротон H+, но и все катионы, а также
галогениды металлов 2 и 3 групп
таблицы Менделеева: AlX3, FeX3, BX3,
SbX5, SnX4, ZnX2 (X=F, Cl, Br, I).
К основаниям Льюиса - все анионы OH-, OR-,
CH3COO-, NH2- и т.д. и нейтральные
соединения, имеющие неподеленные
электронные пары или π- связи - H2O, ROH,
ROR, RCH=O, RSH, NH3, R3N, RCH=CH2, RC6H5 и др.
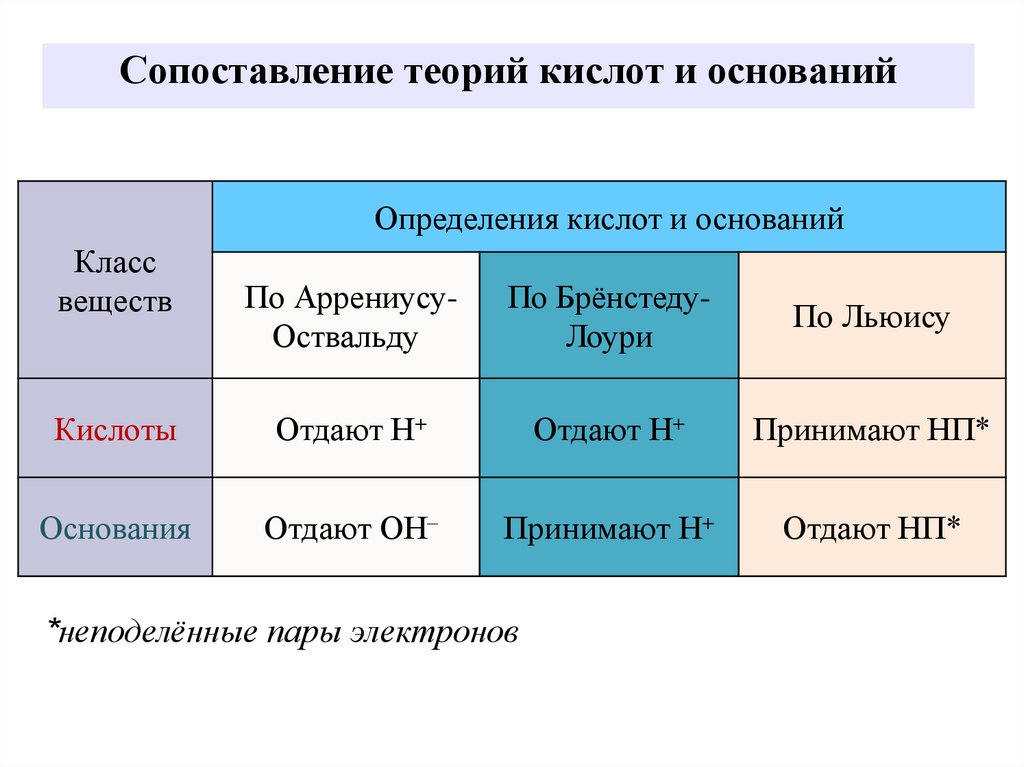
13. Сопоставление теорий кислот и оснований
Определения кислот и основанийКласс
веществ
По АррениусуОствальду
По БрёнстедуЛоури
По Льюису
Кислоты
Отдают Н+
Отдают Н+
Принимают НП*
Основания
Отдают ОН–
Принимают Н+
Отдают НП*
*неподелённые пары электронов
14. Диссоциация воды. рН
Вода как слабый электролит в незначительнойстепени диссоциирует на ионы Н+ и ОН-,
которые находятся в равновесии с недиссоциированными молекулами
Н2О ↔ Н+ + ОН-.
15. Диссоциация воды. рН
Произведение концентраций ионов водорода игидроксид-ионов в воде называется ионным
произведением воды (обозначается Кв).
Опытом установлено, что в 1 л воды при
комнатной температуре (22°С) диссоциации
подвергаются лишь 10-7 моль и при этом образуется
10-7 моль/л ионов Н+ и10-7 моль/л ионов ОН-.
Кв = [Н+][ОН-] = 10-7 ∙ 10-7 = 10-14
Численное значение его при температуре 22°С
равно 10-14:
16. Диссоциация воды. рН
Концентрацию водородных ионов принятовыражать через водородный показатель и
обозначать символом рН .
Кв = [Н+][ОН-] = 10-7 ∙ 10-7 = 10-14
-14 = lg [Н+] +lg [ОН-]
14 = -lg [Н+] -lg [ОН-]
Водородным показателем рН называется
отрицательный десятичный логарифм
концентрации водородных ионов:
рН = -lg[H+]
где [Н+] концентрация ионов водорода, моль/л.
рН + рОН =14
17. Диссоциация воды. рН
С помощью рН реакция растворов характеризуется так: нейтральнаярН =7, кислая рН < 7, щелочная рН > 7.
Чем меньше рН, тем больше концентрация ионов Н+ т. е. выше кислотность
среды; и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е.
выше щелочность среды.
18.
Значения рН различных систем организмаСыворотка крови
7,35 – 7,45
Спинно-мозговая жидкость
7,35 – 7,45
Слюна
6,35 – 6,85
Желудочный сок
0,9 – 1,3
Моча
4,8 – 7,5
Слезная жидкость
7,2 – 7,4
Желчь в пузыре
5,4 – 6,9
19. Буферные системы. Количественные характеристики буферных систем
Буферными системами называют растворы,обладающие свойством сохранять определенное
значение рН при разбавлении или при добавлении
небольших количеств кислоты и щелочи.
20. Типы буферных систем
Состоит из слабойкислоты и ее аниона
НА/А-
HA
ВОН/ В+
H+ + A-
Н2СО3 / НСО3H2CO3
Состоит из слабого
основания
и его катиона
H ++ HCO3-
BOH
B+ + OH-
NH4OH / NH4+
NH4OH
NH4+ + OH-
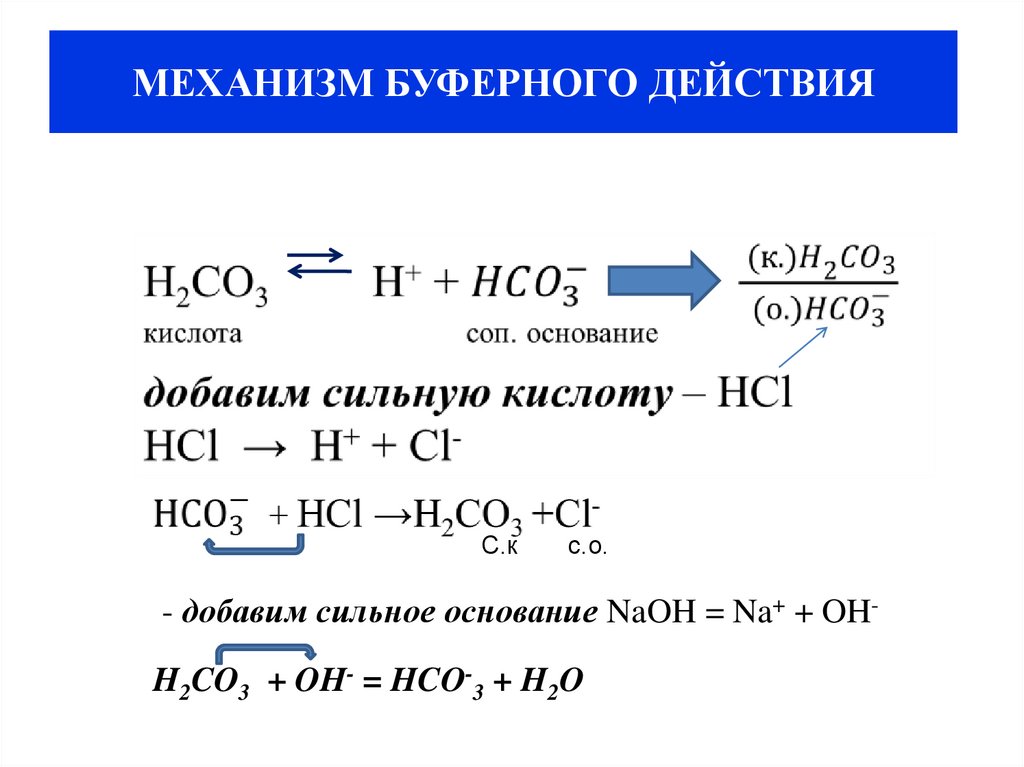
21. МЕХАНИЗМ БУФЕРНОГО ДЕЙСТВИЯ
С.кс.о.
- добавим сильное основание NaOH = Na+ + OHH2CO3 + OH- = HCO-3 + H2O
22. Количественные характеристики буферных систем
23. pH буферных систем
Н2СО3 =Н+ + HCO3-HCO3- / Н2СО3
Умножим на -1
Уравнение Гендерсона
-Хассельбаха
24.
Буферная емкостьБуферная емкость определяется количеством сильной кислоты или
щелочи (в ммоль/л), прибавленной к 1 л буфера и смещающей рН на
единицу.
С
В
=
рН буф.
где: С – число молей прибавленной кислоты или щелочи;
рН буф. – изменение рН буфера при добавлении кислоты или
щелочи – величина положительная.
Буферную емкость можно рассчитать как по кислоте, так и по щелочи:
В
=
СК • VK
рН • Vбуфера
или
В
=
Сщ • Vщ
рН • Vбуфера
Если принять буферную емкость крови за 100 %, то буферные системы
распределяются следующим образом:
Гидрокарбонатная
Фосфатная
Белковая
(белки сыворотки)
Гемоглобиновая
~ 7%
~ 1%
~ 10 %
~ 82 %
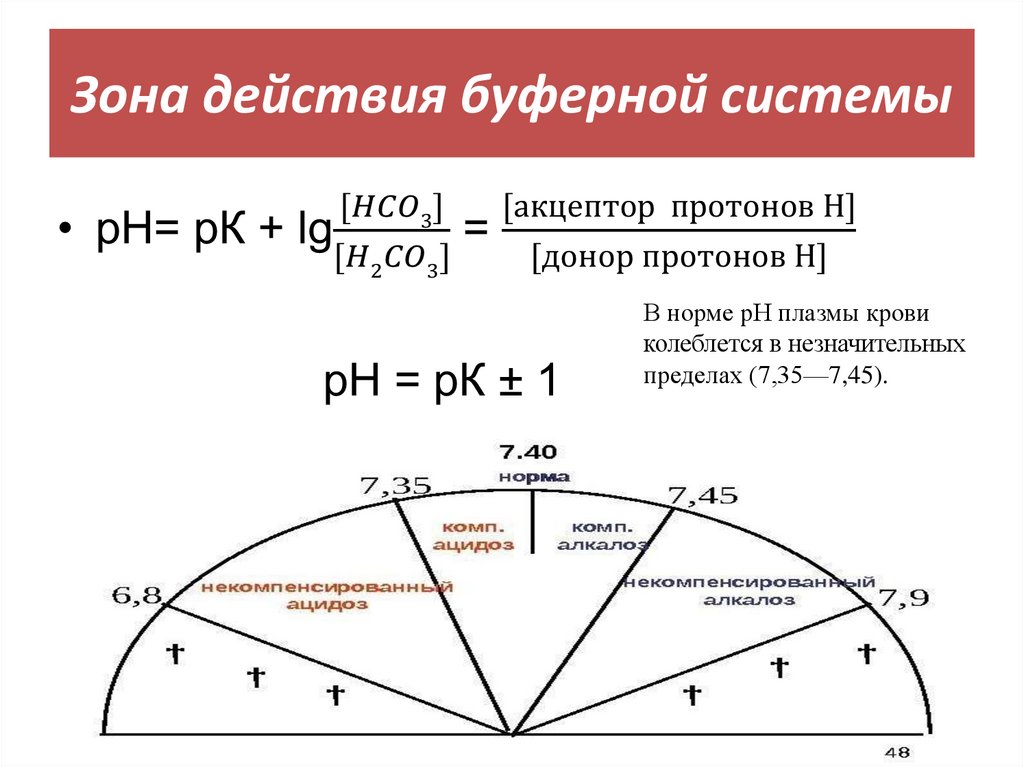
25. Зона действия буферной системы
В норме рН плазмы кровиколеблется в незначительных
пределах (7,35—7,45).
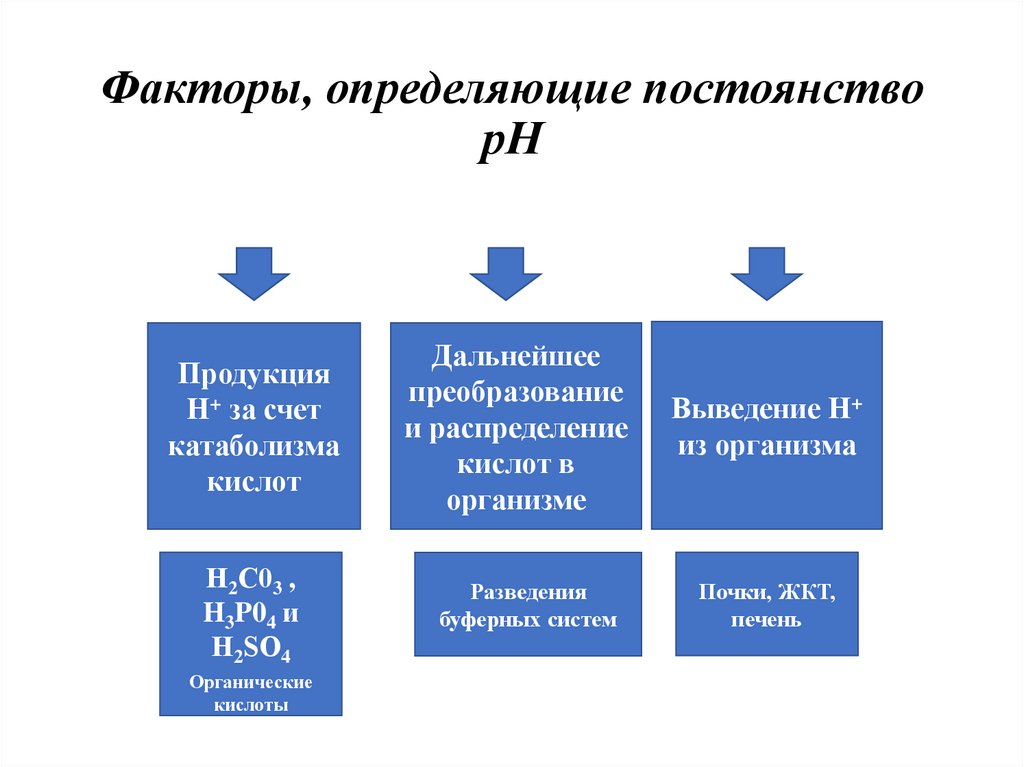
26. Факторы, определяющие постоянство рН
ПродукцияН+ за счет
катаболизма
кислот
Дальнейшее
преобразование
и распределение
кислот в
организме
Выведение Н+
из организма
Н2С03 ,
H3P04 и
Н2SО4
Разведения
буферных систем
Почки, ЖКТ,
печень
Органические
кислоты
27.
28.
• В норме рН плазмы крови колеблется внезначительных пределах (7,35—7,45).
• Его постоянство зависит от буферных свойств
крови, которые обусловлены наличием в ней
нескольких буферных систем:
29. Буферные системы крови
В плазме:В эритроцитах:
Na+ вне клетки
К+ внутри клетки
H2CO3
NaHCO3
гидрокарбонатный
Н2СО3
КНСО3
NaH2PO4
NA2HPO4
фосфатный
КН2РО4
К2НРО4
Pt – COOH
Pt - COONa
белковый
Органические кислоты
Na+ - соль
не характерен
Органические кислоты
К+ - соль
ННb
КНb
гемоглобиновый
ННbО2 оксигемоглобиновый
КНbО2
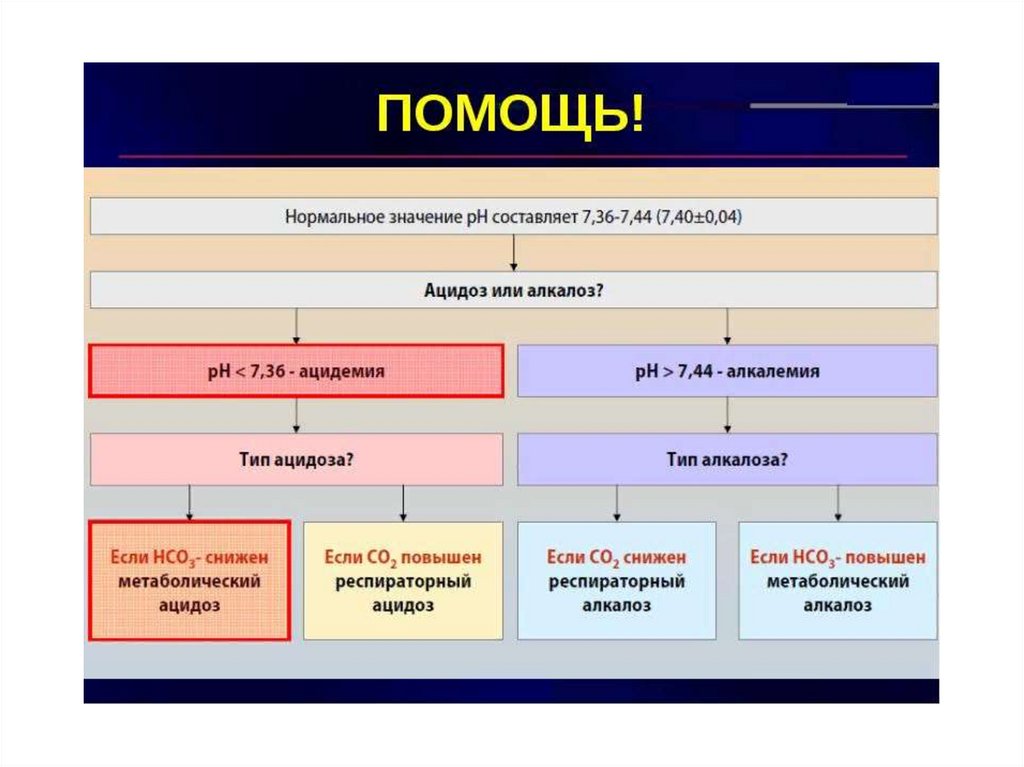
30. АЦИДОЗ
• Ацидоз — нарушение кислотно-щелочногоравновесия, характеризующееся появлением в
крови абсолютного или относительного избытка
кислот и повышением концентрации водородных
ионов.
• Алкалоз — нарушение кислотно-щелочного
равновесия, при котором происходит абсолютное
или относительное увеличение количества
оснований и понижение концентрации
водородных ионов.
31. По механизму развития ацидозы и алкалозы делят
Метаболические – с нарушением метаболизмаРеспираторные – нарушение дыхания
32.
33. Мощность буферных систем плазмы крови и цельной крови
34. Буферные системы крови
Гидрокарбонатнаягде s – коэффициент растворимости СО2 в воде
P(CO2) - парциальное давление углекислого газа
Соотношение [HCO3-] / [H2CO3] = 20: 1 при рН = 7,4
Буферная ёмкость по кислоте больше чем по основанию
35.
Является одним из самых мощных буферных систем:1) Связывает 40% лишних Н+
2) Интегрирует работу основных буферных систем и физиологических
механизмов регуляции КОС
Основная локализация: внеклеточная; Емкость: 10% ;
Поддерживает рН=7, 4 ( рСО 2 =40 мм. рт. ст, Na + =150 ммоль/л ) В связи с
этим, гидрокарбонатный буфер является индикатором КОС, определение его
компонентов – основа для диагностики нарушения КОС.
36. Гемоглобиновый буфер
- главная буферная система эритроцитов, надолю которой приходится около 75% всей
буферной емкости.
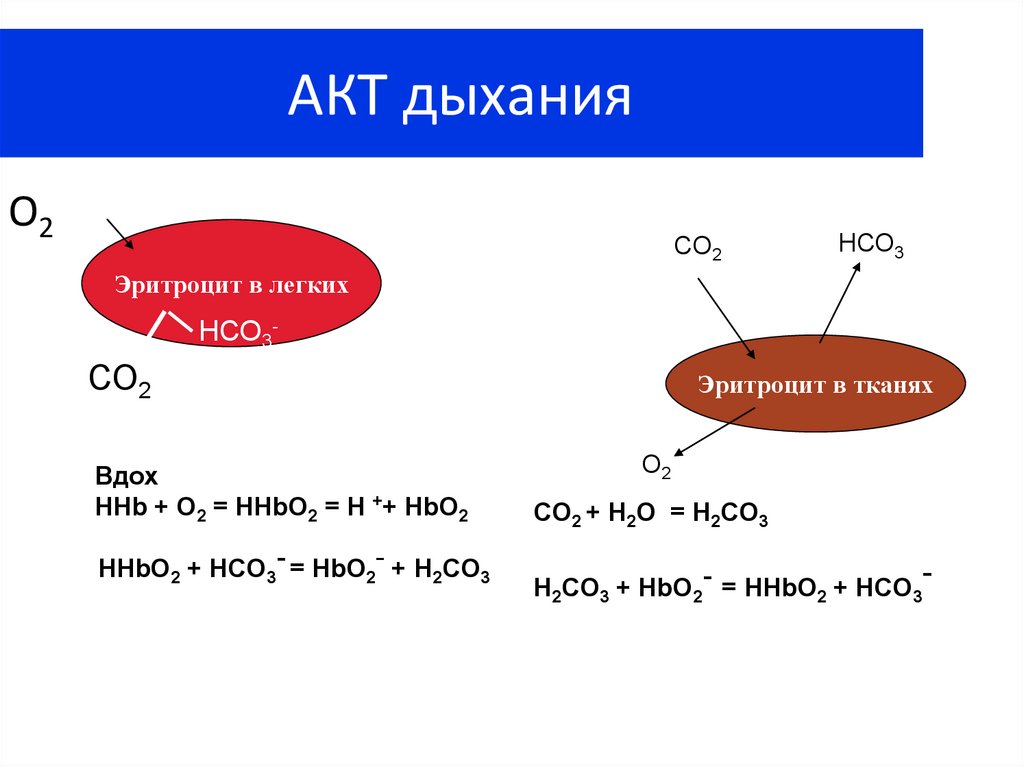
37. АКТ дыхания
О2СО2
НСО3
Эритроцит в легких
НСО3-
СО2
Вдох
HHb + O2 = HHbO2 = H ++ HbO2
HHbO2 + HCO3- = HbO2- + H2CO3
Эритроцит в тканях
О2
CO2 + H2O = H2CO3
H2CO3 + HbO2- = HHbO2 + HCO3
-
38. Фосфатная буферная система
NaH2 PO4/ Na2H PO4 в межклеточном пространствеKH2 PO4/ K2H PO4 в клетке
- Консервативна
- Продукты нейтрализуются через почки
- Концентрация акцепторов H PO42- > доноров
H2 PO4-
- Их соотношение 4:1
39.
40.
41.
Таким образом, буферные системы крови всочетании друг с другом участвуют сразу в
нескольких важнейших физиологических
процессах организма: дыхании, транспорте
кислорода в ткани и поддержании
постоянства рН в крови.
































 chemistry
chemistry








