Similar presentations:
Ионное произведение воды
1.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ.Электролитическая диссоциация воды:
H 2O( Ж ) H 2O( Ж ) H3O ( Р) HO ( Р)
H 2 O H HO
[ H ] [ HO ]
Ka
1.82 10 16
[ H 2 O]
[ H 2O] 55.56 моль / л Const
1
2.
K H 2O [ H ] [ HO ]При 220С
КW = [H+] [HO-] = 10-14
Нейтральная среда:
7
[ H ] [ HO ] 1.0 10 моль / л
Кислая среда характеризуется соотношением:
7
[ H ] [ HO ]; т.е.[ H ] 10 моль / л
Щелочная среда характеризуется соотношением:
7
[ H ] [ HO ]; т.е.[ H ] 10 моль / л
2
3.
Для удобства оценки характера водной средыбезразмерную величину – водородный показатель
используют
pH lg[ H ]
pOH lg[ HO ]
Ионное произведение воды в логарифмической форме:
pH pOH 14
В кислой среде
В щелочной среде
[H+] > 10-7;
[H+] < 10-7;
pH 14 pOH
pH<7
pH>7
pOH 14 pH
3
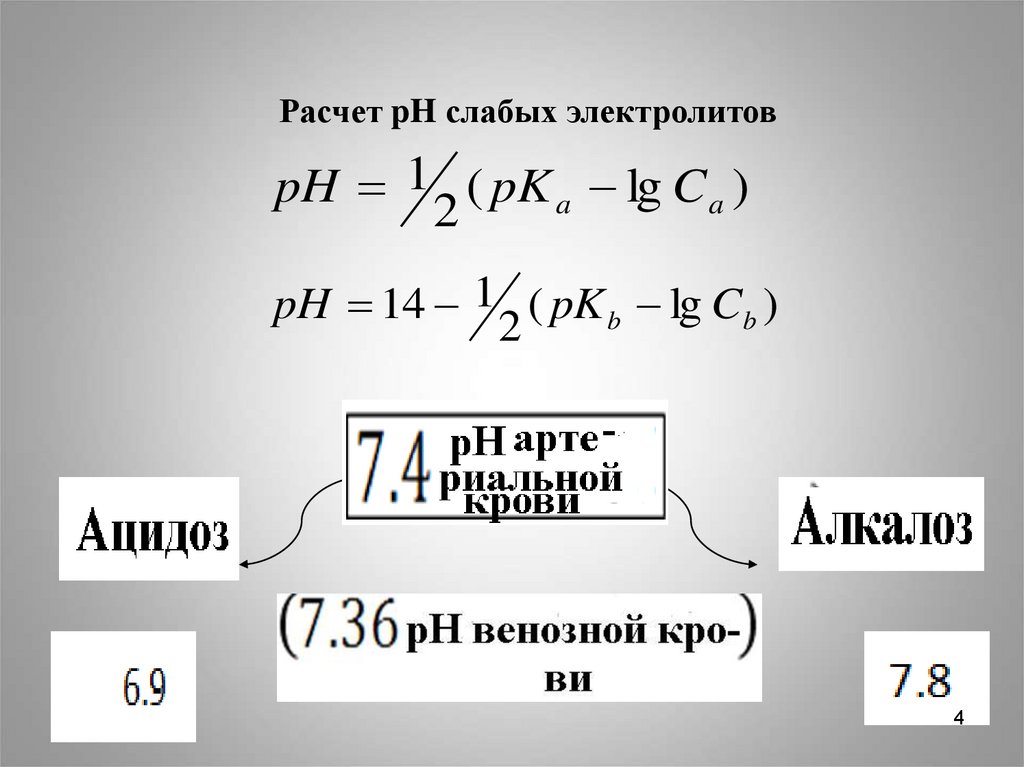
4.
Расчет pH слабых электролитовpH 1 ( pK a lg C a )
2
pH 14 1 ( pK b lg Cb )
2
4
5.
ГИДРОЛИЗ СОЛЕЙГидролиз солей – процесс обменного разложения соли
водой с образованием слабых кислот или/и оснований.
Различают обратимый и необратимый гидролиз солей.
Гидролизу подвергаются только те соли, которые содержат
ионы, соответствующие слабым кислотам или основаниям.
Суть реакции гидролиза заключается в переходе протона от
молекулы воды к аниону соли или от катиона к молекуле воды.
Гидролизу не подвергаются соли,
кислотой и сильным основанием.
образованные
сильной
Гидролизу подвергаются соли образованные :
а) сильной кислотой и слабым основанием;
б) сильным основание и слабой кислотой;
5
6.
в) слабой кислотой и слабым основанием.Рассмотрим пример гидролиза соли, образованной сильной
кислотой и слабым основанием (NH4Cl, AlCl3, CuSO4) гидролизуется
по катиону.
NH 4Cl H 2O NH 4OH HCl
NH 4 Cl H 2 O NH 4 OH H Cl
NH 4 H 2 O NH 4 OH H
кислота
основание
основание’ кислота’
6
7.
KCN H 2O HCN KOHCN H 2 O HCN HO
Гидролиз многозарядного аниона протекает ступенчато:
Na3 PO4 3H 2 O H 3 PO4 3NaOH
3
PO4 H 2 O HPO4
основание
кислота
2
2
HO
кислота’
I ступень
основание’
HPO4 H 2 O H 2 PO4 HO
H 2 PO4 H 2 O H 3 PO4 HO
3
PO4 3H 2O H 3 PO4 3HO
Среда щелочная (pH>7), лакмус-синий.
II ступень
III ступень
общее уравнение
7
8.
Пример гидролиза соли, образованной слабой кислотой ислабым основанием (CH3COONH4,Аl(CH3COO)3, (NH4)2CO3, Cr2S3)
(гидролизуется и по катиону, и по аниону).
CH 3COONH 4 H 2 O CH 3COOH NH 4 OH
CH 3COO NH 4 H 2O CH 3COOH NH 4OH
Характер среды водного раствора таких солей зависит от
соотношения констант диссоциации образующихся кислоты и
основания. (значение pH близка к нейтральной).
Необратимый гидролиз.
Равновесие смещено в сторону образования продуктов
гидролиза. Процесс протекает практически необратимо, т.к. оба
продукта реакции уходят из зоны реакции в виде осадка или
газа.
Cr2 S 3 6 H 2 O 2Cr (OH ) 3 3H 2 S
8
9.
Количественно гидролиз солей может быть охарактеризованстепенью гидролиза (h) и константой гидролиза (Kh).
Степень
гидролиза
(h)
показывает
отношение
числа
прогидролизовавшихся молекул соли к общему числу молекул соли в
растворе.
Степень гидролиза (h) зависит от:
Nh
а. природы
h
б. температуры
No
в. концентрации.
Kh
K H 2O
Ka
Kh
Константа гидролиза (Kh) зависит от:
а. природы соли;
б. температуры;
не зависит от концентрации.
K H 2O
Kb
Kh
Kh
h
C
K H 2O
Kb Ka
9
10.
Формуладля
расчета
рН
среды
раствора
гидролизующейся по аниону (среда щелочная):
соли,
1
pH 7 ( pK a lg C(сол и) )
2
Формула
для
расчета
рН
среды
раствора
гидролизующейся по катиону (среда кислая):
соли,
1
pH 7 ( pK b lg C(соли) )
2
10
11.
БУФЕРНЫЕ РАСТВОРЫБуферный
раствор
–
это
раствор,
содержащий
протолитическую
равновесную
систему,
способную
поддерживать практически постоянным значений pH при его
разбавлении или при добавлении к раствору небольших
количеств сильных кислоты или щелочи.
Буферные системы делятся на кислотные и основные.
Кислотные буферные системы - растворы, содержащие
слабую кислоту (донор протонов) и соль этой кислоты (акцептор
протонов) - сопряженное с этой кислотой основание.
HA ↔ H+ + A11
12.
Например,ацетатная буферная система - смесь уксусной кислоты и ацетата
натрия (CH3COOH/CH3COO-)
гидрокарбонатная буферная система (CO2 . H2O/HCO3-)
гидрофосфатная – (H2PO4-/HPO42-).
Основные буферные системы – растворы, содержащие слабые
основания (акцептор протона) и соль этого основания (донор
протона)-сопряженная с этим основанием кислота.
Например,
аммиачная буферная система – слабого основания NH3 . H2O и
его соли NH4Cl (NH3 . H2O /NH4+).
этиламиновая буферная система ( С2Н5NH2/C2H5NH3+).
12
13.
Механизм действия буферного раствора(на примере ацетатного буфера).
CH 3COOH H CH 3COO
Кислотный компонент
CH 3COONa CH 3COO Na
основный компонент
CH 3 COO H 2 O CH 3COOH HO
При добавлении небольших количеств сильной кислоты:
CH 3COO H CH 3COOH
При добавлении небольших количеств сильной основания:
CH 3COOH HO CH 3COO H 2 O
13
14.
Важными характеристиками буферной системы являютсяего pH и буферная емкость.
Уравнение Гердерсона-Хассельбаха
C (соли )
pH pK a lg
C (кисл.)
Для основной буферной системы:
C (соли )
pH 14 pK b lg
С (основ.)
14
15.
Буферная емкость измеряется количеством кислоты илищелочи (моль-эквивалента), добавление которых к 1 л
буферного раствора изменяет pH на единицу.
C ( 1 кисл.) V (кисл.)
z
Bk
pH V (б. р.)
C ( 1 щел.) V (щел.)
z
Bщ
pH V (б. р.)
Буферные системы организма
Основными буферными системами организма являются:
1. гидрокарбонатная;
2. фосфатная;
3. гемоглобиновая;
4. белковая.
15
16.
Гидрокарбонатная буферная система (CO2 . H2O/HCO3-)H HCO3 H 2CO3 CO2 H 2 O
Гидрофосфатная буферная система содержится как в крови, так и в
клеточной жидкости других тканей, особенно почек.
В клетках состав системы - K2HPO4/KH2PO4 ,
в плазме крови и межклеточной жидкости – Na2HPO4/NaH2PO4.
H HPO4
2
H 2 PO4
2
HO H 2 PO4 HPO4
16
17.
Гемоглобиновая буферная система является сложнойбуферной системой эритроцитов: ННb/Hb- и HHbO2/HbO2- .
Механизм действия системы основан на реакциях:
H Hb HHb
pKa(HHb) = 8.2
H HbO 2 HHbO 2 HHb O2
pKa(HHbO2) = 6.95
При добавлении кислот (увеличение Н+ ) в первую очередь
реагируют анионы гемоглобина.
При действии оснований оксигемоглобин проявляет большую
активность:
HO HHbO 2 HbO 2 H 2 O
HO HHb Hb H 2 O
17
18.
Гемоглобиновая система крови играет важную роль в несколькихважнейших физиологических процессах: дыхания, транспорте
кислорода в ткани и поддержании постоянства pH внутри
эритроцитов и крови.
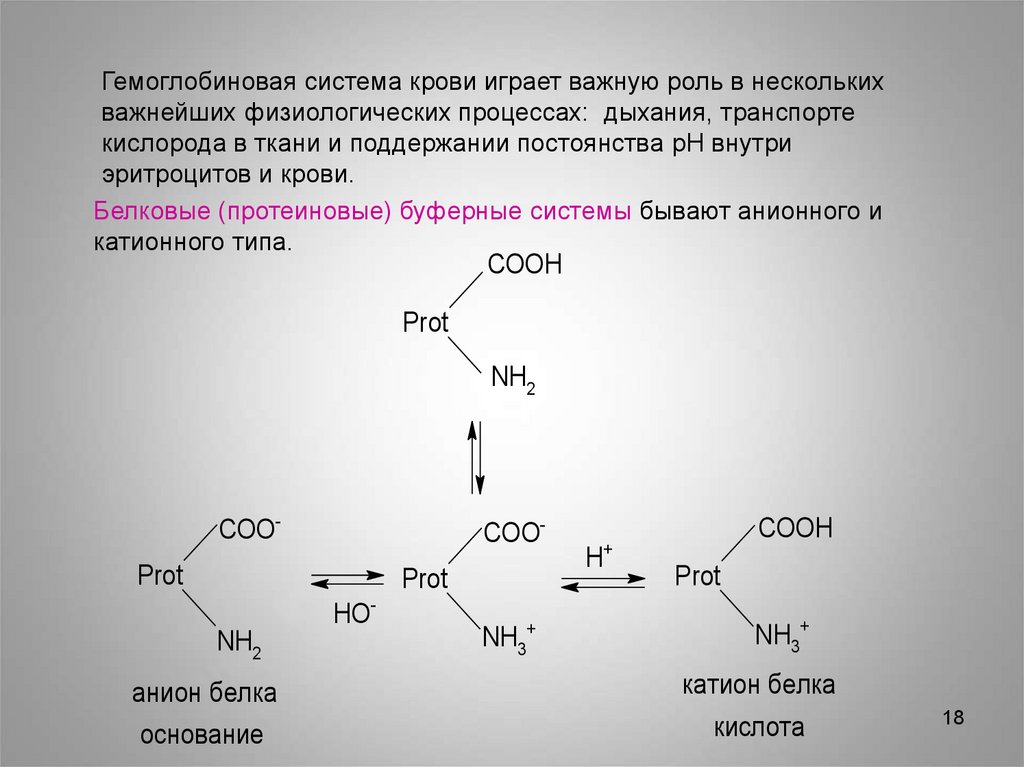
Белковые (протеиновые) буферные системы бывают анионного и
катионного типа.
COOH
Prot
NH2
COO-
COO-
Prot
Prot
HONH2
NH3+
COOH
+
H
Prot
NH3+
анион белка
катион белка
основание
кислота
18
















 chemistry
chemistry








