Similar presentations:
Полимерные растворы. Условия образования
1.
Полимерные растворы – условия образования+
Макромолекулы
Молекулы
растворителя
G2
H2
S2
Gсм = Hсм – T Sсм 0
Gсм = Gр - G1 - G2
Hсм = Hр - H1 - H2
Sсм = Sр - S1 - S2
Gсм = Gсм (Т, С)
G1
H1
S1
Полимерный
раствор
Gр
Hр
Sр
Правило фаз Гиббса
К–Ф+1=f
К – количество компонентов;
Ф – количество фаз;
f – количество степеней свободы;
2.
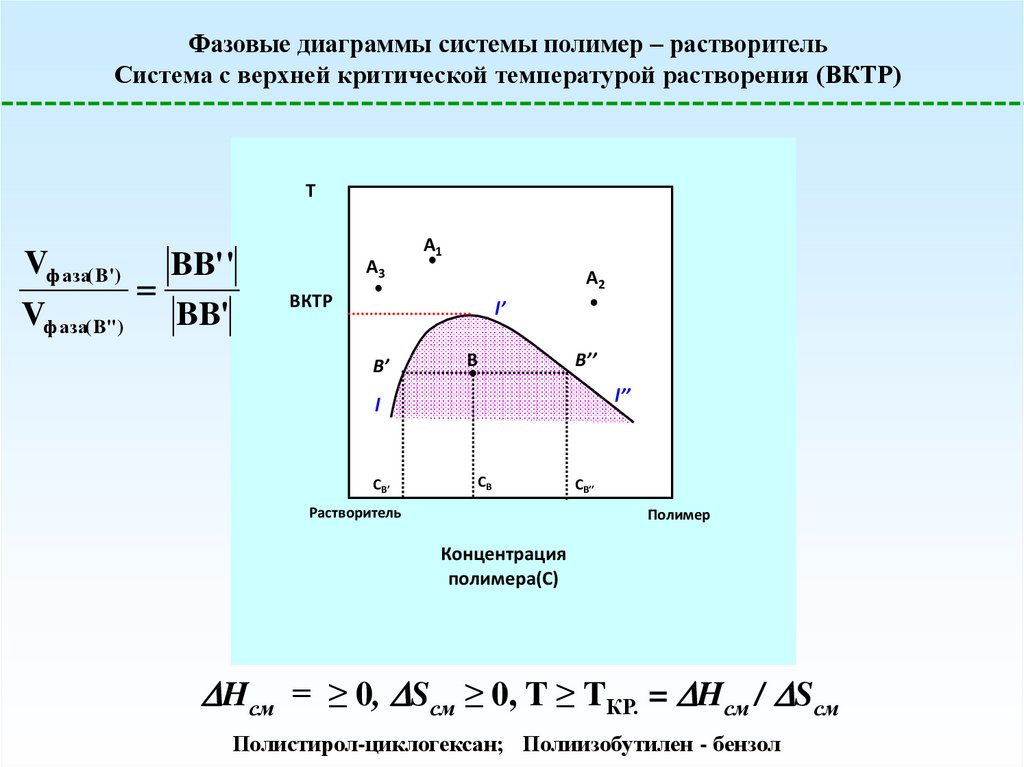
Фазовые диаграммы системы полимер – растворительСистема с верхней критической температурой растворения (ВКТР)
T
Vф аза( B')
Vф аза( B'')
BB' '
BB'
A3
A1
A2
ВКТР
l’
B’
B
B’’
l’’
l
СB’
СB
Растворитель
СB’’
Полимер
Концентрация
полимера(С)
Hсм = ≥ 0, Sсм ≥ 0, T ≥ TКР. = Hсм / Sсм
Полистирол-циклогексан; Полиизобутилен - бензол
3.
Фазовые диаграммы системы полимер – растворительСистема с нижней критической температурой растворения (НКТР)
T
Две фазы
НКТР
Одна фаза
С
Hсм = ≤ 0, Sсм ≤ 0, T ≤ TКР. = Hсм / Sсм
Полиоксиэтилен - вода; нитроцеллюлоза – этанол;
4.
Фазовые диаграммы системы полимер – растворительСистемы с НКТР и ВКТР
Б
A
T
T
ВКТР
Две фазы
Одна фаза
Две фазы
НКТР
Одна фаза
ВКТР
Две фазы
НКТР
С
С
ВКТР ≥ НКТР
ВКТР ≤ НКТР
Полипропиленоксид - вода
5.
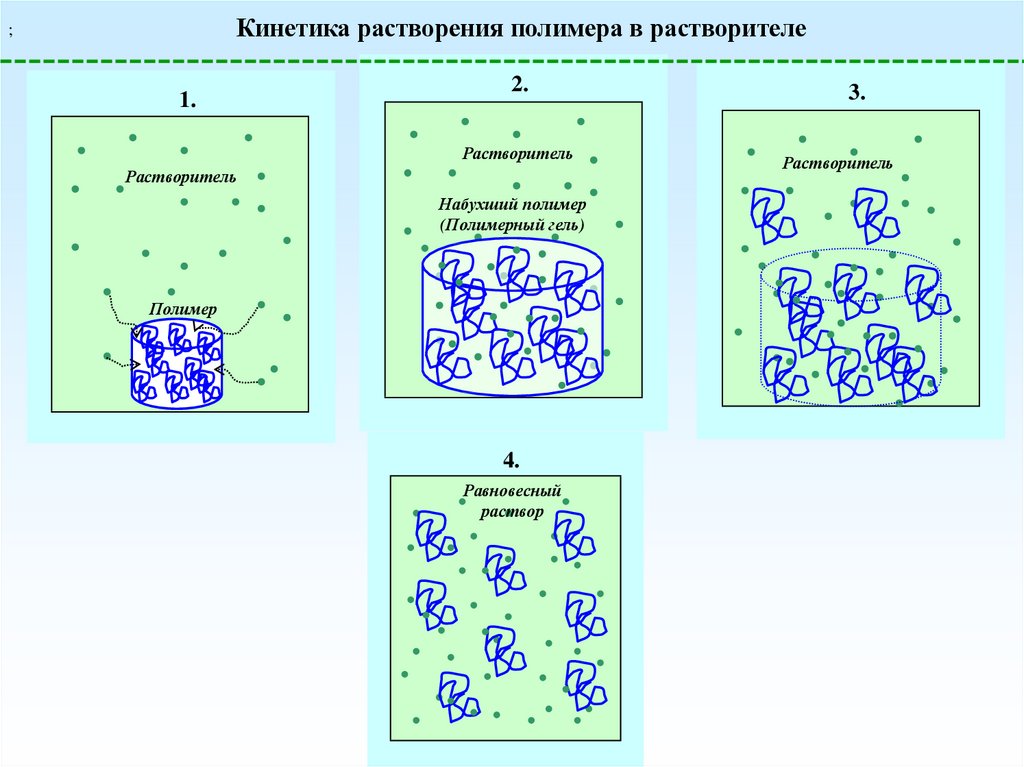
Кинетика растворения полимера в растворителе;
1.
2.
Растворитель
Растворитель
Набухший полимер
(Полимерный гель)
Полимер
4.
Равновесный
раствор
3.
Растворитель
6.
Концентрационные режимы полимерных растворов1
2
3
Полуразбавленные
растворы
Концентрированные
растворы
d
2 Rg
Разбавленные
растворы
d >> 2RG
d ≤ 2RG
d А
А – статистический сегмент
Концентрация крсоссовера (cross over) - C*
d = 2RG ; * = Vпол./Vр-р = 1.
7.
Осмос, осмотическое давление и осмометрия= gh
Капилляр
h
Ячейка раствора
1
2
Полупроницаемая
мембрана
Ячейка растворителя
G см
0
0
n
1 1
( 1 1 )
1
T,p,n2
1
V10
V10
V10
V10
Уравнение состояния раствора
( C, T, Х )
Х = химическая природа полимера и растворителя
8.
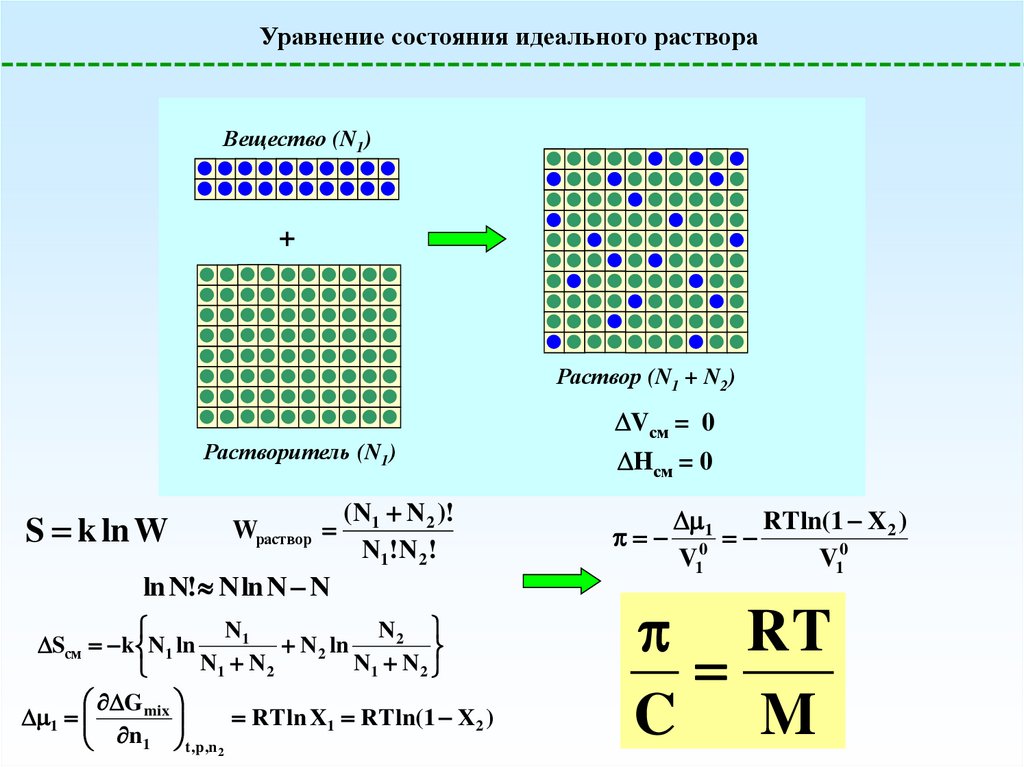
Уравнение состояния идеального раствораВещество (N1)
+
Раствор (N1 + N2)
Растворитель (N1)
S k ln W
Wраствор
( N1 N 2 )!
N1 ! N 2 !
ln N! N ln N N
N1
N2
Sсм k N1 ln
N 2 ln
N1 N 2
N1 N 2
G mix
1
RT ln X1 RT ln(1 X 2 )
n
t ,p ,n
1
2
Vсм = 0
Hсм = 0
1
RT ln(1 X2 )
V10
V10
RT
C M
9.
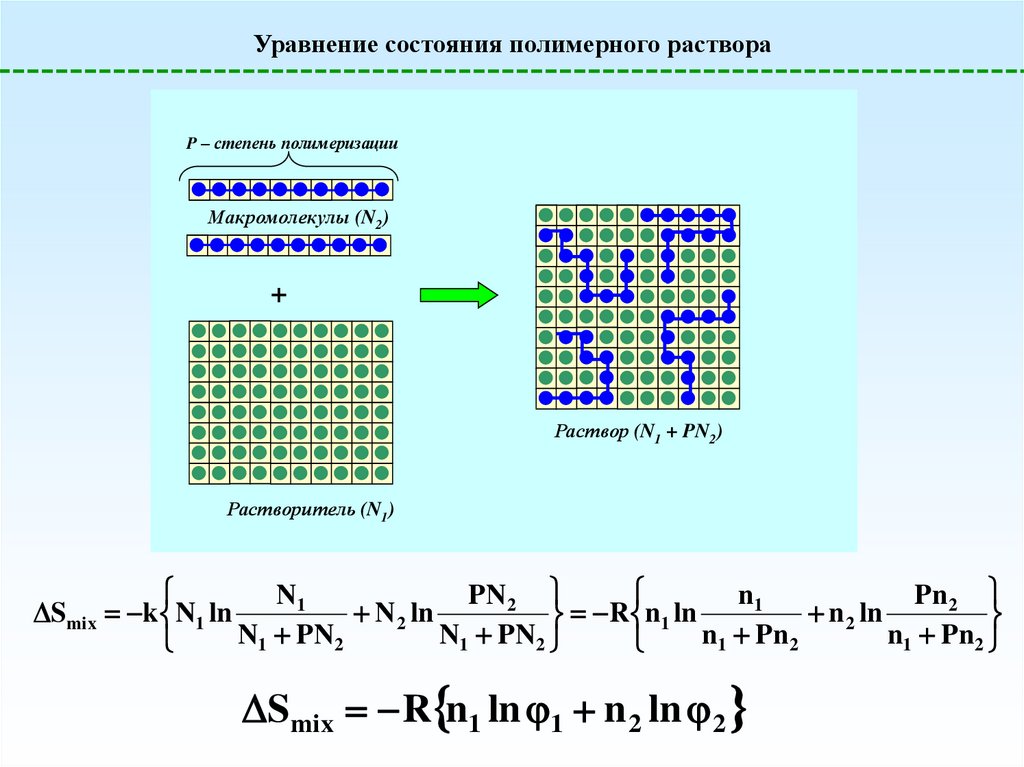
Уравнение состояния полимерного раствораP – степень полимеризации
Макромолекулы (N2)
+
Раствор (N1 + PN2)
Растворитель (N1)
N1
PN2
n1
Pn2
Smix k N1 ln
N 2 ln
n 2 ln
R n1 ln
N
PN
N
PN
n
Pn
n
Pn
1
2
1
2
1
2
1
2
Smix R n1 ln 1 n 2 ln 2
10.
Энергетический параметр взаимодействия Флори-ХаггинсаE11 > 0
E22 > 0
Контакт
Р-тель-Р-тель
(1-1)
Контакт
Пол.-Р-тель
(1-2)
Контакт
Пол.-Пол.
(2-2)
+
Контакт
Р-тель-Р-тель
(1-1)
E12 > 0
2
Контакт
Пол.-Пол.
(2-2)
1
E N A E12 (E22 E11 )
2
E E / N A
RT
kT
Контакт
Р-тель-Пол.
(1-2)
Hmix n1 2 E
H mix RTn 1 2
11.
Уравнение состояния полимерного раствораG mix Hmix T Smix T Smix RT n1 2 n1 ln(1 2 ) n 2 ln 2
G mix
1
1
RT ln(1 2 ) 1 2 22
P
n1 t ,p ,n2
22
ln(1 2 ) 2
2
1
RT 2 1
2
0 0 2
V1
V1 P 2
1
1 1
2
RT
C 2 C
2M1 2
M2
1 1
A2 2
2M 1 2
1
RT C A 2C2
M
RT
RTA 2C
C M
12.
13.
Определения -температуры для данной системы полимер - растворитель1
A2 2
S 1
T
2M 1
~
I
~
H
~
S
-температура - температура, при которой раствор полимера формально
подчиняется законам идеальных растворов (законы Рауля, Вант-Гоффа и др.)
II
1
1
Ткр
1
1
~
S Р
-температура - критическая температура растворения полимера с
бесконечно большой молекулярной массой.
III
N Au
A2
T u 0
2
2M 2
-температура - температура, при которой исключенный объём клубка (u)
равен нулю. Исключенный объем – область пространства, в которую данный
клубок исключает проникновение других клубков. В -условиях клубок
принимает такие размеры, какие он принял бы, если бы растворителя не
было совсем.
14.
15.
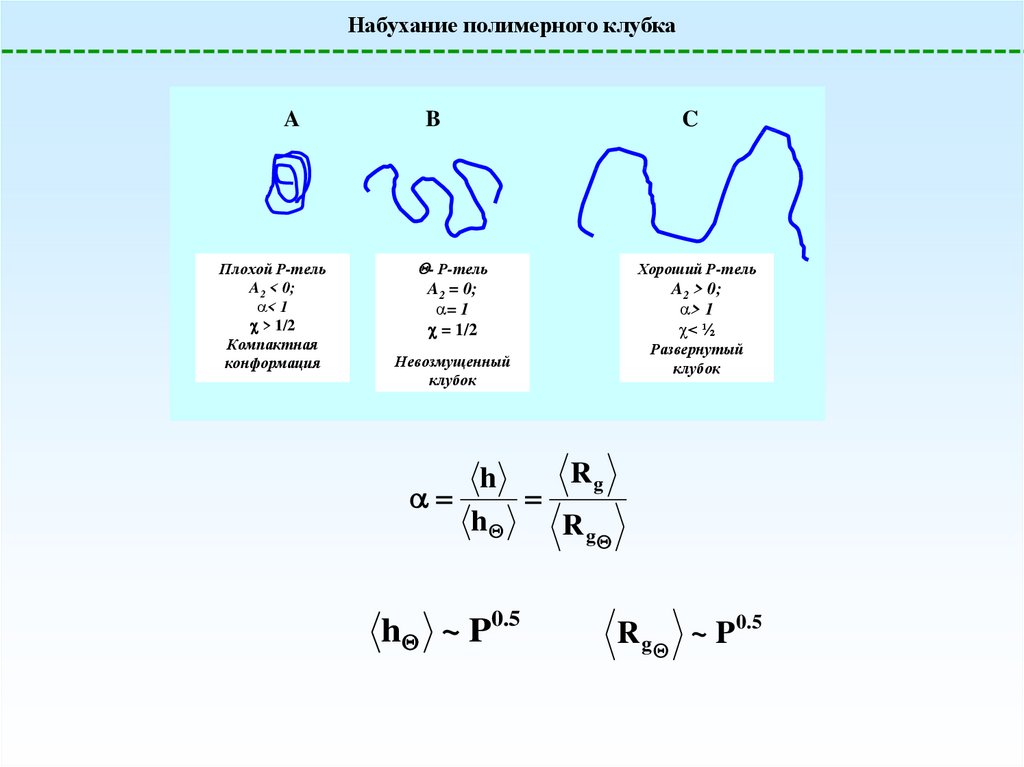
Набухание полимерного клубкаA
Плохой Р-тель
A2 < 0;
< 1
> 1/2
Компактная
конформация
B
- Р-тель
A2 = 0;
= 1
= 1/2
Невозмущенный
клубок
C
Хороший Р-тель
A2 > 0;
> 1
< ½
Развернутый
клубок
Rg
h
h
Rg
h ~ P0.5
R g ~ P 0.5
16.
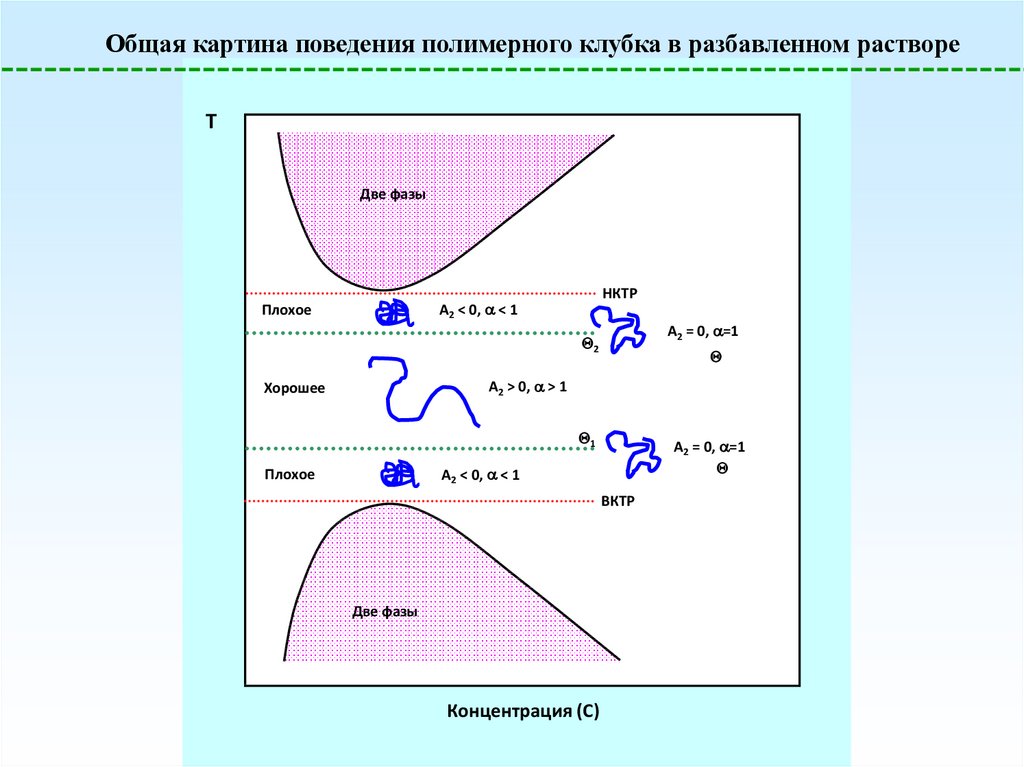
Общая картина поведения полимерного клубка в разбавленном раствореT
Две фазы
НКТР
A2 < 0, < 1
Плохое
A2 = 0, =1
2
A2 > 0, > 1
Хорошее
1
A2 = 0, =1
A2 < 0, < 1
Плохое
ВКТР
Две фазы
Концентрация (C)
17.
Общие принципы исследования макромолекул в растворахБ
A
Свойство раствора (K)
K = K(C)
d
2 Rg
K o lim K (C )
C 0
Разбвлен. р-ры
C < C*
d >> 2 Rg
Концентрация полимера (C)
Задачи исследования полимеров в растворе
1. Определение молекулярной массы изолированных макромолекул - M n M w
2. Определение геометрии (формы) и размеров изолированных макромолекул 3. Определение термодинамического качества растворителя – A2, -температура,
НКТР и/или ВКТР
Определение концентрации кроссовера - С*.
h Rg
18.
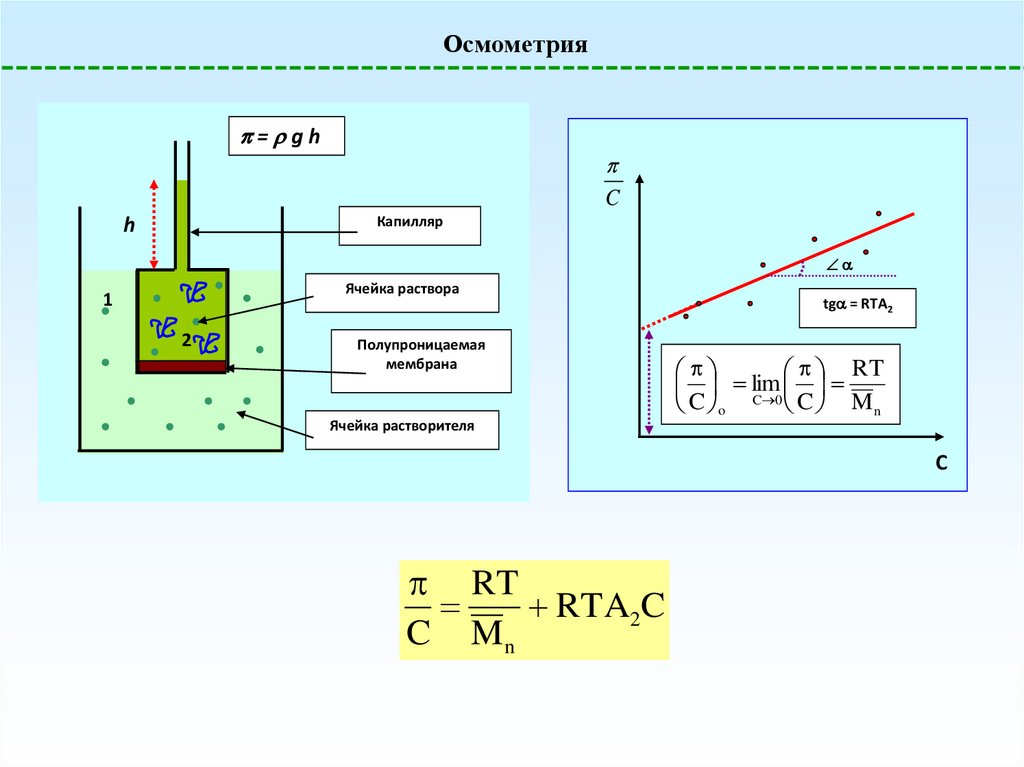
Осмометрия= gh
C
Капилляр
h
Ячейка раствора
1
2
Полупроницаемая
мембрана
tg = RTA2
RT
lim
C 0 C
C
o
Mn
Ячейка растворителя
C
RT
RTA2C
C Mn
19.
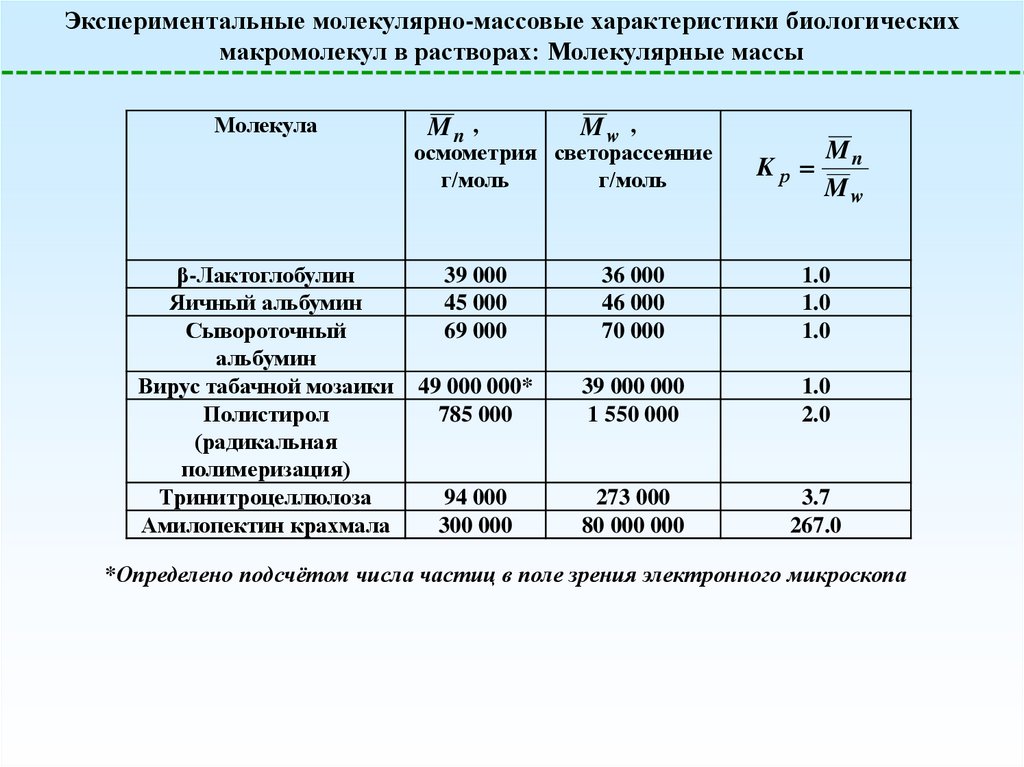
Экспериментальные молекулярно-массовые характеристики биологическихмакромолекул в растворах: Молекулярные массы
Молекула
Mn ,
Mw ,
осмометрия светорассеяние
г/моль
г/моль
β-Лактоглобулин
Яичный альбумин
Сывороточный
альбумин
Вирус табачной мозаики
Полистирол
(радикальная
полимеризация)
Тринитроцеллюлоза
Амилопектин крахмала
Kр
Mn
Mw
39 000
45 000
69 000
36 000
46 000
70 000
1.0
1.0
1.0
49 000 000*
785 000
39 000 000
1 550 000
1.0
2.0
94 000
300 000
273 000
80 000 000
3.7
267.0
*Определено подсчётом числа частиц в поле зрения электронного микроскопа
20.
Вискозиметрия – определение вязкостиЗакон Ньютона
v,
A
l3
x
li
lB
Б
l2
l1
lA
dv
0
dx
= [пуаз] = [дин*сек/см2] = [г/(см*сек)]
0.01 Пуаз = сПуаз
Вязкость воды – 1 сПуаз.
Вязкость – мера внутреннего трения, возникающего при смещении слоёв жидкости
относительно друг друга. Это также мера энергии, рассеиваемой в форме теплоты в
процессе течения жидкости.
21.
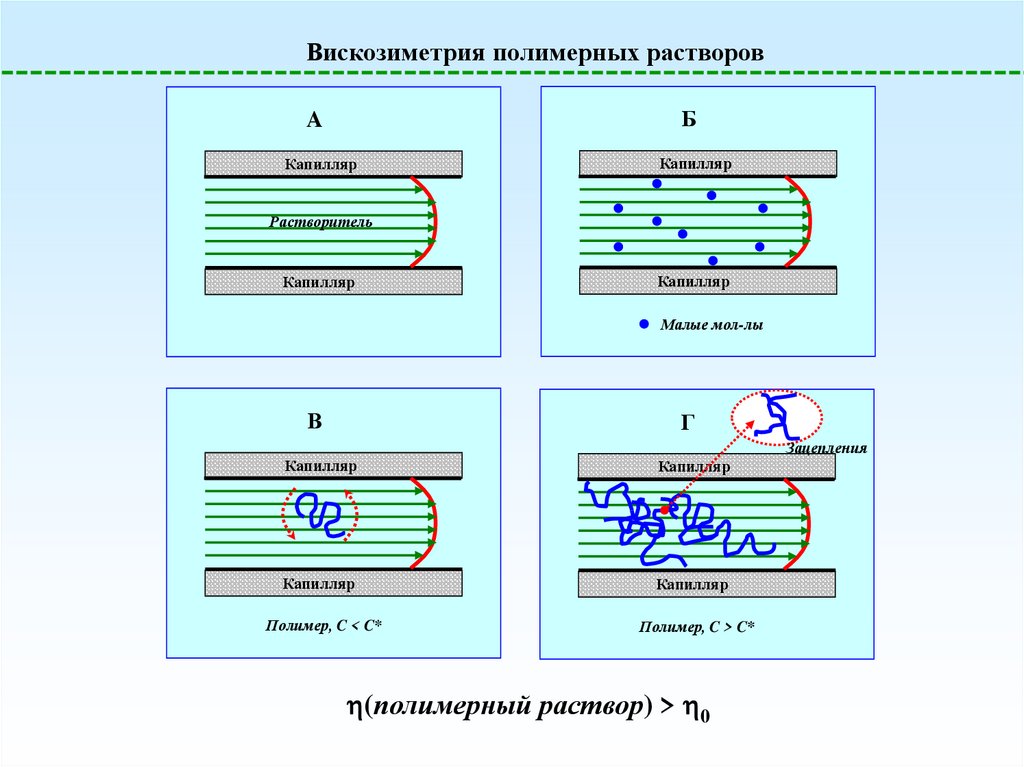
Вискозиметрия полимерных растворовБ
A
Капилляр
Капилляр
Растворитель
Капилляр
Капилляр
Малые мол-лы
В
Г
Зацепления
Капилляр
Капилляр
Капилляр
Капилляр
Полимер, C < C*
Полимер, C > C*
(полимерный раствор) > 0
22.
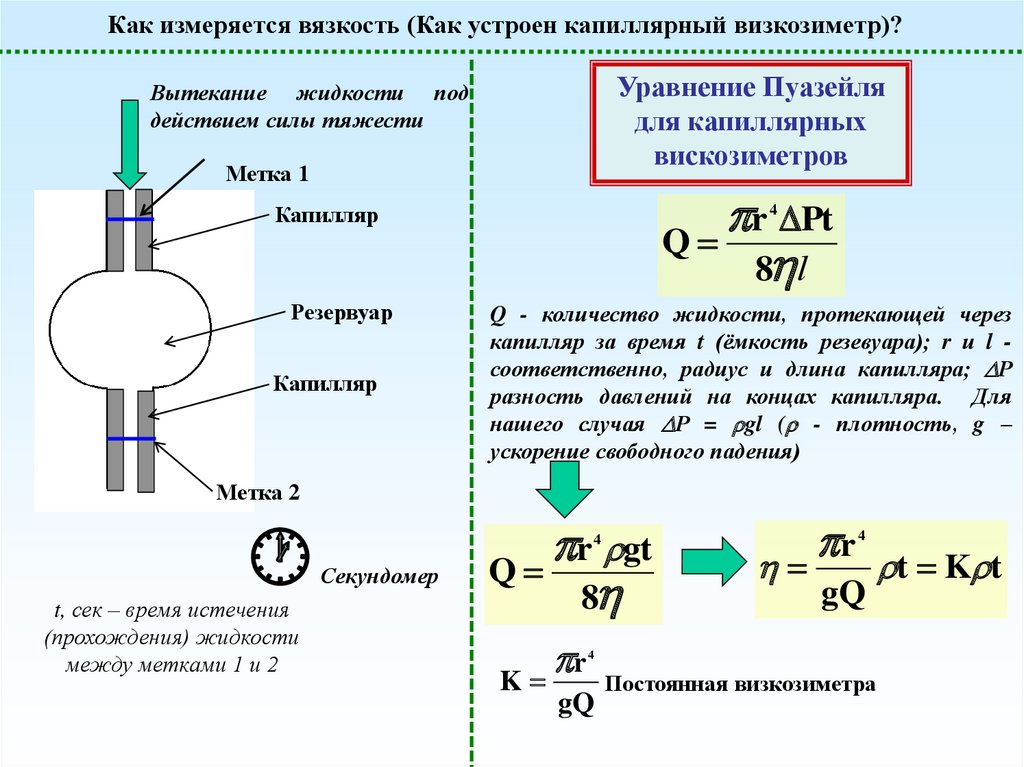
Как измеряется вязкость (Как устроен капиллярный визкозиметр)?Уравнение Пуазейля
для капиллярных
вискозиметров
Вытекание жидкости под
действием силы тяжести
Метка 1
r Pt
Q
8 l
Капилляр
Резервуар
Капилляр
4
Q - количество жидкости, протекающей через
капилляр за время t (ёмкость резевуара); r и l соответственно, радиус и длина капилляра; Р
разность давлений на концах капилляра. Для
нашего случая Р = gl ( - плотность, g –
ускорение свободного падения)
Метка 2
t, сек – время истечения
(прохождения) жидкости
между метками 1 и 2
r gt
Q
8
4
Секундомер
r
K
r
4
gQ
4
gQ
Постоянная визкозиметра
t K t
23.
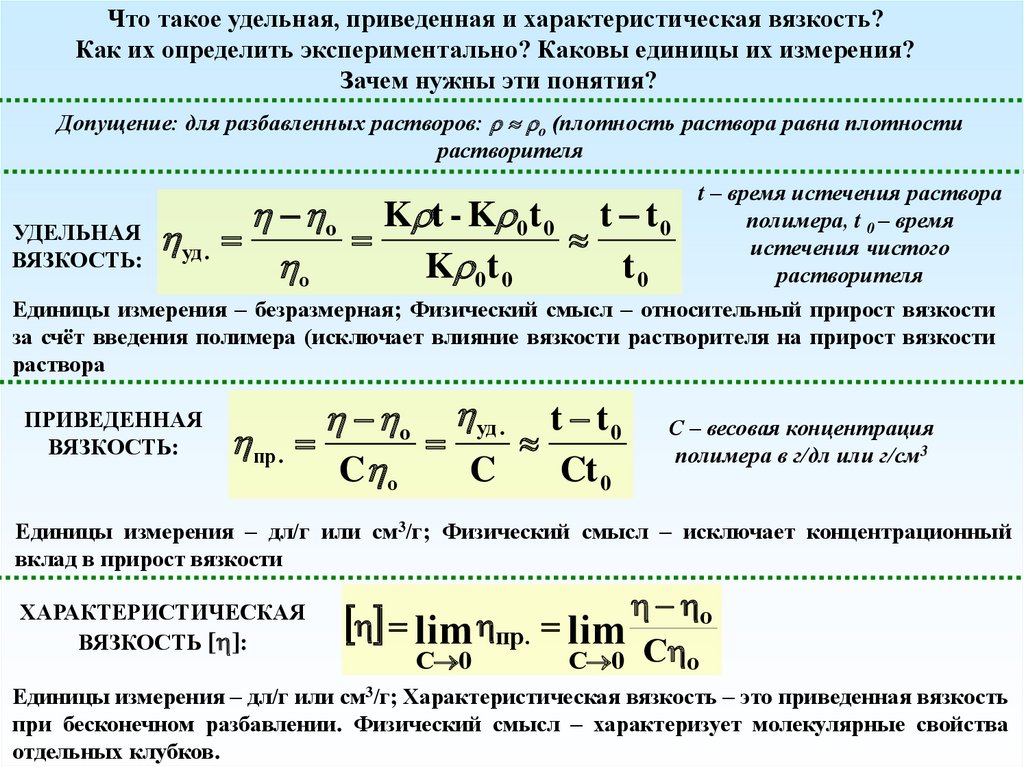
Что такое удельная, приведенная и характеристическая вязкость?Как их определить экспериментально? Каковы единицы их измерения?
Зачем нужны эти понятия?
Допущение: для разбавленных растворов: o (плотность раствора равна плотности
растворителя
t – время истечения раствора
o K t - K 0t 0 t t 0
полимера, t 0 – время
УДЕЛЬНАЯ
истечения чистого
уд .
ВЯЗКОСТЬ:
K
t
t
растворителя
о
0 0
0
Единицы измерения – безразмерная; Физический смысл – относительный прирост вязкости
за счёт введения полимера (исключает влияние вязкости растворителя на прирост вязкости
раствора
ПРИВЕДЕННАЯ
ВЯЗКОСТЬ:
пр .
o уд . t t 0
C о
C
Ct 0
С – весовая концентрация
полимера в г/дл или г/см3
Единицы измерения – дл/г или см3/г; Физический смысл – исключает концентрационный
вклад в прирост вязкости
ХАРАКТЕРИСТИЧЕСКАЯ
ВЯЗКОСТЬ [ ]:
lim пр. lim o
C 0
C 0
С о
Единицы измерения – дл/г или см3/г; Характеристическая вязкость – это приведенная вязкость
при бесконечном разбавлении. Физический смысл – характеризует молекулярные свойства
отдельных клубков.
24.
Как экспериментально определить характеристическую вязкость?Уравнение Хаггинса (эмпирическое) для разбавленных растворов
незаряженных полимеров:
пр.
пр . 2 K hC
tg =[ ]2Kh
[ ]
С, г/дл
Kh - Константа Хаггинса - для гибкоцепных полимеров качественно характеризует
термодинамическое качество растворителя:
Kh = 0.2 0.3 - термодинамически хорошие растворители;
Kh > 0.5 - термодинамически плохие растворители;
25.
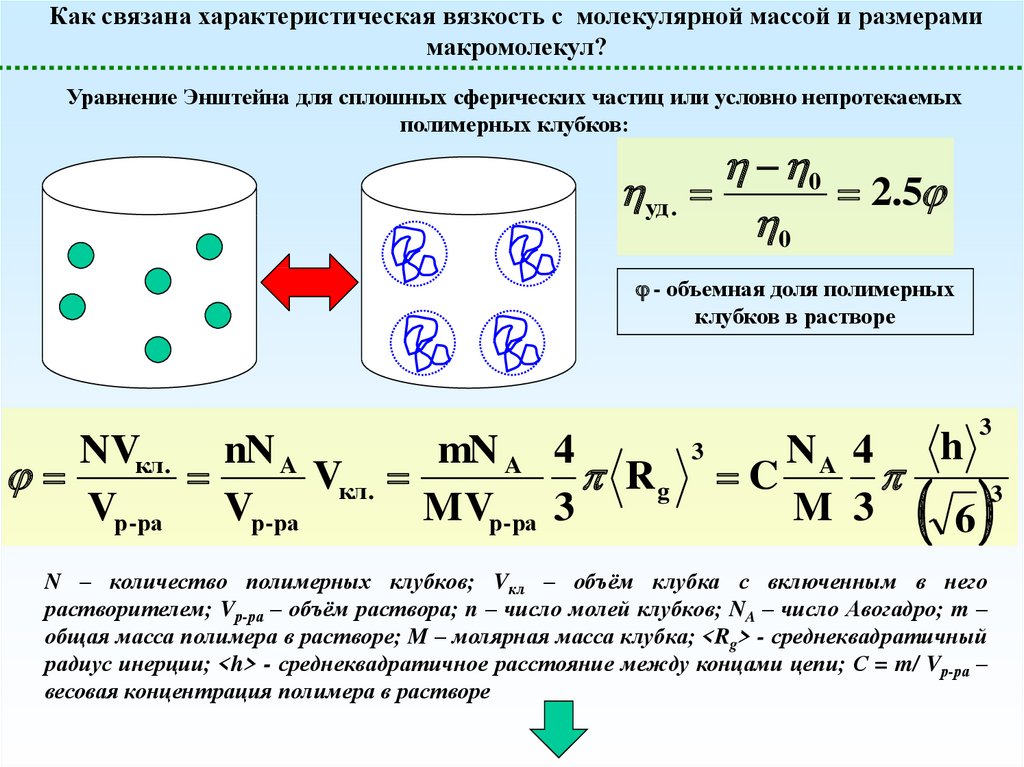
Как связана характеристическая вязкость с молекулярной массой и размерамимакромолекул?
Уравнение Энштейна для сплошных сферических частиц или условно непротекаемых
полимерных клубков:
уд .
0
2.5
0
- объемная доля полимерных
клубков в растворе
NVкл . nN A
mN A 4
Vкл .
Rg
Vр-ра
Vр-ра
MVр-ра 3
3
h
NA 4
C
M 3
6
3
N – количество полимерных клубков; Vкл – объём клубка с включенным в него
растворителем; Vр-ра – объём раствора; n – число молей клубков; NA – число Авогадро; m –
общая масса полимера в растворе; M – молярная масса клубка; <Rg> - среднеквадратичный
радиус инерции; <h> - среднеквадратичное расстояние между концами цепи; С = m/ Vр-ра –
весовая концентрация полимера в растворе
3
26.
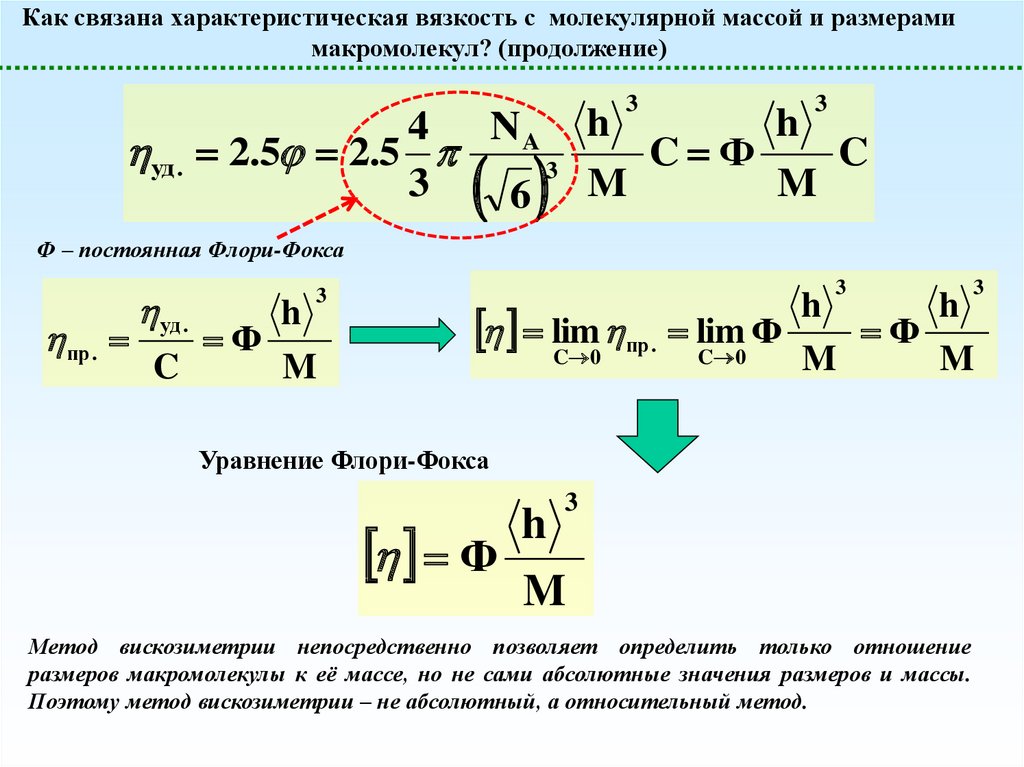
Как связана характеристическая вязкость с молекулярной массой и размерамимакромолекул? (продолжение)
3
уд .
3
h
4 NA h
2.5 2.5
C Ф
C
3
3
M
6 M
Ф – постоянная Флори-Фокса
пр .
уд .
3
h
Ф
C
M
lim
пр .
C 0
3
3
h
h
lim Ф
Ф
C 0
M
M
Уравнение Флори-Фокса
3
h
Ф
M
Метод вискозиметрии непосредственно позволяет определить только отношение
размеров макромолекулы к её массе, но не сами абсолютные значения размеров и массы.
Поэтому метод вискозиметрии – не абсолютный, а относительный метод.
27.
Как из данных вискозиметрии определить коэффициент набухания клубка?В -растворителе
h
Ф
M
В любом другом растворителе:
Коэффициент набухания :
3
3
h
h
Ф
Ф
M
M
3
3
h
h
1
3
28.
НАПОМИНАНИЕ: коэффициент набухания полимерного клубкаA
Плохой р-тель
A2 < 0;
<1
Компактная
конформация
Rg
h
h
Rg
h ~
M
Rg ~ M
B
- р-тель
A2 = 0;
=1
Невозмущенный
клубок
C
Хороший р-тель
A2 > 0;
>1
Развернутый
клубок
- коэффициент набухания. Показывает, во сколько раз
размеры полимерного клубка больше или меньше по
сравнению с -растворителем
В - растворителе клубок имеет такие размеры, как если
бы растворителя не было вообще. Такие размеры
называются «невозмущенными». Когда мы говорили об
изолированном клубке, мы говорили о полимере в растворителе
29.
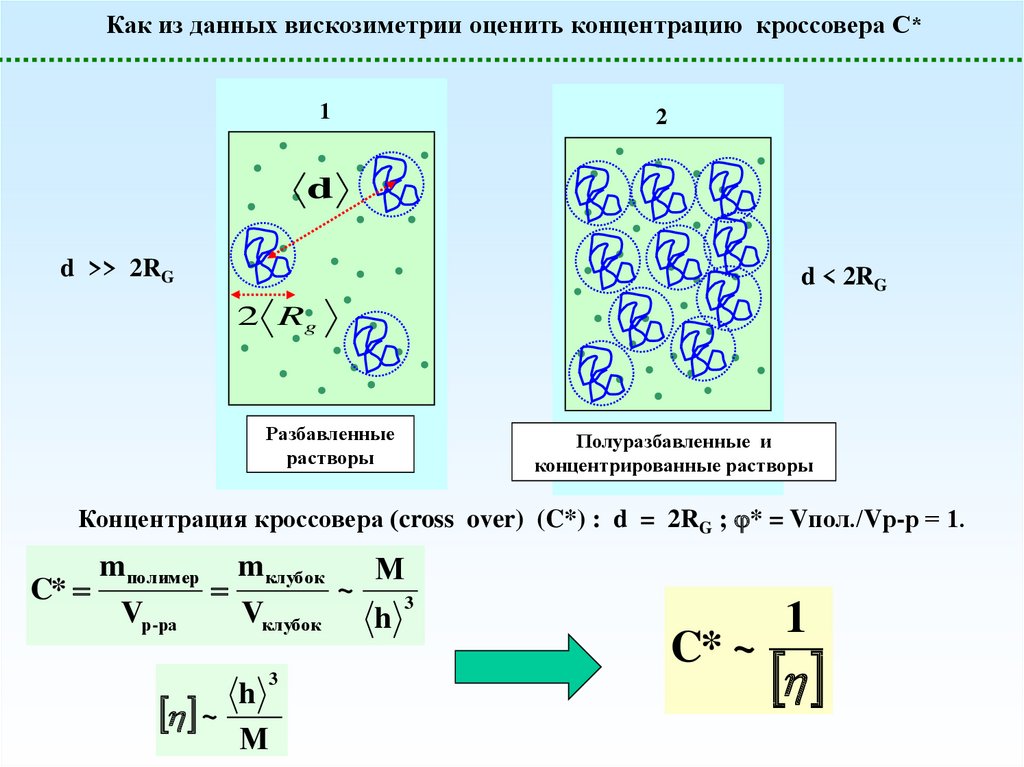
Как из данных вискозиметрии оценить концентрацию кроссовера С*1
2
d
d >> 2RG
d < 2RG
2 Rg
Разбавленные
растворы
Полуразбавленные и
концентрированные растворы
Концентрация кроссовера (cross over) (C*) : d = 2RG ; * = Vпол./Vр-р = 1.
C*
m полимер
Vр-ра
m клубок
Vклубок
3
h
~
М
~
М
h
3
C* ~
1
30.
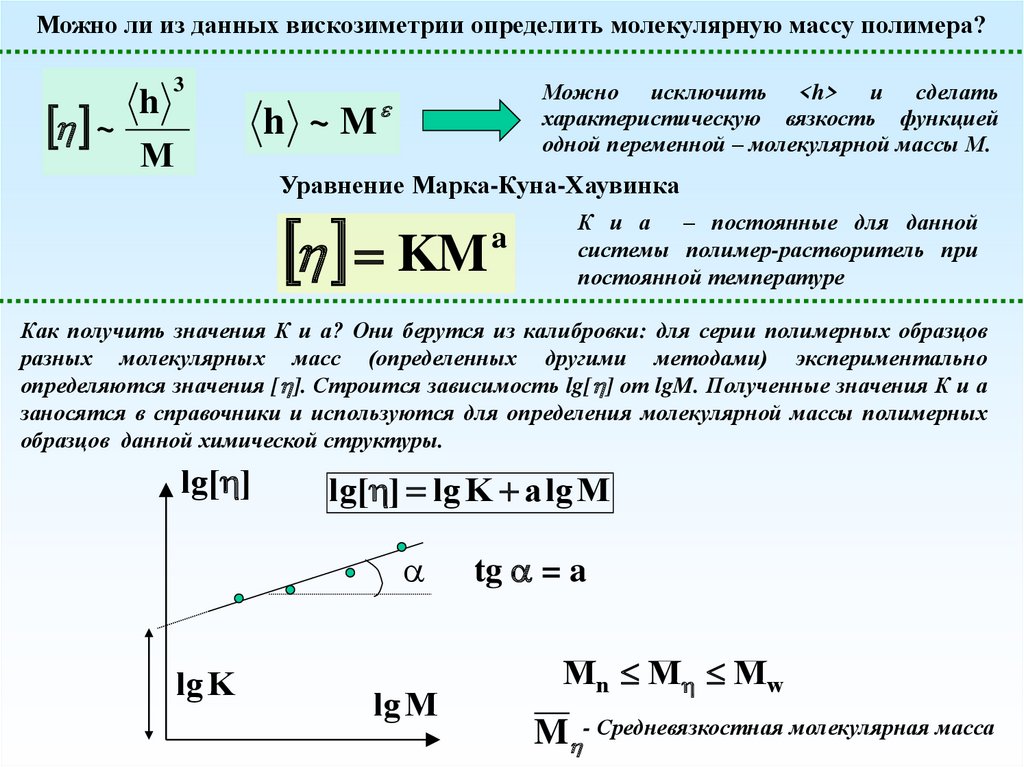
Можно ли из данных вискозиметрии определить молекулярную массу полимера?3
h
~
М
h ~M
Можно исключить <h> и сделать
характеристическую вязкость функцией
одной переменной – молекулярной массы М.
Уравнение Марка-Куна-Хаувинка
KM
a
К и а – постоянные для данной
системы полимер-растворитель при
постоянной температуре
Как получить значения К и а? Они берутся из калибровки: для серии полимерных образцов
разных молекулярных масс (определенных другими методами) экспериментально
определяются значения [ ]. Строится зависимость lg[ ] от lgM. Полученные значения К и а
заносятся в справочники и используются для определения молекулярной массы полимерных
образцов данной химической структуры.
lg[ ]
lg[ ] lg K a lg M
lg K
lg M
tg = a
Mn M M w
M - Средневязкостная молекулярная масса
31.
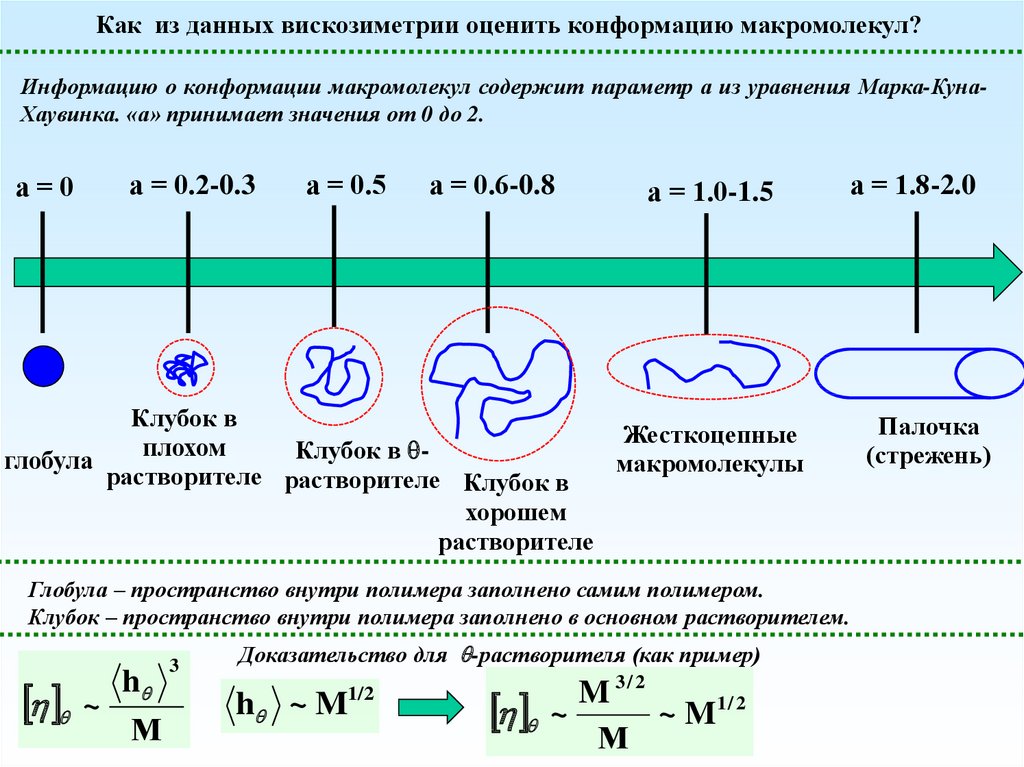
Как из данных вискозиметрии оценить конформацию макромолекул?Информацию о конформации макромолекул содержит параметр а из уравнения Марка-КунаХаувинка. «а» принимает значения от 0 до 2.
а=0
а = 0.2-0.3
а = 0.5
а = 0.6-0.8
а = 1.0-1.5
а = 1.8-2.0
Клубок в
Жесткоцепные
плохом
Клубок
в
глобула
макромолекулы
растворителе растворителе Клубок в
хорошем
растворителе
Глобула – пространство внутри полимера заполнено самим полимером.
Клубок – пространство внутри полимера заполнено в основном растворителем.
h
~
М
3
Доказательство для -растворителя (как пример)
1/2
h ~ M
M 3/ 2
~
~ M1 / 2
М
Палочка
(стрежень)
32.
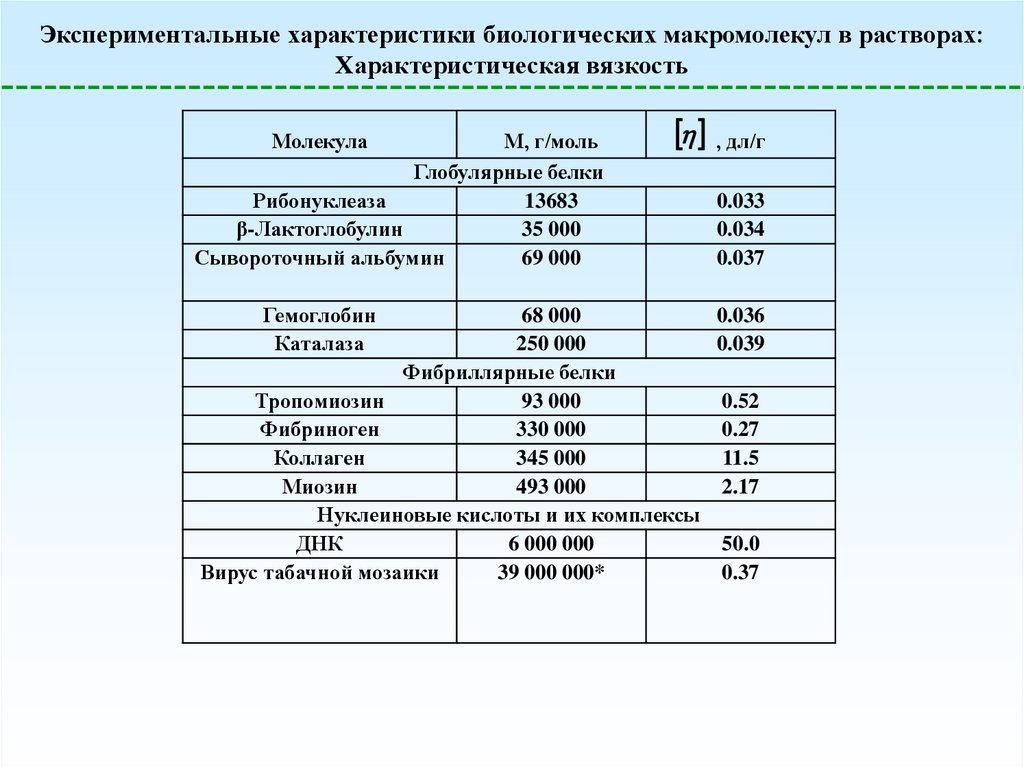
Экспериментальные характеристики биологических макромолекул в растворах:Характеристическая вязкость
Молекула
М, г/моль
Глобулярные белки
Рибонуклеаза
13683
β-Лактоглобулин
35 000
Сывороточный альбумин
69 000
Гемоглобин
Каталаза
, дл/г
0.033
0.034
0.037
68 000
0.036
250 000
0.039
Фибриллярные белки
Тропомиозин
93 000
0.52
Фибриноген
330 000
0.27
Коллаген
345 000
11.5
Миозин
493 000
2.17
Нуклеиновые кислоты и их комплексы
ДНК
6 000 000
50.0
Вирус табачной мозаики
39 000 000*
0.37
33.
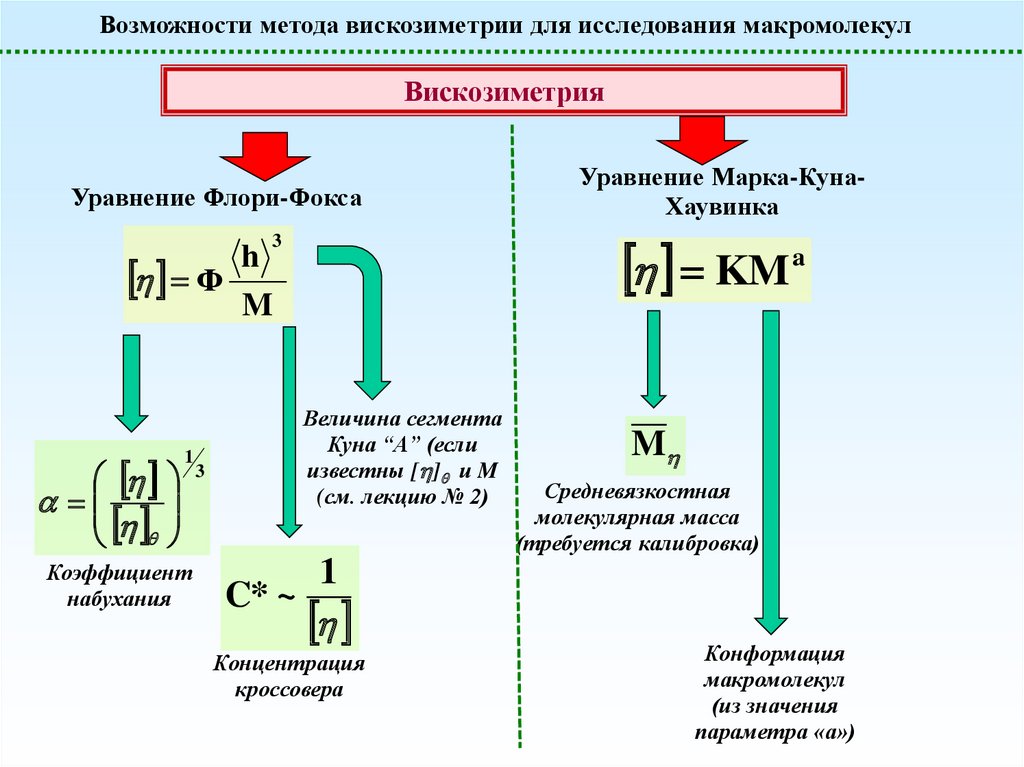
Возможности метода вискозиметрии для исследования макромолекулВискозиметрия
Уравнение Флори-Фокса
KM
3
h
Ф
M
1
Коэффициент
набухания
Величина сегмента
Куна “A” (если
известны [ ] и M
(см. лекцию № 2)
3
C* ~
Уравнение Марка-КунаХаувинка
a
M
Средневязкостная
молекулярная масса
(требуется калибровка)
1
Концентрация
кроссовера
Конформация
макромолекул
(из значения
параметра «а»)
34.
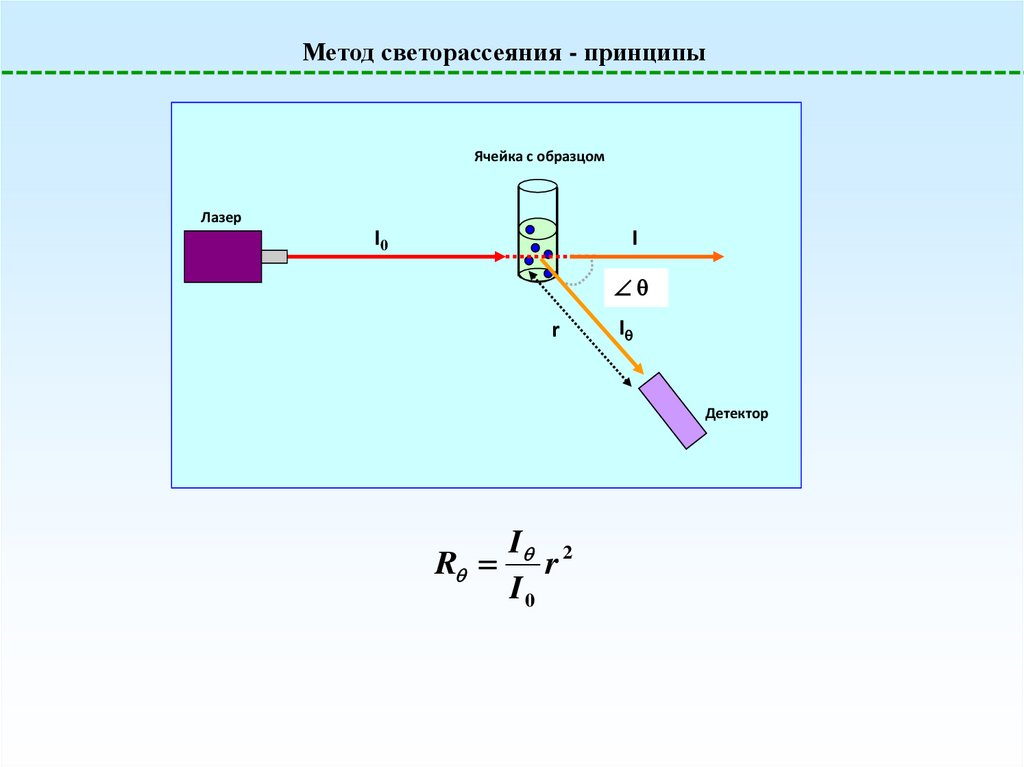
Метод светорассеяния - принципыЯчейка с образцом
Лазер
I0
I
r
I
Детектор
R
I 2
r
I0
35.
Метод светорассеяния для малых частиц2Rg /10
R KC
= 270o
I
I0
I
= 180o
I
= 0o
I
RT
C
dn
4 n
dC
K
N A 4
2
RT
C RTA2C 2
M
RT 2 RTA C
2
C
C
M
= 90o
RT
KC
R KC
1
2 A2C
C M
KC
R
tg = 2A2
KC
1
2 A2C
R
Mw
2
2
0
KC
1
R C 0 M w
C
36.
Метод светорассеяния для крупных частиц= 270o
2Rg > /10
=
I0
180o
KC
1 4 2 2
2
1 k Rg sin 2 A2C ...
R
M w 3
2
o
1 2 3 4C4
2 n0
tg Rg
Со =0; о = 0 Mw
Co
BC sin 2
I
Со =0;
tg A2;
C1
k
о = 0
C2
1
Mw
= 0o
Диаграмма Зимма (двойная экстраполяция):
C3
I
I
= 90o
KC
R
I
2

















 chemistry
chemistry








