Similar presentations:
Таргетная терапия
1.
Государственный медицинский университет г. СемейВыполнила: Карпенко М.И.
Группа: 601 ВОП
Проверила: Андреева О.Б.
Семей 2016 г.
2. План:
1. Введение.2. Ингибиторы факторов роста.
3. Таргетные препараты, блокирующие рецепторы
ангиогенеза.
4. Таргетные препараты – ингибиторы тирозинкиназы.
5. Таргетные препараты,
6. блокирующие белки, осуществляющие проведение
митогенных сигналов.
7. Перспективы и разочарования таргетной терапии.
8. Список использованной литературы.
3. Введение.
•Фундаментальным достижением последнегодесятилетия является образование нового
класса «таргетных,
молекулярно‐ориентированных препаратов»,
создаваемых для воздействия на определенные,
заранее установленные внутриклеточные
молекулярные мишени, имеющие ключевое
значение для жизнедеятельности опухолевой
клетки.
4.
•Все эти мишени имеются и внормальной клетке, но при опухолевой
трансформации происходит их
гиперэкспрессия или гиперактивация,
что и является основанием для
применения определенных таргетных
препаратов.
5.
То есть цели таргетных препаратов в онкологииэто собственные белки организма,
участвующие в процессах
канцерогенеза и определяющие
способность опухоли
к прогрессии и метастазированию
6.
Большинство таргетных препаратов не обладаетспособностью убивать или выраженно повреждать
опухолевые клетки (цитотоксическое воздействие), а
лишь оказывают:
ингибирующее
влияние на
пролиферацию
и/или
(цитостатическое
воздействие)
стимулируют
дифференцировку опухолевых
клеток, за счет
выключения механизмов,
отвечающих за формирование
злокачественного фенотипа
7.
• В связи с этим основным эффектом при ихиспользовании является не излечение, а
длительное сдерживание опухолевого роста или,
в лучшем случае, уменьшение опухолевой массы.
Это никоим образом не уменьшает их потенциальной
значимости, т. к. перевод злокачественной опухоли в
состояние хронического заболевания, текущего
годами, является не менее привлекательной целью,
чем достижение полного излечения.
8.
В онкологии целями для воздействия таргетных препаратов являются:рецепторы к эпидермальным факторам роста (EGFR) и факторам
роста сосудов – VEGF (рецепторы ангиогенеза – VEGFR);
белки, осуществляющие проведение митогенных сигналов от
рецепторов;
молекулы, контролирующие запуск и течение
программированной смерти клеток;
гены, отвечающих за рост и деление раковых клеток;
перспективная новая технология направлена на «выключение» генов на основе
механизма РНК-интерференции (механизма ингибирования экспрессии гена на стадии
трансляции)
9.
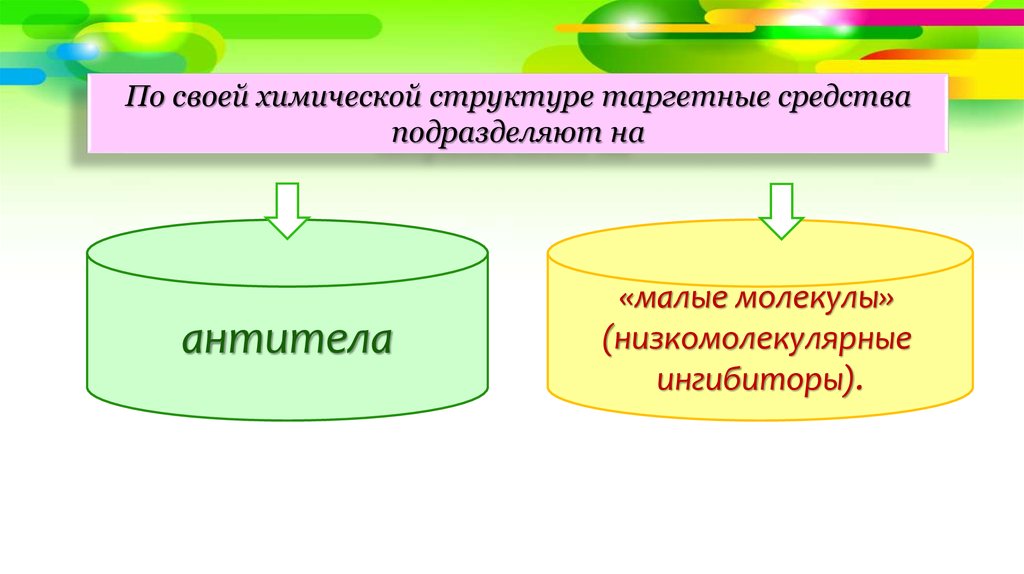
По своей химической структуре таргетные средстваподразделяют на
антитела
«малые молекулы»
(низкомолекулярные
ингибиторы).
10.
антителаЭто продукты природного происхождения с
очень высокой специфичностью.
Они не проникают внутрь клетки, мишенью
являются мембранные рецепторы.
Процедура получения антител дорогостоящая и
всегда подразумевает иммунизацию какого-либо
животного, как правило, мыши.
11.
антителаВ-лимфоциты, полученные от иммунизируемой мыши,
иммортализуются посредством слияния с бессмертными
клетками – клетками миеломы.
«Чистые» мышиные антитела отторгаются иммунной
системой человека, поэтому для преодоления реакций
межвидовой несовместимости осуществляются генноинженерные манипуляции. В одном из технологических
подходов активный (противоопухолевый) эпитоп
мышиных антител вырезается и вставляется в «каркас»
человеческого иммуноглобулина
12.
«малые молекулы» (низкомолекулярные ингибиторы).Это продукт химического синтеза с умеренной
специфичностью («мультитаргетные
препараты»).
Они проникают внутрь клетки и имеют широкий
спектр мишеней.
Способность малых молекул проникать в ЦНС
используется для профилактики и лечения метастазов
в головной мозг.
Стоимость производства – умеренная.
13.
АнтителаМалые молекулы
1. Продукт природного
происхождения
2. Очень высокая специфичность
3. Не проникают внутрь клетки
(мишени: рецепторы)
4. Не проникают через
гематоэнцефалический барьер
5. Внутривенное введение
6. Высокая стоимость производства
1. Продукт химического синтеза
2. Умеренная специфичность
(«мультитаргетные препараты»)
3. Проникают внутрь клетки
(широкий спектр мишеней)
4. Проникают в ЦНС (профилактика
и лечение метастазов в мозг)
5. Пероральное введение
6. Умеренная стоимость
производства
14.
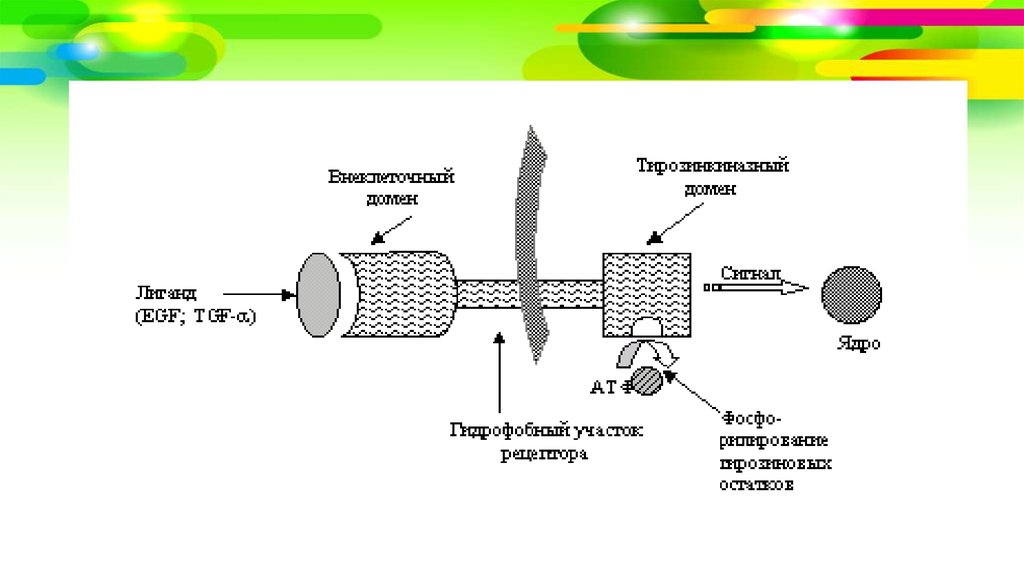
• Рецепторы факторов роста представлены большим семействомразличных трансмембранных белков, локализованными в
поверхностных мембранах клеток.
• Каждый рецептор имеет 3 части (домена):
1. экстрацеллюлярный домен, ответственный за соединение с
лигандом (фактором роста),
2. трансмембранную липофильную часть,
3. интрацеллюлярный домен, представляющий собой
тирозинсодержащие киназы, с активации которых начинается
каскад последующих реакций по передаче сигнала на белкипереносчики
15.
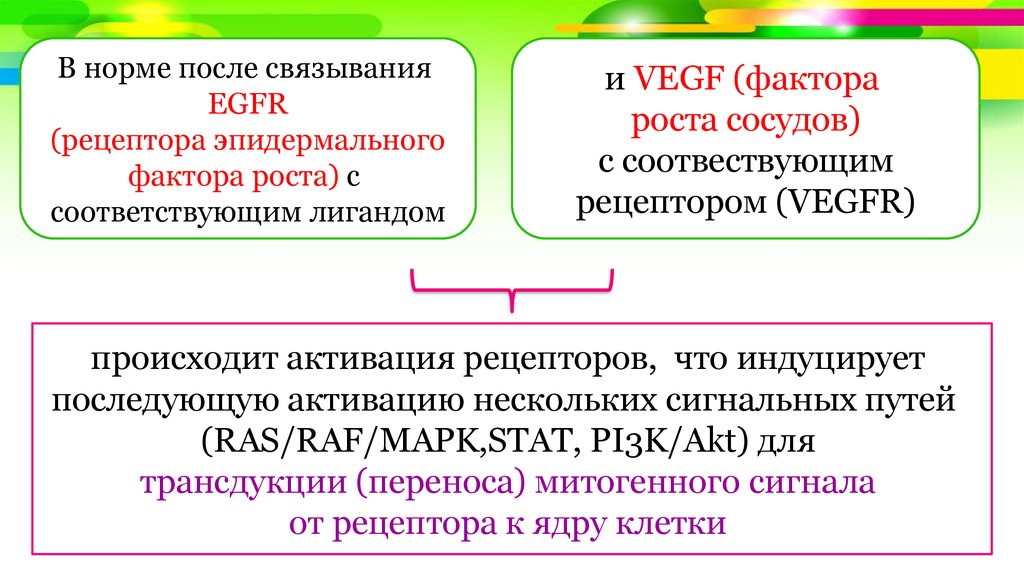
В норме после связыванияEGFR
(рецептора эпидермального
фактора роста) c
соответствующим лигандом
и VEGF (фактора
роста сосудов)
c соотвествующим
рецептором (VEGFR)
происходит активация рецепторов, что индуцирует
последующую активацию нескольких сигнальных путей
(RAS/RAF/MAPK,STAT, PI3K/Akt) для
трансдукции (переноса) митогенного сигнала
от рецептора к ядру клетки
16.
17.
В опухолях часто встречается гиперактивация сигналаот этих рецепторов. Этот феномен является
результатом нескольких событий:
1. гиперэкспрессии рецептора,
2. аутокринной продукции самой опухолью
избыточных количеств лиганда,
3. мутации рецепторов, в результате которой они постоянно
находятся в активированном состоянии, независимо от связывания с
лигандом.
18.
Результаты гиперактивации этих рецепторов вопухолевых клетках многообразны и включают:
1. неконтролируемую пролиферацию
с увеличением подвижности клеток,
2. метастазирование,
3. стимуляцию ангиогенеза,
4. подавление апоптоза.
19.
20.
Исходя из этих данных, в качествепротивоопухолевых агентов предложено
использовать моноклональные антитела к EGFR и
VEGF, связывание которых с рецептором или
ростовым фактором должно вести к
блокированию сигнальных путей и соответственно
к гибели клеток.
21.
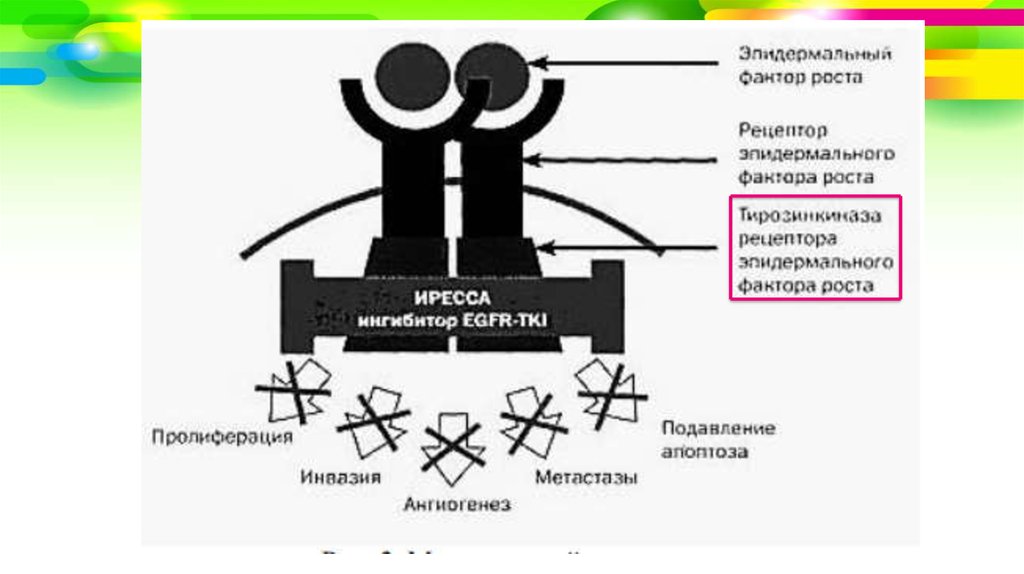
• Механизм действия препаратов: связываясь сэкстрацеллюлярным доменом EGFR, они препятствуют
его связыванию с природным лигандом и тем самым
предотвращают димеризацию рецептора и
последующее аутофосфорилирование тирозинкиназ
интрацеллюлярного домена рецептора.
• В результате не происходит активации белков,
входящих в сигнальный каскад, клетка не получает
пролиферативного сигнала, не делится, и в конечном
итоге наступает апоптоз.
22.
23.
Неоангиогенез является важным патогенетическим фактором роста ипрогрессирования опухолей, т. к. опухоль при достижении определенного
размера (1–2 мм в диаметре) уже не может расти без дополнительного
поступления необходимых веществ. Для этого должен быть активирован
механизм неоангиогенеза, т. е. образование новых сосудов.
Этот момент является критическим для прогресса опухоли, т. к. в результате
неоангиогенеза она превращается из небольшого неопасного для организма
кластера мутантных клеток в опухоль, способную к злокачественному росту,
инвазии и метастазированию.
Поэтому, подавление неоангиогенеза является важным механизмом
противоопухолевого воздействия.
24.
Важнейшую роль в неоангиогенезе играетпролиферация эндотелиальных клеток, для
развития которой наибольшее значение имеет
действие фактора роста эндотелия сосудов (VEGF),
который считаются «прямым стимуляторам»
ангиогенеза.
Высокий уровень экспрессии фактора роста
эндотелия сосудов найден во многих опухолях (рак
толстой кишки, рак молочной железы, рак желудка,
рак легкого). Причиной этого считают условия
гипоксии и оксидативного стресса, характерные
для опухоли.
25.
• Рекомбинантное гуманизированное моноклональноеантитело против фактора роста эндотелия сосудов
(VEGF).
• Бевацизумаб реагирует с участком VEGF, ответственным
за связывание с соответствующим рецептором, что
блокирует образование ангиогенного сигнала и, как
следствие, подавляет неоангиогенез.
26.
Тирозинкиназы — одно из важнейших звеньев в системепередачи сигналов в клетке.
Одной из наиболее универсальных характеристик
процесса злокачественной трансформации является
активация процессов фосфорилирования белков. Поэтому
специфические инактиваторы протеинкиназ представляют
собой самый обширный класс таргетных препаратов.
27.
28.
Препарат иматиниб (гливек) ингибирует тирозинкиназнуюактивность не только рецепторов некоторых факторов
роста, но и химерного белка, продукта химерного гена
BCR/ABL.
Этот химерный ген образуется в гемопоэтических клетках
вследствие транслокации гена ABL с 9-й на 22-ю хромосому.
Следствием этого является образование
«филадельфийской»(Ph) хромосомы.
29.
В результате экспрессии гена BCR/ABL образуетсяхимерный белок р210BCR/ABL, обладающий
повышенной тирозинкиназной активностью.
Появление этого белка в гемопоэтических клеткахпредшественниках приводит к нарушению
нормального функционирования клетки и ее
злокачественной трансформации.
Со временем клетки, содержащие онкобелок р210 ,
вытесняют нормальные стволовые клетки и
развивается клинико-гематологическая картина
хронического миелолейкоза.
30.
• В конце 1990-х гг., была обнаружена экспрессия наповерхности клеток стромальных опухолей ЖКТ
мутантного онкобелка с-kit, что обуславливает
неконтролируемую пролиферацию клеток этой
опухоли.
• Мутированный с-kit обнаруживается в 85–90 % случаев
стромальных опухолей желудочно-кишечного тракта.
• Эти данные и послужили основанием для
исследования эффективности и последующего
внедрения иматиниба для лечения стромальных
опухолей ЖКТ.
31.
mTOR – это внутриклеточный белок – серин-треониноваякиназа. Интегратор передачи сигнала по нисходящему пути.
Регулятор синтеза белков, усиливает трансляцию белков,
управляющих ростом и делением клеток, запускает и
стимулирует процесс клеточного роста, регулирует выработку
нескольких факторов роста сосудов (ангиогенез), регулирует
поглощение питательных веществ и клеточный метаболизм,
ведет к метаболическим изменениям, характерным для рака.
Нарушение регуляции mTOR приводит к развитию различных
заболеваний, в том числе и различных типов рака.
32.
Благодаря таргетной терапии улучшены контроль симптомови качество жизни больных. Заболевания остаются
неизлечимыми, однако с помощью современных подходов
удалось увеличить медиану выживаемости больных.
Препятствием эффективного применения таргетной терапии
являются обширные связи между сигнальными путями, что
позволяет части опухолевых клеток использовать другие
пролиферативные сигналы, и возникающие мутации в
рецепторах, которые могут приводить к потере
чувствительности опухолевой клетки к ингибитору сигнальной
трансдукции.
33.
34.
35. Список использованной литературы.
1. «ТАРГЕТНАЯ ТЕРАПИЯ В ОНКОЛОГИИ» Р. А.Хвастунов, Г. В. Скрыпникова, А. А. Усачев.
2. «ОБЩИЕ ПРЕДСТАВЛЕНИЯ О ТАРГЕТНОЙ
ТЕРАПИИ» Е.Н. Имянитов, 2010 г.































 medicine
medicine








