Similar presentations:
Основы противоопухолевой химиотерапии
1. Основы противоопухолевой химиотерапии
Покровский Вадим, к.м.н., РОНЦ им. Н.Н. Блохина2. Определения
Карциномы — злокачественные опухоли, происходящие из эпителияАденокарциномы — злокачественные опухоли, происходящие из эпителия и
имеющие железистый компонент
Саркомы — злокачественные опухоли, происходящие из тканей мезенхимного
происхождения (соединительные, костные, хрящевые)
Лейкоз ― (от греч. leukós — белый), лейкемия, белокровие, опухолевое
системное заболевание кроветворной ткани
Протоонкоген — ген нормального генома человека, участвует в регуляции
пролиферации клеток. В результате мутаций протоонкоген может стать
онкогеном (вирусным или клеточным)
Онкоген — измененный ген, кодирующий белок, обеспечивающий
пролиферацию и дифференцировку клеточных популяций (протеинкиназы,
ГТФазы, факторы роста)
Вирусный онкоген — вирусный ген, при встраивании/интеграции в геном
вызывает опухолевое перерождение
Онкосупрессор — ген, тормозящий пролиферацию опухолевых клеток. При
выключении функции гена возможна опухолевая трансформация
3. Основные свойства опухолевой клетки
Опухолевая прогрессия — появление и селекция все болееавтономных и агрессивных субклонов (результат высокой
генетической изменчивости и влияния на опухоль
организма)
Самодостаточность в пролиферативных сигналах
Отсутствие (снижение) чувствительности к ростсупрессирующим
сигналам
Неограниченность репликативного потенциала
Ослабление индукции апоптоза
Стимуляция неоангиогенеза (в опухоли диаметром более 2–4 мм
образуются сосуды)
Изменение морфологии
Инвазия и метастазирование
Блок клеточной дифференцировки
Генетическая нестабильность
Метаболический атипизм
4. Регуляция клеточного цикла и ее нарушения в опухолевых клетках
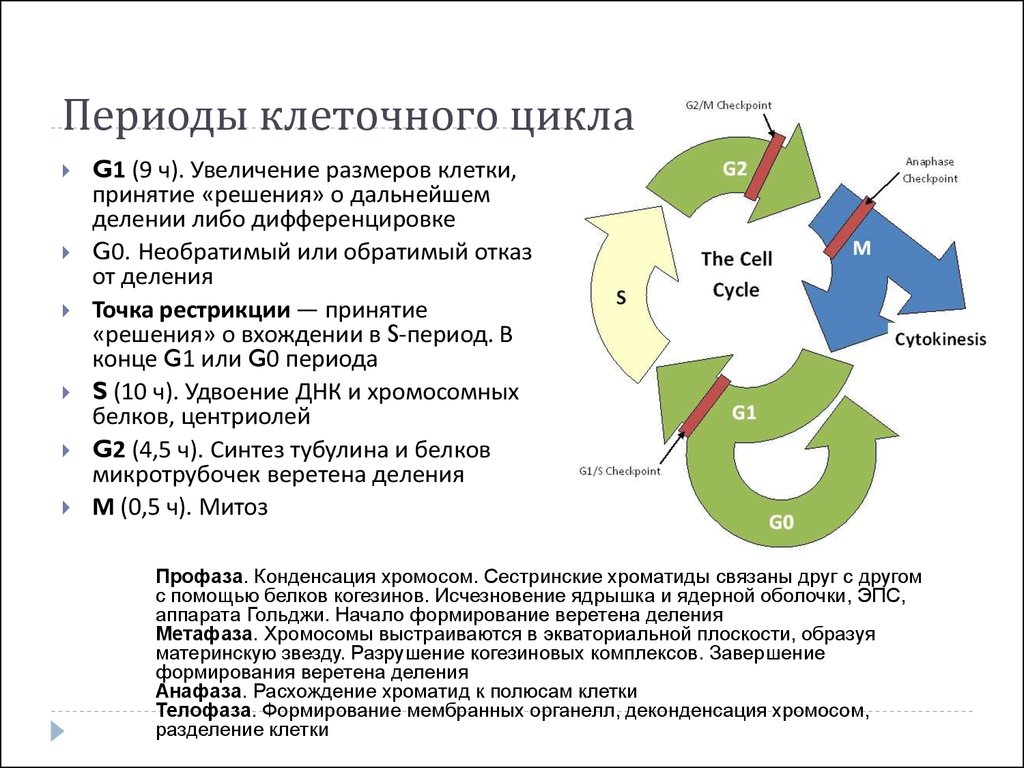
5. Периоды клеточного цикла
G1 (9 ч). Увеличение размеров клетки,принятие «решения» о дальнейшем
делении либо дифференцировке
G0. Необратимый или обратимый отказ
от деления
Точка рестрикции — принятие
«решения» о вхождении в S-период. В
конце G1 или G0 периода
S (10 ч). Удвоение ДНК и хромосомных
белков, центриолей
G2 (4,5 ч). Синтез тубулина и белков
микротрубочек веретена деления
М (0,5 ч). Митоз
Профаза. Конденсация хромосом. Сестринские хроматиды связаны друг с другом
с помощью белков когезинов. Исчезновение ядрышка и ядерной оболочки, ЭПС,
аппарата Гольджи. Начало формирование веретена деления
Метафаза. Хромосомы выстраиваются в экваториальной плоскости, образуя
материнскую звезду. Разрушение когезиновых комплексов. Завершение
формирования веретена деления
Анафаза. Расхождение хроматид к полюсам клетки
Телофаза. Формирование мембранных органелл, деконденсация хромосом,
разделение клетки
6. Регуляция клеточного цикла: циклинзависимые киназы
Молекула киназы (Cdk) состоит из одной неактивной субъединицы. Дляактивации необходимо связывание с циклином. В активном
димерном комплексе «циклин–Cdk» циклин — активаторная, а Cdk —
каталитическая субъединица.
Циклин D–Cdk4/Cdk6 функционирует в начале G1-периода,
способствует прохождению клеткой точки рестрикции.
Циклин E–Cdk2 — вторая половина G1-периода.
Циклин А–Cdk2 — S-период.
Циклин В–Cdk2 — S-период.
Циклин В–Cdk1 — G2-период, вводит клетку в митоз (MPF —
митозстимулирующий фактор).
7. Регуляция клеточного цикла: сигнальные пути
Сигнальные пути «нацелены» в большинстве случаев накомплекс «циклин D–Cdk4/6».
Условия, необходимые для деления клетки:
прикрепление к поверхности
действие ростового фактора
отсутствие контакта с другими клетками
Сигналы:
действие митогенов (от рецепторов эпидермального фактора роста
[стволовые клетки эпителия] или антигенпредставляющей клетки [Тхелперы]))
действие антимитогенов (ФНО, ТФРβ)
прикрепление клетки к матриксу (интегрины)
контактное торможение пролиферации
8. Механизм действия комплексов «циклин-Cdk»
Комплексы G1-фазы обеспечивают:образование компонентов комплексов последующих
стадий, и их активацию в нужный момент
образование субстратов и ферментов, необходимых для
репликации ДНК
Комплексы S- и G2-фазы обеспечивают:
безошибочную репликацию ДНК
образование компонентов митоз-стимулирующего фактора
(«циклин В–Cdk1»)
торможение активности митоз-стимулирующего фактора
во избежание преждевременного начала митоза
9. Нарушения контроля клеточного цикла в опухолевых клетках
Генетические изменения, вызывающие перманентнуюстимуляцию сигнальных путей, активирующих Cdk4/6,
Cdk2. Чаще ― мутации в протоонкогенах
Нарушения в пути передачи сигналов, опосредующих
активацию чекпойнтов в ответ на ростингибирующие
сигналы. Чаще ― мутации в генах-супрессорах
Блокирование или извращение дифференцировки
10. Регуляция апоптоза и ее нарушения в опухолевых клетках
11. Апоптоз: биологическая роль
Уничтожение дефектных клеток.Уничтожение «ненужных» клеток.
Гибель клеток куколки в ходе метаморфоза насекомых.
Редукция пронефроса и мезонефрального канала в эмбриогенезе.
Исчезновение межпальцевых «перепонок» при морфогенезе.
Инволюция органов у горбуш после нереста.
Гибель клеток функционального слоя эндометрия накануне менструации.
Гибель лактоцитов молочных желез после прекращения лактации.
Селекция клеток иммунной системы.
Уничтожение аутореактивных клонов Т- и В-лимфоцитов.
Гибель стимулированных антигеном лимфоцитов при длительном отсутствии антигена.
Селекция половых клеток.
Гибель ооцитов атрезирующих фолликулов.
Регуляция численности клеток.
12. Апоптоз: пусковые факторы
Апоптоз «изнутри»Чрезмерные (нерепарируемые) повреждения хромосом (разрывы ДНК, нарушения
конформации, сшивки)
Повреждение внутриклеточных мембран (перекисное окисление липидов)
Нарушение питания
Апоптоз «по команде»
Действие негативного сигнала.
Гибель лимфоцитов под действием глюкокортикоидов
Fas-лиганд Т-киллера
Сигнал от кадгеринов при контактном торможении
Прекращение действия подкрепляющего сигнала.
Гибель клеток-предшественников крови при отсутствии КСФ
Гибель клеток эндометрия из-за изменения гормонального фона
Гибель клеток при потере связи с опорой (нет сигнала от интегринов)
13. Эффекторы апоптоза
Каспазы. Сериновые протеазы, разрывают пептидные связи, образованные сучастием остатка аспарагиновой кислоты. В клетке содержатся в неактивной
форме — прокаспазы. Каспазный каскад — разветвлённый процесс
последовательной активации каспаз друг другом.
Эндонуклеазы
Ca2+–Mg2+-зависимая эндонуклеаза: активируется под действием каспаз и внутриядерных
белков.
Подобная ДНКазе-I ядерная ДНКаза — катализирует начальные стадии распада хроматина на
очень крупные фрагменты.
Сильные окислители. При действии на клетку ФНО в ней активируется ген
iNO-синтазы, что приводит к увеличению проницаемости мембран, в т.ч.
мембран митохондрий. При апоптозе также инактивируются гены ферментов
антиоксидантной системы (супероксиддисмутаза, каталаза, пероксидаза).
14. Примерная схема апоптоза
1. Повреждение хромосом или мембран.2. Передача сигналов на белок р53.
3. Повышение проницаемости мембран митохондрий.
4. Включение каспазного каскада.
5. Частичный протеолиз каспазами белков-мишеней.
→ конденсация хроматина
→ активация ядерных эндонуклеаз
→ изменение липидного состава плазмолеммы
6. Постепенная фрагментация хроматина.
7. Образование апоптозных телец и их фагоцитоз.
15. Изменения регуляции апоптоза в опухолевых клетках
Потеря экспрессии на поверхности клетки рецепторасмерти FAS
Нарушение проведения апоптогенного сигнала к
митохондриям (инактивация p53 и PTEN)
Ингибирование проницаемости митохондриальной
мембраны для цитохрома С и AIF из-за изменения
экспрессии белков Bcl2
Блокирование активации эффекторных каспаз (потеря
экспресии гена Apaf-1 при метилировании)
Резкое уменьшение жизни каспаз при связывании их с
белками-ингибиторами
16. Основные группы противоопухолевых препаратов
17. Основные пути поиска и разработки новых противоопухолевых агентов
ПериодНаправления
До 1950-х
•Эмпирические находки
•Простые химические модификации
1960-1980-е
Целенаправленный скрининг экстрактов веществ природного
происхождения и средств народной медицины
1990-е-н.вр.
•Поиск молекул, действующих на определенные мишени в
опухолевой клетке
•Поиск путей уменьшения токсичности и повышения
избирательности действия противоопухолевых агентов
•Моделирование и рациональный drug-design
Основные группы мишеней противоопухолевых препаратов
ДНК и процесс ее синтеза
Белки-посредники на различных путях передачи сигнала (регуляция
клеточного цикла, апоптоз)
18. Классификация противоопухолевых препаратов
Алкилирующие агентыАнтиметаболиты
Противоопухолевые антибиотики
Препараты растительного происхождения
1.
2.
3.
4.
1.
2.
Ферментные препараты
Гормональные и антигормональные препараты
Таргетные препараты
5.
6.
7.
1.
2.
8.
Ингибиторы митоза (винкаалкалоиды и таксаны)
Ингибиторы топоизомераз I и II
Моноклональные антитела к мембранным белкам
Низкомолекулярные соединения
Модификаторы биологических реакций
19. 1. Алкилирующие агенты
Механизм действия: образуют положительно заряженные группы, которыесвязываются с электроотрицательными нуклеофильными центрами
оснований ДНК (чаще с O6 или N7 гуанина). При метилировании
происходит изменение структуры азотистого основания, что приводит либо
к разрыву ДНК, либо к образованию сшивок между нитями.
Нерепарируемые повреждения ДНК приводят к активации апоптоза.
Группы
Наиболее важные препараты
Хлорэтиламины
Циклофосфан
Этиленимины
Алкилирующие сульфонаты
Триазины
Темозоломид
Нитрозоалкилмочевины
Комплексные соединения платины
Цисплатин
20. Алкилирующие агенты: хлорэтиламины
Сернистый иприт, sulfur mustardH
H O
Эмбихин, 1950 г.
N H
O
Cl
N
Сарколизин/мелфалан
1950 г.
Cl
N
P
O
H N O
Циклофосфамид
1958 г. ― клинические
испытания
Ифосфамид, 1967 г.
Cl
Cl
21. Алкилирующие агенты: этиленимины
Тиофосфамид (тиотэф), 1950 г.N
S P N
N
N
N
Гексаметилмеламин
(алтретамин), 1960-е гг.
N
N
N
N
22. Алкилирующие агенты: эфиры алкилсульфокислот
OO
S
O
O
O
S
Бусульфан, 1951 г.
O
В отличие от типичных алкилирующих агентов, алкилирует не нуклеиновые
кислоты, а тиоловые группы белков. Первый высокоэффективный препарат
при хроническом миелолейкозе
23. Алкилирующие агенты: триазины
Дакарбазин, 1959 г.Темозоломид, 1984 г.
24. Алкилирующие агенты: производные нитрозомочевины
Нитрозометилмочевина, 1878 г.Cl
H
N
N
N
O
Кармустин, BCNU, 1963 г.
Cl
O
Ломустин, СCNU, 1963 г.
Стрептозотоцин. 1960 г.
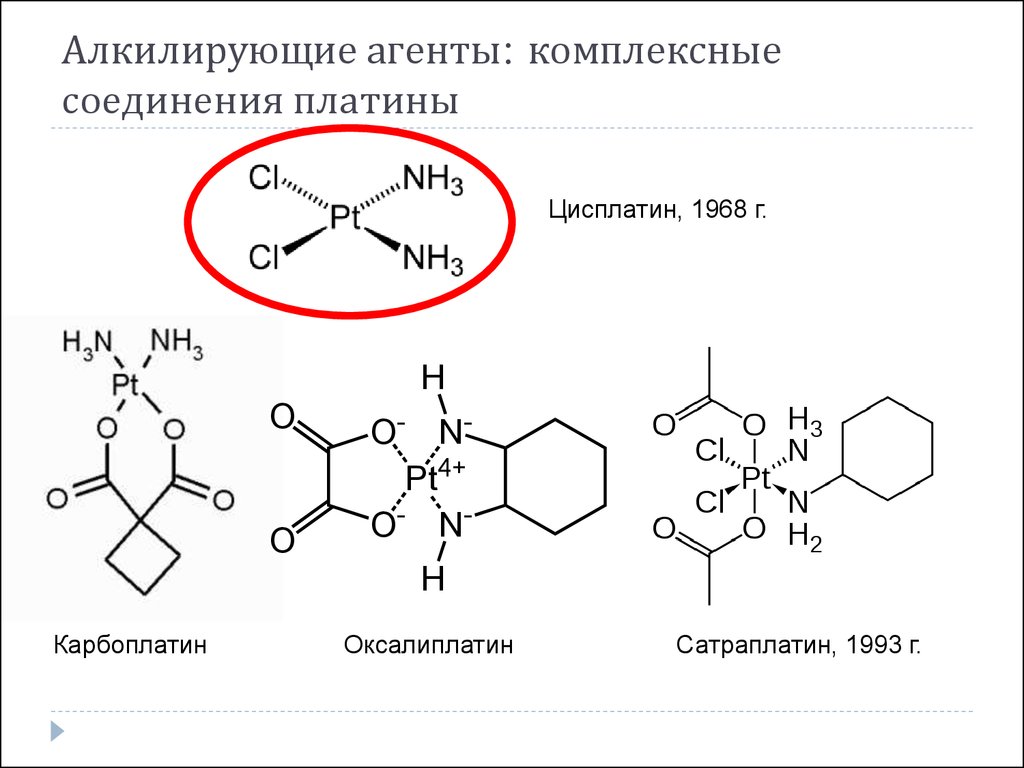
25. Алкилирующие агенты: комплексные соединения платины
Цисплатин, 1968 г.H
O
O
O- NPt4+
O- NH
Карбоплатин
Оксалиплатин
Сатраплатин, 1993 г.
26. 2. Антиметаболиты
Механизм действия: клетки их не распознают и утилизируют как обычныеметаболиты, блокируя важнейшие биохимические реакции в клетке.
Группы
Наиболее важные препараты
Антиметаболиты фолиевой кислоты
Метотрексат
Антиметаболиты пуринов
6-меркаптопурин
Антиметаболиты пиримидинов
5-фторурацил, гемцитабин
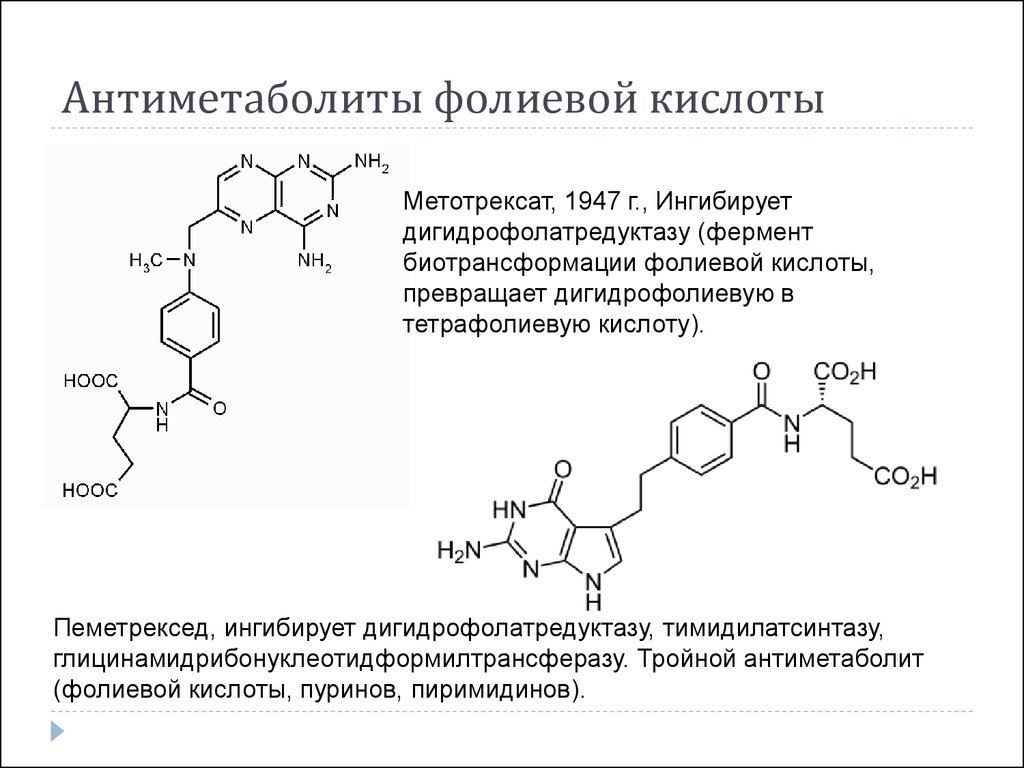
27. Антиметаболиты фолиевой кислоты
Метотрексат, 1947 г., Ингибируетдигидрофолатредуктазу (фермент
биотрансформации фолиевой кислоты,
превращает дигидрофолиевую в
тетрафолиевую кислоту).
Пеметрексед, ингибирует дигидрофолатредуктазу, тимидилатсинтазу,
глицинамидрибонуклеотидформилтрансферазу. Тройной антиметаболит
(фолиевой кислоты, пуринов, пиримидинов).
28. Антиметаболиты пуринов
HO
6-меркаптопурин.
Серосодержащий аналог
гипоксантина.
O
H
O
F
Флударабин. Производное
аденина
O
N
N
N
H
N
N
H
H
29. Антиметаболиты пиримидинов
5-фторурацил, 1957 г. Метаболизируется в печенив 5-фтордезоксиуридин и 5-фтордезоксиурацилтрифосфат. 5-фтордезоксиуридин ингибирует
тимидилатсинтазу, 5-фтордезоксиурацилфосфат
встраивается в клеточную РНК
Фторафур, 1967 г. Метаболизм: под действием тимидинфосфорилазы
опухоли и цитохрома Р450 печени из него образуется 5-фторурацил
UFT. Фторафур + урацил в соотношении 1:4. Урацил конкурентно
связывается с дигидропиримидиндегидрогеназой и уменьшает
резистентность к 5-фторурацилу.
S1. Фторафур + оксониковая кислота + 5-хлордигидропимримидин.
Оксониковая кислота снижает гастроинтестинальную токсичность 5фторурацила за счет ингибирования пиримидинфосфорибозилтрансферазы
клеток ЖКТ. 5-хлордигидропиримидин ― ингибитор
дигидропиримидиндегидрогеназы (в 200 раз более активен, чем урацил).
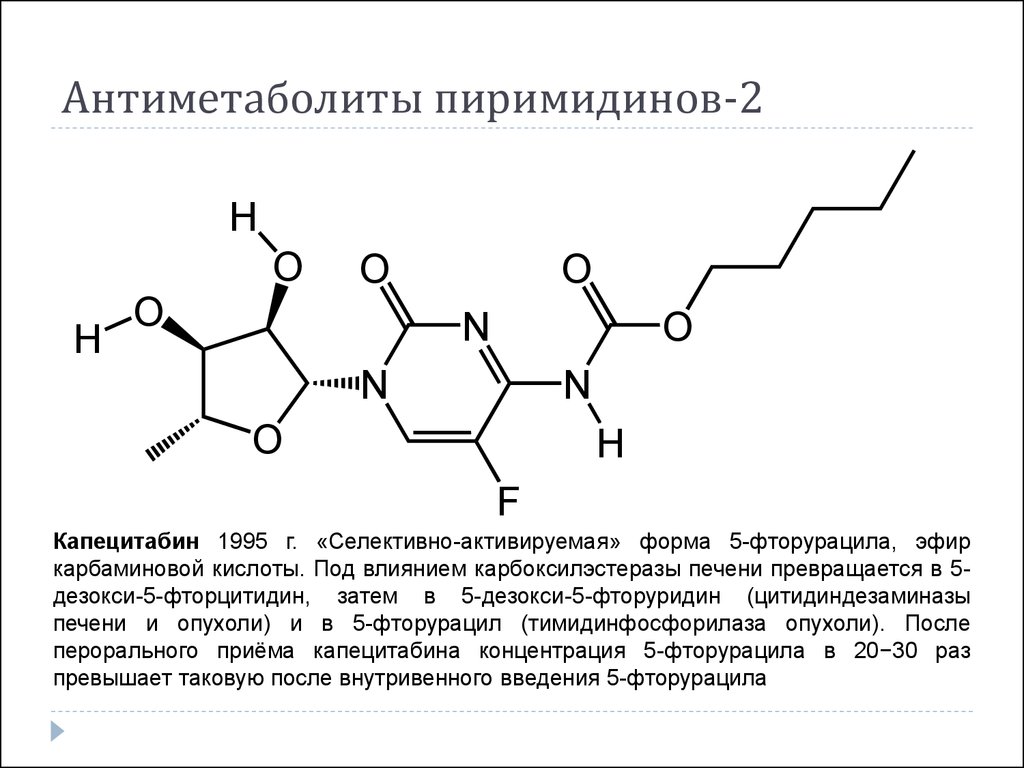
30. Антиметаболиты пиримидинов-2
HO
H
O
O
O
N
O
N
N
O
H
F
Капецитабин 1995 г. «Селективно-активируемая» форма 5-фторурацила, эфир
карбаминовой кислоты. Под влиянием карбоксилэстеразы печени превращается в 5дезокси-5-фторцитидин, затем в 5-дезокси-5-фторуридин (цитидиндезаминазы
печени и опухоли) и в 5-фторурацил (тимидинфосфорилаза опухоли). После
перорального приёма капецитабина концентрация 5-фторурацила в 20−30 раз
превышает таковую после внутривенного введения 5-фторурацила
31. Антиметаболиты пиримидинов-3: аналоги цитидина
HO
H
O
O
Цитозин-арабинозид, 1961 г.
N
N
O
H
N
H
O
H
Гемцитабин, 1988 г.
32. 3. Противоопухолевые антибиотики
Механизм действия: до конца не изучен-Интеркаляторы
-Ингибиторы топоизомеразы II
Группы
Наиболее важные препараты
Актиномицины
Митомицины
Флеомицины
Антрациклины
Антрацендионы
Доксорубицин
33. Флеомицины
HH
O
N
H
H
O
N
N
N
H
N
H
H
N
H
H
O
O
H
H
O
H
H
O
N
O
H
O
N H
O
O
O
H
O
O
N
H
H
H
O
O
N
O
S
N
H
H
N
S
H
N
O
O
H
N
H
O
N
O
N
N
H
H
S+
H
Блеомицин. 1956 г.
34. Антрациклины
HАнтрациклины
H
N
H
Идарубицин, 1975 г.
O
O
H
H
N
H
O
O
Доксорубицин
O
O
O
O
H
O
O
O
H
O
O
O
O
H
O
H
H
O
O
Амрубицин, 1998 г.
H
H
O
O
35. 4. Ферментные препараты
Механизм действия:•ферменты, расщепляющие аминокислоты, необходимые для роста
опухолевых клеток (L-аспарагиназа, аргинин дезиминаза и др.);
•ферменты, разрушающие РНК опухолевых клеток (ранпирназа и др.).
Группы
Наиболее важные препараты
Разрушающие аминокислоты
L-аспарагиназа
Рибонуклеазы
36. L-аспарагиназа
37. 5. Препараты растительного происхождения
Механизм действия:• винкаалкалоиды: cвязываются с белком микротрубочек тубулином,
препятствуют его полимеризации и индуцируют остановку клеточного цикла в
переходе G2/M;
• таксаны: усиливают полимеризацию тубулина, стабилизируя микротрубочки и
прерывая процесс деполимеризации;
• подофиллотоксины: ингибиторы топоизомеразы II, ингибиторы
полимеризации тубулина, приводят к накоплению клеток в поздней S и G2
фазе;
• производные камптотецина: ингибиторы топоизомеразы I.
Группы
Наиболее важные препараты
Алкалоиды безвременника
Винкаалкалоиды
Винкристин
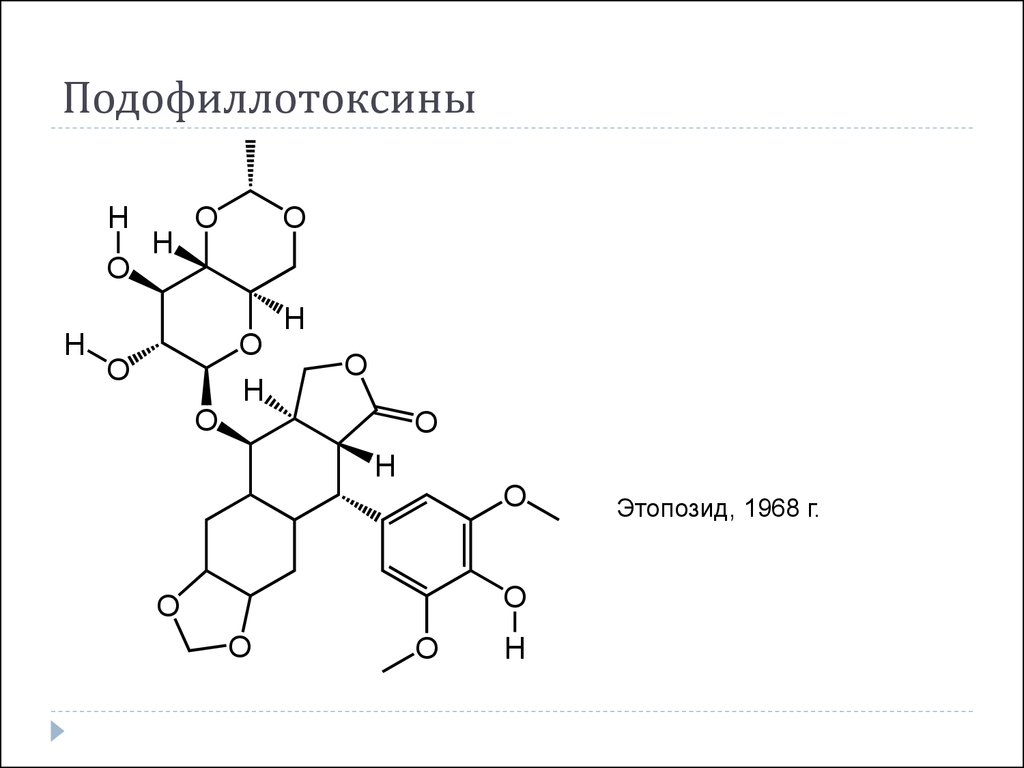
Подофиллотоксины
Этопозид
Производные камптотецина
Иринотекан
Таксаны
Паклитаксел
38. Винкаалкалоиды
ВинкристинO
N
H
H
N
H
O
N
Винбластин
O
H
O
N
H
O
O
O
O
H
O
39. Подофиллотоксины
HO
H
H
O
O
O
O
H
H
O
O
O
H
O
O
O
O
O
H
Этопозид, 1968 г.
40. Производные камптотецина
NN
O
O
O
Иринотекан, 1991 г.,
prodrug SN-38
N
N
O
H
O
O
O
N
N
O
H
N
Топотекан
O
H O
O
41. Таксаны
Паклитаксел, 1971 г.Доцетаксел, 1986 г.
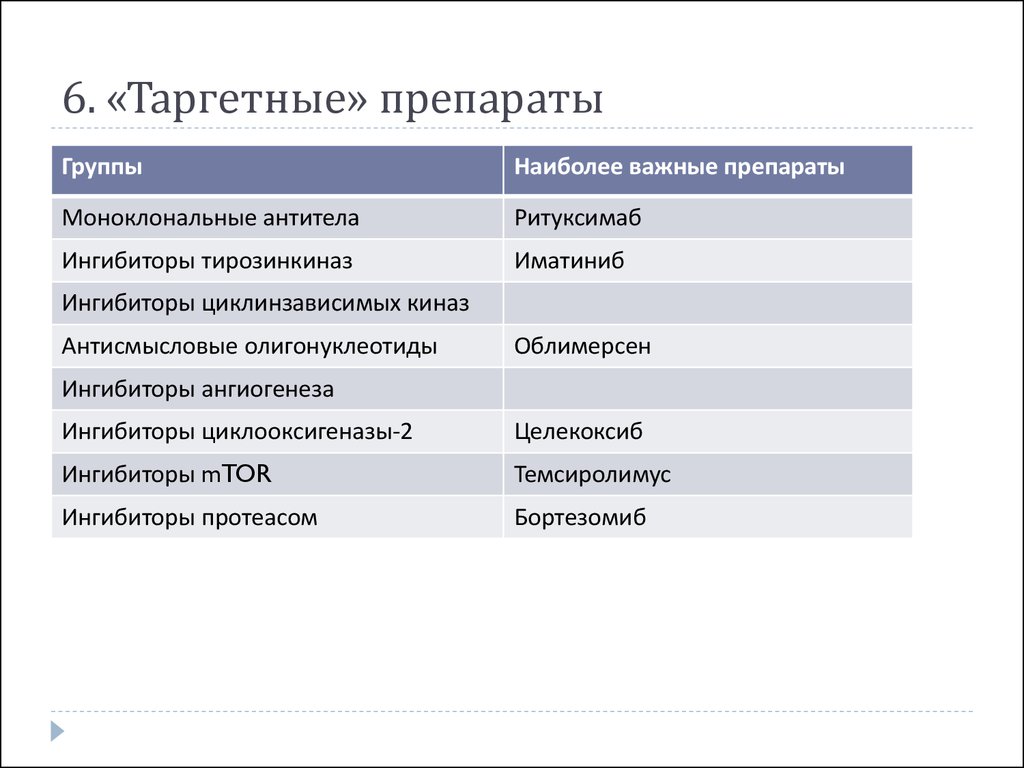
42. 6. «Таргетные» препараты
ГруппыНаиболее важные препараты
Моноклональные антитела
Ритуксимаб
Ингибиторы тирозинкиназ
Иматиниб
Ингибиторы циклинзависимых киназ
Антисмысловые олигонуклеотиды
Облимерсен
Ингибиторы ангиогенеза
Ингибиторы циклооксигеназы-2
Целекоксиб
Ингибиторы mTOR
Темсиролимус
Ингибиторы протеасом
Бортезомиб
43. Моноклональные антитела
Механизм действияКомплемент-зависимая цитотоксичность
Антитело-зависимая клеточная цитотоксичность
Индукция апоптоза
Ингибирование сигнальной трансдукции
Блокада рецепторов (антирецепторы)
Особые виды
Химерные. Содержат 30−35% мышиных и 65−70% антител
Гуманизированные. 90% человеческих, 10% мышиных антител
Основные представители
Ритуксимаб (мабтера). Анти-CD20. Химерное моноклональное
Трастузумаб (герцептин). Гуманизированное моноклональное к Her2/neu
Цетуксимаб. Химерное антитело к EGFR
Бевацизумаб. Гуманизированное моноклональное антитело к VEGF
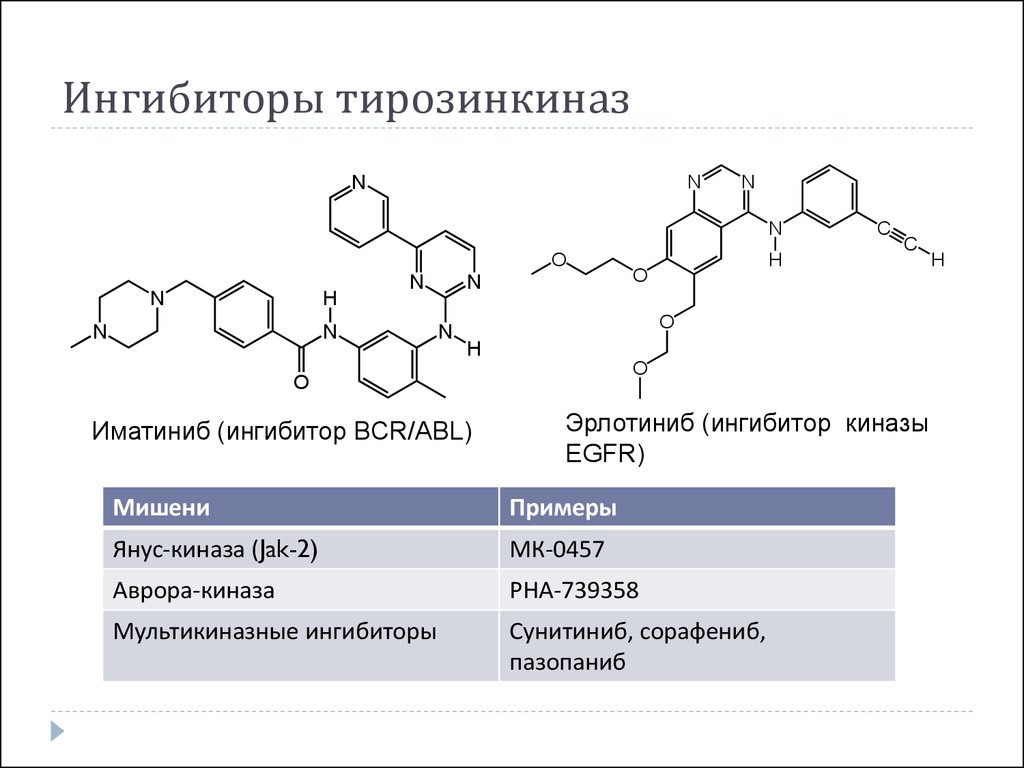
44. Ингибиторы тирозинкиназ
NN
N
N
O
N
H
N
N
N
N
N
H
O
C
C
O
H
O
O
Иматиниб (ингибитор BCR/ABL)
Эрлотиниб (ингибитор киназы
EGFR)
Мишени
Примеры
Янус-киназа (Jak-2)
МК-0457
Аврора-киназа
РНА-739358
Мультикиназные ингибиторы
Сунитиниб, сорафениб,
пазопаниб
H
45. Ингибиторы ангиогенеза
Прямые ингибиторы ангиогенеза - препараты, блокирующие пролиферацию илижизнеспособность эндотелиальных клеток.
Авастин (бевацизумаб). Антитела против рецепторов эндотелиального фактора роста (VEGF).
Витаксин. Антитела противо интегринов α2β3.
Эндостатин. Эндогенный ингибитор.
Скваламин. Ингибитор NHE3.
Непрямые ингибиторы - блокируют синтез ангиогенных белков.
ИФНα. Ингибирует синтез VEGF.
Герцептин. Моноклональные антитела к HER2/neu. Ингибирует синтез TGFβ, ангиопоэтина1,
индуцирует синтез тромбоспондина.
Иресса. Блокатор рецептора EGFR. Блокирует продукцию VEGF, TGFα, ИЛ8.
Семаксаниб. Ингибитор рецептора VEGF 2-го типа.
Ингибиторы матриксных металлопротеиназ
Матриксные металлопротеиназы ― ферменты, участвующие в деградации базальной мембраны,
стимуляции ангиогенеза и метастазирования.
Маримастат
Приномастат
Талидомид. Ингибирует синтез ИЛ8, ИЛ6. Эффективен при множественной миеломе.
46. M-TOR ингибиторы
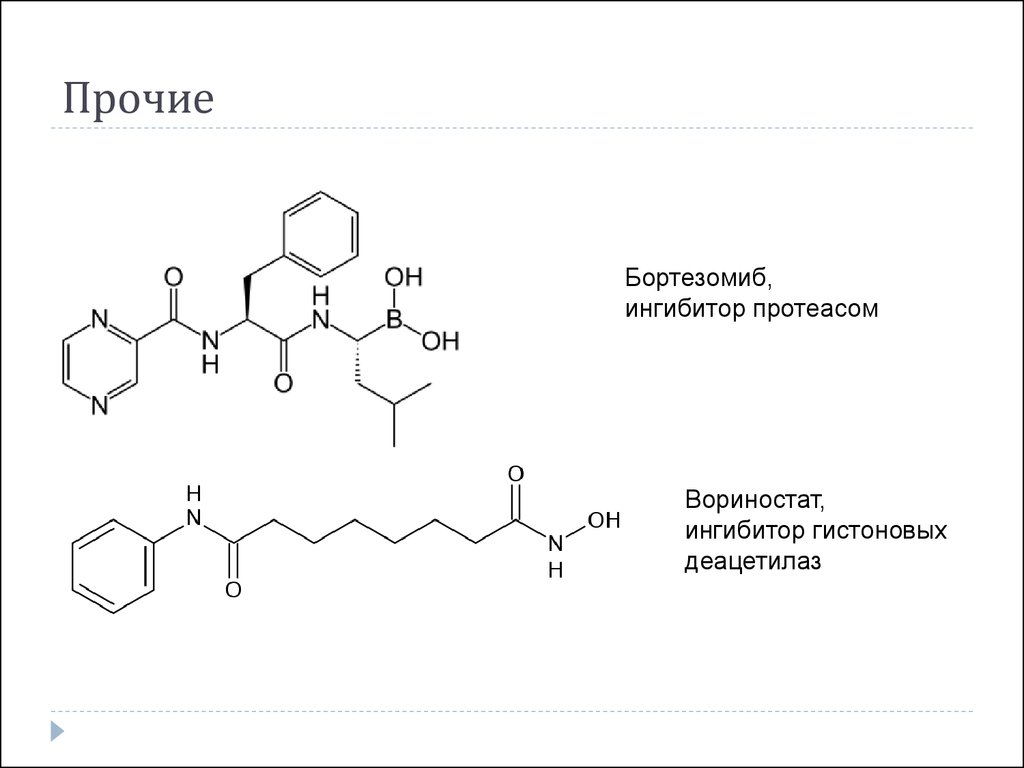
Темсиролимус47. Прочие
Бортезомиб,ингибитор протеасом
Вориностат,
ингибитор гистоновых
деацетилаз
48. Сравнительная характеристика антител и химически синтезированных таргетных препаратов
АнтителаМалые молекулы
Продукт биотехнологического
происхождения
Продукт химического синтеза
Очень высокая специфичность
Умеренная специфичность
Не проникают внутрь клетки
Проникают внутрь клетки
Не проникают через
гематоэнцефалический барьер
Проникают через
гематоэнцефалический барьер
Только парентеральное введение
Возможно введение внутрь
Перспективные мишени:
• геномная нестабильность;
• тканеспецифические гормоны и их рецепторы;
• киназы (EGFR/HER1, BCR/ABL, KIT, mTOR, SRC, LCK, YES, FYN, EPHA2…);
• процессы ангиогенеза;
• и др.
49. 7. Индукторы дифференцировки
I. Витамины и их аналогиПолитрансретиноевая кислота: острый промиелоцитарный лейкоз.
Витамин D3.
II. Цитокины
ИФНα2 ― волосатоклеточный лейкоз, ХМЛ, меланома.
ФНО: на стадии изучения.
III. Низкомолекулярные соединения
Гексаметилбисацетамд
Форболовый эфир
Бутираты
Пептиды (дикарбамин)
IV. Противоопухолевые антибиотики (в малых дозах)
Актиномицин D
Митомицин С
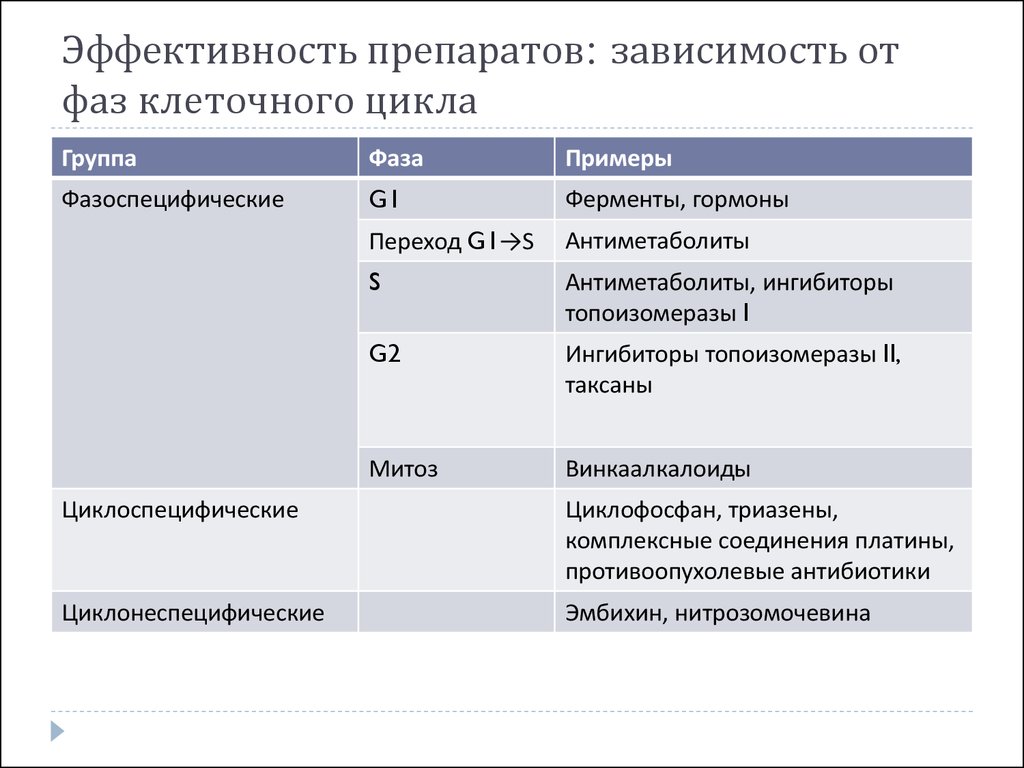
50. Эффективность препаратов: зависимость от фаз клеточного цикла
ГруппаФаза
Примеры
Фазоспецифические
G1
Ферменты, гормоны
Переход G1→S
Антиметаболиты
S
Антиметаболиты, ингибиторы
топоизомеразы I
G2
Ингибиторы топоизомеразы II,
таксаны
Митоз
Винкаалкалоиды
Циклоспецифические
Циклофосфан, триазены,
комплексные соединения платины,
противоопухолевые антибиотики
Циклонеспецифические
Эмбихин, нитрозомочевина
51. Заболевания, при которых с помощью химиотерапии удается вылечить большинство больных
Лимфома ХоджкинаОпухоли трофобласта
Герминогенные опухоли яичка, яичников,
внегонадные герминогенные опухоли
Острый лимфобластный лейкоз
Острый промиелоцитарный лекоз
52. Важные онкологические заболевания, слабо подвергающиеся фармакологическому лечению
Практически нечувствительныеРак поджелудочной железы
Мезотелиома плевры
Рак пищевода
Гепатоцеллюлярный рак
Саркомы мягких тканей
Рак шейки матки
Существуют чувствительные популяции клеток
Немелкоклеточный рак легкого
Рак желудка
Рак почки
Рак мочевого пузыря
Меланома
Папиллярный рак щитовидной железы
Глиомы низкой и промежуточной степени злокачественности











































 medicine
medicine








