Similar presentations:
Магний и кальций
1. Предметная область – химия Урок по теме: «Магний»
2. Содержание
Электронное строение атома MgСтроение простого вещества
Физические свойства Mg
Химические свойства Mg
Горение Mg в кислороде
Горение Mg в воде
Горение Mg в хлоре
Вспышка смеси Mg + AgNO3 от капли воды
Лабораторная работа: «Горение магния на воздухе»
Магнийтермия
Нахождение Mg в земной коре
Получение Mg
Применение Mg и его сплавов
2
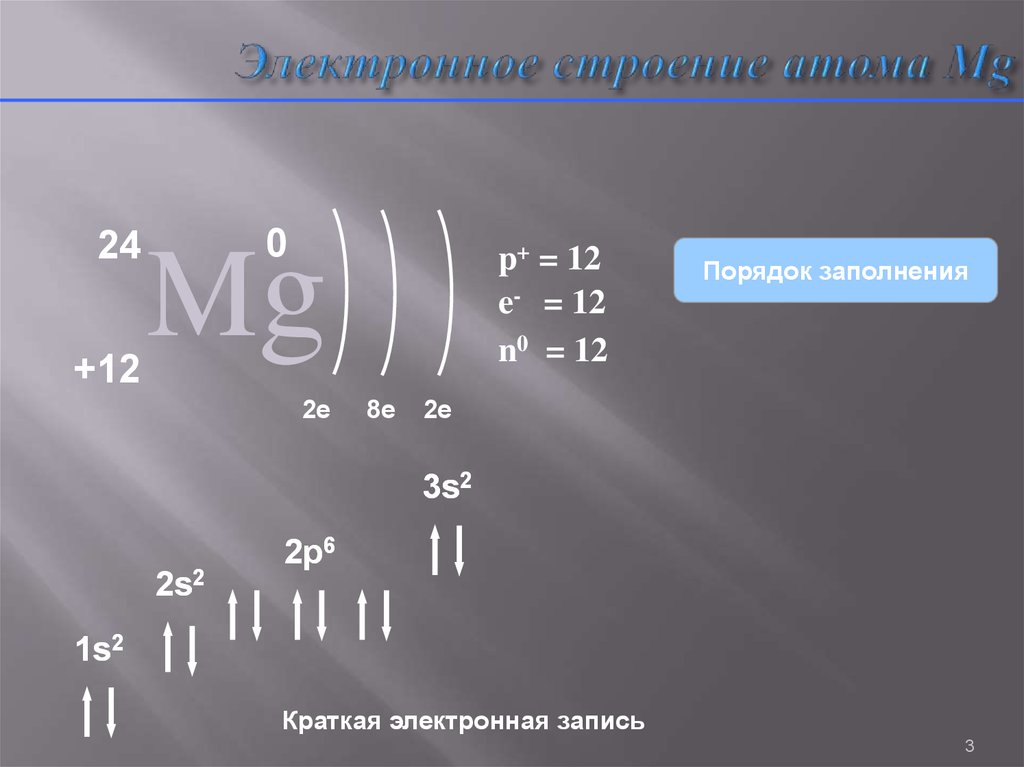
3. Электронное строение атома Mg
24+12
0
Mg
2e
p+ = 12
e- = 12
n0 = 12
8e
Порядок заполнения
2e
3s2
2s2
2p6
1s2
Краткая электронная запись
3
4. Строение простого вещества
МеталлСвязь - металлическая
Кристаллическая решетка металлическая,
гексагональная решетка
4
5. Физические свойства Mg
Цвет – блестящий, серебристо-белыйt пл. = 651°C.
t кип. ≈ 1107°C.
Электропроводный
Легкий, плотность ρ = 1,74 г/см3
Относительно мягкий, пластичный.
5
6. Химические свойства Mg
C неметаллами ( кислородом, серой)C неметаллами ( галогенами, азотом)
C водой
C кислотами
C оксидами
металлов
Mg
+
2HCl
=
Mg
Cl
+
H
↑
2
2
Mg+
Cl
=
Mg
Cl
4Mg2Mg
+ Fe+
==
4Mg
O +2 3Fe
2MgO
3OO
422
t
Mg + 22H
=
Mg(OH)
+
H
↑
4Mg+5H
SO2O
=4MgSO
+H
S+4H
2O
2
2
4
4
2
3Mg
3Mg
+Mg
Al+2+ON
3S2
==3Mg
=Mg
Mg
OS
+ 22Al
3N
6
7. Горение Mg в кислороде
2Mg + O2 = 2MgO2Mg + O2 = 2MgO
7
8. Горение Mg в воде
Что будет, если тушить магний водой?На заводе по переработке вторичного сырья в Уолтон Хиллс, штат Огайо возник пожар. В здании было большое
количество металлов, среди них титан, сталь и магний. Пожарные, опасаясь, что огонь перекинется на
соседнюю бензозаправку решили залить горящее здание водой. Результат не заставил себя ждать - произошел
сильный взрыв, во все стороны разлетелись куски раскаленного добела магния. Ослепительный огонь поднялся на
высоту 50 м. Однако пожарных это ни чему не научило - они продолжили заливать здание, что вызвало новые
взрывы магния. Пожарные вынуждены были отступать под дождем горящего магния. От жара огня начали
плавиться стены здания. Единственный способ погасить пожар магния - засыпать металл большим
количеством песка, что было в данном случае технически невозможно, но это не повод заливать горящий магний
водой. Некомпетентные действия пожарных значительно усугубили масштаб аварии.
Mg + 2H2O = Mg(OH)2 + H2
8
9. Горение Mg в хлоре
Mg + Cl2 = MgCl29
10. Вспышка смеси Mg + AgNO3 от капли воды
3Mg + AgNO3 = 3MgO + 0.5N2 + Ag10
11. Лабораторная работа: «Горение магния на воздухе»
2Mg + O2 = 2MgO11
12. Магнийтермия
– получение металлов восстановлениемоксидов металлов магнием, которое сопровождается
выделением значительного количества теплоты.
4Mg+ Fe3O4 = 4MgO + 3Fe
3Mg + Al2O3 = 3MgO + 2Al
12
13. Нахождение Mg в земной коре
СульфатыКизерит MgSO4×H2O (17,6% Mg)
Лангбейнит 2MgSO4×K2SO4 (11,7% Mg)
Каинит MgSO4×KCI×3H2O (9,8% Mg)
Карбонаты
Магнезит MgCO3 (28,8% Mg)
Доломит MgCO3×CaCO3 (18,2% Mg)
Брусит Mg(OH)2 (Mg 41,7%)
Бишофит MgCl2×6H2O (12,0% Mg)
13
14. Получение Mg
1830 год М. Фарадей:MgCl2 = Mg + Cl2
В 1852 году метод был усовершенствован Р. Бунзеном
В России электролитический метод получения магния
впервые разработал П.П.Федотьев в 1914 г. в Петроградском
политехническом институте
14
15. Применение Mg и его сплавов
1516. Выводы
Магний – химический элемент II группы ПСХЭД.И. Менделеева, в химическом отношении – весьма
активный металл, соединения магния имеют
основной характер. Магний – характерный элемент
мантии Земли, минералы магния многочисленны.
Более половины из них образовались в биосфере – на
дне морей, озер, в почвах. В промышленности
наибольшее количество магния получают
электролизом расплава хлорида магния. Широко
применяются сплавы магния в промышленности.
Магний – постоянная часть растительных и
животных организмов. Из препаратов магния в
медицинской практике применяют: сульфат магния
(как успокаивающее, противосудорожное,
спазмолитическое, слабительное и желчегонное
средство), магнезию жженую (магния оксид) и
карбонат магния (легкое слабительное).
16
17. КАЛЬЦИЙ И ЕГО СОЕДИНЕНИЯ
1718. НАХОЖДЕНИЕ В ПРИРОДЕ
КальцитCaCO3
18
19. АРАГОНИТ CaCO3
1920. ВАТЕРИТ (ФАТЕРИТ) CaCO3
2021. Важнейшее соединение: CaCO3
2122. Важнейшие соединения
ГипсCaSO4 ∙ 2H2O
Фосфориты
и апатиты
Ca3(PO4)2
22
23. Физические свойства
Серебристо-белый,легкий (p=1,55)
t пл. = 851Сᵒ
23
24. Химические свойства
Ca + 2H2O =Ca(OH)2 + H2↑гидроксид кальция
Ca + Cl2 = CaCl2
хлорид кальция
Ca + 2HCl = CaCl2 + H2
хлорид кальция
2Ca + O2 = 2CaO
оксид кальция
24
25. Оксид кальция CaO
СaO – негашеная известьИонная кристаллическая решетка
Белое, тугоплавкое вещество (2570Сᵒ)
25
26. Химические свойства
Ca(OH)2 -гащеная известь, известковоемолоко, известковая вода
26


























 chemistry
chemistry








