Similar presentations:
Бериллий, магний и щелочноземельные металлы
1. Бериллий, магний и щелочноземельные металлы § 15, упр.4
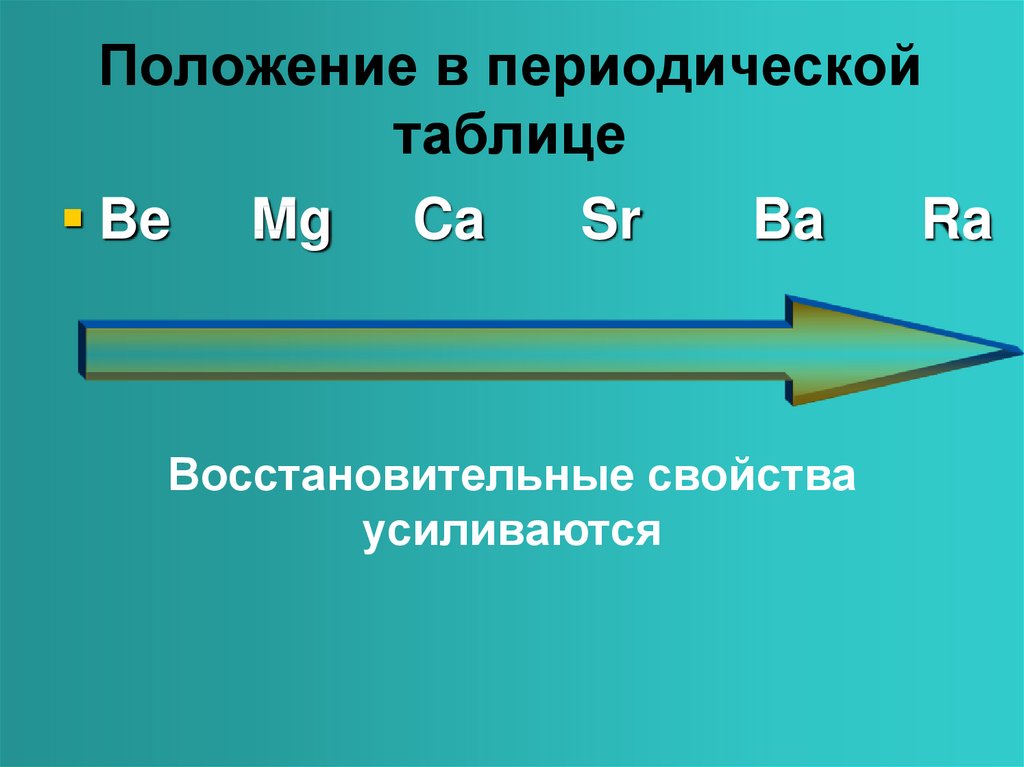
2. Положение в периодической таблице.
В периодической системе находятся в главнойподгруппе II группы.
Являются сильными восстановителями, отдают 2 ē,
во всех соединениях проявляют степень окисления
+2.
Общая конфигурация внешнего энергетического
уровня nS²
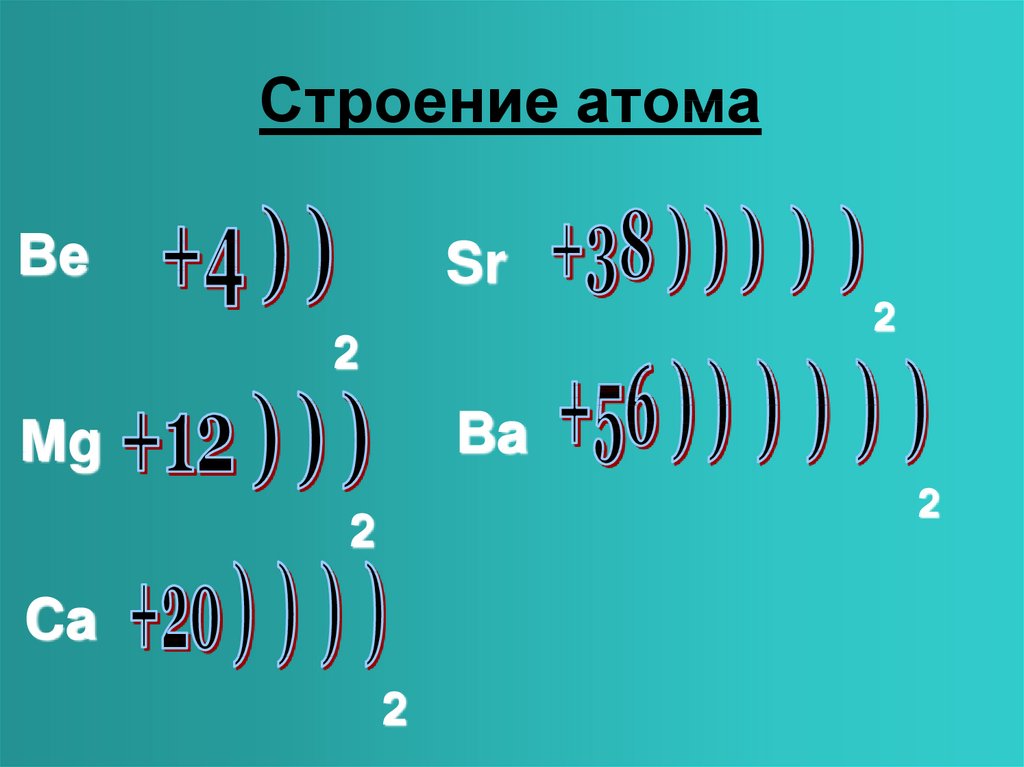
Mg +12 2ē, 8ē, 2ē
Ca +20 2ē, 8ē, 8 ē, 2ē
Sr +38 2ē, 8ē, 18 ē, 8ē, 2ē
Ba +56 2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē
3. Положение в периодической таблице
Be Mg CaSr
Ba
Ra
Восстановительные свойства
усиливаются
4. Строение атома
ВеSr
2
2
Ba
Mg
2
2
Ca
2
5.
Физические свойстващелочноземельных металлов
Щелочноземельные металлы – серебристо-белые,
твёрдые вещества. По сравнению со щелочными
металлами обладают более высокими t°пл. и t°кип.,
потенциалами ионизации, плотностями и твердостью.
Бериллий (Ве) очень твердый материал и способен
оставлять царапины на стекле; твердость других
элементов подгруппы уменьшается, и барий по
твердости близок к свинцу
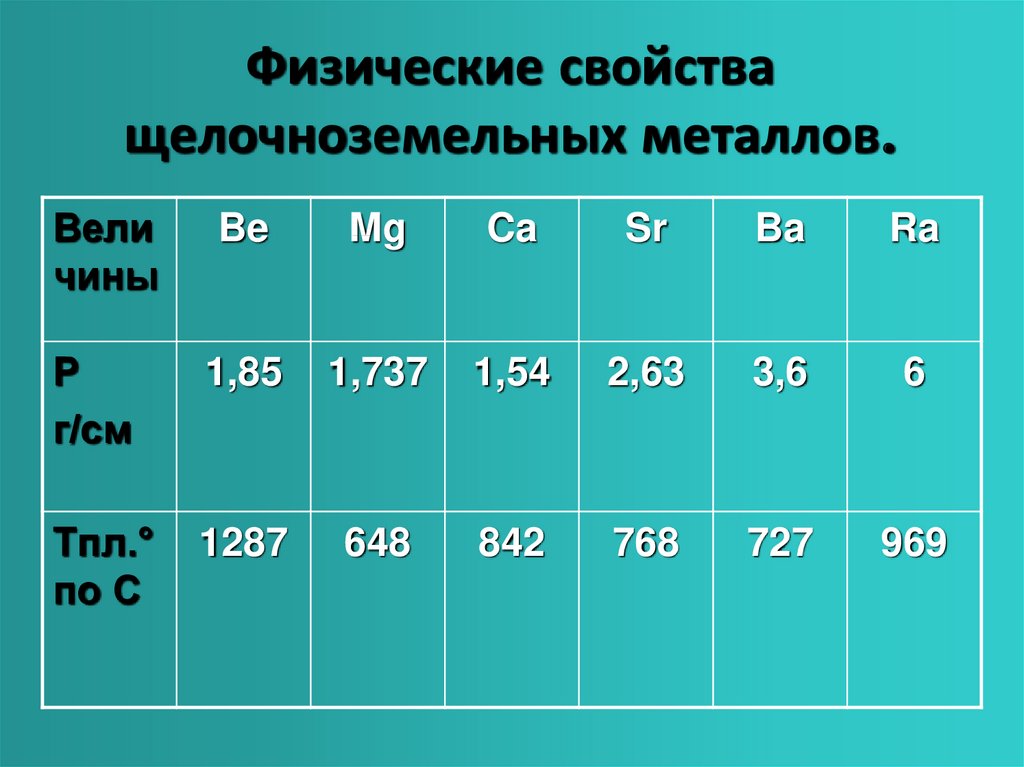
6. Физические свойства щелочноземельных металлов.
Величины
Be
Mg
Ca
Sr
Ba
Ra
Ρ
г/см
1,85
1,737
1,54
2,63
3,6
6
Tпл.°
по С
1287
648
842
768
727
969
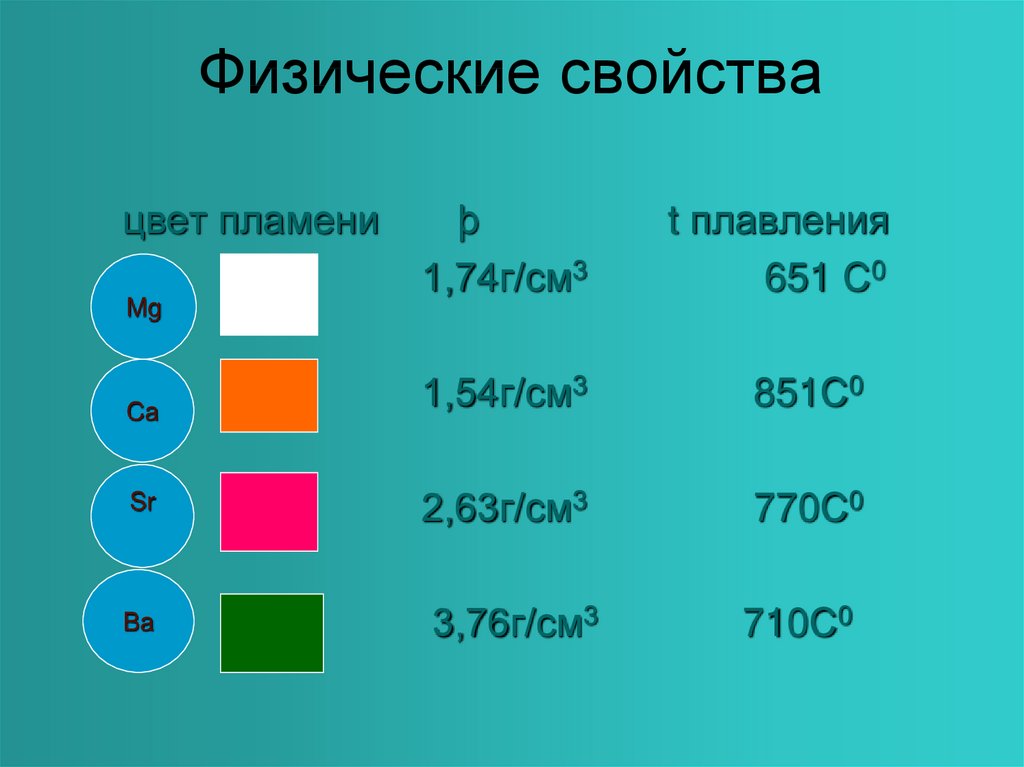
7. Физические свойства
цвет пламениMg
Ca
Sr
Ba
þ
1,74г/см3
t плавления
651 С0
1,54г/см3
851С0
2,63г/см3
770С0
3,76г/см3
710С0
8. Нахождение в природе
Бериллий: 3BeO • Al2O3 • 6SiO2 – бериллМагний: MgCO3 – магнезит
Кальций: CaCO3 • MgCO3 – доломит
KCl • MgSO4 • 3H2O – каинит
KCl • MgCl2 • 6H2O – карналлит
CaCO3 – кальцит (известняк, мрамор, мел.)
Ca3(PO4)2 – апатит, фосфорит
CaSO4 • 2H2O – гипс
CaSO4 – ангидрит
CaF2 – плавиковый шпат (флюорит)
Стронций: SrSO4 – целестин
SrCO3 – стронцианит
Барий: BaSO4 – барит
BaCO3 – витерит
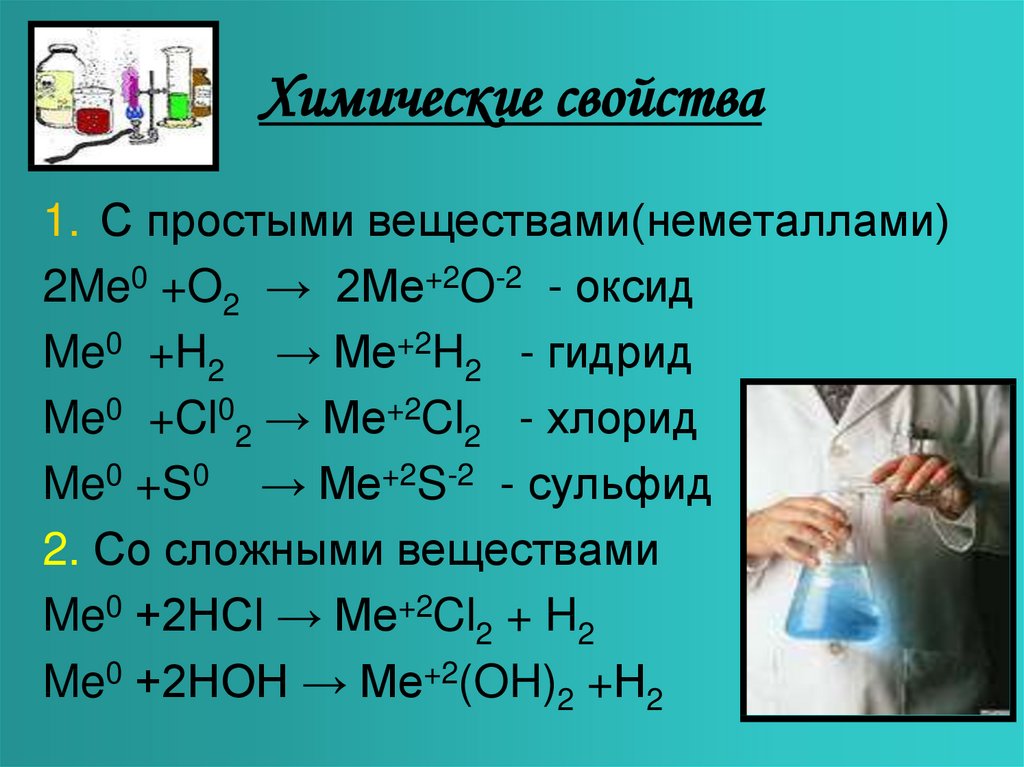
9. Химические свойства
1. С простыми веществами(неметаллами)2Me0 +O2 → 2Me+2O-2 - оксид
Me0 +H2 → Me+2H2 - гидрид
Me0 +Cl02 → Me+2Cl2 - хлорид
Me0 +S0 → Me+2S-2 - сульфид
2. Со сложными веществами
Me0 +2HCl → Me+2Cl2 + H2
Me0 +2HOH → Me+2(OH)2 +Н2
10.
Химические свойства2. Бериллий с водой не реагирует,
магний реагирует медленно, остальные
металлы реагируют с водой, образуя
щелочи и восстанавливая воду до
водорода:
Ме0 + 2Н2О = Ме+2 (ОН)2 + Н2
3. Магний реагирует с кислотами.
Ме0 + 2НCl = Ме+2 Cl2 + Н2
4. Магний и кальций реагирует с
оксидами.
2Мg0 + TiО2 = 2Мg +2О + Ti
06.11.2019
10
11. Соединения щелочноземельных металлов
Оксиды щелочноземельных металлов –МеО, имеютосновный характер, легко реагируют с оксидами
неметаллов с образованием соответствующих солей.
12. BaSO4
Благодаря нерастворимости и способностизадерживать рентгеновские лучи применяется в
рентгенодиагностике – баритовая каша.
13. Ca3(PO4)2
Входит в состав фосфоритов и апатитов, а также всостав костей и зубов. В организме взрослого человека
содержится 1 кг Са в виде фосфата кальция.
14. CaCO3
Карбонат кальция – одно из самыхраспространённых на Земле соединений. Его содержат
горные породы – мел, мрамор, известняк.
15. CaSO4∙ 2H2O
Встречается в природе в виде минерала гипса,представляющего собой кристаллогидрат. Используется
в строительстве, в медицине для наложения гипсовых
повязок, для получения слепков.
16. MgCO3
Широко применяется в производстве стекла,цемента, кирпича, а также в металлургии для перевода
пустой породы в шлак.
17. Са(ОН)2
Гидроксид кальция или гашёная известь с песком иводой называется известковым раствором и широко
используется в строительстве. При нагревании
разлагается на оксид и воду.
18. Проверь себя (работа с таблицей Д.И. Менделеева)
• Сравните атомы элементов, поставив знаки <, >или = вместо *:
а) заряд ядра: Be* Ba; Мg * Al; Ca * К;
б) число электронных слоев: Be * Ba; Мg * Al;
Ca * К;
в) число электронов на внешнем уровне:
Be * Ba; Мg * Al; Ca * К;
г) радиус атома: Be * Ba; Мg * Al; Ca * K;
д) восстановительные свойства: Be* Ba; Мg *Al;
Ca * K.
06.11.2019
18
19.
Проверь себяДополните схемы взаимодействия щелочных металлов с неметаллами
общими формулами и названиями продуктов реакции. Запишите
конкретные уравнения реакций, расставив коэффициенты в них методом
электронного баланса.
а) М+ Н 2
Пример: ___________________
б) М+ S
Пример: _______________________________
в) М+ С12
Пример:
г) М+ N2
Пример: ___________________________
Допишите уравнения реакций. Как изменяется скорость реакций,
расположенных в указанной стрелкой последовательности?
а)
б)
в)
Ca + H2O→ ……………………….
Sr + H2O→……………………….
Ba + Н2О→………………………..
Объясните, от какого фактора зависит скорость реакции взаимодействия
щелочных металлов с водой ………………………..
Назовите продукты реакций. Опишите, как доказать их образование.
………………………............................................
06.11.2019
19
20. § 12, стр.50, упр.4
Домашнее задание§ 12, стр.50, упр.4
06.11.2019
20














 chemistry
chemistry








